张 杨,谢笔钧,孙智达 *
(华中农业大学食品科学技术学院,湖北 武汉 430070)
摘 要:采用XAD-7HP大孔树脂对蓝莓果及蓝莓酒渣花色苷进行纯化,用固相微萃取小柱对蓝莓酒花色苷进行纯化浓缩。通过高效液相色谱-二极管阵列-电喷雾-串联质谱法鉴定了蓝莓果、酒渣、酒中花色苷的组成,并对蓝莓果和蓝莓酒渣花色苷的抗氧化性进行了评价。结果表明:通过XAD-7HP大孔树脂纯化所得的蓝莓果、蓝莓酒渣及利用固相微萃取小柱纯化所得的蓝莓酒中花色苷含量分别为(210.52±5.74)、(151.12±0.88)、(8.93±0.14)mg/g。蓝莓果中鉴定出11 种花色苷;蓝莓酒渣中鉴定出12 种花色苷,其中包括3 种酰化花色苷;蓝莓酒中鉴定出9 种花色苷,其中包含1 种酰化花色苷。蓝莓果和蓝莓酒渣花色苷抗氧化性实验结果表明,蓝莓果和蓝莓酒渣花色苷清除2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基IC 50值分别为(1.43±0.02)、(1.19±0.03)μg/mL,清除1,1-二苯基-2-苦基肼自由基IC 50值分别为(3.28±0.03)、(2.41±0.01)μg/mL;蓝莓果和蓝莓酒渣花色苷清除自由基能力及还原力均显著优于VC,蓝莓酒渣花色苷抗氧化性显著强于蓝莓果花色苷。
关键词:蓝莓酒渣;花色苷;结构鉴定;抗氧化性
蓝莓学名越橘,属杜鹃花科(Ericaceae)越橘属(Vaccinium spp.)植物,因其富含维生素、矿物质、微量元素以及花色苷、酚酸、黄酮、黄烷醇等酚类化合物而极富营养价值,是世界粮农组织推荐的五大健康水果之一 [1]。近年来,国内外对蓝莓花色苷的研究日益增多,主要集中在初步提取纯化上,所用原料以蓝莓鲜果为主,近些年逐渐扩展到皮渣、果渣和酒渣等废弃物的利用方面 [2-4]。对其生理活性的研究涉及抗氧化 [5]、降血压 [6]、抗癌 [7]等,但涉及机理方面的研究较少。国外对蓝莓的研究历史悠久,现主要集中在生理功能及机理方面,包括抗氧化 [8]、改善心血管疾病 [9]、抗菌 [10]、改善记忆力 [11]等,对其工艺方面的研究以保健品和药品为主,主要用于眼科及改善血液循环方面,很多药品已商业化。花色苷结构鉴定方面的研究国内外报道较多,但蓝莓花色苷的结构鉴定多以国外报道为主,蓝莓中花色苷种类十分丰富,如Liu Yixiang等 [12]从中国野生蓝莓中鉴定出13 种花色苷,Nicoue等 [13]以加拿大的野生蓝莓为原料鉴定出了20余种花色苷,Barnes等 [14]从蓝莓中鉴定出26 种花色苷。我国蓝莓资源丰富,蓝莓酒作为一种极具商业价值和营养价值的保健型果酒也逐渐进入人们的视野 [4],酿酒的附加产物——蓝莓酒渣中依然含有丰富的花色苷,将生产蓝莓酒所剩的酒渣加以利用,能变废为宝,增加蓝莓的附加值,具有巨大的经济价值和环境效应。而国内外关于蓝莓酒渣花色苷的研究并不多见,其结构鉴定方面的报道更为少见。以蓝莓酒渣为研究重点,对其进行结构鉴定和抗氧化性研究,并与蓝莓果和蓝莓酒进行比较,确定蓝莓酒渣中花色苷的组分,从多方面评价其抗氧化性,为其研究及商业利用提供参考依据。
1.1 材料与试剂
蓝莓果、蓝莓酒渣、蓝莓酒均由华中农业大学生命科学技术学院提供。
XAD-7HP大孔吸附树脂 美国Rohm&Haas公司;ENVI-18 SPE固相微萃取小柱 美国Supelco公司;1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、Folin-Ciocalteu试剂 美国Sigma公司;乙腈、甲醇(均为色谱纯) 美国Thermo Fisher Scientific公司;95%乙醇、乙酸乙酯、盐酸 国药集团化学试剂上海有限公司。
1.2 仪器与设备
UV-2450型紫外-可见分光光度计 日本岛津公司;分析天平 上海伦捷机电仪表有限公司;带自动进样器的高效液相色谱(high performance liquid chromatography,HPLC)与质谱(mass spectrometry,MS)联用仪美国Agilent公司。
1.3 方法
1.3.1 蓝莓果、酒渣及酒花色苷的提取纯化
取一定量的蓝莓果或蓝莓酒渣,充分破碎,用70%的乙醇溶液(pH 3.0)按照1∶20(g/mL)的料液比充分混合后于50 ℃条件下浸提120 min,抽滤并收集滤液,将滤渣再按照上述方法提取一次,合并滤液,于40 ℃条件下减压浓缩得到深紫色的黏稠粗提物。经XAD-7HP大孔树脂纯化,40 ℃减压浓缩得到纯化的蓝莓果及蓝莓酒渣花色苷浓缩液,真空干燥得到紫黑色粉末。
取一定量的蓝莓酒,用蒸馏水稀释2 倍,3 倍体积乙酸乙酯萃取3 次,合并水相并除去其中残留的乙酸乙酯,用Supelclean ENVI-18 SPE固相微萃取小柱进行纯化富集,用50%甲醇溶液(pH 3.0)洗脱,收集颜色最深的洗脱液,旋去甲醇得花色苷浓缩液,真空干燥得到紫黑色粉末。
1.3.2 总酚含量的测定
采用Folin-Ciocalte比色法 [15]。取一定质量浓度纯化后的蓝莓果、蓝莓酒渣及蓝莓酒冻干粉溶液于15 mL的一批管中,加入6 mL蒸馏水及0.5 mL Folin-Ciocalte试剂,8 min后立即加入质量分数20% Na 2CO 3溶液1.5 mL及蒸馏水1.9 mL,混合后于25 ℃条件下水浴2 h,取出后于765 nm波长处测定吸光度。在相同条件下测定不同质量浓度的没食子酸吸光度,绘制标准曲线,结果以没食子酸当量表示(mg没食子酸/g干质量)。
1.3.3 花色苷含量的测定
采用pH值示差法 [16]。取1 mg/mL的蓝莓果、蓝莓酒渣及蓝莓酒花色苷溶液1 mL,分别用pH 1.0(0.2 mol/L KCl-0.2 mol/L HCl体积比25∶67)和pH 4.5(0.2 mol/L NaAc-0.2 mol/L HAc体积比45∶50)的缓冲溶液稀释至5 mL,40 ℃条件下静置平衡30 min,以等量溶剂加相应缓冲溶液为空白,分别于520 nm和700 nm波长条件下测定吸光度,总花色苷含量以矢车菊色素-3-葡萄糖苷计,按式(1)计算:
式中:ε为矢车菊-3-葡萄糖苷消化系数,26 900 L/(cm·mg);DF为稀释因子;M w为矢车菊-3-葡萄糖苷相对分子质量,449.2;A为吸光度,A=(A 520 nm-A 700 nm) pH 1.0-(A 520 nm-A 700 nm) pH 4.5。
1.3.4 HPLC-MS法鉴定蓝莓果、蓝莓酒渣、蓝莓酒中花色苷组成
1.3.4.1 样品处理
取纯化后的蓝莓果、蓝莓酒渣及蓝莓酒花色苷配成1 mg/mL的溶液,过0.22 μm水相滤膜后备用。
1.3.4.2 分析条件
2695型HPLC仪,检测器为二极管阵列检测器(diode array detector,DAD),波长为520 nm。
蓝莓果及蓝莓酒渣花色苷检测条件 [17]:流动相:A:体积分数2.5%的甲酸溶液;B:甲酸-乙腈-水体积比2.5∶47.5∶50;分离柱:C 18(416 mm×150 mm,5 μm)。流速为1 mL/min,进样量20 μL,温度25 ℃。梯度洗脱程序为:0~25 min,12%~30% B;25~34 min,30%~100% B;34~40 min,100%~12% B;40~50 min,12% B。
蓝莓酒花色苷检测条件 [18]:流动相:A:体积分数5%的甲酸溶液;B:甲酸-甲醇-水体积比5∶50∶45;梯度洗脱程序为:0~4 min,6%~15% B;4~13 min,15%~25% B;13~20 min,25%~50% B;20~35 min,50%~80% B;35~40 min,80%~100% B;40~45 min,100%~6% B;45~50 min,6% B。
1.3.4.3 MS条件
电喷雾电离离子源,正离子扫描模式,雾化气压力40 psi,干燥气温度325 ℃,干燥器流量10 L/min,毛细管电压3 500 V,离子扫描范围m/z 100~2 000。
1.3.5 总抗氧化力的测定
采用ABTS法 [8]。将7 mmol/L ABTS溶液和2.45 mmol/L过硫酸钾溶液各取5 mL混合,置于暗处反应12 h,产生ABTS +·,用水将ABTS +·溶液稀释使其在734 nm波长条件下的吸光度为0.70±0.02。将1 mL不同质量浓度的蓝莓果及蓝莓酒渣花色苷溶液加到2 mL ABTS +·溶液中均匀混合,10 min后测其在734 nm波长处的吸光度,记作A 1;测2 mL ABTS +·溶液与1 mL溶剂混合后在734 nm波长处的吸光度,记作A 0;2 mL蒸馏水与1 mL样液在734 nm波长处的吸光度记作A 2。以VC作为阳性对照。ABTS +·清除率计算见公式(2):
1.3.6 DPPH自由基的清除能力的测定
参照文献[19],取不同质量浓度的样液2 mL和 2×10 -4mol/L的DPPH乙醇溶液2 mL,加入同一具塞试管中,摇匀,在室温条件下避光反应30 min,于517 nm波长条件下测其吸光度,空白组以等体积无水乙醇代替DPPH溶液,对照组以等体积蒸馏水代替样品溶液,按式(3)计算蓝莓果花色苷、蓝莓酒渣花色苷对DPPH自由基的清除率。以VC作为阳性对照。
式中:A 0为对照组吸光度;A i为样品组吸光度;A j为空白组吸光度。
1.3.7 还原力的测定
参照文献[5],取不同质量浓度的样液1 mL于试管中,依次加入0.2 mol/L磷酸盐缓冲液(pH 6.6) 2.5 mL和1%六氰合铁酸钾溶液2.5 mL,于50 ℃条件下水浴保温20 min后快速冷却,加入10%三氯乙酸溶液2.5 mL,以3 000 r/min离心10 min,取上清液2.5 mL,依次加入2.5 mL蒸馏水、0.1%的三氯化铁溶液0.5 mL,充分混匀后静置10 min,在700 nm波长处测定其吸光度,吸光度越大表示还原力越强。
1.4 数据分析
每个数据平行测量3 次,结果采用
 。相关性与显著性差异采用SPSS 16.0统计软件进行分析。不同组间平均数通过一元方差分析进行比较,若组间存在显著性差异(P<0.05),采用Duncan检验进行组间多重比较。
。相关性与显著性差异采用SPSS 16.0统计软件进行分析。不同组间平均数通过一元方差分析进行比较,若组间存在显著性差异(P<0.05),采用Duncan检验进行组间多重比较。
2.1 总酚和花色苷含量
表1 总酚和花色苷含量测定结果
Table 1 Contents of total phenolics and anthocyanins in extracts ofblueberry fruits and blueberry wine lees

注:同列不同字母表示差异显著(P<0.05)。
mg/g样品花色苷含量 总酚含量蓝莓果提取物210.52±5.74 c508.89±21.87 c蓝莓酒渣提取物151.12±0.88 b436.67±6.80 b蓝莓酒提取物8.93±0.14 a292.22±3.93 a
由表1可知,经大孔树脂XAD-7HP初步纯化所得的蓝莓果提取物中花色苷和总酚含量显著大于蓝莓酒渣提取物,蓝莓果提取物中花色苷含量是蓝莓酒渣的1.39 倍,总酚含量是蓝莓酒渣提取物的1.17 倍,说明蓝莓酒渣中依然含有十分丰富的花色苷。蓝莓酒提取物中花色苷含量显著少于蓝莓果和蓝莓酒渣提取物。
2.2 蓝莓果、酒渣、酒中花色苷成分的鉴定比较
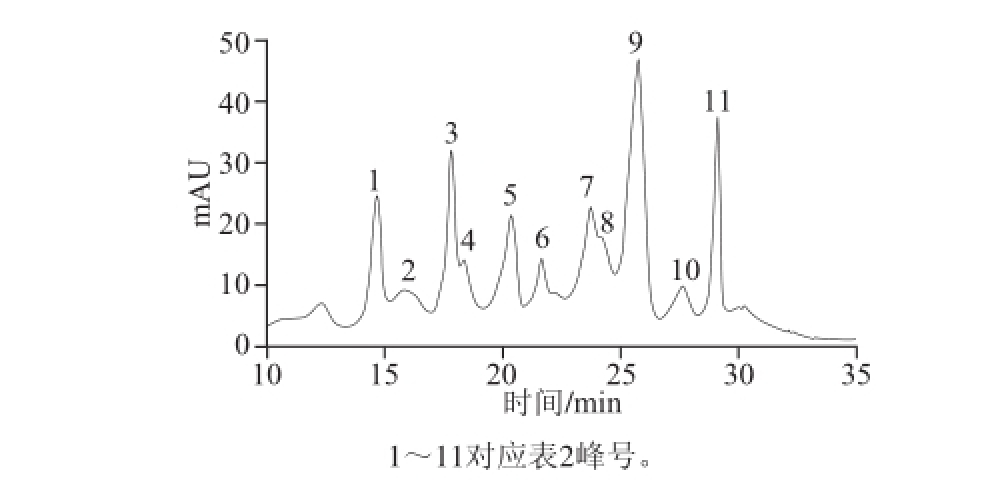
图1 520nm波长条件下蓝莓果花色苷的HPLC图
Fig.1 HPLC chromatogram of the anthocyanin extract from blueberry fruits detected at 520 nm
表2 蓝莓果花色苷HPLC-DAD-MS/MS分离鉴定结果
Table 2 HPLC-MS data and tentative identification of anthocyaninsfrom blueberry fruits
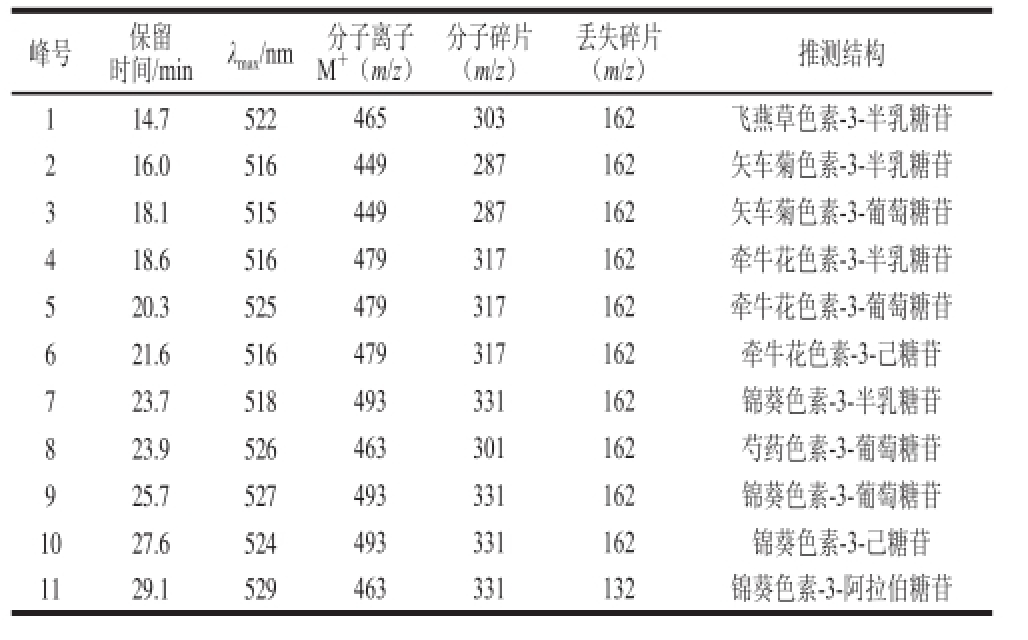
峰号保留时间/minλ max/nm分子离子M +(m/z)分子碎片(m/z)丢失碎片(m/z)推测结构114.7522465303162飞燕草色素-3-半乳糖苷216.0516449287162矢车菊色素-3-半乳糖苷318.1515449287162矢车菊色素-3-葡萄糖苷418.6516479317162牵牛花色素-3-半乳糖苷520.3525479317162牵牛花色素-3-葡萄糖苷621.6516479317162牵牛花色素-3-己糖苷723.7518493331162锦葵色素-3-半乳糖苷823.9526463301162芍药色素-3-葡萄糖苷925.7527493331162锦葵色素-3-葡萄糖苷1027.6524493331162锦葵色素-3-己糖苷1129.1529463331132锦葵色素-3-阿拉伯糖苷
由图1可知,蓝莓果提取物中花色苷种类丰富,至少有11 种,根据表2的保留时间和MS数据,结合资料 [5,13-14]分析可知,按照出峰顺序依次为飞燕草色素(m/z 303)、矢车菊色素(m/z 287)、牵牛花色素(m/z 317)、锦葵色素(m/z 331)以及芍药花色素(m/z 301)这5 种花色素苷元,与之相连的糖残基有半乳糖、葡萄糖和阿拉伯糖3 种。其中2、3号峰具有相同的分子离子峰(m/z 449)和分子碎片(m/z 287),根据出峰顺序,由文献[5,13-14]推测2号峰为矢车菊色素-3-半乳糖苷,3号峰为矢车菊色素-3-葡萄糖苷。4、5、6号峰有相同的分子离子峰(m/z 479)和分子碎片(m/z 317),根据出峰顺序和文献[5,13-14]推测4号峰为牵牛花色素-3-半乳糖苷,5号峰为牵牛花色素-3-葡萄糖苷,6号峰为另一种未知的牵牛花色素-3-己糖苷。7、9、10号峰具有相同的分子离子峰(m/z 493)和分子碎片(m/z 331),推测其分别为锦葵色素-3-半乳糖苷、锦葵色素-3-葡萄糖苷和未知的锦葵色素-3-己糖苷。其中保留时间为25.7 min(9号)的花色苷含量最高,其次是保留时间为29.1 min(11号)、23.8 min(7号)的花色苷,由文献[5,13-14]可知这3 种花色苷依次为锦葵色素-3-葡萄糖苷、锦葵色素-3-半乳糖苷和锦葵色素-3-阿拉伯糖苷。说明蓝莓果中含量最高的花色苷为锦葵色素-3-葡萄糖苷。
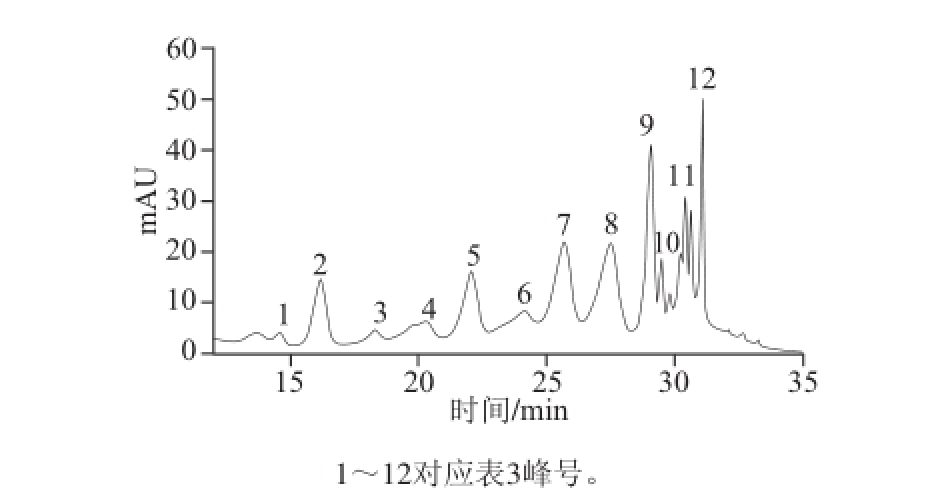
图2 520nm波长条件下蓝莓酒渣花色苷的HPLC图
Fig.2 HPLC chromatogram of the anthocyanin extract from blueberry wine lees detected at 520 nm
表3 蓝莓酒渣花色苷HPLC-DAD-MS/MS分离鉴定结果
Table 3 HPLC-MS data and tentative identification of anthocyaninsfrom blueberry wine lees
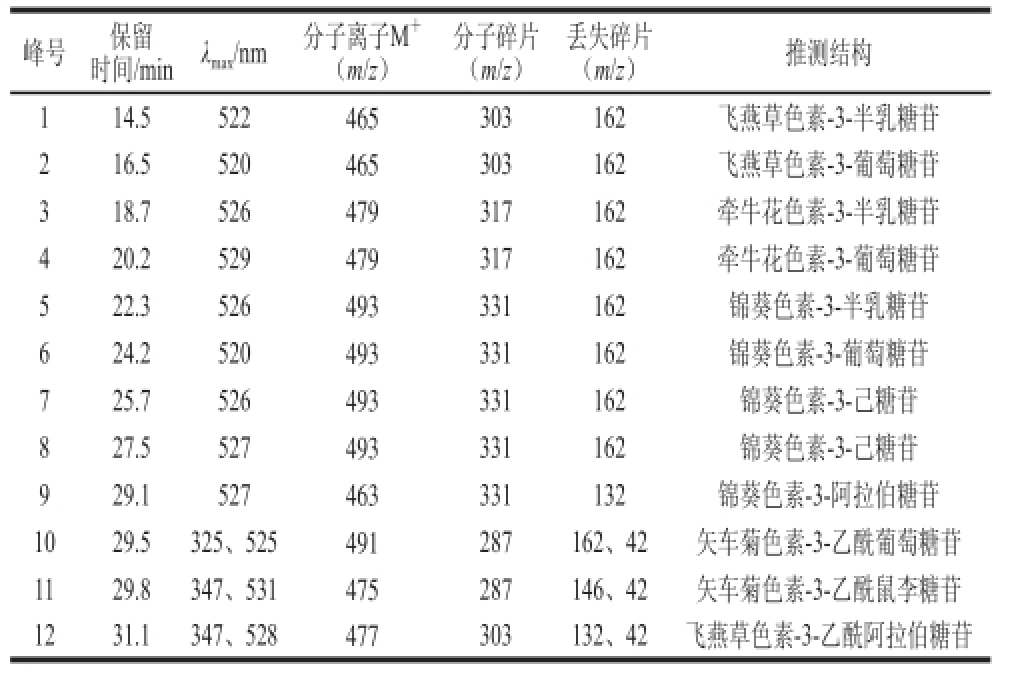
峰号保留时间/minλ max/nm分子离子M +(m/z)分子碎片(m/z)丢失碎片(m/z)推测结构114.5522465303162飞燕草色素-3-半乳糖苷216.5520465303162飞燕草色素-3-葡萄糖苷318.7526479317162牵牛花色素-3-半乳糖苷420.2529479317162牵牛花色素-3-葡萄糖苷522.3526493331162锦葵色素-3-半乳糖苷624.2520493331162锦葵色素-3-葡萄糖苷725.7526493331162锦葵色素-3-己糖苷827.5527493331162锦葵色素-3-己糖苷929.1527463331132锦葵色素-3-阿拉伯糖苷1029.5325、525491287162、42矢车菊色素-3-乙酰葡萄糖苷1129.8347、531475287146、42矢车菊色素-3-乙酰鼠李糖苷1231.1347、528477303132、42飞燕草色素-3-乙酰阿拉伯糖苷
由图2可知,蓝莓酒渣提取物中至少有12 种花色苷,根据表3的保留时间和MS数据,查阅相关资料 [5,13-14,20]可知,1、2号的分子离子峰(m/z 465)和分子碎片(m/z 303)相同,依据出峰顺序推测1号为飞燕草色素-3-半乳糖苷,2号为飞燕草色素-3-葡萄糖苷。与蓝莓果相比,飞燕草色素-3-己糖苷相对含量发生了显著减少,而在蓝莓酒渣中,12号峰在紫外-可见区的347、528 nm波长处有吸收,根据其分子离子峰(m/z 477)和分子碎片(m/z 303)推测其可能是飞燕草色素-3-乙酰阿拉伯糖苷。蓝莓果中检测出矢车菊色素-3-己糖苷,蓝莓酒渣中未检测出,而10号峰在紫外-可见区的325、525 nm波长处有吸收,其分子离子峰为m/z 491,分子碎片为m/z 287,推测其为矢车菊色素-3-乙酰葡萄糖苷;11号在347、531 nm波长处有吸收,其分子离子峰为m/z 475,分子碎片为m/z 287,推测其为矢车菊色素-3-乙酰鼠李糖苷。说明经过发酵作用,蓝莓果中的飞燕草色素和矢车菊色素发生了酰化作用。图2中3、4号峰由表3推测其分别为牵牛花色素-3-半乳糖苷和牵牛花色素-3-葡萄糖苷,与图1中的5、6号相对应;5~9号峰由表3推测可知均为锦葵色素,说明蓝莓酒渣中含量最为丰富的花色苷仍为锦葵素类的花色苷,且与图1中的7、9~11号峰相对应,说明经过发酵作用,蓝莓果中的牵牛花色素和锦葵色素并未发生酰化作用,且锦葵素类的花色苷依然是其中含量最高的花色苷。由图1和表2可知芍药花色素在蓝莓果中含量很少,而在蓝莓酒渣中未检测到芍药花色素。

图3 520nm波长条件下蓝莓酒花色苷HPLC图
Fig.3 HPLC chromatogram of the anthocyanin extract from blueberry wine detected at 520 nm
表4 蓝莓酒花色苷HPLC-DAD-MS/MS分离鉴定结果
Table 4 HPLC-MS data and tentative identification of anthocyaninsfrom blueberry wine
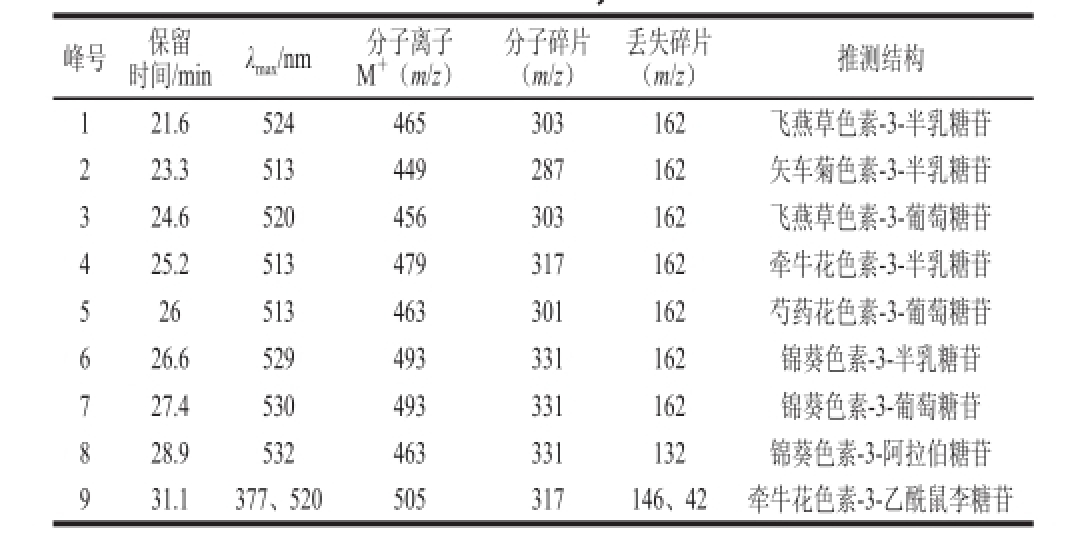
峰号保留时间/minλ max/nm分子离子M +(m/z)分子碎片(m/z)丢失碎片(m/z)推测结构121.6524465303162飞燕草色素-3-半乳糖苷223.3513449287162矢车菊色素-3-半乳糖苷324.6520456303162飞燕草色素-3-葡萄糖苷425.2513479317162牵牛花色素-3-半乳糖苷526513463301162芍药花色素-3-葡萄糖苷626.6529493331162锦葵色素-3-半乳糖苷727.4530493331162锦葵色素-3-葡萄糖苷828.9532463331132锦葵色素-3-阿拉伯糖苷931.1377、520505317146、42牵牛花色素-3-乙酰鼠李糖苷
由图3可知,蓝莓酒中至少有9 种花色苷,根据表4的保留时间和MS数据,结合资料 [5,13-14]分析可知,按照出峰顺序依次为飞燕草色素(m/z 303)、矢车菊色素(m/z 287)、牵牛花色素(m/z 317)、芍药花色素(m/z 301)以及锦葵色素(m/z 331),与图1、2中的出峰顺序基本一致。其中4号峰(M +m/z 479,分子碎片m/z 317,推测为牵牛花色素-3-葡萄糖苷)相对含量较少,而9号峰根据其在紫外-可见区377、520 nm波长处有吸收,分子离子峰为m/z 505,分子碎片为m/z 317,推测其为牵牛花色素-3-乙酰鼠李糖苷,说明经过发酵作用,蓝莓果中的牵牛花色素发生了酰化作用,且酰化的牵牛花色素出现在了蓝莓酒中。6~8号峰相对含量最高,对应的花色苷依次为锦葵色素-3-半乳糖苷、锦葵色素-3-葡萄糖苷和锦葵色素-3-阿拉伯糖苷,这与图1中的7、9~11号以及图2中的5~9号相对应,说明锦葵素类的花色苷依然是蓝莓酒中含量最高的花色苷。
2.3 蓝莓果、酒渣花色苷抗氧化能力的测定

图4 蓝莓果花色苷、蓝莓酒渣花色苷和VC清除ABTS
+·(A)、DPPH自由基(B)能力及还原力(C)
Fig.4 Scavenging effects of the anthocyanin extracts from blueberry fruits, blueberry wine lees and VC on ABTS radical (A), DPPH radical (B) and reduction ability (C)
表5 蓝莓果花色苷、蓝莓酒渣花色苷、VC清除自由基IICC
50值
Table 5 IC
50of free radical scavenging capacity for the anthocyaninextracts from blueberry fruits and blueberry wine lees and VC

注:同列不同字母表示差异显著(P<0.05)。
μg/mL样品ABTS +·清除IC 50DPPH自由基清除IC 50蓝莓果花色苷1.43±0.02 b3.28±0.03 b蓝莓酒渣花色苷1.19±0.03 a2.41±0.01 aVC5.40±0.07 c9.78±0.20 c
由图4及表5可知,蓝莓果和蓝莓酒渣花色苷的抗氧化能力均随质量浓度的增大而提高,两者抗氧化能力显著优于VC,且蓝莓酒渣花色苷抗氧化性显著强于蓝莓果花色苷。ABTS +·清除实验中,蓝莓果花色苷、蓝莓酒渣花色苷、VC清除ABTS +·的IC 50值大小顺序为VC>蓝莓果花色苷>蓝莓酒渣花色苷,表明蓝莓酒渣花色苷清除ABTS +·的能力显著强于蓝莓果花色苷,且两者均显著高于VC。部分研究表明酰化花色苷清除ABTS +·的能力要强于未酰化的花色苷,如张智等 [21]研究表明酰化的蓝靛果花色苷清除ABTS +·能力要显著强于未酰化花色苷。酰化的花色苷使得有机酸与糖链相连而形成了“三明治”构型,有效地提高了其稳定性 [22],从而更利于其发挥生理功效。蓝莓酒渣花色苷清除ABTS +·的能力好于蓝莓果花色苷可能与蓝莓酒渣中含有酰化的花色苷有关。清除DPPH自由基的能力可用来衡量果蔬等物质的抗氧化能力 [19]。由图4及表5可知,蓝莓果花色苷和蓝莓酒渣花色苷均有较强的清除DPPH自由基的能力,且清除率与其质量浓度呈正相关。蓝莓果花色苷、蓝莓酒渣花色苷、VC清除DPPH自由基的IC 50值大小顺序为VC>蓝莓果花色苷>蓝莓酒渣花色苷,表明蓝莓酒渣花色苷清除DPPH自由基的能力要显著强于蓝莓果花色苷,且二者均显著强于VC。研究表明酰化的花色苷清除DPPH自由基的能力要强于未酰化的花色苷,如Azevedo等 [23]研究表明酰化的锦葵素-3-葡萄糖苷清除DPPH自由基的能力要显著强于未酰化的花色苷,李路宁等 [24]的研究也表明酰化作用能提高蓝莓花色苷的抗氧化性。因此蓝莓酒渣花色苷清除DPPH自由基能力较强的原因可能与其中含有酰化的花色苷有关。由图4可知,蓝莓果花色苷、蓝莓酒渣花色苷的还原力与其质量浓度呈正相关,一般来说,样品的还原力与其抗氧化活性有明显的相关性 [5]。统计分析表明,在相同质量浓度条件下,蓝莓酒渣花色苷的还原力要显著强于蓝莓果花色苷,随着质量浓度的增大,这种优势更加明显,且蓝莓酒渣花色苷和蓝莓果花色苷的还原力均显著大于同等质量浓度条件下VC的还原力。这也可能与蓝莓酒渣中含有酰化的花色苷有关 [25]。当蓝莓果花色苷质量浓度为42.10 μg/mL时,吸光度为0.84±0.03,其质量浓度达到84.20 μg/mL时,吸光度为1.43±0.05;蓝莓酒渣花色苷质量浓度为45.33 μg/mL时,吸光度为1.17±0.02,其质量浓度为60.44 μg/mL时,吸光度达到1.42±0.01;VC质量浓度为40 μg/mL时,吸光度只有0.28±0.00,其质量浓度达到150.00 μg/mL时,吸光度为0.98±0.01。说明蓝莓果花色苷和蓝莓酒渣花色苷均具有较强的还原力。
采用乙醇提取及大孔树脂XAD-7HP对蓝莓果和蓝莓酒渣进行纯化,利用固相微萃取小柱对蓝莓酒进行纯化浓缩,所得花色苷含量分别为(210.52±5.74)、(151.12±0.88)、(8.93±0.14)mg/g。对纯化后的蓝莓果、蓝莓酒渣及蓝莓酒采用HPLC-MS联用技术进行结构鉴定比较,蓝莓果中鉴定出11 种花色苷,其中含量最高的为锦葵色素-3-葡萄糖苷,未鉴定出酰化的花色苷;蓝莓酒渣中鉴定出12 种花色苷,其中含量最高的仍为锦葵色素-3-葡萄糖苷,且鉴定出3 种酰化的花色苷,可能为矢车菊色素-3-乙酰葡萄糖苷、矢车菊色素-3-乙酰鼠李糖苷、飞燕草色素-3-乙酰阿拉伯糖苷;蓝莓酒中鉴定出9 种花色苷,含量最高的仍为锦葵色素-3-葡萄糖苷,鉴定出1 种酰化的花色苷,推测其为牵牛花色素-3-乙酰鼠李糖苷。表明蓝莓果种花色苷的种类和含量都十分丰富,且锦葵色素-3-葡萄糖苷为其中含量最高的花色苷,蓝莓果经过发酵所得的蓝莓酒及所剩的蓝莓酒渣中仍含有十分丰富的花色苷,其中锦葵色素-3-葡萄糖苷经过发酵作用其结构并未发生变化,而矢车菊色素、飞燕草色素经过发酵过程发生了酰化作用且出现在了蓝莓酒渣中,牵牛花色素在发酵过程中发生了酰化作用且出现在了蓝莓酒中。对蓝莓果和蓝莓酒渣花色苷的抗氧化能力的检测,通过统计分析表明蓝莓果和蓝莓酒渣花色苷均具有显著的清除ABTS +·、DPPH自由基的能力及较强的还原力,且都显著优于VC,而蓝莓酒渣花色苷的抗氧化性又要显著强于蓝莓果花色苷,这可能与蓝莓酒渣中含有酰化的花色苷有关 [21-25]。
参考文献:
[1] 史海芝, 刘惠民. 国内外蓝莓研究现状[J]. 江苏林业科技, 2009, 36(4): 48-51.
[2] 杜超, 马立志, 蒋家印. 蓝莓皮渣中花色苷的非酸化甲醇提取和纯化研究[J]. 江苏农业科学, 2015(5): 254-257.
[3] 安晓婷, 周涛, 李春阳, 等. 大孔树脂纯化蓝莓果渣多酚及其组成分析[J]. 食品科学, 2013, 34(20): 1-6. DOI:10.7506/spkx1002-6630-201320001.
[4] 王秀菊. 蓝莓干酒及蓝莓酒渣花色苷提取工艺的研究[D]. 泰安: 山东农业大学, 2010.
[5] 李颖畅. 蓝莓花色苷提取纯化及生理功能研究[D]. 沈阳: 沈阳农业大学, 2008.
[6] 马立志, 李金星, 刘志刚, 等. 蓝莓果汁及不同纯度蓝莓花色苷对原发性高血压大鼠血压的影响[J]. 食品科学, 2014, 35(19): 266-271. DOI:10.7506/spkx1002-6630-201419053.
[7] 陈琦, 李少伟, 贾宇臣, 等. 蓝莓花青素通过下调p53基因DNA甲基化抑制口腔癌KB细胞增殖及诱导细胞凋亡[J]. 遗传, 2014, 36(6): 566-573.
[8] HUANG W Y, ZHANG H C, LIU W X, et al. Survey of antioxidant capacity and phenolic composition of blueberry, blackberry, and strawberry in Nanjing[J]. Journal of Zhejiang University-Science B, 2012, 13(2): 94-102. DOI:10.1631/jzus.B1100137.
[9] ROOPCHAND D E, KUHN P, ROJO L E, et al. Blueberry polyphenol-enriched soybean flour reduces hyperglycemia, body weight gain and serum cholesterol in mice[J]. Pharmacological Research, 2013, 68(1): 59-67. DOI:10.1016/j.phrs.2012.11.008.
[10] SHEN X, SUN X H, XIE Q C, et al. Antimicrobial effect of blueberry (Vaccinium corymbosum L.) extracts against the growth of Listeria monocytogenes and Salmonella Enteritidis[J]. Food Control, 2014, 35(1): 159-165. DOI:10.1016/j.foodcont.2013.06.040.
[11] WHUTE A R, WILLIAMS C M. Effects of a single dose of a flavonoid-rich blueberry drink on memory in 8 to 10 y old children[J]. Nutrition, 2015, 31(3): 531-534.
[12] LIU Y X, SONG X, HAN Y, et al. Identification of anthocyanin components of wild Chinese blueberries and amelioration of lightinduced retinal damage in pigmented rabbit using whole berries[J]. Journal of Agricultural and Food Chemistry, 2011, 59(1): 356-363. DOI:10.1016/j.nut.2014.09.013.
[13] NICOUE E E, SAVARD S, BELKACEMI K. Anthocyanins in wild blueberries of quebec: extraction and identification[J]. Journal of Agricultural and Food Chemistry, 2007, 55(14): 5626-5635.
[14] BARNES J S, NGUYEN H P, SHEN S, et al. General method for extraction of blueberry anthocyanins and identi cation using high performance liquid chromatography-electrospray ionization-ion traptime of ight-mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(23): 4728-4735.
[15] 刘文旭, 黄午阳, 曾晓雄, 等. 草莓、黑莓、蓝莓中多酚类物质及其抗氧化活性研究[J]. 食品科学, 2011, 32(23): 130-133.
[16] 刘晓燕, 李金星, 刘志刚, 等. 中压液相色谱与大孔树脂联用纯化蓝莓果渣中花色苷[J]. 食品科技, 2014, 39(6): 207-213.
[17] 何会, 宋哲, 谢碧秀, 等. 荔枝皮花色苷体外抗氧化能力研究[J]. 食品科学, 2009, 30(11): 22-25. DOI:10.3321/j.issn:1002-6630.2009.11.003.
[18] 侯小歌. 不同工艺方法对赤霞珠干红葡萄酒多酚物质的影响研究[D].杨凌: 西北农林科技大学, 2006.
[19] 周玮婧, 隋勇, 孙智达, 等. 荔枝皮原花青素与VC、VE的协同抗氧化研究[J]. 食品科学, 2012, 33(3): 5-8.
[20] WU X L, PRIOR R L. Systematic identification and characterization of anthocyanins by HPLC-ESI-MS/MS in common foods in the United States: fruits and berries[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2589-2599.
[21] 张智, 臧云, 王群. 酰基化蓝靛果花色苷的抗氧化性研究[J]. 现代食品科技, 2013, 29(3): 534-538.
[22] 田小燕, 邓洁红, 位佳静, 等. 花色苷有机酸酰化及黄酮辅色研究进展[J]. 农产品加工(学刊), 2012(11): 126-131.
[23] AZEVEDO J, TEIXEIRA N, OLIVEIRA J, et al. Effect of sugar acylation on the antioxidant properties of Vitis vinifera red grape malvidin-3-glucoside[J]. International Journal of Food Science and Technology, 2011, 46(2): 343-349. DOI:10.1111/j.1365-2621.2010.02497.x.
[24] 李路宁, 陈威, 赵立仪, 等. 蓝莓花青素的酰化及其抗氧化性评价[J].食品工业科技, 2014, 35(6): 102-106.
[25] MATSUFUJI H, KIDO H, MISAWA H, et al. Stability to light, heat, and hydrogen peroxide at different pH values and DPPH radical scavenging activity of acylated anthocyanins from red radish extract[J]. Journal of Agricultural and Food Chemistry, 2007, 55(9): 3692-3701.
Composition Analysis of Anthocyanidins in Blueberry Wine Lees, Blueberries and Blueberry Wine and Comparison of Antioxidant Activity of Anthocyanidins in Blueberries and Wine Lees
ZHANG Yang, XIE Bijun, SUN Zhida*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Abstract:Anthocyanidins from blueberries and blueberry wine lees were purified by XAD-7HP macroporous resin chromatography. Anthocyanidins from blueberry wine were purified and concentrated by solid phase extraction (SPE) using a Supelclean ENVI-18 cartridge. High performance liquid chromatography with diode array detection combined with electrospray ionization tandem mass spectrometry (HPLC-DAD-ESI-MS/MS) was used to analyze the anthocyanidin composition of extracts. Antioxidant activity of anthocyanidins in blueberries and blueberry wine lees was evaluated. The results indicated that the contents of anthocyanidins in the extracts from blueberries, blueberry wine lees and blueberry wine were (210.52 ± 5.74), (151.12 ± 0.88), and (8.93 ± 0.14) mg/g, respectively. A total of eleven anthocyanins were identified in the extracts from blueberries while twelve anthocyanins in the extracts from blueberry wine lees, among which three anthocyanins were acidylated. Nine anthocyanins in the extracts from blueberry wine were identified, one of which was acidylated. The IC 50values of ABTS radical scavenging activity for anthocyanidins from blueberries and blueberry wine lees were (1.43 ± 0.02) and (1.19 ± 0.03) μg/mL, respectively, while those for scavenging effects on 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical were (3.28 ± 0.03) and (2.41 ± 0.01) μg/mL, respectively. Free radical scavenging effects and reducing power of the anthocyanins from blueberris and blueberry wine lees were much stronger than those of VC. The results indicated that the antioxidant activity of anthocyanidins in blueberry wine lees was much stronger better than that of blueberries.
Key words:blueberry wine lees; anthocyanidins; composition analysis; antioxidant activity
DOI:10.7506/spkx1002-6630-201602029
中图分类号:TS255.2
文献标志码:A
文章编号:1002-6630(2016)02-0165-07
引文格式:
张杨, 谢笔钧, 孙智达. 蓝莓酒渣、果、酒中花色苷成分鉴定及酒渣与果中花色苷抗氧化活性比较[J]. 食品科学, 2016,37(2): 165-171. DOI:10.7506/spkx1002-6630-201602029. http://www.spkx.net.cn
ZHANG Yang, XIE Bijun, SUN Zhida. Composition analysis of anthocyanidins in blueberry wine lees, blueberries and blueberry wine and comparison of antioxidant activity of anthocyanidins in blueberries and wine lees[J]. Food Science, 2016, 37(2): 165-171. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201602029. http://www.spkx.net.cn
收稿日期:2015-04-13
作者简介:张杨(1989—),女,硕士研究生,主要从事天然产物化学研究。E-mail:1048624802@qq.com
*通信作者:孙智达(1963—),男,教授,博士,主要从事天然产物化学和毒理研究。E-mail:sunzhida@mail.hzau.edu.cn