表1 正交试验因素与水平
Table 1 Factors and their coded levels used in orthogonal array design

水平因素A甲醇体积/mLB超声时间/minC提取次数1 10201 2 20302 3 30403
周伟娥 1,2,凌 云 1,张 元 1,李绍辉 1,蒋受军 2,姚美伊 1,李红娜 1,郑 阳 1,张 峰 1,*
(1.中国检验检疫科学研究院食品安全研究所,北京 100123;2.广西中医药大学药学院,广西 南宁 530299)
摘 要:通过正交试验分析法对肉制品中栀子黄色素提取方法进行优化。利用正交试验设计考察提取溶剂体积、超声时间和提取次数对肉制品中栀子黄色素提取回收率的影响。 结果表明,肉制品中栀子黄色素的最优提取条件为:甲醇为提取溶剂、固液比1∶6(g/mL)、超声提取时间20 min、提取2 次;建立高效液相色谱法测定肉制品中栀子黄色素中藏花素和藏花酸方法的线性范围为0.5~50 mg/mL,相关系数大于0.999,检出限不高于0.07 μg/g,加标平均回收率为83.51%~96.00%,相对标准偏差不大于2.94%。该方法准确度高、简单、快速,可适用于肉制品中栀子黄色素中藏花素和藏花酸含量检测。
关键词:高效液相色谱法;正交试验;肉制品;藏花素;藏花酸;栀子黄
随着社会的发展和人民生活水平的提高,食品添加剂的安全问题越来越受到人们重视,也逐渐成为我国重要的食品安全问题 [1-3]。2002年,我国食品工业“十五”发展规划中表明我国食品添加剂发展的方向是天然、营养、多功能且安全可靠等。着色剂作为是食品添加剂中重要一员,受到了关注 [4-7]。其可分为食用合成色素和食用天然色素 [8],食用合成色素虽具备颜色鲜艳,种类多样等优点,但其毒害作用不容忽视,许多国家都限制或禁止其使用 [9-11],使其应用受到限制 [12],而天然色素具有天然无毒害的特点,越来越受欢迎 [13-14]。
栀子黄色素是自然界罕见的水溶性类胡萝卜天然色素,其主要有效成分是藏花素和藏花酸 [15]。其有清热祛火,凉血利胆,降低胆固醇,安全无毒等作用,是一种集着色、营养、保健多功能为一体的食用植物色素 [16]。日本和我国在许多食品中都已添加了栀子黄色素 [17-19],GB 2760—2014《食品添加剂使用标准》中也规定了栀子黄的最大使用量,但目前对食品中栀子黄的检测方法的研究较少且过去往往认为栀子苷是栀子黄的主要成分,以栀子苷为对照品检测食品中栀子黄含量 [20-21],但GB/T 7912—2010《食品添加剂栀子黄》中规定了栀子黄的主要成分是藏花素和藏花酸,以栀子苷为主成分是不够合理的,所以食品中栀子黄含量测定存在不同意见 [22-25]。为了有效控制食品中栀子黄的用量,本实验选择以藏花素和藏花酸为对照品,建立高效液相色谱分析方法,以监测市场食品中栀子黄色素的用量。
1.1 材料与试剂
藏花素、藏花酸(纯度98.0%) 美国Chroma DEX公司;乙腈、甲醇、正己烷(均为色谱纯) 美国Fisher Scientific公司;乙酸(色谱纯) 西陇化工有限公司;0.22 μm滤膜 天津津隆公司;盐焗鸡熟肉制品(含栀子黄) 香河正大有限公司。
1.2 仪器与设备
LC-30AD高效液相色谱仪、SPD-M20A二极管阵列检测、SIL-30AC自动进样器 日本岛津公司;R-134A旋转蒸发仪 瑞士Büchi公司;KQ-500DE超声仪 昆山市超声仪有限公司;十万分之一电子天平 美国Mettler Toledo公司;高速台式冷冻离心机 美国Beckman Coulter公司;Muti Shaker Mms振荡仪 日本Tokyo Rirakikai公司。
1.3 方法
1.3.1 标准溶液的配制
精确称取藏花素和藏花酸各5.0 mg,分别置于50 mL的棕色容量瓶中,甲醇定容,配成0.1 mg/mL储备液,并在18 ℃保存待用。
1.3.2 标准曲线的绘制
准确移取适量藏花素和藏花酸储备标准溶液到10 mL棕色容量瓶中,用甲醇稀释,配成藏花素和藏花酸的一系列标准曲线的质量浓度为0.5、1、2、5、10、20、50 μg/mL溶液,在优化后的色谱条件下测定,以各物质的峰面积为纵坐标,质量浓度为横坐标绘制标准曲线。
1.3.3 样品前处理
1.3.3.1 色谱条件优化所用基本前处理方法
盐焗鸡样品切成小块后均质,准确称取5.00 g样品于50 mL离心管中,用30 mL甲醇提取,超声20 min(500 W、40 kHz),离心10 min(转速为5 000 r/min)后,取出上清液,再用30 mL上述提取溶剂和提取残渣,合并提取液并混匀,旋转蒸发仪浓缩至10 mL,过0.22 μm滤膜,待高效液相色谱测定。
1.3.3.2 样品提取方式比较
比较超声与振荡的提取方式。将盐焗鸡熟肉制品切成小块后均质,准确称取5.00 g,平行取12 份,用30 mL甲醇溶解样品,其中6 份超声30 min(功率500 W,频率40 kHz);另外6 份样品振荡30 min;12 份样品离心10 min(转速10 000 r/min),取出上清液,过0.22 μm滤膜,待高效液相色谱测定。
1.3.3.3 提取溶剂比较
实验考察水、甲醇、乙醇溶剂对样品中栀子黄提取效率的影响。盐焗鸡熟肉制品切成小块后均质,准确称取5.00 g,平行取18 份,分别用30 mL水、甲醇和乙醇溶解样品,各6 份,超声30 min(功率500 W,频率40 kHz),离心10 min(转速10 000 r/min),取出上清液,过0.22 μm滤膜,待高效液相色谱测定。
1.3.3.4 单因素及正交试验
采用单因素试验考察甲醇提取溶剂的体积、超声时间和提取次数对盐焗鸡样品中的栀子黄提取量的影响。
表1 正交试验因素与水平
Table 1 Factors and their coded levels used in orthogonal array design

水平因素A甲醇体积/mLB超声时间/minC提取次数1 10201 2 20302 3 30403
采用L 9(3 4)正交试验表,考察三因素三水平的最佳组合,以获得肉制品中栀子黄的最佳提取条件。正交试验样品采用加标样品。在5.00 g空白样品中分别加入0.5 mL 0.1 mg/mL藏花素和藏花酸储备液,根据正交试验表1方案处理样品,采用高效液相色谱检测,并计算提取回收率,公式如下:
式中:C 1为藏花素和藏花酸高效液相色谱测定并计算所得质量浓度;C 2为藏花素和藏花酸理论质量浓度5 μg/mL。
1.3.4 色谱条件
Extend-C 18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.003%乙酸溶液(B),梯度洗脱(0.0~1.0 min,20% A;1.0~8.0 min,20%~60% A;8.0~8.1 min,60%~70% A;8.10~13.0 min,70%~98% A;13.0~15.0 min,98%~20% A;15.0~20.0 min,20% A);流速1.0 mL/min;检测波长442(藏花素)、425 nm(藏花酸);进样量10 μL;柱温为常温。
1.3.5 加标回收率实验
取盐焗鸡肉制样品(含栀子黄)18 份,每份5.00 g,加入低、中、高混合标品,各6 份,按照1.3.3节的样品前处理方法处理样品,进行加标回收率实验。
1.3.6 精密度、重复性和稳定性实验
精密度实验:精密移取1 mL 10 μg/mL的混合标品,按照1.3.4节色谱条件重复进样6 次,分别以藏花素和藏花酸的峰面积为对象,计算其相对标准偏差(relative standard deviation,RSD),以考察色谱仪器的精密度。
重复性实验:取同一盐焗鸡样品6 份,每份5.00 g,按照1.3.3节处理样品,按照1.3.4节色谱条件测定藏花素和藏花酸的峰面积,并计算RSD。
稳定性实验:取一盐焗鸡样品5.0 g,按照1.3.3节处理样品后,分别在0、2、4、6、8 h进样测定,藏花素和藏花酸的峰面积,并计算RSD。
2.1 色谱条件的优化
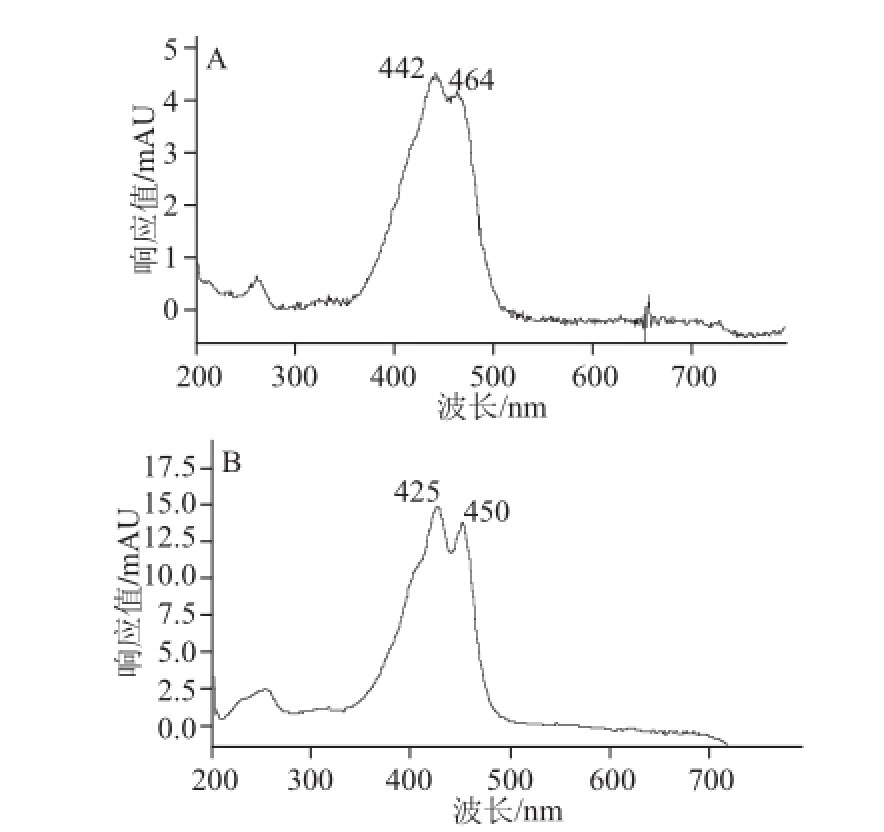
图1 藏花素(A)、藏花酸(B)光谱图
Fig.1 UV scanning spectra of crocin (A) and crocetion (B)
本实验考察了最大吸收波长、流动相组成和梯度洗脱条件。对藏花素和藏花酸标准溶液进行扫描,结果显示藏花素在波长442 nm处有最大吸收,藏花酸在波长425 nm处有最大吸收,如图1所示。比较了流动相甲醇-水溶液、甲醇-0.003%乙酸溶液、乙腈-水溶液、乙腈-0.003%乙酸溶液的色谱峰形和响应,结果显示乙腈-0.003%乙酸溶液比甲醇-0.003%乙酸溶液峰形好,比乙腈-水溶液响应高,酸可以增强响应,提高检测的灵敏度,结果采用乙腈-0.003%乙酸溶液作为流动相。实验通过1.3.4节梯度洗脱条件,使藏花素和藏花酸获得良好的分离度。
在1.3.3.1节前处理方法和1.3.4节的色谱条件下,分别测定了空白溶剂,混标溶液和盐焗鸡样品色谱图,如图2所示。色谱图在15 min内完成出峰,分离度好,专属性强。
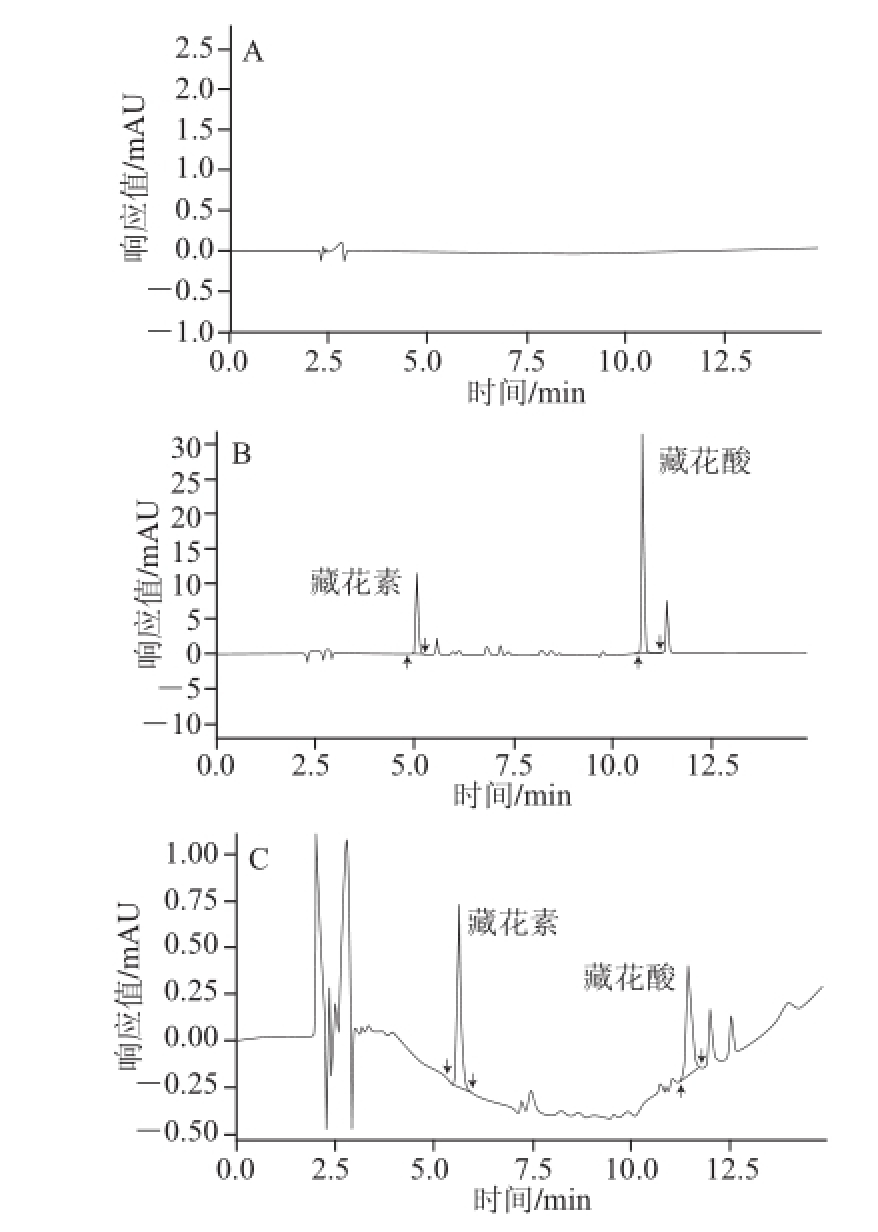
图2 栀子黄的色谱图
Fig.2 Chromatograms of blank sample, gardenia yellow standard and salt-roasted chicken
A.空白溶液;B.栀子黄标准溶液;C.盐焗鸡样品。
2.2 前处理方法的优化
2.2.1 提取方式的选择
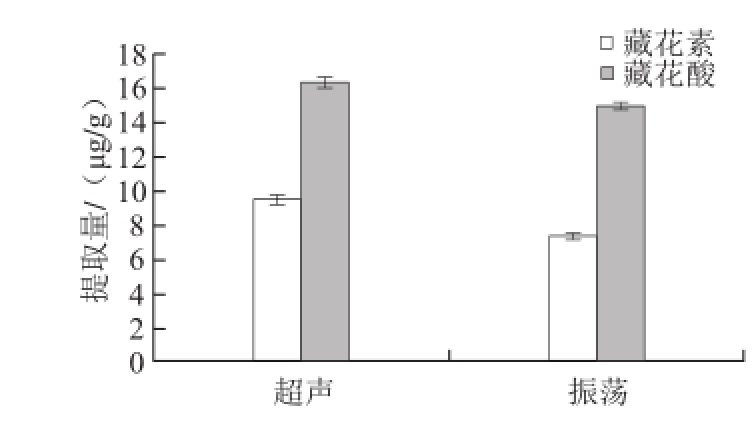
图3 提取方式的比较
Fig.3 Comparison of two extraction methods
超声对栀子黄色素的提取效率比振荡的高一些,结果如图3所示。可能是因为超声的空化作用更有利于栀子黄色素溶于甲醇溶剂中,所以结果采用超声提取样品。
2.2.2 提取溶剂的选择

图4 提取溶剂的选择
Fig.4 selection of optimal extraction solvent
图4结果显示,甲醇更有利于藏花素的提取,乙醇更有利于藏花酸的提取。但栀子黄的提取量是由藏花素和藏花酸的提取量推算而得,甲醇同时提取两者效率比乙醇更优,所以采用甲醇溶液提取盐焗鸡肉制品中的栀子黄。
2.2.3 单因素试验的考察
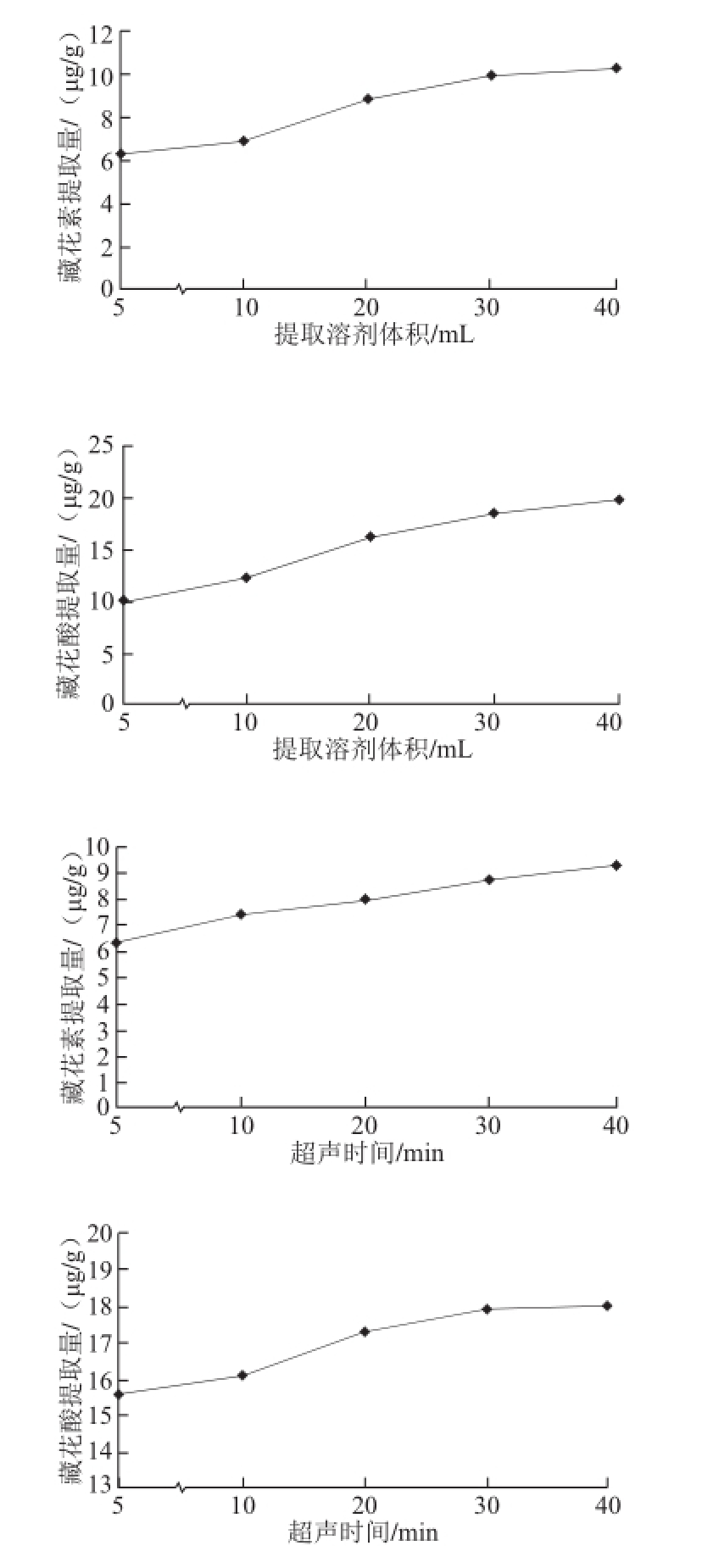

图5 各因素对栀子黄提取量的影响
Fig.5 Effect of extraction conditions on the content of crocetion analyzed by one-factor-at-a-time design
如图5所示,甲醇提取溶剂体积40 mL,超声时间40 min,提取5 次,栀子黄的提取量达最高。
2.2.4 正交试验优化
从表2可以看出,R A>R C>R B,3 个因素对盐焗鸡肉制品中的栀子黄提取回收率的影响大小依次是甲醇体积>提取次数>超声时间。正交试验得出的最优提取工艺是A 3B 2C 3。3 个因素中,甲醇提取溶液体积因素影响最为显著。综合考虑试验时间和强度,优化的提取条件选为A 3B 1C 2,即甲醇提取溶液体积30 mL,超声时间20 min,提取次数2 次。
表2 L
9(3
4)正交试验设计及结果
Table 2 L
9(3
4) orthogonal array design with experimental results
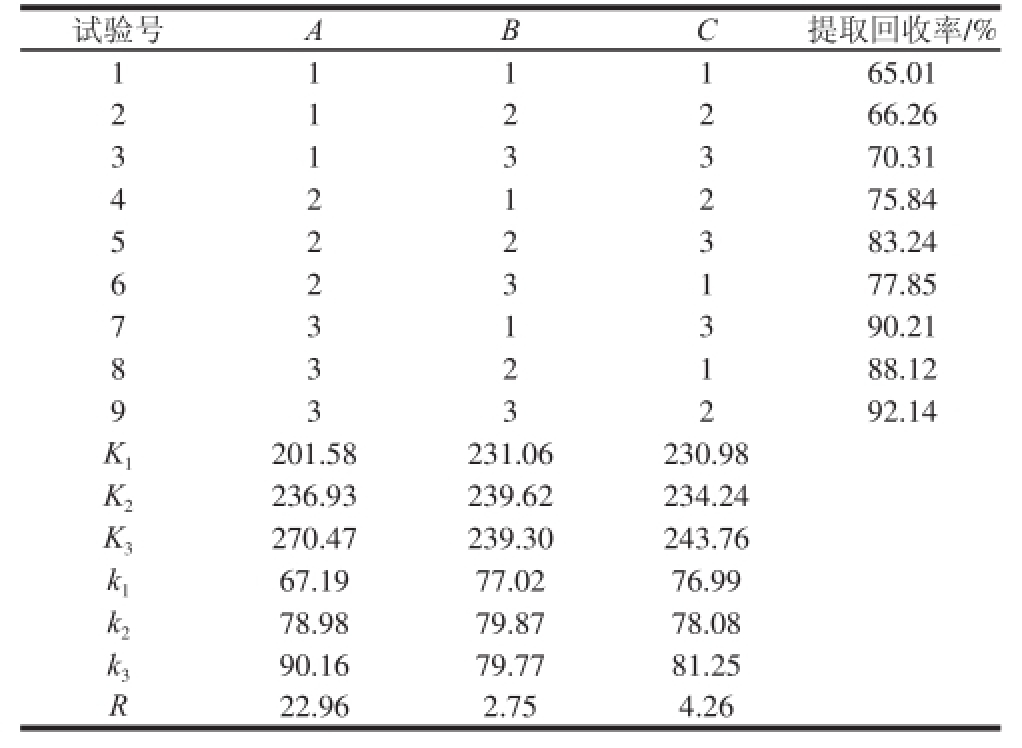
试验号ABC提取回收率/% 1 1 1 1 65.01 2 66.26 3 1 3 3 70.31 1 2 2 4 75.84 5 2 2 3 83.24 2 1 2 6 77.85 7 3 1 3 90.21 2 3 1 8 88.12 9 3 3 2 92.14 3 2 1 K 1201.58231.06230.98 K 2236.93239.62234.24 K 3270.47239.30243.76 k 167.19 77.0276.99 k 278.98 79.87 78.08 k 390.16 79.77 81.25 R 22.962.75 4.26
2.3 验证实验
按A 3B 1C 2条件进行3 次平行实验,肉制品中的栀子黄提取回收率为93.65%,高于表2中的每项实验,故选择A 3B 1C 2为最佳提取工艺条件。
2.4 净化方式的优化
本实验对比了液液萃取、固相萃取,溶剂萃取的净化方式。盐焗鸡熟肉制品切成小块均质,准确称取5.00 g,平行取18 份,加入30 mL甲醇溶液,超声30 min(功率500 W,频率40 kHz),离心10 min(转速10 000 r/min),取出上清液。取6 份上清液加入等体积的正己烷液液萃取脱脂取上清液,用旋转蒸发仪浓缩,用2 mL甲醇溶解过膜,待测;取6 份上清液通过HLB固相萃取柱净化,分别用5 mL水和甲醇依次活化后上样,用5 mL甲醇洗脱,洗脱液氮吹干后用2 mL甲醇溶解,过0.22 μm滤膜,待高效液相色谱测定;取6 份甲醇提取后的残渣再用30 mL的甲醇溶剂萃取涡旋10 min后,离心10 min(转速10 000 r/min),合并提取液后用旋转蒸发仪浓缩,残渣定容至10 mL后过膜,待高效液相色谱测定。通过液液萃取、固相萃取和溶剂萃取的净化方式的比较,测得藏花素平均含量为6.23、5.52、10.46 μg/g;藏花酸的平均含量为11.45、9.89、20.69 μg/g。在色谱图上分析,3 种净化方式都避免了杂质的干扰,而用甲醇溶剂萃取能够保证较高而稳定的回收率。所以选择甲醇溶剂萃取。
2.5 线性关系的考察
在1.3.4节色谱条件下,对系列质量浓度的混标溶液进行检测,将标准溶液逐步稀释至其响应值为噪音的3 倍(即信噪比为3∶1)所对应的溶液质量浓度为检出限。同时将加标样品经1.3.3节前处理,测得响应值为噪音的10 倍(即信噪比10∶1)所对应的溶液质量浓度为方法定量限。其回归方程、相对系数、线性范围、检出限和定量限结果见表3。由表3可知,该方法线性良好,检出限和定量限符合国家标准食品添加剂的残留检测要求。
表3 藏花素和藏花酸回归方程、检测限和定量限
Table 3 Regression equations, limits of detection and limits ofquantitation for crocin and crocetion
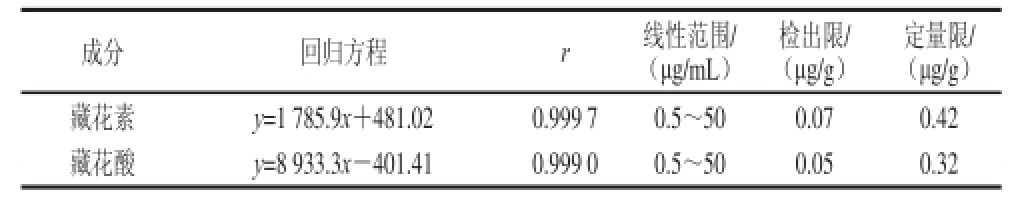
定量限/(μg/g)藏花素y=1 785.9x+481.020.999 70.5~500.070.42藏花酸y=8 933.3x-401.410.999 00.5~500.05 0.32成分回归方程r线性范围/(μg/mL)检出限/(μg/g)
2.6 加标回收率考察
如表4所示,样品中藏花素和藏花酸的回收率在83.51%~96.00%间,回收率良好,该方法具有可行性。
表4 加标回收率考察
T
Table 4 Recovery rates of crocin and crocetion fromspiked real sample
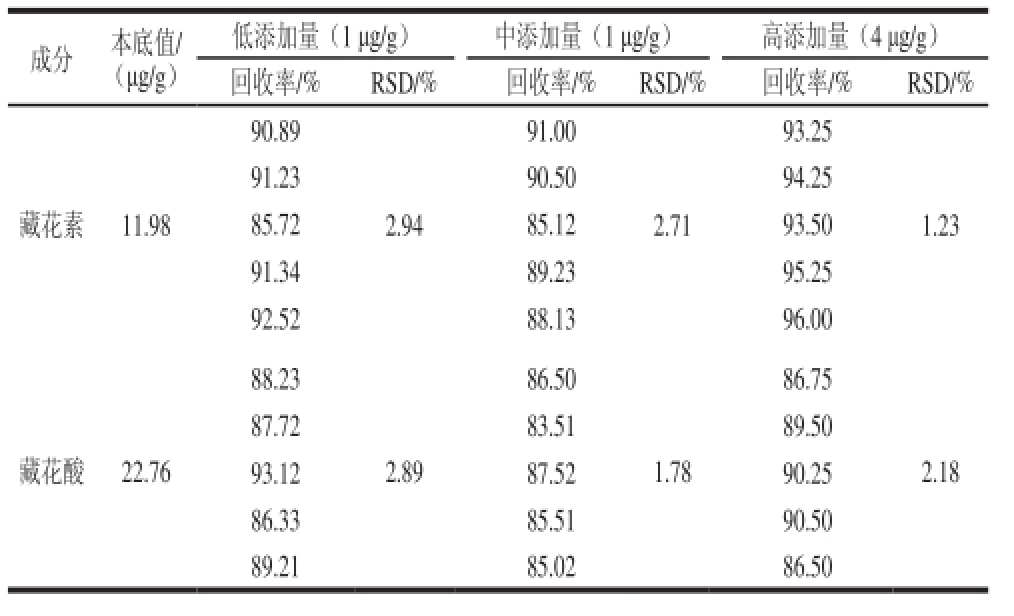
成分本底值/(μg/g)低添加量(1 μg/g)中添加量(1 μg/g)高添加量(4 μg/g)回收率/%RSD/%回收率/%RSD/%回收率/%RSD/% 90.89 91.00 93.25藏花素11.98 91.2390.50 94.25 85.7285.12 93.50 91.3489.23 95.25 92.5288.1396.00 2.94 2.71 1.23 88.23 86.50 86.75藏花酸22.76 87.7283.5189.50 93.1287.5290.25 86.3385.5190.50 89.2185.0286.50 2.89 1.78 2.18
2.7 精密度、重复性和稳定性考察
精密度实验结果表明,藏花素和藏花酸的RSD分别为0.04%和0.12%,可以看出仪器具有较高的精密度。
重复性实验结果表明,藏花素峰面积的RSD(n=6)为1.28%;测得藏花酸峰面积的RSD(n=6)为1.68%,说明该方法重复性良好。
稳定性实验结果表明,分别测得藏花素和藏花酸峰面积的RSD(n=6)为2.21%和1.86%,可见在8 h内稳定性良好。
2.8 样品的测定
表5 6个批次的盐焗肉制品栀子黄色素含量
Table 5 Contents of gardenia yellow in six batches of salt-roasted chicken

μg/g成分样品1样品2样品3样品4样品5样品6藏花素11.30 13.2112.4514.9211.8312.88藏花酸23.5022.1221.3220.6722.9721.43
6 个批次的盐焗鸡样品的测定结果如表5所示,根据我国食品添加剂使用标准规定肉制品中栀子黄的最大使用量为1 500 μg/g。由结果可知,6 个批次的盐焗鸡肉制样品中藏花素和藏花酸的含量之和远小于我国食品添加剂使用标准规定肉制品中栀子黄的最大使用量,可推测6 个批次的盐焗鸡肉制品中栀子黄的含量符合标准。
本实验通过正交试验得出肉制品中栀子黄的最优提取条件为甲醇溶剂体积为30 mL、超声提取时间20 min、提取2 次,并采用Agilent Extent-C 18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-0.003%乙酸溶液(梯度洗脱),流速1.0 mL/min,藏花素和藏花酸检测波长分别为442 nm和425 nm。结果表明藏花素和藏花酸在15 min内出峰,分离效果好,线性范围为0.5~50 mg/mL,相关系数大于0.999,平均回收率为83.51%~96.00%,RSD为1.23%~2.94%,检出限不高于0.07 μg/g,最终建立了一种准确、简单、快速的高效液相色谱法测定肉制品中藏花素和藏花酸的含量,为今后测定食品中的栀子黄提供有益的参考。
参考文献:
[1] 王明强, 陈顺浩, 浦绍飞, 等. 预防和控制食品添加剂对食品安全的影响及防止对策[J]. 中国调味品, 2012, 37(4): 14-19. DOI:10.3969/ j.issn.1000-9973.2012.04.004.
[2] WILCOCK A, PUN M, KHANONA J, et al. Consumer attitudes, knowledge and behaviour: a review of food safety issues[J]. Trends in Food Science and Technology, 2004, 15(2): 56-66.
[3] 卢剑, 孙勇, 耿宁, 等. 我国食品安全问题及监管模式建立研究[J].食品科学, 2010, 31(5): 319-323.
[4] 齐晓东, 刘娟娟, 唐欣, 等. 食品着色剂行业发展及存在问题[J]. 粮油食品科技, 2011, 19(2): 57-60. DOI:10.3969/ j.issn.1007-7561.2011.02.020.
[5] 毛希琴, 李春玲, 任国杰, 等. 高效液相色谱法同时检测化妆品中38 种限用着色剂[J]. 色谱, 2015, 33(3): 282-290. DOI:10.3724/ SP.J.1123.2014.11017.
[6] 魏莹, 吴之翔. 简述着色剂在调味品、食品中的应用[J]. 中国调味品, 2014, 39(5): 126-128. DOI:10.3969/j.issn.1000-9973.2014. 05.033.
[7] 马育松, 李玮, 艾连峰, 等. 高效液相色谱/二极管阵列检测器同时测定辣椒及其制品中11 种脂溶性着色剂[J]. 分析测试学报, 2014, 33(1): 93-97. DOI:10.3969/j.issn.1004-4957.2014.01.017.
[8] ABEROUMAND A. A review article on edible pigments properties and sources as natural biocolorants in foodstuff and food industry[J]. World Journal of Dairy and Food Sciences, 2011, 6(1): 71-78.
[9] 刘慧慧, 宫向红, 徐英江, 等. 固相萃取-高效液相色谱法同时测定海米中10 种合成色素[J]. 食品科学, 2014, 35(4): 170-173. DOI:10.7506/spkx1002-6630-201404035.
[10] 赵延胜, 杨敏莉, 张峰, 等. 液相色谱/四极杆-飞行时间质谱法筛查奶酪中29 种禁用和限用合成色素[J]. 色谱, 2011, 29(7): 631-636. DOI:10.3724/SP.J.1123.2011.00631.
[11] 赵延胜, 董英, 张峰, 等. 食品中46 种禁限用合成色素的分级提取净化体系研究[J]. 分析化学, 2012, 40(2): 249-256. DOI:10.3724/ SP.J.1096.2012.10443.
[12] 陆晓红. 饮料中合成着色剂高效液相测定预处理方法的研究[J]. 中国卫生检验志, 2007, 17(8): 1516-1517. DOI:10.3969/ j.issn.1004-8685.2007.08.076.
[13] 袁超, 鲁晶鸽. 天然食用色素的功能及应用研究进展[J]. 粮食与油脂, 2015, 28(2): 5-8.
[14] LU R L, LUO F F, HU F L, et al. Identification and production of a novel natural pigment, cordycepoid A, from Cordyceps bifusispora[J]. Applied Microbiology and Biotechnology, 2013, 97(14): 6241-6249.
[15] 曾凡逵, 李爱军, 黄雪松, 等. 栀子黄色素的研究现状[J]. 中国食品添加剂, 2006(2): 110-113. DOI:10.3969/j.issn.1006-2513. 2006.02.028.
[16] 杨博媛, 惠伯棣. 栀子黄色素的生物学功能及安全性的研究进展[J]. 中国食品添加剂, 2013(4): 193-200. DOI:10.3969/ j.issn.1006-2513.2013.04.027.
[17] 梅蕾蕾, 胡晓. 栀子中藏花素的药理学和药代动力学研究进展[J].中国临床药理学与治疗学, 2013, 18(7): 837-840.
[18] 中日两国食品着色剂标准研讨会第二次会议纪要[J]. 中国食品添加剂, 2005(2): 135.
[19] 钟旭东. 浅谈中日天然色素的特性和应用[J]. 中国食品工业, 2009(6): 20-21. DOI:10.3969/j.issn.1006-6195.2009.06.006.
[20] 陈艳华, 于中军. 高效液相色谱法测定蛋糕中的栀子黄[J]. 中国实用医药, 2010, 5(24): 155. DOI:10.3969/j.issn.1673-7555.2010.24.123.
[21] 李严巍, 王梅, 阎惠芳, 等. 食品中桅子黄色素的定性定量方法[J].食品与发酵工业, 1996(6): 39-42. DOI:10.13995/j.cnki.11-1802/ ts.1996.06.009.
[22] YAMADA S, OSHIMA H, OSHIMA H, et al. Adoption of crocetin as an indicator compound for detection of gardenia yellow in food products: analysis of natural coloring matters in food[J]. Japanese Society for Food Hygiene and Safety, 1996, 37(6): 372-377.
[23] 李永利, 张焱, 翟志雷, 等. 高效液相色谱法测定食品中栀子黄[J]. 中国卫生检验杂志, 2008, 18(1): 72. DOI:10.3969/ j.issn.1004-8685.2008.01.030.
[24] 丁艳, 孙益民, 马芝森, 等. 高效液相色谱法测定食品中的栀子黄的研究[J]. 食品科学, 2006, 27(2): 199-202.
[25] 赵璨, 张浩, 陈阳, 等. 栀子黄色素不同标准的合理性探讨[J].华西药学杂志, 2012, 27(5): 554-556. DOI:10.13375/j.cnki. wcjps.2012.05.011.
Determination of Gardenia Yellow in Meat Products by High Performance Liquid Chromatography
ZHOU Wei’e
1,2, LING Yun
1, ZHANG Yuan
1, LI Shaohui
1, JIANG Shoujun
2, YAO Meiyi
1, LI Hongna
1, ZHENG Yang
1, ZHANG Feng
1,*
(1. Institute of Food Safety, Chinese Academy of Inspection and Quarantine, Beijing 100123, China; 2. College of Pharmacy, Guangxi University of Traditional Chinese Med icine, Nanning 530299, China)
Abstract:With the aim of developing an optimal sample preparation method for the determination of gardenia yellow in meat products by high performance liquid chromatography (HPLC), orthogonal design methodology was employed to optimize the recovery rate of gardenia yellow from samples with respect to four extraction conditions including solid/solvent ratio (g/mL), ultrasonic extraction time and extraction number. The optimal extraction conditions were achieve d as follows: samples were ultrasonically extracted twice for 20 min each using methanol with a solid/solvent ratio of 1:6 (g/mL). The HPLC method established based on these optimized extraction conditions exhibited a good linear relationship in the range from 0.5 to 50 mg/mL with correlation coefficient of higher than 0.999 and a detection limit of 0.07 μg/g for crocin and crocetion in meat products. The mean spike recovery rates for both gardenia yellows in meat products were in the range of 83.51%–96.00% with a relative standard deviation (RSD) of 2.94%. This method is accurate, simple, quick and suitable for the determination of crocin and crocetion in meat products.
Key words:high performance liquid chromatography; orthogonal experiment; meat; crocin; crocetion; gardenia yellow
DOI:10.7506/spkx1002-6630-201602033
中图分类号:O657.72
文献标志码:A
文章编号:1002-6630(2016)02-0187-06
引文格式:
周伟娥, 凌云, 张元, 等. 高效液相色谱法测定肉制品中栀子黄色素含量[J]. 食品科学, 2016, 37(2): 187-192. DOI:10.7506/spkx1002-6630-201602033. http://www.spkx.net.cn
ZHOU Wei’e, LING Yun, ZHANG Yuan, et al. Determination of gardenia yellow in meat products by high performance liquid chromatography[J]. Food Science, 2016, 37(2): 187-192. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201602033. http://www.spkx.net.cn
收稿日期:2015-04-26
基金项目:国家重大科学仪器设备开发专项(2012YQ14000806);北京市科技计划课题(2141100002614020);国家质检总局科技计划项目(2013K202);调味品中添加剂及非食品添加物质的系统筛查及确证方法研究项目(2013IK198)
作者简介:周伟娥(1988—),女,硕士研究生,研究方向为食品药品分析和安全性评价。E-mail:824047422@qq.com
*通信作者:张峰(1974—),男,研究员,博士,研究方向为分析化学。E-mail:fengzhang@126.com