葡萄冷藏时间对贮后货架期芳香物质的影响
张 鹏
1,邵 丹
2,李江阔
1,*,颜廷才
2,陈绍慧
1
(1.国家农产品保鲜工程技术研究中心(天津),天津市农产品采后生理与贮藏保鲜重点实验室,天津 300384;2.沈阳农业大学食品学院,辽宁 沈阳 110866)
摘 要:为明确冷藏时间对葡萄贮后货架期芳香物质的影响,以‘无核寒香蜜’葡萄为试材,运用顶空固相微萃取-气相色谱-质谱(head space solid-phase microextraction and gas chromatography mass spectrometry,HS-SPME-GCMS)联用技术检测冷藏15、45 d出库后常温货架期间(0、3、6 d)挥发性成分的变化,并采用电子鼻对不同冷藏期(15、30、45、60 d)出库后常温货架的果实进行判别分析。结果表明,葡萄的挥发性成分主要由酯类、醛类和醇类组成,主要挥发性成分为乙酸乙酯、青叶醛、正己醇、叶醇、香茅醇。冷藏45 d后常温货架期间酯类和醇类物质的相对含量均低于冷藏15 d同期果实,醛类物质则较高。电子鼻结果表明,通过线性判别分析可以有效区分不同冷藏期的葡萄,贮后货架期间,除冷藏15 d出库后0、3 d货架重叠外,其余冷藏期货架期间均互不重叠,即随着贮后常温货架的延长,葡萄中挥发性成分变化较大,电子鼻区分效果越加明显;负荷加载分析分析得出,W1W(硫化氢、萜烯类)、W1S(芳香成分)、W2S(乙醇)传感器对挥发性气味的贡献较大,与HS-SPME-GC-MS分析相佐证。因此,HS-SPME-GC-MS结合电子鼻对葡萄冷藏时间及贮后货架期的芳香物质判别具有可行性。
关键词:葡萄;芳香物质;冷藏时间;货架时间;顶空固相微萃取-气相色谱-质谱联用技术;电子鼻
形状、大小、口感、色泽、营养成分等指标通常用于综合评价果品品质的优劣,但芳香成分已逐渐成为评价果实品质的主要指标之一
[1]。利用顶空固相微萃取(head space solid phase micorextraction,HS-SPME)技术
[2-3]结合气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术
[4]对葡萄的挥发性成分进行研究已趋于成熟。该技术具有操作时间短、样品量小、无需萃取溶剂、重现性好等优点,现广泛应用于葡萄
[5-6]、樱桃番茄
[7]、梨
[8]、苹果
[9]等水果挥发性成分的分析。电子鼻作为一种新型的果实无损检测技术,不仅能够快速、无损地检测果实产生的挥发性成分,而且可以获得样品的“指纹数据”
[10-12],从而实现对果品内在质量的快速有效检测。樊丽等
[13]以‘嘎拉’苹果为试材,使用电子鼻和GC-MS联用技术研究其在20 ℃货架期间芳香品质的变化,表明电子鼻结合GC-MS分析可以将不同贮藏期的苹果区分开,此方法具有可行性。
低温贮藏保鲜技术
[14-15]可以延长果蔬的贮藏期,保持果实较好的品质和风味。但经低温中长期贮藏后,果实的品质和风味会有较大的变化。大部分果实贮藏后作为一种商品主要是为了销售,但由于果实长期处于较低温度条件下贮藏,使生理代谢相对减弱,可能会抑制香气成分的形成,削弱果实整体的芳香品质。成明
[16]以玫瑰香葡萄为试材,研究结果表明冷库贮藏期间,葡萄的主要香气成分醛类和醇类随着贮藏期的延长相对含量均呈下降趋势,主要物质(E)-2-己烯醛、里那醇、橙花醇的相对含量也均呈下降趋势。因此,研究低温贮藏后常温货架期间果实的风味变化,显得尤为重要。
目前关于不同冷藏期出库后葡萄果实芳香品质差异的报道十分少见。本研究以‘无核寒香蜜’葡萄为试材,运用SPME-GC-MS技术分析不同冷藏期出库后货架期间果实挥发性成分的变化,利用电子鼻技术对其进行判别区分,并探讨其对不同冷藏期出库后货架期间电子鼻区分效果,以期为葡萄冷藏期的选择及货架期间的变化提供理论依据。
1 材料与方法
1.1 材料与试剂
‘无核寒香蜜’葡萄于2014年8月17日采自辽宁省兴城市庭院式葡萄园,成熟度为九成(可溶性固形物含量(19.60±0.06)%、可滴定酸含量(0.75±0.03)%、糖酸比26.13%)。当天运回实验室,挑拣去坏果、落粒。选取无病虫害、无机械损伤的果实,称取2.5 kg/袋放入聚乙烯保鲜袋中,扎紧袋口后置于冷库存放。分别冷藏(0±0.5)℃,15、30、45、60 d后从冷库拿出放入常温(22~24 ℃)条件下存放,在货架时间0、3、6 d测定分析芳香物质,实验测定2 次重复。
NaCl 天津市风船化学试剂科技有限公司。
1.2 仪器与设备
50/30 μm CAR/DVB/PDMS、100 μm PDMS萃取头和SPME手动手柄 美国Supleco公司;Trace DSQ MS GC-MS联用仪 美国Finnigan公司;PC-420D数字型磁力加热搅拌装置 美国Corning公司;PEN3电子鼻德国Airsense公司。
1.3 方法
1.3.1 挥发性成分的测定
葡萄破碎榨汁后离心(8 000 r/min、15 min),4 层纱布过滤,取上清液8 mL装入带有磁力搅拌子的15 mL顶空瓶中,于50 ℃水浴15 min,之后加入2.5 g NaCl加盖封口,置于磁力加热搅拌器上(转速为550 r/min),然后将SPME头插入顶空瓶的顶空部分(离液面约1 cm处)于50 ℃吸附30 min后拔出萃取头,立即插入GC-MS进样口,于250 ℃解吸5 min。
GC条件:HP-INNOWAX色谱柱(30 m×250 μm,0.25 μm);程序升温:40 ℃保留3 min,然后以5 ℃/min升至150 ℃,再以10 ℃/min升至220 ℃,保留10 min。传输线温度250 ℃,载气He,流速1 mL/min,不分流。MS条件:连接杆温度280 ℃,电离方式电子电离,离子源温度200 ℃,扫描范围35~350 u。
1.3.2 电子鼻检测
将葡萄样品(果实温度接近常温,质量约(10.5±0.10) g)分别放入250 mL烧杯中用保鲜膜封口,在常温条件下放置5 min后采用顶空吸气法进行电子鼻检测分析。测定条件为:传感器清洗时间220 s,自动调零时间10 s,样品准备时间5 s,样品测试时间50 s,样品测定间隔时间1 s,自动稀释0,内部流量100 mL/min,进样流量100 mL/min。为了保证实验数据的稳定性和精确度,选取测定过程中第38~40秒的数据用于后续分析。为了消除漂移现象,更好地保证测量数据的稳定性和精确度,要求每次测量前后,传感器都要进行清洗和标准化。统计分析10 个不同选择性传感器的G/G
0值。按照上述方法,每个处理重复测定6 次。
1.4 数据分析
挥发性成分的分析:通过检索NIST/Wiley标准谱库,并结合文献的标准谱图
[17-18],进行定性分析,并用峰面积归一法测算各挥发性成分的相对含量。
电子鼻分析:通过电子鼻Winmuster分析软件对采集到数据进行分析,采用线性判别式分析(linear discriminant analysis,LDA)、负荷加载分析(loadings analysis,LA)。
应用SPSS 17.0软件Duncan氏新复极差法进行数据差异显著性分析,应用Excel软件对数据进行统计分析。
2 结果与分析
2.1 GC-MS对葡萄不同贮后常温货架期间挥发性成分分析
表1 不同贮后常温货架期间葡萄挥发性物质种类的变化
Table 1 Changes in chemical classes of volatile substances in grapeduring shelf life at room temperature after cold storage for different days
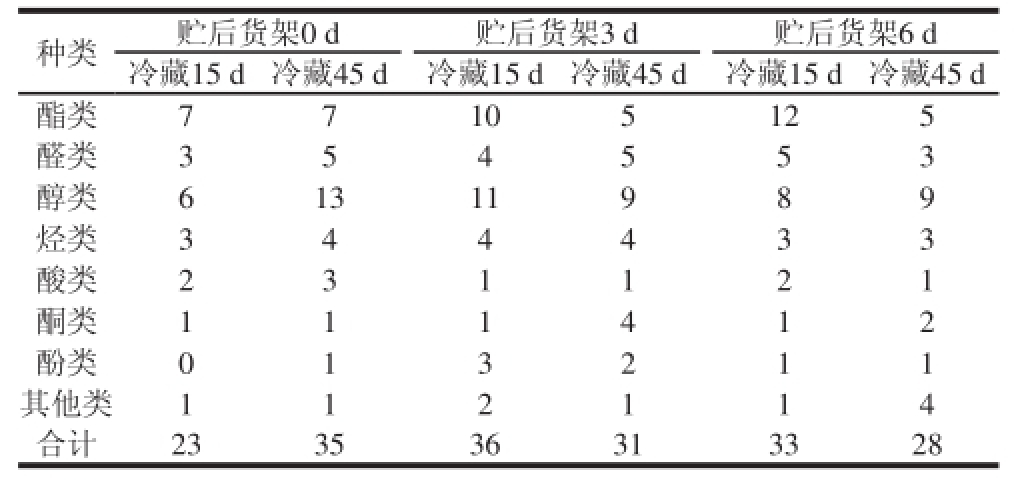
种类贮后货架0 d贮后货架3 d贮后货架6 d冷藏15 d冷藏45 d冷藏15 d冷藏45 d冷藏15 d冷藏45 d酯类7710 5125醛类354 553醇类61311 989烃类344 433酸类231 121酮类111 412酚类013 211其他类112 114合计233536313328
表2 不同贮后常温货架期间葡萄挥发性物质的相对含量
Table 2 The relative contents of volatile substances in grape during shelf life after cold storage for different days

%编号化学名称化学式贮后货架0 d贮后货架3 d贮后货架6 d冷藏1 5 d冷藏4 5 d冷藏1 5 d冷藏4 5 d冷藏1 5 d冷藏4 5 d酯类(e s t e r)1乙酸乙酯(e t h y l a c e t a t e)C
4H
8O
24 2 . 4 4 ± 2 . 1 2
c3 6 . 7 2 ± 1 . 8 4
f3 7 . 3 2 ± 1 . 8 7
e4 0 . 7 1 ± 2 . 0 4
d6 1 . 7 9 ± 3 . 0 9
a4 9 . 0 5 ± 2 . 4 5
b2丁酸乙酯(b u t a n o i c a c i d , e t h y l e s t e r)C
6H
12O
21 . 5 7 ± 0 . 0 8
c2 . 5 2 ± 0 . 1 3
a1 . 2 2 ± 0 . 0 6
d1 . 4 7 ± 0 . 0 7
c1 . 4 6 ± 0 . 0 7
c1 . 7 8 ± 0 . 0 9
b3 2 -丁烯酸乙酯(2 -b u t e n o i c a c i d , e t h y l e s t e r)C
6H
10O
23 . 3 1 ± 0 . 1 7
a—1 . 0 5 ± 0 . 0 5
c—1 . 5 7 ± 0 . 0 8
b—4正己酸乙酯(h e x a n o i c a c i d , e t h y l e s t e r)C
8H
16O
20 . 9 1 ± 0 . 0 5
ab1 . 0 0 ± 0 . 0 5
a0 . 0 9 ± 0 . 0 1
c—0 . 7 5 ± 0 . 0 4
b—5(Z)-3 -己烯酸乙酯(3 -h e x e n o i c a c i d , e t h y l e s t e r , ( Z ) -)C
8H
14O
20 . 0 6 ± 0 . 0 0
a——0 . 0 7 ± 0 . 0 1
a—6 3 -羟基丁酸乙酯(b u t a n o i c a c i d , 3 -h y d r o x y -, e t h y l e s t e r)C
6H
12O
31 . 0 3 ± 0 . 0 5
b——1 . 2 3 ± 0 . 0 6
a—7(Z)-9 -十八烯酸苯甲酯(9 -o c t a d e c e n o i c a c i d ( Z ) -, p h e n y l m e t h y l e s t e r)C
25H
40O
20 . 0 5 ± 0 . 0 0
b—0 . 1 2 ± 0 . 0 1
a——8 2 -羟基-4 -甲基-戊酸乙酯(p e n t a n o i c a c i d , 2 -h y d r o x y -4 -m e t h y l -, e t h y l e s t e r)C
8H
16O
3——1 . 3 0 ± 0 . 0 7
a——9己二酸二异丙酯(h e x a n e d i o i c a c i d , b i s ( 1 -m e t h y l e t h y l ) e s t e r)C
12H
22O
4——1 . 0 0 ± 0 . 0 5
a——1 0苯乙酸环丁基酯(p h e n y l a c e t i c a c i d , c y c l o b u t y l e s t e r)C
12H
14O
2——1 . 2 1 ± 0 . 0 6
a—0 . 5 6 ± 0 . 0 3
b—1 1肉豆蔻酸异丙酯(i s o p r o p y l m y r i s t a t e)C
17H
34O
2—1 . 7 2 ± 0 . 0 9
a0 . 5 0 ± 0 . 0 3
d1 . 2 6 ± 0 . 0 6
b0 . 7 5 ± 0 . 0 4
c0 . 5 3 ± 0 . 0 3
d1 2邻苯二甲酸二异丁酯 (1 , 2 -b e n z e n e d i c a r b o x y l i c a c i d , b i s ( 2 -m e t h y l p r o p y l ) e s t e r)C
16H
22O
4——0 . 4 0 ± 0 . 0 2
a——0 . 2 6 ± 0 . 0 1
b1 3四氢呋喃-2 -乙酸乙酯(t e t r a h y d r o f u r a n -2 -a c e t i c a c i d e t h y l e s t e r)C
8H
14O
3——0 . 3 9 ± 0 . 0 2 a—1 4苯甲酸乙酯(b e n z o i c a c i d , e t h y l e s t e r)C
9H
10O
2—0 . 2 9 ± 0 . 0 1
b—0 . 5 1 ± 0 . 0 3
a0 . 1 6 ± 0 . 0 1
b0 . 2 0 ± 0 . 0 2
b1 5 2 -甲基-丙酸-2 -乙基-3 -羟基己酯 (p r o p a n o i c a c i d , 2 -m e t h y l -, 2 -e t h y l -3 -h y d r o x y h e x y l e s t e r)C
12H
24O
3——0 . 4 9 ± 0 . 0 2
a—1 6 3 -苯丙酸乙酯(b e n z e n e p r o p a n o i c a c i d , e t h y l e s t e r)C
11H
14O
2——0 . 4 0 ± 0 . 0 2
a—1 7 2 , 2 , 4 -三甲基戊二醇异丁酯(2 , 2 , 4 -t r i m e t h y l -p e n t a n e d i o l i s o b u t y l)C
16H
30O
4—1 . 0 4 ± 0 . 0 5
a——1 8邻苯二甲酸二丁酯(d i b u t y l p h t h a l a t e)C
16H
22O
4—0 . 3 4 ± 0 . 0 2
a—0 . 3 8 ± 0 . 0 2
a——合计4 9 . 3 7 4 3 . 6 3 4 4 . 2 1 4 4 . 3 3 6 9 . 6 2 5 1 . 8 2醛类(a l d e h y d e)1乙醛(a c e t a l d e h y d e)C
2H
4O 1 . 1 5 ± 0 . 0 6
a——1 . 1 6 ± 0 . 0 6
a0 . 8 5 ± 0 . 0 4
b—2己醛(h e x a n a l)C
6H
12O 4 . 9 2 ± 0 . 2 5
e8 . 8 5 ± 0 . 4 4
b6 . 5 3 ± 0 . 3 3
d9 . 0 3 ± 0 . 4 5
a3 . 1 6 ± 0 . 1 6
f7 . 7 0 ± 0 . 3 9
c3青叶醛(2 -h e x e n a l , ( E ) -)C
6H
10O 1 0 . 9 7 ± 0 . 5 5
d1 8 . 9 3 ± 0 . 9 5
a1 4 . 5 5 ± 0 . 7 3
b1 4 . 4 4 ± 0 . 7 2
b6 . 3 2 ± 0 . 3 2
e1 4 . 1 2 ± 0 . 7 1
c4顺-3 -己烯醛(3 -h e x e n a l , ( Z ) -)C
6H
10O—6 . 7 7 ± 0 . 3 4
a1 . 6 7 ± 0 . 0 8
d4 . 7 2 ± 0 . 2 4
b0 . 8 5 ± 0 . 0 4
e2 . 5 3 ± 0 . 1 3
c5苯乙醛(b e n z e n e a c e t a l d e h y d e)C
8H
8O—0 . 2 1 ± 0 . 0 1
b0 . 4 4 ± 0 . 0 2
a—0 . 1 7 ± 0 . 0 1
b—6(E , E)-2 , 4 -二己烯醛(2 , 4 -h e x a d i e n a l , ( E , E ) -)C
6H
8O—1 . 7 4 ± 0 . 0 9
a—1 . 3 4 ± 0 . 0 7
b——合计1 7 . 0 4 3 6 . 5 0 2 3 . 1 9 3 0 . 6 9 1 1 . 3 5 2 4 . 3 5醇类(a l c o h o l)1(2 Z)-2 , 4 -戊二烯-3 -苯基-1 -醇 (2 , 4 -p e n t a d i e n -1 -o l , 3 -p e n t y l -, ( 2 Z ) -)C
10H
18O 0 . 7 2 ± 0 . 0 4
a——2 2 -庚醇(2 -h e p t a n o l)C
7H
16O 0 . 2 3 ± 0 . 0 1
a—0 . 2 3 ± 0 . 0 1
a——3正己醇(1 -h e x a n o l)C
6H
14O 1 1 . 5 6 ± 0 . 5 8
a1 . 5 8 ± 0 . 0 8
d5 . 0 6 ± 0 . 2 5
b1 . 2 9 ± 0 . 0 6
e4 . 2 4 ± 0 . 2 1
c1 . 0 0 ± 0 . 0 5
f4叶醇(3 -h e x e n -1 -o l , ( Z ) -)C
6H
12O 1 5 . 6 1 ± 0 . 7 8
a—8 . 1 0 ± 0 . 4 1
b2 . 6 2 ± 0 . 1 3
d5 . 0 1 ± 0 . 2 5
c1 . 9 8 ± 0 . 1 0
e5顺-2 -己烯-1 -醇(2 -h e x e n -1 -o l , ( Z ) -)C
6H
12O 1 . 0 4 ± 0 . 0 5
a——0 . 6 4 ± 0 . 0 3
b—6 D -香茅醇(6 -o c t e n -1 -o l , 3 , 7 -d i m e t h y l -, ( R ) -)C
10H
20O 1 . 6 2 ± 0 . 0 8
a0 . 3 7 ± 0 . 0 2
d1 . 1 5 ± 0 . 0 6
b0 . 5 3 ± 0 . 0 3
cd1 . 4 6 ± 0 . 0 7
a0 . 5 9 ± 0 . 0 3
c
续表2 %
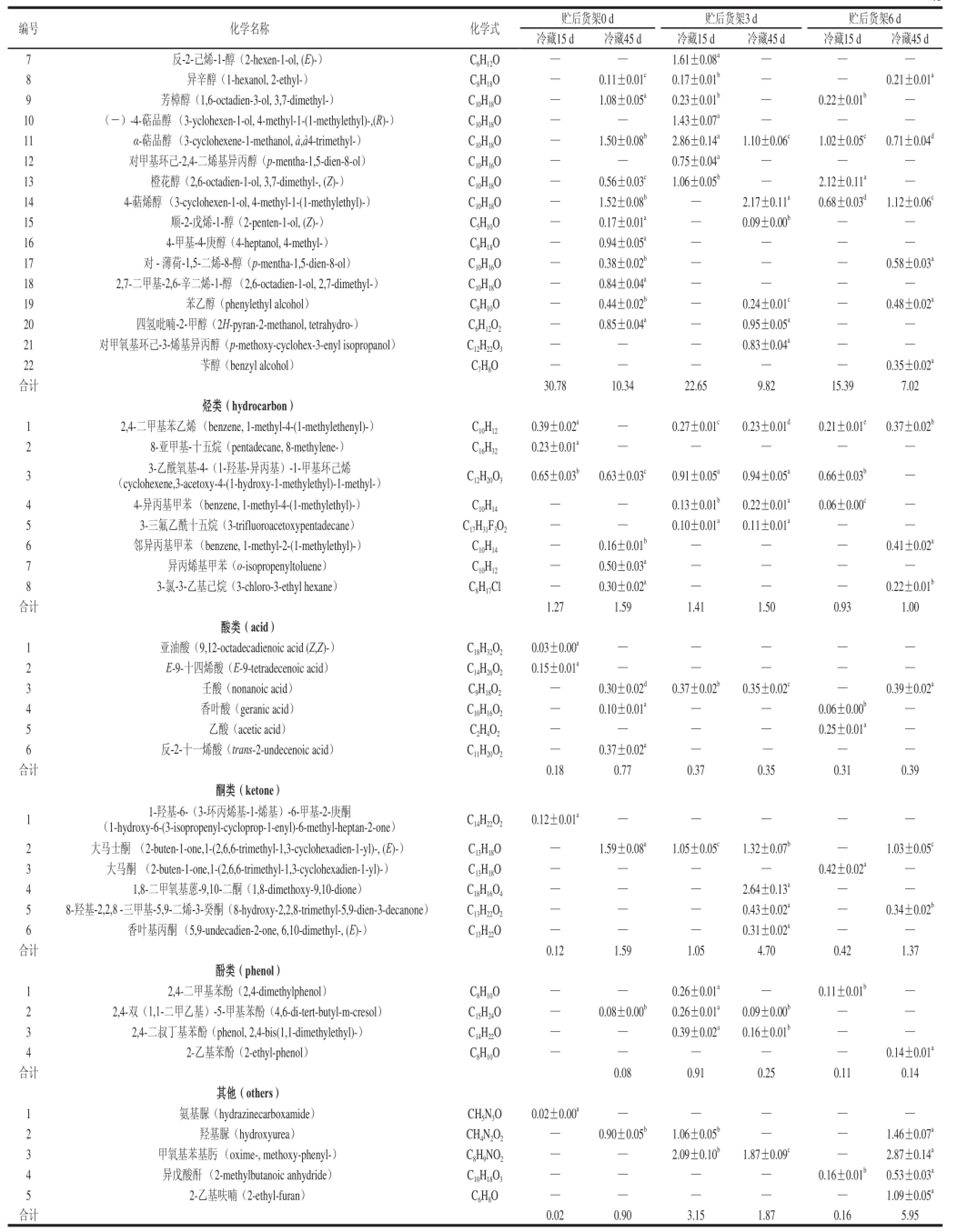
注:—.未检测到。同一行肩标不同小写字母表示差异达显著水平(P<0.05)。
编号化学名称化学式贮后货架0 d贮后货架3 d贮后货架6 d冷藏1 5 d冷藏4 5 d冷藏1 5 d冷藏4 5 d冷藏1 5 d冷藏4 5 d 7反-2 -己烯-1 -醇(2 -h e x e n -1 -o l , ( E ) -)C
6H
12O——1 . 6 1 ± 0 . 0 8
a——8异辛醇(1 -h e x a n o l , 2 -e t h y l -)C
8H
18O—0 . 1 1 ± 0 . 0 1
c0 . 1 7 ± 0 . 0 1
b——0 . 2 1 ± 0 . 0 1
a9芳樟醇(1 , 6 -o c t a d i e n -3 -o l , 3 , 7 -d i m e t h y l -)C
10H
18O—1 . 0 8 ± 0 . 0 5
a0 . 2 3 ± 0 . 0 1
b—0 . 2 2 ± 0 . 0 1
b—1 0(-)-4 -萜品醇 (3 -y c l o h e x e n -1 -o l , 4 -m e t h y l -1 -( 1 -m e t h y l e t h y l ) -, ( R ) -)C
10H
18O——1 . 4 3 ± 0 . 0 7
a——1 1 α -萜品醇 (3 -c y c l o h e x e n e -1 -m e t h a n o l , à , à 4 -t r i m e t h y l -)C
10H
18O—1 . 5 0 ± 0 . 0 8
b2 . 8 6 ± 0 . 1 4
a1 . 1 0 ± 0 . 0 6
c1 . 0 2 ± 0 . 0 5
c0 . 7 1 ± 0 . 0 4
d1 2对甲基环己-2 , 4 -二烯基异丙醇(p -m e n t h a -1 , 5 -d i e n -8 -o l)C
10H
16O——0 . 7 5 ± 0 . 0 4
a——1 3橙花醇(2 , 6 -o c t a d i e n -1 -o l , 3 , 7 -d i m e t h y l -, ( Z ) -)C
10H
18O—0 . 5 6 ± 0 . 0 3
c1 . 0 6 ± 0 . 0 5
b—2 . 1 2 ± 0 . 1 1
a—1 4 4 -萜烯醇 (3 -c y c l o h e x e n -1 -o l , 4 -m e t h y l -1 -( 1 -m e t h y l e t h y l ) -)C
10H
18O—1 . 5 2 ± 0 . 0 8
b—2 . 1 7 ± 0 . 1 1
a0 . 6 8 ± 0 . 0 3
d1 . 1 2 ± 0 . 0 6
c1 5顺-2 -戊烯-1 -醇(2 -p e n t e n -1 -o l , ( Z ) -)C
5H
10O—0 . 1 7 ± 0 . 0 1
a—0 . 0 9 ± 0 . 0 0
b——1 6 4 -甲基-4 -庚醇(4 -h e p t a n o l , 4 -m e t h y l -)C
8H
18O—0 . 9 4 ± 0 . 0 5
a——1 7对 - 薄荷-1 , 5 -二烯-8 -醇(p -m e n t h a -1 , 5 -d i e n -8 -o l)C
10H
16O—0 . 3 8 ± 0 . 0 2
b——0 . 5 8 ± 0 . 0 3
a1 8 2 , 7 -二甲基-2 , 6 -辛二烯-1 -醇 (2 , 6 -o c t a d i e n -1 -o l , 2 , 7 -d i m e t h y l -)C
10H
18O—0 . 8 4 ± 0 . 0 4
a——1 9苯乙醇(p h e n y l e t h y l a l c o h o l)C
8H
10O—0 . 4 4 ± 0 . 0 2
b—0 . 2 4 ± 0 . 0 1
c—0 . 4 8 ± 0 . 0 2
a2 0四氢吡喃-2 -甲醇(2 H -p y r a n -2 -m e t h a n o l , t e t r a h y d r o -)C
6H
12O
2—0 . 8 5 ± 0 . 0 4
a—0 . 9 5 ± 0 . 0 5
a——2 1对甲氧基环己-3 -烯基异丙醇(p -m e t h o x y -c y c l o h e x -3 -e n y l i s o p r o p a n o l)C
12H
22O
3——0 . 8 3 ± 0 . 0 4
a——2 2苄醇(b e n z y l a l c o h o l)C
7H
8O——0 . 3 5 ± 0 . 0 2
a合计3 0 . 7 8 1 0 . 3 4 2 2 . 6 5 9 . 8 2 1 5 . 3 9 7 . 0 2烃类(h y d r o c a r b o n)1 2 , 4 -二甲基苯乙烯 (b e n z e n e , 1 -m e t h y l -4 -( 1 -m e t h y l e t h e n y l ) -)C
10H
120 . 3 9 ± 0 . 0 2
a—0 . 2 7 ± 0 . 0 1
c0 . 2 3 ± 0 . 0 1
d0 . 2 1 ± 0 . 0 1
e0 . 3 7 ± 0 . 0 2
b2 8 -亚甲基-十五烷(p e n t a d e c a n e , 8 -m e t h y l e n e -)C
16H
320 . 2 3 ± 0 . 0 1
a——3 3 -乙酰氧基-4 -(1 -羟基-异丙基)-1 -甲基环己烯(c y c l o h e x e n e , 3 -a c e t o x y -4 -( 1 -h y d r o x y -1 -m e t h y l e t h y l ) -1 -m e t h y l -)C
12H
20O
30 . 6 5 ± 0 . 0 3
b0 . 6 3 ± 0 . 0 3
c0 . 9 1 ± 0 . 0 5
a0 . 9 4 ± 0 . 0 5
a0 . 6 6 ± 0 . 0 3
b—邻异丙基甲苯 (b e n z e n e , 1 -m e t h y l -2 -( 1 -m e t h y l e t h y l ) -)C
10H
14—0 . 1 6 ± 0 . 0 1
b——0 . 4 1 ± 0 . 0 2
a7异丙烯基甲苯(o -i s o p r o p e n y l t o l u e n e)C
10H
12—0 . 5 0 ± 0 . 0 3
a——8 3 -氯-3 -乙基己烷(3 -c h l o r o -3 -e t h y l h e x a n e)C
8H
17C l—0 . 3 0 ± 0 . 0 2
a——0 . 2 2 ± 0 . 0 1
b合计1 . 2 7 1 . 5 9 1 . 4 1 1 . 5 0 0 . 9 3 1 . 0 0酸类(a c i d)1亚油酸(9 , 1 2 -o c t a d e c a d i e n o i c a c i d ( Z , Z ) -)C
18H
32O
20 . 0 3 ± 0 . 0 0
a——2 E -9 -十四烯酸(E -9 -t e t r a d e c e n o i c a c i d)C
14H
26O
20 . 1 5 ± 0 . 0 1
a——3壬酸(n o n a n o i c a c i d)C
9H
18O
2—0 . 3 0 ± 0 . 0 2
d0 . 3 7 ± 0 . 0 2
b0 . 3 5 ± 0 . 0 2
c—0 . 3 9 ± 0 . 0 2
a4香叶酸(g e r a n i c a c i d)C
10H
16O
2—0 . 1 0 ± 0 . 0 1
a——0 . 0 6 ± 0 . 0 0
b—5乙酸(a c e t i c a c i d)C
2H
4O
2——0 . 2 5 ± 0 . 0 1
a—6反-2 -十一烯酸(t r a n s -2 -u n d e c e n o i c a c i d)C
11H
20O
2—0 . 3 7 ± 0 . 0 2
a— ——合计0 . 1 8 0 . 7 7 0 . 3 7 0 . 3 5 0 . 3 1 0 . 3 9酮类(k e t o n e)4 -异丙基甲苯 (b e n z e n e , 1 -m e t h y l -4 -( 1 -m e t h y l e t h y l ) -)C
10H
14——0 . 1 3 ± 0 . 0 1
b0 . 2 2 ± 0 . 0 1
a0 . 0 6 ± 0 . 0 0
c—5 3 -三氟乙酰十五烷(3 -t r i f l u o r o a c e t o x y p e n t a d e c a n e)C
17H
31F
3O
2——0 . 1 0 ± 0 . 0 1
a0 . 1 1 ± 0 . 0 1
a——6 4 1 1 -羟基-6 -(3 -环丙烯基-1 -烯基)-6 -甲基-2 -庚酮(1 -h y d r o x y -6 -( 3 -i s o p r o p e n y l -c y c l o p r o p -1 -e n y l ) -6 -m e t h y l -h e p t a n -2 -o n e)C
14H
22O
20 . 1 2 ± 0 . 0 1
a——大马士酮 (2 -b u t e n -1 -o n e , 1 -( 2 , 6 , 6 -t r i m e t h y l -1 , 3 -c y c l o h e x a d i e n -1 -y l ) -, ( E ) -)C
13H
18O—1 . 5 9 ± 0 . 0 8
a1 . 0 5 ± 0 . 0 5
c1 . 3 2 ± 0 . 0 7
b—1 . 0 3 ± 0 . 0 5
c3大马酮 (2 -b u t e n -1 -o n e , 1 -( 2 , 6 , 6 -t r i m e t h y l -1 , 3 -c y c l o h e x a d i e n -1 -y l ) -)C
13H
18O——0 . 4 2 ± 0 . 0 2
a—4 1 , 8 -二甲氧基蒽-9 , 1 0 -二酮(1 , 8 -d i m e t h o x y -9 , 1 0 -d i o n e)C
18H
16O
4——2 . 6 4 ± 0 . 1 3
a——5 8 -羟基-2 , 2 , 8 -三甲基-5 , 9 -二烯-3 -癸酮(8 -h y d r o x y -2 , 2 , 8 -t r i m e t h y l -5 , 9 -d i e n -3 -d e c a n o n e)C
13H
22O
2——0 . 4 3 ± 0 . 0 2
a—0 . 3 4 ± 0 . 0 2
b6香叶基丙酮 (5 , 9 -u n d e c a d i e n -2 -o n e , 6 , 1 0 -d i m e t h y l -, ( E ) -)C
13H
22O——0 . 3 1 ± 0 . 0 2
a——合计0 . 1 2 1 . 5 9 1 . 0 5 4 . 7 0 0 . 4 2 1 . 3 7酚类(p h e n o l)1 2 , 4 -二甲基苯酚(2 , 4 -d i m e t h y l p h e n o l)C
8H
10O——0 . 2 6 ± 0 . 0 1
a—0 . 1 1 ± 0 . 0 1
b—2 2 , 4 -双(1 , 1 -二甲乙基)-5 -甲基苯酚(4 , 6 -d i -t e r t -b u t y l -m -c r e s o l)C
15H
24O—0 . 0 8 ± 0 . 0 0
b0 . 2 6 ± 0 . 0 1
a0 . 0 9 ± 0 . 0 0
b——3 2 , 4 -二叔丁基苯酚(p h e n o l , 2 , 4 -b i s ( 1 , 1 -d i m e t h y l e t h y l ) -)C
14H
22O——0 . 3 9 ± 0 . 0 2
a0 . 1 6 ± 0 . 0 1
b——4 2 -乙基苯酚(2 -e t h y l -p h e n o l)C
8H
10O——0 . 1 4 ± 0 . 0 1
a合计0 . 0 8 0 . 9 1 0 . 2 5 0 . 1 1 0 . 1 4其他(o t h e r s)1氨基脲(h y d r a z i n e c a r b o x a m i d e)C H
5N
3O 0 . 0 2 ± 0 . 0 0
a——2羟基脲(h y d r o x y u r e a)C H
4N
2O
2—0 . 9 0 ± 0 . 0 5
b1 . 0 6 ± 0 . 0 5
b——1 . 4 6 ± 0 . 0 7
a3甲氧基苯基肟 (o x i m e -, m e t h o x y -p h e n y l -)C
8H
9N O
2——2 . 0 9 ± 0 . 1 0
b1 . 8 7 ± 0 . 0 9
c—2 . 8 7 ± 0 . 1 4
a4异戊酸酐 (2 -m e t h y l b u t a n o i c a n h y d r i d e)C
10H
18O
3——0 . 1 6 ± 0 . 0 1
b0 . 5 3 ± 0 . 0 3
a5 2 -乙基呋喃(2 -e t h y l -f u r a n)C
6H
8O——1 . 0 9 ± 0 . 0 5
a合计0 . 0 2 0 . 9 0 3 . 1 5 1 . 8 7 0 . 1 6 5 . 9 5 2
由表1可知,葡萄贮后常温货架期间共提取出8 类23~36 种挥发性成分,其中醇类6~13 种、酯类5~12 种、醛类3~5 种、烃类3~4 种、酸类1~3 种、酮类1~4 种、酚类0~3 种、其他类1~4 种。冷藏45 d贮后货架第0天时的有效挥发性成分为35 种,高于冷藏15 d贮后货架第0天的23 种,冷藏15 d贮后货架第3、6天的有效挥发性成分分别为36、33 种,而冷藏45 d贮后货架第3、6天的有效挥发性成分分别为31、28 种,表明了冷藏15 d的果实在货架第0天时可能由于采收成熟度的关系,挥发性成分总数较少,而随着冷藏时间的延长(45 d)和贮后货架期的延长(第3天),挥发性成分总数达到最佳,即冷藏45 d贮后货架第0天和冷藏15 d贮后货架第3天挥发性成分总数最多。但随着冷藏15 d贮后货架期的进一步延长(第6天),果实由成熟走向衰老,其挥发性成分总数下降;冷藏45 d贮后货架第0天果实已经完全成熟,随着贮后货架期的延长、果实衰老的加剧,果实挥发性成分总数持续下降。具体的物质种类见表1,各类挥发性成分相对含量见表2。
由表2可知,不同冷藏时间贮后货架期间葡萄果实中各类挥发性成分的相对含量变化情况,葡萄的挥发性成分主要由酯类、醛类和醇类组成。贮后货架第0天时,冷藏15、45 d葡萄果实中的酯类物质相对含量分别为49.37%和43.63%,主要由有草莓香味的乙酸乙酯
[19-21]组成,其冷藏45 d的相对含量比15 d的下降了13.48%;冷藏15 、45 d葡萄果实中的醛类物质相对含量分别为17.04%和36.50%,主要由具有新鲜绿叶香味的青叶醛
[20]和具有青草、苹果气味的己醛组成,其冷藏45 d的相对含量分别比15 d的上升了72.56%和79.88%;冷藏15、45 d葡萄果实中的醇类物质相对含量分别为30.78%和10.34%,共同具有的主要物质为正己醇和D-香茅醇,其冷藏45 d的相对含量分别比15 d的下降了86.33%和77.16%,冷藏15 d时检测到相对含量为15.61%的叶醇,45 d时未检测到,但冷藏45 d时检测到芳樟醇、α-萜品醇、橙花醇、4-萜烯醇等醇类物质,在15 d时均未检测到;烃类、酸类、酮类、酚类和其他类物质45 d的总体相对含量均较15 d的有所上升。
贮后货架第3天时,冷藏15、45 d葡萄果实中的酯类物质相对含量分别为44.21%和44.33%,乙酸乙酯冷藏45 d的相对含量比15 d的上升了9.08%;冷藏15、45 d葡萄果实中的醛类物质相对含量分别为23.19%和30.69%,青叶醛冷藏45 d的相对含量比15 d的下降了0.76%,己醛上升了38.28%;冷藏15、45 d葡萄果实中的醇类物质相对含量分别为22.65%和9.82%,正己醇、叶醇、D-香茅醇和α-萜品醇冷藏45 d的相对含量比15 d的下降了约53.91%~74.51%。
贮后货架第6天时,冷藏15、45 d葡萄果实中的酯类物质相对含量分别为69.62%和51.82%,乙酸乙酯冷藏45 d的相对含量比15 d的上升了20.62%;冷藏15、45 d葡萄果实中的醛类物质相对含量分别为11.35%和24.35%,青叶醛和己醛冷藏45 d的相对含量比15 d的显著上升;冷藏15、45 d葡萄果实中的醇类物质相对含量分别为15.39%和7.02%,正己醇、叶醇、D-香茅醇和α-萜品醇冷藏45 d的相对含量比15 d显著下降。
综合比较货架期第0、3、6天挥发性成分的相对含量,发现冷藏15、45 d后的酯类物质随着货架期的延长呈现上升趋势,醛类、醇类物质均呈下降趋势。贮后货架期间冷藏45 d的酯类和醇类物质相对含量要低于15 d的果实,而醛类物质相对含量高于15 d的果实,这些变化与果实内部发生的生理生化反应相关。果实的成熟伴随着香气物质的产生,成熟度、新鲜度等因素会影响香气物质的种类及含量
[22]。果实以不饱和亚油酸和亚麻酸经氧合酶催化合成C
6醛及相应的醇,醇和酰基-CoA在醇酰基转移酶作用下又可以合成为酯类。随着果实的衰老,醇脱氢酶催化醛类形成相应的醇类,酯类物质则可能发生水解等反应生成醇类而含量下降。酯类和醇类物质是葡萄的主要香气成分来源
[23],冷藏15 d后货架期间酯类和醇类物质总体相对含量达到66.86%以上,45 d的相对含量为53.97%以上,说明随着冷藏期的延长,葡萄的整体良好风味被削弱。冷藏15 d后的挥发性物质种类在货架期间除货架第0天外,均比45 d的高,风味物质种类的增多可能与微生物代谢活动或原料自身反应水解果实中的营养物质生成相应杂环类、醛类、酮类等化合物有关,这对葡萄风味的形成具有积极的贡献作用。
2.2 LDA方法对葡萄不同贮后常温货架期间的电子鼻分析

图1 不同贮后常温货架期间葡萄的LDA
Fig.1 Linear discriminant analysis of volatile components of grape during shelf life after cold storage for different days
LDA注重所采集挥发性气体的响应值在空间中的分布状态以及彼此之间的距离
[24]。选取挥发性气体平缓的时间段(38~40 s)进行线性判别分析,得到葡萄不同冷藏时间贮后常温货架期间的LDA分析结果,见图1,LD1贡献率为52.64%,LD2贡献率为35.56%,贡献率总和为89.20%,基本能够代表样品的主要信息。由图1可以看出,冷藏15、30、45、60 d后货架第0、6天果实的挥发性成分分别沿LD1减小,在LD2上变化不大,说明不同贮后货架第0、6天时果实香气成分变化较大,冷藏15、30、45 d后货架第3天时果实在LD2上变化较大,60 d与45 d之间LD1变化较大,说明果实挥发性成分发生变化,进一步比较冷藏45、60 d后货架期间之间的变化,发现冷藏45 d是葡萄挥发性成分发生变化的拐点,这可能与长时间冷库低温冷藏导致果实内部生理生化反应发生变化有关。
图1还显示了不同贮后常温货架期间葡萄的芳香速率所呈现的变化趋势。15、30 d贮后货架从第0~3天速率(距离)变化较小,但从第3~6天速率变化较大,说明第0~3天气味有一定停顿,样品气味变化不大;45、60 d贮后货架与其呈相反的变化趋势,即从第0~3天速率变化较大,但从第3~6天速率变化较小。除冷藏15 d贮后第0天与第3天未区分开外,其余冷藏期贮后货架期间均能够区分开,可能是由于冷藏期(15 d)较短,贮后货架第0天与第3天葡萄果实挥发性成分变化不大。由图1可知,15、30 d贮后货架第0、3、6天在实线的上方,45、60 d贮后货架第0、3、6天在实线的下方。可以看出,冷藏45 d后,葡萄的挥发性成分发生了较大的变化,与GC-MS联用的分析结果相一致。因此,采用电子鼻技术能够有效区分不同冷藏期葡萄果实,除冷藏15 d的贮后第0、3天外,还能够区分不同冷藏期贮后货架期间的果实。
2.3 LA方法对葡萄不同贮后常温货架期间的电子鼻分析

图2 不同贮后常温货架期间葡萄的负荷加载分析
Fig.2 Loading analysis of volatile components of grape during shelf life after cold storage for different days
电子鼻中内置10 个金属传感器,对于不同气味给予不同的响应信号。LA可以反映传感器对于样品挥发性气味贡献率的相对重要性。距离原点越远,表示此传感器对于挥发性成分的分析中所起的作用越大,反之,则说明该传感器作用较小
[25]。图2显示,LA1贡献率是80.91%,LA2贡献率为16.78%,且W1W(硫化氢、萜烯类)传感器对第1主成分贡献率最大,W1S(芳香成分)、W2S(乙醇)对第2主成分贡献率较大,传感器W2W(硫化氢类)、W5S(氨氧化物)、W6S(氢气)、W3S(芳香烷烃)、W5C(烷烃)、W3C(氨类)、W1C(芳香苯类)对第1主成分的贡献率相对较小,除W2W(硫化氢类)、W5S(氨氧化物)、W6S(氢气)对第2主成分贡献率接近0外,其余4 种传感器对第2主成分的贡献率依次递增。
3 结 论
通过HS-SPME-GC-MS分析技术研究了不同贮后常温货架期间葡萄的挥发性芳香物质种类以及含量变化,结果表明,‘无核寒香蜜’葡萄挥发性成分主要由酯类、醛类、醇类物质组成;挥发性物质主要为乙酸乙酯、青叶醛、正己醇、叶醇、香茅醇。挥发性成分组成及含量随着货架期延长发生变化,冷藏45 d后常温货架期间‘无核寒香蜜’葡萄中的酯类和醇类物质相对含量要低于同期15 d的葡萄,而醛类物质相对含量高于同期15 d的葡萄。冷藏15、45 d后‘无核寒香蜜’葡萄中的酯类物质随着常温货架期的延长而升高,而醛类和醇类物质则降低,为研究葡萄低温贮藏期的选择提供了依据。
不同贮后常温货架期间葡萄的挥发性成分存在差异,利用电子鼻快速无损判别成为可能。LDA方法可以有效区分冷藏15、30、45、60 d的果实,且除冷藏15 d的第0、3天外,还可以区分不同冷藏期(15、45 d)贮后常温货架(第0、3、6天)的果实,这也说明了冷藏15 d的果实在常温货架前3 d过程中挥发性物质变化不大,而随着冷藏期和贮后常温货架期的延长,葡萄中挥发性物质发生了较大的变化,这与HS-SPME-GC-MS分析相吻合。另外,利用LA方法分析得出W1W(硫化氢、萜烯类)、W1S(芳香成分)、W2S(乙醇)传感器对挥发性气味的贡献相对较大。
参考文献:
[1] 张鹏, 李江阔, 陈绍慧. 气质联用和电子鼻对1-MCP 不同处理时期苹果检测分析[J]. 食品与发酵工业, 2014, 40(9): 144-151.
[2] STASHENKO E E, MARTÍNEZ J R. Sampling volatile compounds from natural products with headspace/solid-phase micro-extraction[J]. Journal of Biochemical and Biophysical Methods, 2007, 70(2): 235-242. DOI:10.1016/j.jbbm.2006.08.011.
[3] RISTICEVIC S, NIRI V H, VUCKOVIC D, et al. Recent developments in solid-phase microextraction[J]. Analytical and Bioanalytical Chemistry, 2009, 393(3): 781-795. DOI:10.1007/ s00216-008-2375-3.
[4] 李婷婷, 丁婷, 邹朝阳, 等. 顶空固相微萃取-气质联用技术结合电子鼻分析4 ℃冷藏过程中三文鱼片挥发性成分的变化[J]. 现代食品科技, 2015, 31(2): 249-260.
[5] 张海宁, 王亚超, 马辉, 等. GC-MS分析夏黑葡萄中挥发性香气成分[J].江苏农业科学, 2014, 42(8): 294-297.
[6] ROSA P, ANTONIO S B, SILVIA M R, et al. Establishment of the varietal profile of Vitis vinifera L. grape varieties from different geographical regions based on HS-SPME/GC-qMS combined with chemometric tools[J]. Microchemical Journal, 2014, 116(9): 107-117.
[7] 常培培, 梁燕, 张静, 等. 5 种不同果色樱桃番茄品种果实挥发性物质及品质特性分析[J]. 食品科学, 2014, 35(22): 215-221. DOI:10.7506/spkx1002-6630-201422042.
[8] 陈计峦. 梨香气成分分析、变化及理化特征指标的研究[D]. 北京:中国农业大学, 2005. DOI:10.7666/d.y773574.
[9] 张博, 辛广, 李铁纯. 固相微萃取气质联用分析红王将苹果香气成分[J]. 食品科学, 2008, 29(10): 520-521. DOI:10.3321/ j.issn:1002-6630-200810124.
[10] 张虹艳, 丁武. 电子鼻对不同温度下生鲜羊奶贮藏时间的判定[J].食品科学, 2011, 32(16): 257-260.
[11] 肖涛, 殷勇, 于慧春, 等. 不同包装纯牛奶的电子鼻检测[J]. 食品科学, 2011, 32(14): 307-310.
[12] El BARBRI N, LLOBET E, El BARI N, et al. Electronic nose based on metal oxide semiconductor sensors as an alternative technique for the spoilage classification of red meat[J]. Sensors, 2008, 8(1): 142-156. DOI:10.3390/s8010142.
[13] 樊丽, 任小林, 向春燕, 等. 基于电子鼻和GC-MS评价嘎拉苹果采后芳香品质[J]. 食品科学, 2014, 35(22): 164-168. DOI:10.7506/ spkx1002-6630-201422031.
[14] 高雪, 杨绍兰, 王然, 等. 近冰温贮藏对鲜切西兰花保鲜效果的影响[J].中国食品学报, 2013, 13(8): 140-146.
[15] 申春苗, 汪良驹, 王文辉, 等. 近冰温贮藏对黄金梨保鲜与货架期品质的影响[J]. 果树学报, 2010, 27(5): 739-744.
[16] 成明. 不同贮藏条件对葡萄香气成分变化影响的研究[D]. 天津: 天津科技大学, 2011.
[17] 汪正范, 杨树民, 吴侔天, 等. 色谱联用技术[M]. 北京: 化学工业出版社, 2001: 63-120.
[18] 丛浦珠, 苏克蔓. 质谱分析[M]. 北京: 化学工业出版社, 2000: 27-51.
[19] 李华. 葡萄的芳香物质[J]. 中外葡萄与葡萄酒, 2001(6): 43-44.
[20] GUTH H. Identification of character impact odorants of different white wine varieties[J]. Journal of Agricultural and Food Chemistry, 1997, 45: 3027-3032.
[21] 商家胤, 田淑芬, 集贤, 等. 设施巨峰葡萄二次果果实品质及芳香化合物组分分析[J]. 西北植物学报, 2014, 34(9): 1836-1842. DOI:10.7606/j.issn.1000-4025.2014.09.1836.
[22] 刘传和, 刘岩, 谢盛良, 等. 不同成熟度菠萝果实香气成分分析[J]. 热带作物学, 2009, 30(2): 234-234. DOI:10.3969/ j.issn.1000-2561.2009.02.023.
[23] 张晓. 黑比诺营养系品种葡萄与葡萄酒香气研究[D]. 杨凌: 西北农林科技大学, 2007.
[24] 周亦斌, 王俊. 基于电子鼻的番茄成熟度及贮藏时间评价的研究[J]. 农业工程学报, 2005, 21(4): 113-117. DOI:10.3321/ j.issn:1002-6819.2005.04.025.
[25] 江琳琳, 潘磊庆, 屠康, 等. 基于电子鼻对水蜜桃货架期评价的研究[J].食品科学, 2010, 31(12): 229-232.
Effects of Cold Storage Time on Aroma Components of Grape during Subsequent Shelf Life
ZHANG Peng
1, SHAO Dan
2, LI Jiangkuo
1,*, YAN Tingcai
2, CHEN Shaohui
1
(1. Tianjin Key Laboratory of Postharvest Physiology and Storage of Agricultural Products, National Engineering and Technology Research Center for Preservation of Agricultural Products (Tianjin), Tianjin 300384, China; 2. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Abstract:This study aimed to clarify the effects of cold storage time on aroma compo nents of grape during subsequent shelf life at room temperature. Suffolk Red seedless grapes were detected for changes in volatile components during the shelf life (on days 0, 3 and 6) after cold storage for 15 and 45 days by head space solid-phase microextraction (HS-SPME) combined with gas chromatography-mass spectrometry (GC-MS) and for changes in aroma components during the shelf life after cold storage for 15, 30, 45 and 60 days using electronic nose (e-nose). The results showed that volatile components of grape were mainly composed of esters, aldehydes and alcohol, with ethyl acetate, aoba aldehyde, n-hexyl alcohol, leaf, citronellol being the major volatile components. After cold storage for 45 days, the relative contents of esters and alcohols were lower than those of the grapes stored for 15 days whereas the content of aldehydes was higher in the grapes cold-stored for 45 days during the shelf life. E-nose combined with linear discriminant analysis (LDA) could effectively distinguish the grapes cold-stored for different times. Volatile aroma components of grapes were not overlapped during the shelf life after all cold storage periods except on days 0 and 3 of the shelf life after 15-day cold storage, that was, volatile components of grapes varied widely with prolonged storage time at room temperature after cold storage, which could be distinguished effectively by e-nose. Loading analysis (LA) showed that hydrogen sulfide and terpenes (W1W), aroma components (W1S), and ethanol (W2S) sensors were the major contributors to volatile odors, which was consistent with the results of HS-SPME-GC-MS analysis. Therefore, it is feasible to use H S-SPME-GC-MS combined with electronic nose to distinguish grapes during the shelf life at room temperature after cold storage for different times based on their aroma components.
Key words:grape; volatile components; cold storage time; shelf life; head space solid-phase microextraction combined with gas chromatography-mass spectrometry (HS-SPME-GC-MS); electronic nose
DOI:10.7506/spkx1002-6630-201602039
中图分类号:TS255.3
文献标志码:A
文章编号:1002-6630(2016)02-0218-07
引文格式:
张鹏, 邵丹, 李江阔, 等. 葡萄冷藏时间对贮后货架期芳香物质的影响[J]. 食品科学, 2016, 37(2): 218-224. DOI:10.7506/ spkx1002-6630-201602039. http://www.spkx.net.cn
ZHANG Peng, SHAO Dan, LI Jiangkuo, et al. Effects of cold storage time on aroma components of grape during subsequent shelf life[J]. Food Science, 2016, 37(2): 218-224. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201602039. http://www.spkx.net.cn
收稿日期:2015-05-25
基金项目:“十二五”国家科技支撑计划项目(2012BAD38B01)
作者简介:张鹏(1981—),女,助理研究员,博士,研究方向为果蔬贮运保鲜。E-mail:zhangpeng811202@163.com
*通信作者:李江阔(1974—),男,副研究员,博士,研究方向为农产品安全与果蔬贮运保鲜新技术。E-mail:lijkuo@sina.com




