红树莓果醋酿造过程中抗氧化性能的变化
张 强
1,辛秀兰
2,*,杨富民
1,陈 亮
2,张 雪
2,池 蓬
2
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.北京电子科技职业学院生物工程学院,北京 100029)
摘 要:采用液态深层快速发酵法发酵红树莓果醋,分析红树莓酿造过程中总多酚、总黄酮、花色苷的含量以及1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基(·OH)、超氧阴离子自由基(
 )清除率的变化。结果表明:总多酚、总黄酮、花色苷的含量先升高后降低,3 种自由基清除率随着醋酸发酵明显升高,醋酸发酵10 d后,总多酚、总黄酮、花色苷含量分别保留了68%、85%、38%,DPPH自由基、
)清除率的变化。结果表明:总多酚、总黄酮、花色苷的含量先升高后降低,3 种自由基清除率随着醋酸发酵明显升高,醋酸发酵10 d后,总多酚、总黄酮、花色苷含量分别保留了68%、85%、38%,DPPH自由基、
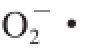 、·OH清除率分别为98.63%、83.82%、78.36%。相关性分析显示总多酚、总黄酮、花色苷含量互为极显著正相关,且与主成分1成很高的负相关;·OH清除率、
、·OH清除率分别为98.63%、83.82%、78.36%。相关性分析显示总多酚、总黄酮、花色苷含量互为极显著正相关,且与主成分1成很高的负相关;·OH清除率、
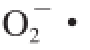 清除率、DPPH自由基清除率互为极显著正相关,且与主成分1成很高的正相关。聚类分析将酿造过程分为3 个集群,代表发酵过程中抗氧化性能不同的变化趋势。
清除率、DPPH自由基清除率互为极显著正相关,且与主成分1成很高的正相关。聚类分析将酿造过程分为3 个集群,代表发酵过程中抗氧化性能不同的变化趋势。
关键词:红树莓果醋;抗氧化;自由基清除率;主成分分析;聚类分析
红树莓(Rubus idaeus)又名覆盆子、托盘、马林等,系蔷薇科悬钩子属。果实柔嫩多汁,香甜可口,风味独特,富含多种氨基酸和有机酸,尤其富含超氧化物歧化酶、类黄酮、花青素等大量抗氧化物质,能够起到抗衰老,抗心血管疾病等作用,具有很高的医药及保健作用,被誉为第三代水果
[1]。
果醋作为新型饮料,是一种运用现代生物技术,以水果或果品的加工脚料为主要原料,利用微生物二次发酵酿造的营养丰富,口感优良的酸味饮料。果醋具有很高的保健价值,富含的有机酸能促进肌肉中乳酸和丙酮酸等疲劳物质分解,其中尼克酸能促进胆固醇的代谢,起到降血脂的作用,此外还有很高的杀菌能力和防腐败作用,其特有的挥发性香气成分能刺激大脑神经中枢,有助于消化功能的增强。近年来,果醋市场需求呈上升趋势,这与果醋兼有水果和食醋的营养保健功能密不可分,是集多功能于一身的新型饮品,被称为“第四代功能性饮料”
[2-4]。
本实验采用液态深层快速发酵制醋的方法,主要是通过对空气、温度的控制,短时间内使经扩大培养的醋酸菌借助自吸空气的气流以及摇床的机械振动充分搅拌混合,加大了气液混合面积从而进行全面的酒精氧化,生成高醋酸含量的果醋。
目前,红树莓果实不耐贮运的问题制约着红树莓产业的发展,采摘后如果不及时进行销售或加工,会造成大量鲜果积压和腐烂,因此对红树莓的深加工成为发展方向。本实验对红树莓果醋在酿造过程中抗氧化物质含量和清除自由基能力进行测定,通过相关性、主成分分析等统计方法,进一步分析抗氧化性能的变化规律及特点,以期为红树莓果醋产品的研究开发提供科学依据。
1 材料与方法
1.1 材料与试剂
红树莓冷冻果由北京汇源果汁有限公司提供。
果酒酵母1399、醋酸杆菌20056 中国发酵工业研究所;没食子酸、芦丁 天津市百世化工有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH) 美国Sigma公司;其余试剂均为分析纯。
1.2 仪器与设备
ZKSY-6恒温智能水浴锅 郑州长城科工贸有限公司;豪威斯AR5120型电子天平 北京天平医用厂;UV-1800紫外分光光度计 北京彭曼科技有限责任公司;J0050024生化培养箱 上海福玛实验设备有限公司;日立CR-GIII高速离心机 天美科学仪器有限公司。
1.3 方法
1.3.1 工艺流程
原料挑选→破碎→酶解→成分调整→灭酶、巴氏果酒酵母 醋酸杆菌
↓ ↓
灭菌→酒精发酵(10 d)→醋酸发酵(10 d)→陈酿→澄清→过滤→灌装灭菌→成品
具体过程:挑选成熟、饱满、色泽鲜艳的红树莓果实,打浆。往浆液中添加50 mg/L的果胶酶,在45 ℃条件下酶解3 h。添加白砂糖调整糖度为18°Bx,使发酵液满足酵母发酵的需求。将成分调整后的红树莓果汁在85 ℃条件下保温15 min,达到灭酶灭菌的目的。之后在红树莓果汁中接种果汁含量为3%的驯化后的果酒酵母1969,30 ℃酒精发酵10 d。然后在红树莓果汁中接种9%驯化后的醋酸杆菌20056,28 ℃醋酸发酵10 d。将醋酸发酵好的红树莓果醋置于14 ℃,陈酿30 d后,用硅藻土澄清过滤,装入瓶中灭菌。
1.3.2 总多酚含量的测定
参考赵金梅等
[5]的方法略有改动,采用Folin-酚比色法进行测定。精确称取没食子酸25 mg溶解于100 mL水中,即得没食子酸标准母液。分别取0.1、0.2、0.3、0.4、0.5 mL于5 支比色管中,分别加入体积分数为10%的Folin-酚试剂2.5 mL和75 mg/mL Na
2CO
3溶液2 mL,加水定容至10 mL,对应含量为0.025、0.05、0.075、0.1、0.125 mg/mL的没食子酸溶液,在45 ℃水浴中反应15 min,取出样品混匀10 s后,在波长765 nm处测定其吸光度。以没食子酸的质量浓度为横坐标(x,mg/mL),以吸光度为纵坐标(y)绘制标准曲线,拟合的回归方程为:y=8.112 0x-0.055 8,相关系数R
2=0.999 4。
样品测定:取红树莓液体样品0.1 mL,稀释10 倍,按上述步骤操作,用水定容至25 mL,在45 ℃水浴中反应15 min,取出样品混合10 s后在波长765 nm处测定其吸光度。
1.3.3 总黄酮含量的测定
参考白立敏等
[6]的方法略有改动,采用亚硝酸钠-硝酸铝比色法测定。精确称取芦丁标品28 mg溶于体积分数为30%的乙醇溶液,定容至50 mL,分别取0.6、1.2、1.8、2.4、3.0 mL于比色管中,分别加入50 g/L NaNO
2溶液0.4 mL,摇匀,静置6 min,再加入10% Al(NO
3)
3溶液0.4 mL,摇匀,静置6 min,再加入1 mol/L NaOH溶液4 mL,用30%的乙醇定容至10 mL,静置15 min,在波长510 nm处测定其吸光度。以芦丁的质量浓度x为横坐标,以吸光度y为纵坐标绘制标准曲线,拟合的回归方程为:y=1.818 5x+0.030 1,相关系数R
2=0.998 4。
样品测定:取红树莓液体样品1 mL,按上述步骤操作并测定吸光度。
1.3.4 花色苷含量的测定
参考肖军霞等
[7]的方法,采用pH示差法测定。分别移取2 份0.4 mL花色苷提取液,分别用pH 1.0和pH 4.5的缓冲溶液定容至10 mL,每隔10 min分别在波长为520、700 nm处测定吸光度,直至稳定。
式中:A为吸光度;ε为矢车菊-3-葡萄糖苷消光系数26 900 L/(mol·cm);L为比色皿光程1 cm;M
W为矢车菊-3-葡萄糖苷相对分子质量449.2 g/mol;DF为稀释因子;V为最终体积/mL;m为样品质量/g。
1.3.5 羟自由基(·OH)清除率的测定
参考包怡红等
[8]的方法测定。取3 支比色管,分别加入稀释5 倍的样品5 mL,依次加入6 mmol/L FeSO
4溶液2 mL,6 mmol/L H
2O
2溶液2 mL,混匀静置10 min,再加入6 mmol/L水杨酸溶液2 mL,混匀静置30 min,在520 nm波长处测定其吸光度。
式中:A
J为加入样品后的吸光度;A
I为不加水杨酸样品的吸光度;A
0为空白(蒸馏水)吸光度。
1.3.6 超氧阴离子自由基(O
2
-·)清除率的测定
参考张小强等
[9]的方法测定。取0.05 mol/L,pH 8.2的Tris-HCl缓冲液4.5 mL于试管中,置25 ℃水浴中预热20 min。分别加入不同浓度的待测品0.1 mL后均加入2.5 mmol/L邻苯三酚(由10 mmol/L HCl配制)0.4 mL,混匀后25 ℃水浴中准确反应4 min,立即加入2 滴8 mol/L HCl终止反应。用蒸馏水调零,在299 nm波长处测定吸光度。空白组以0.1 mL蒸馏水代替样品试液。
1.3.7 DPPH自由基清除率的测定
参考包怡红等
[8]的方法。精确吸取0.5 mL红树莓液体样品于比色管中,放入2 mL 0.2 mmol/L的 DPPH溶液,用无水乙醇定容至5 mL,摇匀置于暗处30 min后,在波长517 nm处测定其吸光度。
式中:A
J为样品+DPPH溶液的吸光度;A
I为样品+无水乙醇溶液的吸光度;A
0为DPPH+无水乙醇溶液的吸光度。
1.4 数据分析
实验平行3 次,采用SPSS 18.0、Excel 2003软件进行数理统计分析与相关性分析,分别采用降维法、欧氏距离法对发酵过程中红树莓果醋的抗氧化性能进行主成分分析和聚类分析。
2 结果与分析
2.1 发酵过程中总多酚、总黄酮、花色苷含量变化

图1 红树莓果醋酿造过程中总多酚含量的变化
Fig.1 Change in total phenolic content during the fermentation of red raspberry vinegar
由图1可知,红树莓酿造过程中总多酚的含量在酒精发酵阶段先上升后下降。在酒精发酵起始阶段,由于酵母菌发酵作用,红树莓果浆中多酚物质更好地溶于果汁中
[10],使得前2 d的总多酚含量略有上升。在发酵中期趋于平稳。醋酸发酵结束后,总多酚含量保留了68%。
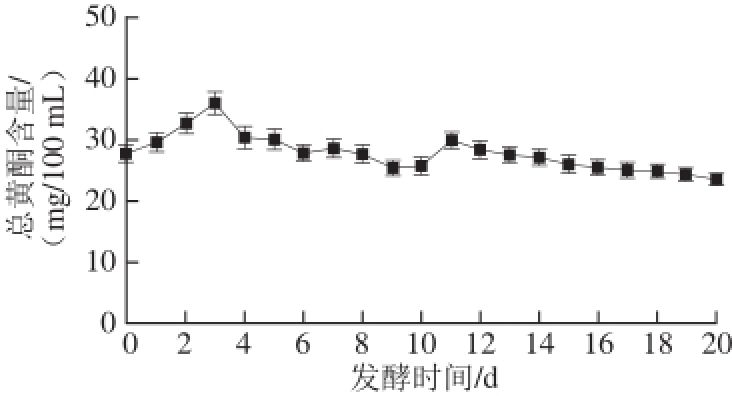
图2 红树莓果醋酿造过程中总黄酮含量的变化
Fig.2 Change in total flavonoid content during the fermentation of red raspberry vinegar
树莓黄酮具有抗氧化活性,能够清除自由基,抑制肠道革兰氏阳性肠球菌的生长繁殖,进而抑制肠道的腐败。此外,黄酮类化合物能够降低血管内皮细胞羟脯酸的代谢,减少胶原纤维的积累,有利于防止血栓的形成
[11-12]。由图2可知,红树莓酿造过程中总黄酮的含量在酒精发酵阶段先上升后下降,之后趋于平稳。醋酸发酵结束后,总黄酮含量保留了85%。由于酵母在发酵过程中产生大量次级代谢产物与多酚类物质反应生成衍生物,酶促反应导致总黄酮降解
[13]。醋酸发酵初期上升机理目前尚不清楚,有待进一步研究。
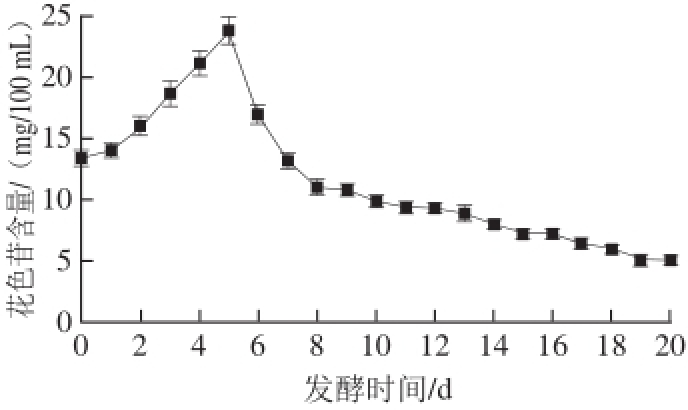
图3 红树莓果醋酿造过程中总花色苷含量的变化
Fig.3 Change in total anthocyanin content during the fermentation of red raspberry vinegar
红树莓酿造过程中花色苷的含量在酒精发酵阶段先上升后下降,之后趋于平稳。醋酸发酵结束后,总花色苷含量保留了38%。酒精发酵初期果皮、果肉细胞在发酵液底部,使其含有的花色苷物质在发酵液中分布不均匀,由于之后的缓释作用导致发酵初期花色苷含量上升。由于酵母的细胞壁对花色苷有一定的吸附作用
[14],因此随着酵母不断大量的繁殖,在酶促反应下花色苷的含量不断降低。此外有研究证明,随着发酵的进行糖含量的减少促进了花色苷的降解
[15]。花色苷在酸性条件下稳定,所以随着醋酸发酵的进行,花色苷的氧化程度变小,下降幅度减小,逐渐趋于稳定。
2.2 发酵过程中自由基清除率的变化
DPPH自由基在有机溶剂中是一种稳定的自由基,在517 nm波长处具有最大吸收率,有自由基清除剂存在时,DPPH自由基的单电子被捕捉而使其颜色变浅,吸光度与抗氧化性成反比线性关系,从而用以评价实验样品的抗氧化能力
[16]。氧自由基主要指
 和·OH,它们能使脂质过氧化,破损生物膜的结构及功能,加速机体衰老
[17]。
和·OH,它们能使脂质过氧化,破损生物膜的结构及功能,加速机体衰老
[17]。
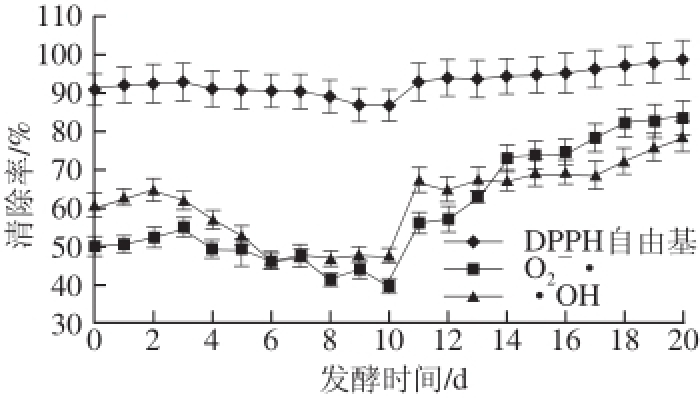
图4 红树莓果醋酿造过程中DPPH自由基、
 和·OH清除率的变化
和·OH清除率的变化
Fig.4 Changes in DPPH, superoxide anion and hydroxyl free radical scavenging activities during the fermentation of red raspberry vinegar
由图4可知,在酒精发酵阶段3 种自由基清除率均有不同程度的下降:DPPH自由基清除率下降了4.71%,但一直大于85%,保持了较高的清除率;·OH清除率下降了13.36%,
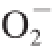 ·清除率下降了10.39%,两者下降趋势相近,清除率保持在40%~65%之间。在酒精发酵初期,由于红树莓果汁中含有一定量的氧,并且酵母菌大量繁殖,导致发酵液抗氧化性能下降。发酵后期由于积累了大量的酒精,增加了酒中酚类物质的活性以及酚类物质在发酵过程中降解的综合作用,3 种自由基的清除率在酒精发酵后期有一定的波动变化
[18-19]。
·清除率下降了10.39%,两者下降趋势相近,清除率保持在40%~65%之间。在酒精发酵初期,由于红树莓果汁中含有一定量的氧,并且酵母菌大量繁殖,导致发酵液抗氧化性能下降。发酵后期由于积累了大量的酒精,增加了酒中酚类物质的活性以及酚类物质在发酵过程中降解的综合作用,3 种自由基的清除率在酒精发酵后期有一定的波动变化
[18-19]。
从醋酸发酵中期开始,3 种自由基清除率均呈上升趋势,
 、·OH清除率分别上升了44.2%、31.1%,DPPH自由基清除率上升了11.93%,虽然程度较小,但仍保持大于90%的较高清除率。随着发酵的进行以及醋酸的积累,红树莓果醋酸度上升,提供了更多带正电的氢离子,进而提高了自由基的清除率。
、·OH清除率分别上升了44.2%、31.1%,DPPH自由基清除率上升了11.93%,虽然程度较小,但仍保持大于90%的较高清除率。随着发酵的进行以及醋酸的积累,红树莓果醋酸度上升,提供了更多带正电的氢离子,进而提高了自由基的清除率。
2.3 抗氧化性能相关性分析
表1 清除自由基能力与花色苷、总多酚和总黄酮含量的相关性分析
Table1 Linear correlation coefficients between free radical scavenging capacities and the contents of total anthocyanins, total phenols, flavonoids
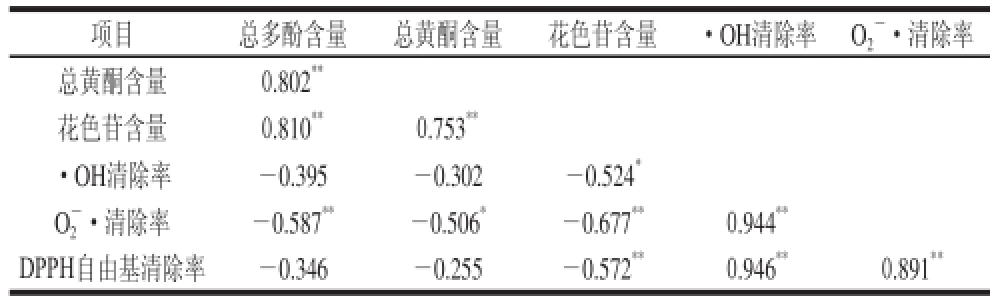
注:**.P<0.01,表示相关性极显著;*.P<0.05,表示相关性显著。
项目总多酚含量总黄酮含量花色苷含量·OH清除率O
2
-·清除率
-·清除率-0.587
**-0.506
*-0.677
**0.944
**DPPH自由基清除率-0.346-0.255-0.572
**0.946
**0.891
**总黄酮含量0.802
**花色苷含量0.810
**0.753
**·OH清除率-0.395-0.302-0.524
*O2
表1采用Pearson’s相关系数分析红树莓果醋酿造过程中自由基清除性能与总多酚、总黄酮、花色苷含量的相关性,结果表明:总多酚、总黄酮、花色苷含量互为极显著正相关,·OH清除率、
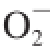 ·清除率、DPPH自由基清除率互为极显著正相关,花色苷含量与3 种自由基清除率成显著负相关,
·清除率、DPPH自由基清除率互为极显著正相关,花色苷含量与3 种自由基清除率成显著负相关,
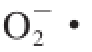 清除率与3 种抗氧化物质含量成显著负相关。研究表明,天然抗氧化剂主要来源于植物多酚,其中以黄酮类化合物最为常见,其共同结构为C6—C3—C6,花色苷同样具有黄酮类特有的3C结构,三者结构相近,因此三者之间具有极显著的相关性
[20]。氧自由基(
清除率与3 种抗氧化物质含量成显著负相关。研究表明,天然抗氧化剂主要来源于植物多酚,其中以黄酮类化合物最为常见,其共同结构为C6—C3—C6,花色苷同样具有黄酮类特有的3C结构,三者结构相近,因此三者之间具有极显著的相关性
[20]。氧自由基(
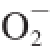 ·、·OH)与DPPH自由基的氧化与机体内的电子链传递有很高的相关性
[21],这可能是3 种自由基之间有较高的相关性的原因之一,有待进一步研究。
·、·OH)与DPPH自由基的氧化与机体内的电子链传递有很高的相关性
[21],这可能是3 种自由基之间有较高的相关性的原因之一,有待进一步研究。
2.4 抗氧化性能主成分分析结果
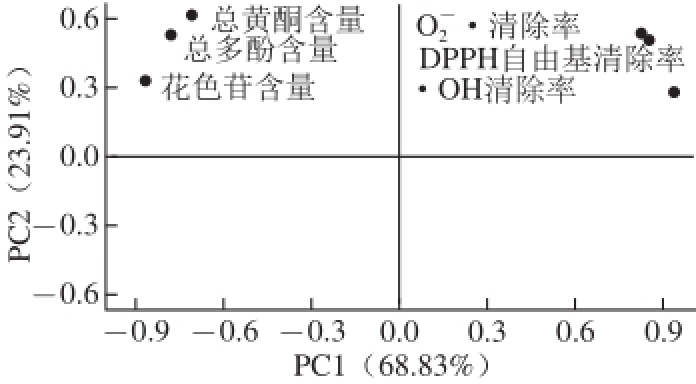
图5 抗氧化性能的主成分分析
Fig.5 Principal component analysis of antioxidant properties
由图5可知,PC1、PC2分别解释了变量的68.83%、23.91%,累计贡献率为92.74%,因此这2 个主成分能够代表整体数据的信息特征。不同抗氧化指标在主成分分析图上有较好的分类,总多酚、总黄酮、花色苷含量与PC1成很高的负相关性,DPPH自由基清除率、
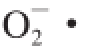 清除率、·OH清除率与PC1成很高的正相关性,上述变量均与PC2成一定的正相关性。·OH清除率,花色苷含量与PC1相关性最高,说明二者对红树莓果醋酿造过程中抗氧化性能的贡献最高。
清除率、·OH清除率与PC1成很高的正相关性,上述变量均与PC2成一定的正相关性。·OH清除率,花色苷含量与PC1相关性最高,说明二者对红树莓果醋酿造过程中抗氧化性能的贡献最高。
2.5 红树莓果醋酿造过程中抗氧化性能的聚类分析结果采用欧氏距离法对酿造过程中的抗氧化性能进行聚类分析,结果如图6所示。所测样本明显的分为3 个集群:集群1为发酵前5 d,自由基清除率和抗氧化物质含量都有不同程度的上升;集群2主要为酒精发酵后期以及醋酸发酵第1天,抗氧化物质——多酚、黄酮、花色苷迅速降解,抗氧化性能下降,是抗氧化性能转变的过渡时期;集群3为醋酸发酵期,自由基清除率大幅度稳定升高,抗氧化物质稳定小幅度下降。通过聚类分析表明不同发酵时期的变量数据特点,对红树莓酿造过程中抗氧化性能起到了很好的评价作用,是一种行之有效的分析方法。
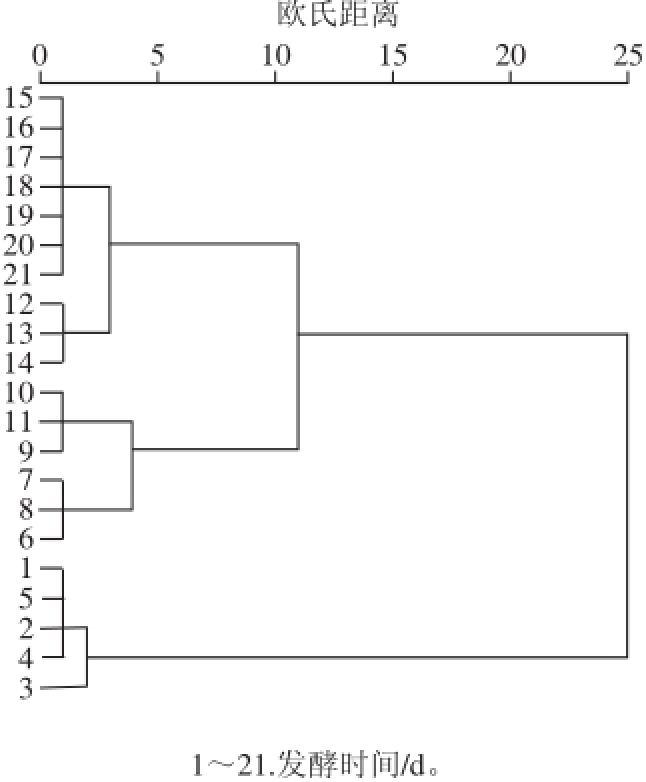
图6 抗氧化性能的聚类分析树状图
Fig.6 Cluster analysis dendrogram of antioxidant properties
3 讨 论
近年来,抗氧化研究在食品、药品领域应用广泛,但由于每种测定抗氧化活性的方法所得结果差异较大,且没有一种单一有效的实验方法可以用来精确评价抗氧化活性,因此需要通过多种实验方法、统计方法来完整精确地评价抗氧化活性
[22]。本实验对红树莓果醋发酵过程中总多酚、总黄酮、花色苷的含量和3 种自由基(·OH、DPPH自由基、
 )清除率进行了分析,评价红树莓果醋的抗氧化性能。结果发现,总多酚、总黄酮、花色苷3 种抗氧化物质含量依次减小,并且在酿造过程中总体趋势相近,这与三者的主体结构有关。DPPH自由基清除率在发酵过程中保持较高的水平,·OH、
)清除率进行了分析,评价红树莓果醋的抗氧化性能。结果发现,总多酚、总黄酮、花色苷3 种抗氧化物质含量依次减小,并且在酿造过程中总体趋势相近,这与三者的主体结构有关。DPPH自由基清除率在发酵过程中保持较高的水平,·OH、
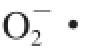 清除率变化趋势相近并在醋酸发酵阶段迅速上升。
清除率变化趋势相近并在醋酸发酵阶段迅速上升。
实验确定了总多酚、总黄酮、花色苷含量与3 种自由基(DPPH自由基、
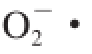 、·OH)清除率的关系,通过相关分析表明花色苷与3 种自由基清除率成显著负相关,
、·OH)清除率的关系,通过相关分析表明花色苷与3 种自由基清除率成显著负相关,
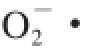 清除率与3 种抗氧化物质成显著负相关;主成分分析表明·OH清除率、花色苷含量对红树莓果醋酿造过程中抗氧化性能的贡献最高;聚类分析将红树莓酿造过程分为3 类,集群1呈上升趋势,集群2呈大幅度下降趋势,集群3显示3 种自由基清除率稳定上升。
清除率与3 种抗氧化物质成显著负相关;主成分分析表明·OH清除率、花色苷含量对红树莓果醋酿造过程中抗氧化性能的贡献最高;聚类分析将红树莓酿造过程分为3 类,集群1呈上升趋势,集群2呈大幅度下降趋势,集群3显示3 种自由基清除率稳定上升。
本实验采用液态深层快速发酵制醋的方式,最大程度保留了红树莓中的抗氧化物质,醋酸发酵后总多酚含量保留了68%,总黄酮含量保留了85%,花色苷含量保留了38%,DPPH自由基清除率为98.63%,
 清除率为83.82%,·OH清除率为78.36%。可为红树莓果醋酿造过程中抗氧化性能研究提供理论支持,为红树莓果醋产品的开发提供实践依据。
清除率为83.82%,·OH清除率为78.36%。可为红树莓果醋酿造过程中抗氧化性能研究提供理论支持,为红树莓果醋产品的开发提供实践依据。
参考文献:
[1] 吕长鑫, 李萌萌, 梁洁玉, 等. 响应面分析法优化红树莓酸性乳饮料复合稳定剂[J]. 中国食品学报, 2014, 14(10): 149-156.
[2] 李亮亮, 李丹丹, 赵福杰, 等. 红树莓果酒主发酵工艺的优化[J]. 食品工业科技, 2014, 35(11): 257-261. DOI:10.13386/ j.issn1002-0306.2014.11.048.
[3] 王佳莹. 果醋饮料生产调查研究[D]. 洛阳: 河南科技大学, 2011: 12-14.
[4] 李秋. 沙棘果醋的研制及其成分分析[D]. 无锡: 江南大学, 2008: 10-15.
[5] 赵金梅, 高贵田, 薛敏, 等. 不同品种猕猴桃果实的品质及抗氧化活性[J]. 食品科学, 2014, 35(9): 118-112. DOI:10.7506/spkx1002-6630-201409024.
[6] 白立敏, 王晓杰, 辛秀兰, 等. 红树莓总黄酮的提取纯化及含量测定[J]. 湖北农业科学, 2008, 47(11): 1328-1330. DOI:10.3969/ j.issn.0439-8114.2008.11.036.
[7] 肖军霞, 黄国清, 仇宏伟, 等. 红树莓花色苷的提取及抗氧化活性研究[J]. 食品科学, 2011, 32(8): 15-18.
[8] 包怡红, 李文星, 齐君君, 等. 提取条件对蓝靛果花色苷抗氧化活性的影响[J]. 食品科学, 2010, 31(22): 20-24.
[9] 张小强, 浦跃朴, 尹立红, 等. 冬虫夏草及人工虫草菌丝体对超氧阴离子自由基和羟自由基清除作用的实验研究[J]. 中国老年学杂志, 2003, 23(11): 773-775. DOI:10.3969/j.issn.1005-9202.2003.11.028.
[10] 张晓松, 孙艳梅, 胡振生, 等. 都柿果酒在酿制过程中总酚和花色苷含量和抗氧化活性[J]. 东北农业大学学报, 2010, 41(3): 120-124. DOI:10.3969/j.issn.1005-9369.2010.03.027.
[11] RIITTA P, LIISA N. Bioactive berry compounds-novel tools against human pathogens[J]. Microbiol Biotechnol, 2005, 67(1): 8-18. DOI:10.1007/s00253-004-1817-x.
[12] BAGCHI D, SEN C K, BAGCHI M, et al. Anti-angiogenic, antioxidant, and anti-carcinogenic properties of a novel anthocyanin-rich berry extract formula[J]. Biochemistry, 2004, 69(1): 75-80. DOI:10.1023/ B:BIRY.0000016355.19999.93.
[13] MORATA A, GOMEZ-CORDOVES M C, COLOMO B, et al. Pyruvic acid and acetaldehyde production by different strains of Saccharomyces cerevisae: relationship with vitisin A and B formation in red wines[J]. Food Chemistry, 2003, 51(25): 7402-7409. DOI:10.1021/jf0304167 10.1021/jf0304167.
[14] MORATA A, GOMEZ-CORDOVES M C, SUBERVIOLA J, et al. Adsorption of anthocyanins by yeast cell walls during the fermentation of red wines[J]. Journal of Agricultural and Food Chemistry, 2003, 51(14): 4084-4088. DOI:10.1021/jf021134u.
[15] SHIMADA K, FUJIKAWA K. Antioxidative properties of xanthan on autoxidation of soybean oil in cyclodextrin emulsion[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 945-948. DOI:10.1021/ jf00018a005.
[16] 付琴琴, 王岸娜, 吴立根. 食醋抗氧化活性的研究进展[J]. 河南工业大学学报, 2012, 33(1): 84-88. DOI:41-1378/N.20120208.0844.020.
[17] 李明月, 郝雅兰, 樊明涛, 等. 石榴酒酿造过程中的多酚及其抗氧化性[J]. 天津农业科技, 2014, 20(11): 19-23. DOI:10.3969/ j.issn.1006-6500.2014.11.005.
[18] DARAVINGAS G, CAIN R F. Thermal degradation of black raspberry anthocyanin pigments in model systems[J]. Journal of Food Science, 1968, 33(2): 138-142. DOI:10.1111/j.1365-2621.1968.tb01338.x.
[19] MARTENS S, MITHER A. Flavones and flavone synthases[J]. Phytochemistry, 2005, 66(20): 2399-2407. DOI:10.1016/ j.phytochem.2005.07.013.
[20] 刘畅, 周家春. 植物多酚抗氧化性研究[J]. 粮食与油脂, 2011(2): 43-46. DOI:10.3969/j.issn.1008-9578.2011.02.012.
[21] KAY C D, KROON P A, CASSIDY A. The bioactivity of dietary anthocyanins is likely to bemediated by their degradation products[J]. Molecular Nutrition & Food Research, 2009, 53(Suppl 1): 92-101. DOI:10.1002/mnfr.200800461.
[22] TABART J, KEVERS C, PINCEMAIL J, et al. Comparative antioxidant capacities of phenolic compounds measured by various tests[J]. Food Chemistry, 2 009, 113(4): 1226-1233. DOI:10.1016/ j.foodchem.2008.08.013.
Changes in Antioxidant Properties of Red Raspberry Vinegar during Fermentation
ZHANG Qiang
1, XIN Xiulan
2,*, YANG Fumin
1, CHEN Liang
2, ZHANG Xue
2, CHI Peng
2
(1. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China;2. College of Bioengineering, Beijing Polytechnic, Beijing 100029, China)
Abstract:The changes in the contents of total polyphenols, total flavonoids and total anthocyanins, and radical scavenging capacities against 1,1-diphenyl-2-picrylhydrazyl (DPPH), hydroxyl and superoxide anion free radicals in red raspberry vinegar produced by submerged fermentation were analyzed during the fermentation process. The results indicated that the contents of total polyphenols, total flavonoids and total anthocyanins increased first and then decreased. The scavenging rates of all three kinds of free radicals increased significantly with acetic acid fermentation. After acetic acid fermentation for 10 days, 68% of the total polyphenols, 85% of the total flavonoids and 38% of the total anthocyanins were retained, and the scavenging rates of DPPH, hydroxyl and superoxide anion free radicals were 98.63%, 78.36% and 83.82%, respectively. Our results also showed there were had extremely significant positive correlations among the contents of total polyphenols, total flavonoids and total anthocyanins, and each of these was highly negative correlated with principal component 1. The scavenging rates of DPPH, hydroxyl and superoxide ani on free radicals also had extremely significant positive correlation with each other, and each showed a highly positive correlation with principal component 1. In addition, the brewing process was divided into three clusters by cluster analysis, which represented the changing trend of antioxidant properties at different fermentationstages.
Key words:red raspberry vinegar; antioxidant properties; radical scavenging rates; principal component analysis; cluster analysis
DOI:10.7506/spkx1002-6630-201603002
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)03-0006-06
引文格式:
张强, 辛秀兰, 杨富民, 等. 红树莓果醋酿造过程中抗氧化性能的变化[J]. 食品科学, 2016, 37(3): 6-11. DOI:10.7506/ spkx1002-6630-201603002. http://www.spkx.net.cn
ZHANG Qiang, XIN Xiulan, YANG Fumin, et al. Changes in antioxidant properties of red raspberry vinegar during fermentation[J]. Food Science, 2016, 37(3): 6-11. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603002. http://www.spkx.net.cn
收稿日期:2015-03-12
基金项目:国家自然科 学基金青年科学基金项目(21306002);公益性行业(农业)科研专项(201103037);北京市教委科技计划面上项目(KM201510858001)
作者简介:张强(1988—),男,硕士研究生,研究方向为小浆果深加工。E-mail:867959208@qq.com
*通信作者:辛秀兰(1968—),女,教授,博士,研究方向为小浆果资源研究及产品推广。E-mail:xiulanxin@163.com
 )清除率的变化。结果表明:总多酚、总黄酮、花色苷的含量先升高后降低,3 种自由基清除率随着醋酸发酵明显升高,醋酸发酵10 d后,总多酚、总黄酮、花色苷含量分别保留了68%、85%、38%,DPPH自由基、
)清除率的变化。结果表明:总多酚、总黄酮、花色苷的含量先升高后降低,3 种自由基清除率随着醋酸发酵明显升高,醋酸发酵10 d后,总多酚、总黄酮、花色苷含量分别保留了68%、85%、38%,DPPH自由基、
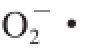 、·OH清除率分别为98.63%、83.82%、78.36%。相关性分析显示总多酚、总黄酮、花色苷含量互为极显著正相关,且与主成分1成很高的负相关;·OH清除率、
、·OH清除率分别为98.63%、83.82%、78.36%。相关性分析显示总多酚、总黄酮、花色苷含量互为极显著正相关,且与主成分1成很高的负相关;·OH清除率、
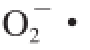 清除率、DPPH自由基清除率互为极显著正相关,且与主成分1成很高的正相关。聚类分析将酿造过程分为3 个集群,代表发酵过程中抗氧化性能不同的变化趋势。
清除率、DPPH自由基清除率互为极显著正相关,且与主成分1成很高的正相关。聚类分析将酿造过程分为3 个集群,代表发酵过程中抗氧化性能不同的变化趋势。




 和·OH,它们能使脂质过氧化,破损生物膜的结构及功能,加速机体衰老
和·OH,它们能使脂质过氧化,破损生物膜的结构及功能,加速机体衰老

 和·OH清除率的变化
和·OH清除率的变化
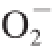 ·清除率下降了10.39%,两者下降趋势相近,清除率保持在40%~65%之间。在酒精发酵初期,由于红树莓果汁中含有一定量的氧,并且酵母菌大量繁殖,导致发酵液抗氧化性能下降。发酵后期由于积累了大量的酒精,增加了酒中酚类物质的活性以及酚类物质在发酵过程中降解的综合作用,3 种自由基的清除率在酒精发酵后期有一定的波动变化
·清除率下降了10.39%,两者下降趋势相近,清除率保持在40%~65%之间。在酒精发酵初期,由于红树莓果汁中含有一定量的氧,并且酵母菌大量繁殖,导致发酵液抗氧化性能下降。发酵后期由于积累了大量的酒精,增加了酒中酚类物质的活性以及酚类物质在发酵过程中降解的综合作用,3 种自由基的清除率在酒精发酵后期有一定的波动变化
 、·OH清除率分别上升了44.2%、31.1%,DPPH自由基清除率上升了11.93%,虽然程度较小,但仍保持大于90%的较高清除率。随着发酵的进行以及醋酸的积累,红树莓果醋酸度上升,提供了更多带正电的氢离子,进而提高了自由基的清除率。
、·OH清除率分别上升了44.2%、31.1%,DPPH自由基清除率上升了11.93%,虽然程度较小,但仍保持大于90%的较高清除率。随着发酵的进行以及醋酸的积累,红树莓果醋酸度上升,提供了更多带正电的氢离子,进而提高了自由基的清除率。

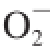 ·清除率、DPPH自由基清除率互为极显著正相关,花色苷含量与3 种自由基清除率成显著负相关,
·清除率、DPPH自由基清除率互为极显著正相关,花色苷含量与3 种自由基清除率成显著负相关,
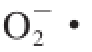 清除率与3 种抗氧化物质含量成显著负相关。研究表明,天然抗氧化剂主要来源于植物多酚,其中以黄酮类化合物最为常见,其共同结构为C6—C3—C6,花色苷同样具有黄酮类特有的3C结构,三者结构相近,因此三者之间具有极显著的相关性
清除率与3 种抗氧化物质含量成显著负相关。研究表明,天然抗氧化剂主要来源于植物多酚,其中以黄酮类化合物最为常见,其共同结构为C6—C3—C6,花色苷同样具有黄酮类特有的3C结构,三者结构相近,因此三者之间具有极显著的相关性
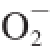 ·、·OH)与DPPH自由基的氧化与机体内的电子链传递有很高的相关性
·、·OH)与DPPH自由基的氧化与机体内的电子链传递有很高的相关性

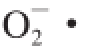 清除率、·OH清除率与PC1成很高的正相关性,上述变量均与PC2成一定的正相关性。·OH清除率,花色苷含量与PC1相关性最高,说明二者对红树莓果醋酿造过程中抗氧化性能的贡献最高。
清除率、·OH清除率与PC1成很高的正相关性,上述变量均与PC2成一定的正相关性。·OH清除率,花色苷含量与PC1相关性最高,说明二者对红树莓果醋酿造过程中抗氧化性能的贡献最高。

 )清除率进行了分析,评价红树莓果醋的抗氧化性能。结果发现,总多酚、总黄酮、花色苷3 种抗氧化物质含量依次减小,并且在酿造过程中总体趋势相近,这与三者的主体结构有关。DPPH自由基清除率在发酵过程中保持较高的水平,·OH、
)清除率进行了分析,评价红树莓果醋的抗氧化性能。结果发现,总多酚、总黄酮、花色苷3 种抗氧化物质含量依次减小,并且在酿造过程中总体趋势相近,这与三者的主体结构有关。DPPH自由基清除率在发酵过程中保持较高的水平,·OH、
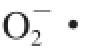 清除率变化趋势相近并在醋酸发酵阶段迅速上升。
清除率变化趋势相近并在醋酸发酵阶段迅速上升。
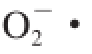 、·OH)清除率的关系,通过相关分析表明花色苷与3 种自由基清除率成显著负相关,
、·OH)清除率的关系,通过相关分析表明花色苷与3 种自由基清除率成显著负相关,
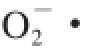 清除率与3 种抗氧化物质成显著负相关;主成分分析表明·OH清除率、花色苷含量对红树莓果醋酿造过程中抗氧化性能的贡献最高;聚类分析将红树莓酿造过程分为3 类,集群1呈上升趋势,集群2呈大幅度下降趋势,集群3显示3 种自由基清除率稳定上升。
清除率与3 种抗氧化物质成显著负相关;主成分分析表明·OH清除率、花色苷含量对红树莓果醋酿造过程中抗氧化性能的贡献最高;聚类分析将红树莓酿造过程分为3 类,集群1呈上升趋势,集群2呈大幅度下降趋势,集群3显示3 种自由基清除率稳定上升。
 清除率为83.82%,·OH清除率为78.36%。可为红树莓果醋酿造过程中抗氧化性能研究提供理论支持,为红树莓果醋产品的开发提供实践依据。
清除率为83.82%,·OH清除率为78.36%。可为红树莓果醋酿造过程中抗氧化性能研究提供理论支持,为红树莓果醋产品的开发提供实践依据。