蔺海鑫 1,林 洪 1,王晓斐 2,吕良涛 1,李振兴 1,*
(1.中国海洋大学食品安全实验室,山东 青岛 266003;2.威海职业学院生物与化学工程系,山东 威海 264200)
摘 要:以菲律宾蛤仔原肌球蛋白为研究对象,探讨美拉德反应导致核糖糖化后对其结构及免疫原性的影响。利用酶联免疫及点印记技术分析核糖对原肌球蛋白IgE/IgG结合能力的影响。通过圆二色谱(circular dichroism,CD)、有效赖氨酸含量测定等分析蛋白二级结构及相关基团的变化。结果表明,以美拉德反应为基础的与核糖的糖化反应时间达到12 h后,产物的IgE结合能力下降76.2%,IgG结合能力下降了86.8%,α-螺旋含量下降了71.7%,蛋白表面疏水性增加了192%,有效赖氨酸含量降低了45.5%。实验表明,与核糖的糖基化反应时间达到4 h后能够有效地改变菲律宾蛤仔原肌球蛋白的结构,从而降低其免疫活性。
关键词:过敏原;原肌球蛋白;美拉德;IgE结合活性;菲律宾蛤仔
菲律宾蛤仔(Ruditapes philippinarum),俗称花蛤、蛤蜊,是我国四大养殖贝类之一 [1],是日本、东南亚等国家的主要经济类水产品 [2],深受我国消费者的喜爱。随着其产量和消费量的增加,因食用菲律宾蛤仔而引起的过敏事件时有发生 [3],而目前能够消除双壳贝类过敏的唯一方法是避免食用。尽管如此,作为一种普通食材,菲律宾蛤仔仍被用于许多食品或调味品的制作,依旧可能引发过敏病症。
目前研究发现,软体动物类最主要的过敏源之一是原肌球蛋白,分子质量在35~38 kD [4]。在加工过程中,由于蛋白质本身存在不稳定性,一些蛋白质会产生变性、聚合 [5]及其他的化学修饰,这些改变可能会影响过敏原的免疫活性 [6]。降低原肌球蛋白致敏性的方式有很多,例如热加工、超高压处理和辐照等 [7-8],但效果都不尽如人意。
美拉德反应是指蛋白质分子上的氨基(主要是赖氨酸(lysine,Lys)中ε-氨基)或羧基与碳水化合物以共价键形式相结合的一种化学反应 [9]。同时,有报道称它可以在一定程度上改变过敏原的抗原性,其中包括花生过敏原 [10]、樱桃过敏原 [11]、卵清蛋白 [12]、大豆蛋白 [13]以及β-乳球蛋白 [14]过敏原。美拉德反应通过将还原糖引入,使目的蛋白增加了糖链,从而改变了其结构,进而影响其线性表位。需要注意的是,以美拉德反应为基础的糖基化反应涉及到加热,此过程也可能使过敏蛋白原有的抗原决定簇产生变化。
本研究选取还原性较强的核糖,通过与菲律宾蛤仔原肌球蛋白这一过敏组分进行美拉德反应,借助酶联免疫吸附实验、点印记、圆二色谱、荧光扫描以及赖氨酸测定等方法探索人工糖基化过程对原肌球蛋白构象及抗原性的影响,旨在对反应过程中结构与过敏原性的变化有更全面的了解。
1.1 材料与试剂
新鲜菲律宾蛤仔购自青岛市家乐福超市。
纯化的菲律宾蛤仔原肌球蛋白、兔抗蛤蜊多克隆抗体由中国海洋大学食品安全实验室制备。2 份贝类过敏患者血清由青岛大学医学院附属医院提供。过敏患者均有临床过敏病史,包括特应性皮炎、鼻炎等过敏症状。
硝酸纤维素膜、8-苯胺基-1-萘磺酸铵盐(1-anilino-8-naphthalene-sulfonate,ANS)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)试剂、标准蛋白Marker、丙烯酰胺 北京Solarbio分公司;牛血清白蛋白(bovine serum albumin,BSA)、3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB) 美国Sigma公司;辣根过氧化物酶(horseradish peroxidase,HRP)、标记的羊抗人IgE-HRP、标记的羊抗兔IgG-HRP 北京中杉金桥公司;化学发光底物(chemiluminescence,ECL) 美国Thermo Fisher公司;酸性橙 四川格雷西亚化学技术有限公司;其他试剂均为分析纯。
1.2 仪器与设备
天能Tanon-4200SF凝胶成像系统 上海天能公司;自动纯水仪 北京康铭泰克科技发展有限公司;DYY-12电泳仪 北京六一仪器厂;DHG-9070A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;JASCO J-815CD旋光仪 日本光学公司;F-4600荧光光谱扫描仪 日本日立制作所;离心机 美国Sigma公司;MultiscanMK3酶标仪 美国Thermo Fisher公司。
1.3 方法
1.3.1 菲律宾蛤仔原肌球蛋白的糖基化改性
参照Nakamura等 [15]的方法稍做修改。具体操作步骤如下:将0.5 mg/mL纯化后的原肌球蛋白溶液与含有1 mmol/L NaHCO 3、5 mmol/L β-巯基乙醇和1.2 mol/L核糖的溶液等体积混合,每管200 μL分装后进行真空冷冻干燥。干燥后样品置于60 ℃条件下反应不同时间。
1.3.2 SDS-PAGE
参考Wang等 [16]的操作步骤。样品上样量5 μg/孔,凝胶浓度分别为体积分数5%的浓缩胶和体积分数12%的分离胶,电压强度100 V,时长1.5 h。考马斯亮蓝染色后使用凝胶成像仪拍照。
1.3.3 圆二色谱(circular dichroism,CD)
美拉德反应后的产物采用CD检测分析其二级结构变化 [17]。室温下操作,扫描波长范围190~260 nm,扫描速率50 nm/min,带宽1 nm,响应时间2 s,连续扫描3次取平均值,纯水作为空白对照。结果使用CDNN 4.0软件分析。
1.3.4 反应产物中有效赖氨酸含量测定
参照肖玲等 [18]方法略作修改:准确量取液体核糖糖基化反应物115 μL加入A瓶、50 μL加入B瓶。两瓶各加入16 g/100 mL乙酸钠溶液30 μL。A瓶中加入3 μL丙酸酐纯品,B瓶中加入3 μL草酸-乙酸-磷酸缓冲液。两瓶置于振荡器振荡30 min。分别加入酸性橙溶液300 μL,振荡2 h。6 000 r/min离心取上清液100 μL,用草酸-乙酸-磷酸盐缓冲溶液定容至10 mL。在482 nm波长下测定吸光度。根据酸性橙标准曲线查找相应浓度,赖氨酸含量计算公式如下。
式中:c A、c B分别为剩余染料稀释前浓度/(mmol/L);m A、m B分别为反应物质量/g。
1.3.5 蛋白表面疏水性测定
参考Kato等 [19]的方法略作修改。用20 mmol/L Tris-HCl溶液(p H 7.5)稀释蛋白,使蛋白质量浓度在0.05~0.5 mg/mL之间。取不同质量浓度的样品1.5 mL,加入15 μL ANS溶液,振荡后静置3 min,对F-4600型荧光分光光度计设定激发波长λ ex=370 nm(狭缝校正5 nm),发射波长λ em=490 nm(狭缝校正5 nm),以荧光强度对蛋白质质量浓度作图并外推至蛋白质量浓度为0 mg/mL,曲线初始阶段斜率即为样品表面疏水性指数。
1.3.6 点印记
根据Zheng等 [20]的方法略作修改。1 μg样品点至醋酸纤维素膜中央,质量分数为5%脱脂奶粉溶液封闭过夜,兔抗蛤蜊抗体(1∶100 000倍稀释)或病人血清(1∶10倍稀释)37 ℃作用1.5 h,羊抗兔IgG-HRP(1∶5 000倍稀释)或羊抗人IgE-HRP(1∶500倍稀释)37 ℃作用1 h。每一步反应后都用含0.1%吐温-20的磷酸盐缓冲液(phosphate-buffered saline containing 0.1% Tween-20,PBST)溶液洗3 次。最后采用ECL化学发光显色,凝胶成像系统拍照。
1.3.7 间接酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)
参照吴丽莎 [21]的方法并作适当修改。每孔1 μg样品包被至96 孔酶标板上,4 ℃过夜,1% BSA溶液于37 ℃封闭2 h,兔抗蛤蜊抗体(1∶100 000倍稀释)或病人血清(1∶10倍稀释)37 ℃作用1.5 h,羊抗兔IgG-HRP(1∶5 000倍稀释)或羊抗人IgE-HRP(1∶500倍稀释)37 ℃作用40 min。每一步反应后都用PBST溶液洗3 次。最后采用TMB显色20 min,2 mol/L 硫酸溶液终止后于450 nm波长处测定吸光度。
2.1 菲律宾蛤仔原肌球蛋白与核糖美拉德反应后蛋白组分变化
本实验选取核糖这一还原糖,与目的蛋白菲律宾蛤仔原肌球蛋白混合冻干后进行反应。随着反应的进行,原肌球蛋白条带发生迁移,并在更高分子质量的位置形成了核糖-原肌球蛋白复合物。反应20 min后,在40 kD左右处形成新的条带。并且随着反应时间的加长,反应速率减慢,条带逐渐变宽,在反应60 min后形成了分子质量约为45 kD的产物。反应4 h后,整个泳道模糊(图1)。
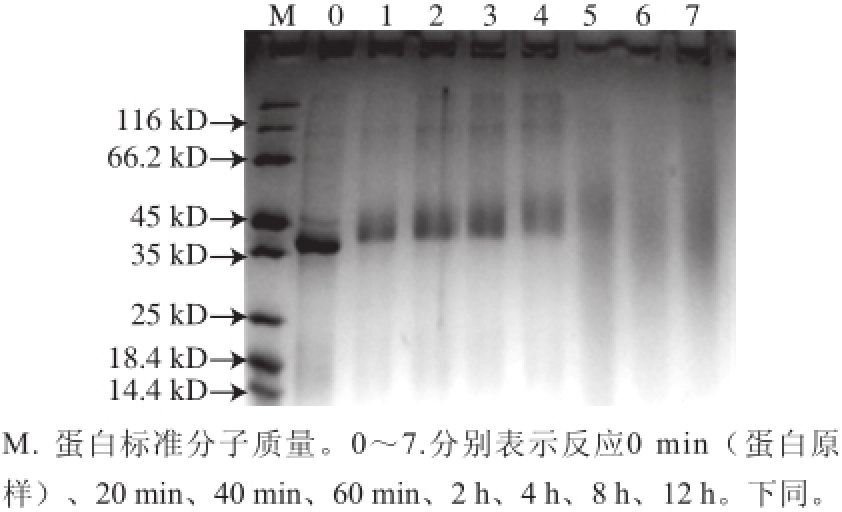
图1 原肌球蛋白与核糖反应不同时间后产物SDS-PAGE图
Fig.1 Electrophoretic patterns of tropomyosin extracted from Ruditapes philippinarum reacted with ribose for different times
同时,反应的过程中也伴随着产物颜色的变化。反应开始20 min,核糖-原肌球蛋白产物呈淡黄色。反应进行40 min后,产物颜色呈橘色。反应进行60 min,产物颜色呈红色。随着反应的不断进行,产物的颜色在逐渐加深。当反应进行到8 h后,产物颜色呈棕黑色,同时伴有颗粒状固体产生。
2.2 菲律宾蛤仔原肌球蛋白与核糖美拉德反应后二级结构变化
用圆二色性光谱测定后结果见图2,α-螺旋含量在反应60 min后迅速下降了49.1%,之后持续下降,但变化速率明显减慢,从1~12 h,α-螺旋含量比60 min时下降了44.4%,反应12 h后,α-螺旋含量比初始含量下降了71.7%。同时,β-折叠和无规卷曲的变化与α-螺旋的变化趋势正好相反,均呈上升趋势。反应初1 h内,β-折叠增加了172%,从1~12 h增加了224%。无规卷曲在前60 min增加了485%,从1~12 h增加了17.9%。β-转角的含量基本维持不变。这说明,原肌球蛋白与核糖的糖基化反应基本是由α-螺旋的伸展解螺旋转换成无规卷曲和β-折叠,同时,因为糖链在蛋白中的引入,使得生成的产物结构复杂,无规卷曲含量极高。
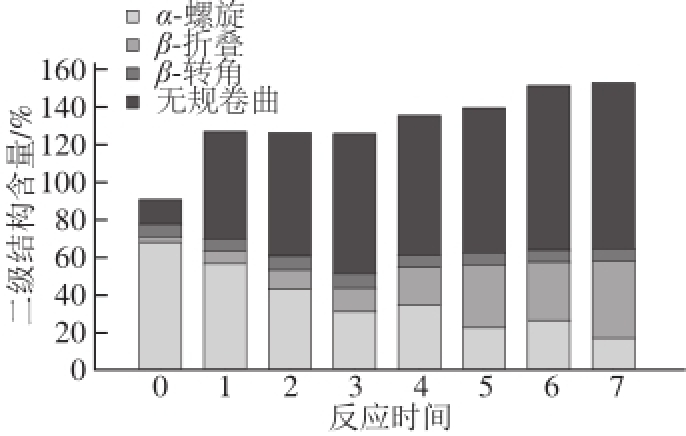
图2 原肌球蛋白与核糖反应不同时间后产物二级结构比例
Fig.2 Proportion of secondary structures of tropomyosin reacted with ribose for different times
2.3 菲律宾蛤仔原肌球蛋白与核糖美拉德反应后有效赖氨酸含量变化
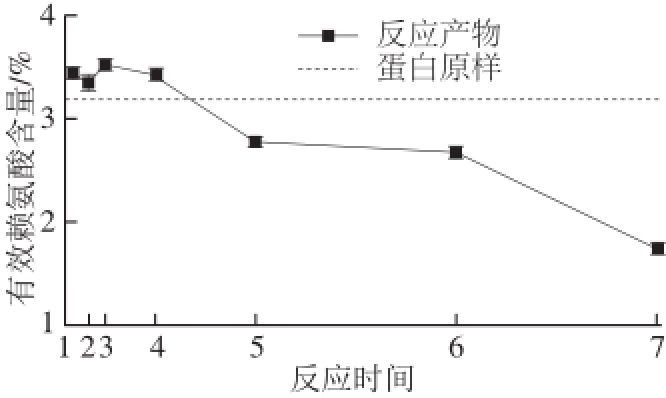
图3 原肌球蛋白与核糖反应不同时间后有效赖氨酸含量变化
Fig.3 Changes in effective lysine content of tropomyosin reacted with ribose for different times
由图3可知,当原肌球蛋白与核糖混合物在60 ℃反应时,有效赖氨酸含量有波动,也可能与所用检测方法有一定关系,但是有效赖氨酸含量总体呈先小范围增加后大幅度减少的趋势。反应进行60 min后,有效赖氨酸含量从反应初始的3.19%波动上升到3.52%,反应4 h后,赖氨酸含量降低至2.78%,反应12 h后降至1.74%,比初始含量降低了45.5%。
2.4 菲律宾蛤仔原肌球蛋白与核糖美拉德反应后表面疏水性变化
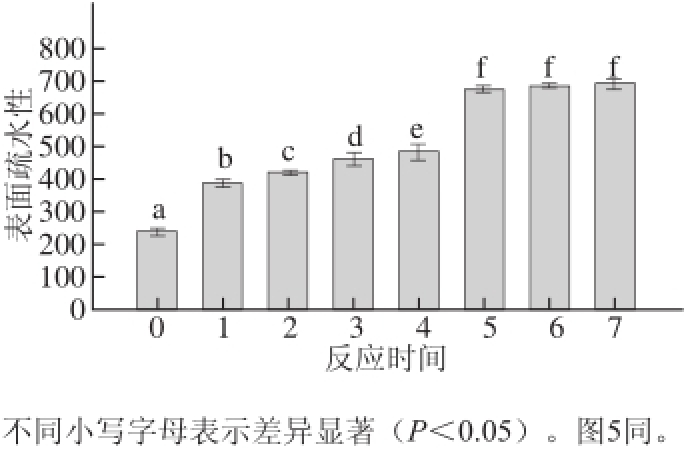
图4 原肌球蛋白与核糖反应不同时间后产物表面疏水性变化
Fig.4 Changes in hydrophobicity of tropomyo sin reacted with ribose for different times
由图4可知,菲律宾蛤仔原肌球蛋白表面疏水性随着与核糖反应时间的增长逐渐增加。与蛋白原样相比,反应20、40、60 min、2、4、8、12 h的表面疏水性分别增长了62.7%、76.9%、96.2%、103%、186%、189.0%和192%。但是,在反应时间为4、8、12 h的疏水性结果无显著性差异(P>0.05)。
2.5 菲律宾蛤仔原肌球蛋白与核糖美拉德反应后IgG/IgE结合能力变化
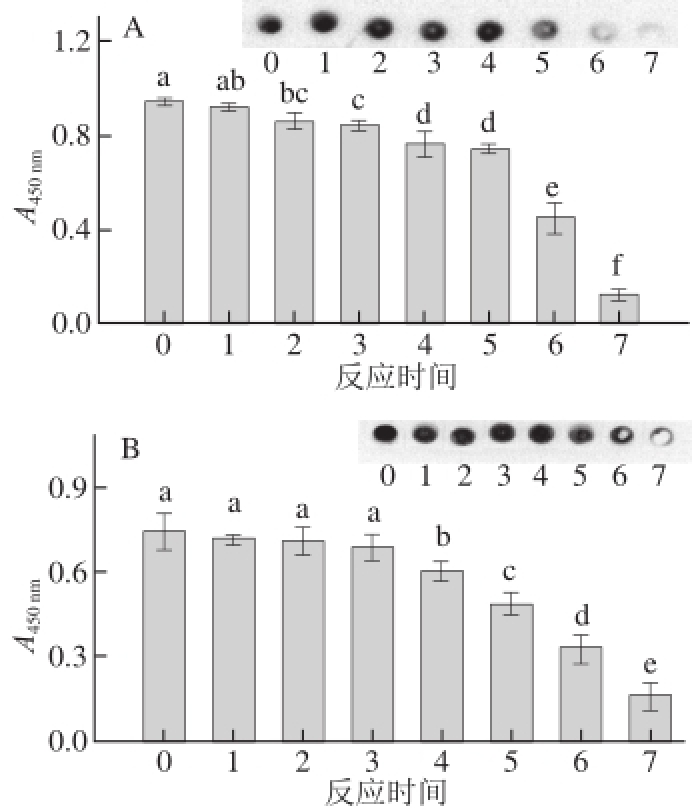
图5 原肌球蛋白与核糖反应产物与IgG(A)和IgE(B)结合能力
Fig.5 Determination of IgG (A) and IgE (B) binding property of tropomyosin reacted with ribose for different times
由图5A可知,产物的IgG结合能力随着反应的进行持续下降。反应20 min后,结合能力的变化无显著性差异(P>0.05);反应40 min后开始有显著性差异(P<0.05),IgG结合能力下降8.65%;反应进行2 h后差异极显著(P<0.01),下降了18.8%,反应12 h后降低程度最大,较初始时下降了86.8%。测定结果趋势与采用点印记实验的结果相一致。
图5B显示了产物与蛤蜊过敏患者血清中特异性IgE结合能力的变化。反应时长在60 min之内,结合能力较稳定,与初始时并无显著性差异(P>0.05)。反应进行2 h后,IgE结合能力显著(P<0.05)下降了18.8%,反应12 h后的结合能力降低程度最大,较初始时下降了76.2%。测定结果趋势与采用点印记实验的结果相一致,当糖基化反应时长超过2 h之后,特异性IgE结合能力才有较明显下降。
菲律宾蛤仔原肌球蛋白与核糖的美拉德反应,SDS-PAGE呈现的现象与之前其他过敏原反应的现象相似 [10,25-26]。产物分子质量增大的原因可能是因为蛋白上结合了更多糖链 [10],迁移率变低。同时,在以美拉德反应为基础的糖基化反应中,会导致蛋白分子之间交联聚集,从而导致了产物的溶解度下降 [27]。先前的报道已经证明,α-螺旋是通过NH—及—CO之间的氢键保持稳定的 [28],α-螺旋及无规卷曲含量的变化,说明在与核糖反应的过程中,菲律宾蛤仔原肌球蛋白解螺旋,稳定性下降,生成了无规卷曲和β-折叠。同时,反应过程中增强的疏水性表明了蛋白的变性,同时有更多疏水基团暴露在蛋白质表面,蛋白结构发生了变化。
赖氨酸是人体的必需氨基酸之一,也是很多食源性蛋白的限制性氨基酸。蛋白因带有游离氨基而呈碱性。同时,由于侧链的游离氨基,赖氨酸对热非常敏感,因此极易发生糖基化反应,所以有效赖氨酸含量是用来评价美拉德反应进程的指标之一 [25]。随着糖基化反应的进行,赖氨酸的含量总体呈下降趋势,这与先前部分研究结果相符 [25,29]。有研究表明,即便有效赖氨酸的含量在反应过程中没有明显的变化规律 [30-31],但糖基化反应仍使过敏原当中有效赖氨酸的含量发生了明显的变化。
以美拉德为基础的糖基化反应复杂,生成物的种类包括首先形成的Schiff碱,重排后形成的稳定Amadori产物,继续反应后又生成其他的稳定物质 [22]。在本实验中,使用兔抗蛤蜊抗体及贝类过敏患者血清对反应后的产物进行了抗原性的检测。结果显示,美拉德反应可以在一定程度上降低致敏性,这与其他的一些研究结果相似:果糖和低聚糖可有效降低大豆分离蛋白的抗原性 [23];使用阿拉伯半乳糖和木葡聚糖与荞麦粉发生美拉德反应,主要过敏原Fag e 1的变应原性降低 [15];采用葡萄糖与榛子主要过敏原Cor a 11的糖基化反应,也使其过敏性有所降低 [24]。还原糖类 影响过敏原的原因,可能是由于赖氨酸存在于表位部分,糖基化反应使其加入反应,由于表位的活性丧失进而影响过敏原活性 [33]。基于抗原表位的形成机理,某些亲水性抗原表位发生了改变,可能也是过敏性降低的原因之一。糖基化的复杂反应过程中产生了活性羰基,活泼的基团攻击氨基酸导致过敏原结构改变 [30]。但是并非所有的糖基化反应都可以使过敏原蛋白的致敏性减弱,葡萄糖与扇贝原肌球蛋白的美拉德反应使其IgE结合能力增加了49% [25]。这说明,糖基化对于过敏原的活性的影响很复杂,结构的变化确实能够改变其免疫活性,但是不同种类的还原糖对于同种或不同蛋白的影响存在很大差异,对于其影响机理还有待更深入的研究。
参考 文献:
[1] 刘青, 张越, 付鑫, 等. 菲律宾蛤仔的研究进展[J]. 河北渔 业, 2011(1): 56-59. DOI:10.3969/J.ISSN.1004-6755.2011.01.017.
[2] TAKAHASHI G K, KURODA T, MUROGA K. Purification and antibacterial characterization of a novel isoform of the Manila clam lectin (MCL-4) from the plasma of the Manila clam, Ruditapes philippinarum[J]. Comparative Biochemistry and Physiology. Part B: Biochemistry and Molecular Biology, 2008, 150(1): 45-5 2. DOI:10.1016/j.cbpb.2008.01.006.
[3] 李小燕. 食物过敏原可视化检测抗体微阵列的构建[D]. 青岛: 中国海洋大学, 2010:13-14.
[4] EMOTO A, ISHIZAKI S, SHIOMI K. Tropomyosins in gastropods and bivalves: identifi cation as major allergens and amino acid sequence features[J]. Food Chemistry, 2009, 114(2): 634-641. DOI:10.1016/ j.foodchem.2008.09.100.
[5] SONG Y N, LI Z X, LIN H, et al. Effect of malondialdehyde treatment on the IgE binding capacity and conformational structure of shrimp tropomy osin[J]. Food Chemistry, 2015, 175: 374-380. DOI:10.1016/ j.foodchem.2014.12.001.
[6] MILLS E N C, SANCHO I A, RIGHBY M N, et al. Impact of food processing on the structural and allergenic properties of food allergens[J]. Molecular Nutrition & Food Research, 2009, 53(8): 963-969. DOI:10.1002/mnfr.200800236.
[7] LI Z X, LIN H, CAO L M, et al. Reduction of allergenic properties of shrimp (Penaeus vannamei) allergens by high intensity ultrasound[J]. European Food Reasearch & Technology, 2006, 223(5): 639-644. DOI:10.1007/s00217-005-0246-0.
[8] LÜ L T, LIN H, LI Z X, et al. Identification of oxidative modifi cation of shrimp (Metapenaeus ensis) tropomyosin induced by malonaldehyde[J]. European Food Research and Technology, 2014, 239(5): 847-855. DOI:10.1007/s00217-014-2281-1.
[9] AMES J M. Control of the Maillard reaction in food systems[J]. Trends in Food Science & Technology, 1990, 1: 150-154. DOI:10.1016/0924-2244(90)90113-D.
[10] GRUBER P, BECKER W, HOFMANN T. Influence of the Maillard reaction on the allergenicity of rAra h 2, a recombinant major allergen from peanut[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 2289-2296. DOI:10.1021/jf048398w.
[11] GRUBER P, VIETHS S, WANGORSCH A, et al. Maillard reaction and enzymatic browning affect the allergenicity of Pru av 1, the major allergen from cherry[J]. Journal of Agricultural and Food Chemistry, 2004, 52(12): 4002-4007. DOI:10.1021/jf035458+.
[12] SLUTTER B, SOEMA P C, DING Z, et al. Conjugation of ovalbumin to trimethyl chitosan improves immunogenicity of the antigen[J]. Journal of Controlled Release, 2010, 143(2): 207-214. DOI:10.1016/ j.jconrel.2010.01.007.
[13] WILSON S, BLASCHEK K, MEJIA E. Allergenic proteins in soybean: processing and reduction of P34 allergenicity[J]. Nutrition Reviews, 2005, 63(2): 47-58. DOI:10.1111/j.1753-4887.2005.tb00121.x.
[14] AOKI T, ISKANDAR S, YOSHIDA T, et al. Reduced immunogenicity of β-lactoglobulin by conjugating with chitosan[J]. Bioscience, Biotechnology and Biochemistry, 2014, 70(10): 2349-2356. DOI:10.1271/bbb.50398.
[15] NAKAMURA S, SUZUKI Y, ISHIKAWA E, et al. Reduction of in vitro allergenicity of buckwheat Fag e 1 through the maillard-type glycosylation with polysaccharides[J]. Food Chemistry, 2008, 109(3): 538-545. DOI:10.1016/j.foodchem.2007.12.075.
[16] WANG X D, LIN H, SUI J X, et al. The effect of fish matrix on the enzyme-linked immunosorbent assay of antibiotics[J]. Journal of the Science of Food and Agriculture, 2013, 93(7): 1603-1609. DOI:10.1002/jsfa.5931.
[17] KELLY S M, JESS T J, PRICE N C. How to study proteins by circular dichroism[J]. Biochimica et Biophysica Acta - Proteins and Proteomics, 2005, 1751(2): 119-139. DOI:10.1016/j.bbapap.2005.06.005.
[18] 肖玲, 龚月生. 染料结合法测定豆粕中有效赖氨酸[J]. 饲料工业, 2001(4): 33-34. DOI:10.3969/j.issn.1001-991X.2001.04.014.
[19] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta(BBA)-Protein Structure, 1980, 624(1): 13-20. DOI:10.1016/0005-2795(80)90220-2.
[20] ZHENG L N, LIN H, PAWAR R, et al. Mapping IgE binding epitopes of major shrimp (Penaeus monodon) allergen with immunoinformatics tools[J]. Food and Chemical Toxicology, 2011, 49(11): 2954-2960. DOI:10.1016/j.fct.2011.07.043.
[21] 吴丽莎. 虾过敏原提取物量效关系的表征[D]. 青岛: 中国海洋大学, 2012: 37-38.
[22] 龚平, 阚建全. 美拉德反应产物性质的研究进展[J]. 食品与发酵工业, 2009, 35(4): 141-146.
[23] van de LAGEMAAT J, SILVÁN J M, MORENO F J, et al. In vitro glycation and antigenicity of soy proteins[J]. Food Research International, 2007, 40(1): 153-160. DOI:10.1016/ j.foodres.2006.09.006.
[24] IWAN M, VISSERS Y M, FIEDOROWICZ E, et al. Impact of maillard reaction on immunoreactivity and allergenicity of the hazelnut allergen Cor a 11[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 7163-7171. DOI:10.1021/jf2007375.
[25] NAKAMURA A, WATANABE K, OJIMA T, et al. Effect of Maillard reaction on allergenicity of scallop tropomyosin[J]. Journal of Agricultural and Food Chemistry, 2005, 53(19): 7559-7564. DOI:10.1021/jf0502045.
[26] 阮韦伟. 糖基修饰改性对拟穴青蟹过敏原性质的影响[D]. 厦门: 集美大学, 2012: 78.
[27] YEBOAH F K, ALLI I, YAYLAYAN V A, et al. Monitoring glycation of lysozyme by electrospray ionization mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2000, 48(7): 2766-2774. DOI:10.1021/jf990978j.
[28] LIU R, ZHAO S M, LIU Y M, et al. Effect of pH on the gel properties and secondary structure of fish myosin[J]. Food Chemistry, 2010, 121(1): 196-202. DOI:10.1016/j.foodchem.2009.12.030.
[29] LI Z X, JIA NG M Z, YOU J, et al. Impact of Maillard reaction conditions on the antigenicity of parvalbumin, the major allergen in grass carp[J]. Food and Agricultural Immunology, 2013, 25(4): 486-497. DOI:10.1080/09540105.2013.838943.
[30] 李庆丽, 李振兴, 林洪, 等. 美拉德反应中麦芽糖、葡萄糖对虾过敏原活性影响的研究[J]. 食品工业科技, 2009, 30(1): 79-81; 84. DOI:10.13386/j.issn1002-0306.2009.09.021.
[31] 张轶群, 李振兴, 林洪, 等. 果糖和木糖在美拉德反应中对虾类过敏原活性影响的研究[J]. 食品科学, 2009, 30(9): 11-14.
Effect of Maillard Reaction on IgE Binding Capacity and Conformational Structure of Tropomyosin from Short-Neck Clam (Ruditapes philippinarum)
LIN Haixin
1, LIN Hong
1, WANG Xiaofei
2, LÜ Liangtao
1, LI Zhenxing
1,*
(1. Food Safety Laboratory, Ocean University of China, Qingdao 266003, China; 2. Department of Biological and Chemical Engineering, Weihai Vocational College, Weihai 264200, China)
Abstract:The aim of the present study was to assess changes in conformational structures and potential allergenicity of tropomyosin from short-neck clams after glycation with ribose. Changes in potential allergenicity were characterized by immunological techniques, while circular dichroism (CD) and available lysine were determined to define conformational changes. An unfolded structure was found as glycation proceeded. Correspondingly, the amount of available lysine was reduced by 45.5% and surface hydrophobicity was increased by 192% when the reaction time was 12 h. Indirect enzyme linked immunosorbent assay (ELISA) and dot-blot results of glycation showed that potential allergenicity correlated well with structural changes. Allergenicity decreased significantly after unfolding of the protein. These results showed that conformational changes in tropomyosin induced by glycation significantly influenced the allergenicity of tropomyosin.
Key words:allergen; tropomyosin; Maillard; IgE-binding capacity; short-neck clam
DOI:10.7506/spkx1002-6630-201603005
中图分类号:TS254.5
文献标志码:A
文章编号:1002-6630(2016)03-0022-05
引文格式:
蔺海鑫, 林洪, 王晓斐, 等. 美拉德反应对菲律宾蛤仔原肌球蛋白结构及免疫活性的影响[J]. 食品科学, 2016, 37(3): 22-26. DOI:10.7506/spkx1002-6630-201603005. http://www.spkx.net.cn
LIN Haixin, LIN Hong, WANG Xiaofei, et al. Effect of Maillard reaction on IgE binding capacity and conformational structure of tropomyosin from short-neck clam (Ruditapes philippinarum)[J]. Food Science, 2016, 37(3): 22-26. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603005. http://www.spkx.net.cn
收稿日期:2015-02-12
基金项目:“十二五”国家科技支撑计划项目(2012BAD28B05)
作者简介:蔺海鑫(1989—),女,硕士研究生,研究方向为水产品过敏性。E-mail:snow-in-sky@163.com
*通信作者:李振兴(1978—),男,副教授,博士,研究方向为食品安全与质量控制。E-mail:lizhenxing@ouc.edu.cn