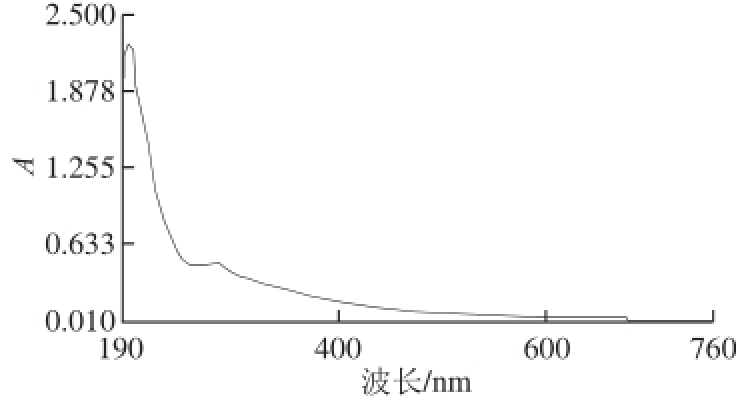
图1 多糖溶液的紫外-可见光吸收光谱
Fig.1 Ultraviolet-visible absorption curve of the polysaccharide solution
张耀雷 1,黄立新 1,*,张彩虹 1,2,谢普军 1,张 琼 1,丁莎莎 1
(1.中国林业科学研究院林产化学工业研究所,生物质化学利用国家工程实验室,国家林业局林产化学工程重点开放性实验室,江苏省生物质能源与材料重点实验室,江苏 南京 210042;2.中国林业科学研究院林业新技术研究 所,北京 100091)
摘 要:采用Sepharose CL-6B凝胶柱纯化壶瓶枣多糖(polysaccharides from Zizyphus jujube Mill. cv. Hupingzao,简称ZJP)ZJP-2和ZJP-5组分,并对纯化后多糖的结构进行分析。结果表明:经纯化后得到ZJP-2b和ZJP-5a两种组分均一的壶瓶枣活性多糖,分子质量分别为89.21、61.60 kD,均具备多糖的特征吸收峰,且均以β-构型的吡喃糖为主;ZJP-2b中单糖组成主要为鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖,其物质的量比为32.4∶9.5∶9.4∶14.7∶9.7,而ZJP-5a中单糖组成主要为鼠李糖、阿拉伯糖、木糖、甘露糖和半乳糖,其物质的量比为20.2∶42.9∶2.2∶7.5∶14.5;当质量浓度为3.5 mg/mL时,ZJP-2b和ZJP-5a的羟自由基清除率分别为30.51%和57.22%。
关键词:壶瓶枣;活性多糖;纯化;结构
壶瓶枣(Zizyphus jujube Mill. cv. Hupingzao)是鼠李科枣属植物枣树的果实,为中国十大名枣之一,主要产自山西太谷等地,有2 000多年的栽培历史,产量较高,是一种较好的提取红枣多糖的原料 [1]。多糖是红枣中重要的生物活性物质 [2],具有抗肿瘤、降血脂、抗衰老、抗病毒、抗溃疡等多种生理活性 [3],近年来,随着研究的深入,研究人员发现红枣多糖能显著刺激小鼠脾脏细胞增殖 [4],增强兔肠中抗氧化酶的活性 [5],其中金丝小枣多糖可以增强小鼠胸腺和脾脏的功能指数,拥有潜在的抗补体活性 [6]。随着社会经济的发展和生活水平的提高,人们对药品、保健品向绿色型、环保型发展的要求越来越高,因此,红枣多糖的提取开发具有广阔的市场和应用前景。然而,经提取、分离步骤得到的壶瓶枣多糖理化性质不同,仅存在部分活性多糖 [7],因此需将其分级纯化并通过活性分析筛选出活性多糖。目前采用的分级纯化方法主要是柱层析法,其中固定相包括二乙氨基乙基(diethylaminoethyl,DEAE)-纤维素、琼脂糖凝胶、葡聚糖等 [8],经过纯化后常采用高效液相色谱(high performance liquid chromatography,HPLC)法、高压电泳法及比旋度法等鉴定多糖纯度 [9]。
本实验采用Sepharose CL-6B凝胶柱纯化壶瓶枣多糖(polysaccharides from Zizyphus jujube Mill. cv. Hupingzao,简称ZJP)ZJP-2和ZJP-5组分,HPLC法鉴定其纯度及分子质量,并对其单糖组成与官能团结构进行研究。
1.1 材料与试剂
壶瓶枣多糖ZJP-2和ZJP-5组分,实验室自制 [10],经过D900型大孔吸附树脂层析柱和DEAE-52纤维素层析柱纯化,并经抗氧化活性筛选而得到。
MD44透析袋(M w3 500) Biosharp生物科技有限公司;Sepharose CL-6B 瑞典Pharmacia公司;不同分子质量葡聚糖标准品 阿拉丁(上海)有限公司;葡萄糖、苯酚、乙酸酐、吡啶和盐酸羟胺均为分析纯 南京化学试剂厂;牛血清白蛋白、考马斯亮蓝G-250 美国Sigma公司;水杨酸 国药集团化学试剂有限公司;VC西安沃尔森生物技术有限公司。
1.2 仪器与设备
Wizard2.0型真空冷冻干燥机 美国VirTis公司;CPA225D型分析天平 赛多利斯科学仪器(北京)有限公司;SHZ-D(III)型循环水式真空泵、RE-5299型旋转蒸发仪 上海东玺制冷仪器有限公司;HH-4型数显恒温水浴锅 金坛市荣华仪器制造有限公司;UV-2102PC型紫外-可见分光光度仪 上海尤尼科光谱设备有限公司;LC-20AB型HPLC仪、SIL-20A型自动进样器、RID-10A型示差折光检测器、CTO-20A型柱温箱 日本岛津公司;MAGNA-IR550型红外光谱仪 美国Thermo Electron公司;7890A型气相色谱仪 美国安捷伦公司。
1.3 方法
1.3.1 蛋白质含量的测定
以牛血清白蛋白(bovine serum albumin,BSA)为标准品,蛋白质含量测定采用考马斯亮蓝法 [11],标准曲线方程为ρ=0.123 2A-0.006 5(R 2=0.993 0)(其中ρ为溶液中蛋白质质量浓度/(mg/mL);A为样品在595 nm波长处的吸光度;线性范围为0~0.1/(mg/mL))。图1为壶瓶枣多糖的全波长扫描图,在280 nm波长处存在蛋白质的特征吸收峰 [12],故在280 nm波长处测定吸光度,用以跟踪检测蛋白质质量浓度。

图1 多糖溶液的紫外-可见光吸收光谱
Fig.1 Ultraviolet-visible absorption curve of the polysaccharide solution
1.3.2 多糖质量浓度的测定
以葡萄糖为标准品,壶瓶枣多糖含量的测定及采用苯酚-硫酸法 [13],标准曲线方程为:ρ= 0.066 6A-0.000 3(R 2=0.999 0)(其中ρ为溶液中多糖质量浓度/(mg/mL);A为样品在490 nm波长处的吸光度;线性范围为0~0.15 mg/mL)。
1.3.3 壶瓶枣多糖ZJP-2和ZJP-5组分的分级纯化
将已经过前期纯化的壶瓶枣多糖组分(ZJP-2和ZJP-5)分别经Sepharose CL-6B凝胶柱(15 mm×800 mm,45~165 μm)进一步纯化,用去离子水和0~1.0 mol/L的NaCl溶液以0.45 mL/min的流速洗脱,每6 mL体积隔管检测,作洗脱曲线,收集不同组分,浓缩后透析48 h。
1.3.4 壶瓶枣多糖纯度及分子质量测定
分别将分子质量为4.32、12.60、60.60、110.00、289.00 kD的葡聚糖配制成2 mg/mL溶液,分别进样,记录保留时间t,并以t为横坐标、分子质量为纵坐标绘制标准曲线,得保留时间和分子质量的回归方程为M w=454.12-45.33t(R 2=0.989)。将纯化后壶瓶枣多糖ZJP-2和ZJP-5组分按1.3.3节进样洗脱,若出现多个峰说明纯化效果较差,需进一步纯化;若为单一峰则说明纯化效果较好,多糖为单一组分 [14],并根据所得保留时间,通过回归方程计算其分子质量。
液相色谱条件 [15]:色谱柱:Waters Ultrahydrogel TMLinear(7.8 mm×300 mm,混合颗粒),保护柱:Waters Ultrahydrogel Guard Column(6 mm×40 mm,6 μm),进样量为20 μL,流动相为0.1 mol/L NaNO 3溶液,流速为1 mL/min,柱温为45 ℃。
1.3.5 壶瓶枣多糖羟自由基(•OH)清除率测定
取1 mg/mL纯化后多糖溶液、9 mmol/L FeSO 4溶液、9 mmol/L水杨酸-乙醇溶液、8.8 mmol/L H 2O 2溶液各1 mL,在37 ℃条件下水浴30 min,于510 nm波长处测定吸光度A 1;用蒸馏水代替壶瓶枣多糖溶液在上述条件下测定吸光度A 0;1 mL壶瓶枣多糖溶液与3 mL蒸馏水混合,于510 nm波长处测定吸光度A 2。按下式计算壶瓶枣多糖对•OH的清除率,以VC作为对照 [16]。
1.3.6 红外光谱扫描
将纯化后不同组分壶瓶枣多糖冻干后,准确称取不同组分多糖2 mg,分别与200 mg KBr干燥粉末混匀,研磨后经压片机压片,在红外光谱仪上扫描4 000~400 cm -1之间的红外光谱。
1.3.7 单糖组成分析
称取冻干后壶瓶枣活性多糖5 mg分别溶于20 mL质量分数为3%的硫酸溶液中,于100 ℃条件下酸水解4 h。冷却后用BaCO 3完全中和,离心后取上清液即为水解液。将水解液移入于圆底烧瓶中,65 ℃真空烘干,依次加入盐酸羟胺10 mg、吡啶0.5 mL,振荡后90 ℃水浴30 min,取出后冷却至室温,加入醋酸酐0.6 mL于90 ℃水浴酰化30 min,得到产物直接进行气相色谱(gas chromatography,GC)分析 [17]。分别称取葡萄糖、鼠李糖、甘露糖、木糖、半乳糖和阿拉伯糖标准品3.0 mg于带塞试管中按上述步骤酰化,得到的产物直接进行GC分析。
GC分析条件 [18]:Agilent HP-5气相色谱柱(30 m×320 μm,0.25 μm),气化室温度250 ℃,检测器温度280 ℃,程序升温:180 ℃以1.5 ℃/min升温至220 ℃,保持1 min,再以5 ℃/min升温至 250 ℃,保持3 min,检测器:火焰离子检测器,N 2流速为24 mL/min,H 2流速为60 mL/min,空气流速为350 mL/min,吹扫流量为3.0 mL/min,色谱柱流量为1 mL/min。
2.1 壶瓶枣多糖ZJP-2和ZJP-5组分的分级纯化结果
采用Sepharose CL-6B凝胶柱对壶瓶枣多糖ZJP-2和ZJP-5组分进行分级纯化,洗脱曲线如图2所示。各个组分洗脱峰狭窄对称,说明分离效果较好,且两种多糖分别可以得到主要组分ZJP-2b和ZJP-5a,考马斯亮蓝法检测结果表明无蛋白质存在,且多糖溶液在280 nm波长处无吸收,由此可判断壶瓶枣多糖ZJP-2和ZJP-5组分中无蛋白质存在。
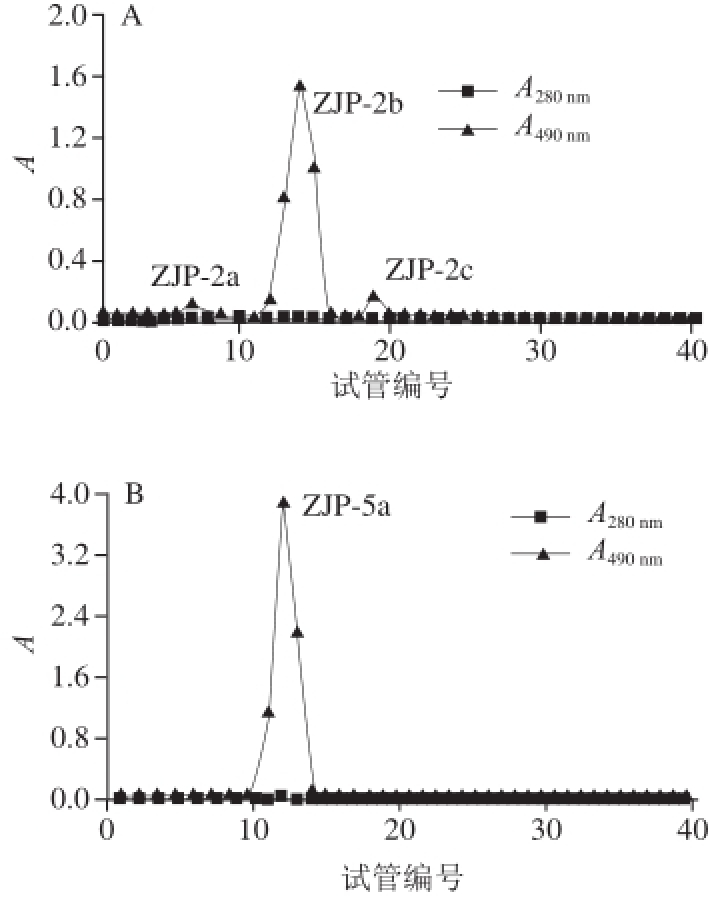
图2 ZJP-2(A)、ZJP-5(B)的Sepharose CL-6B凝胶柱洗脱曲线
Fig.2 Elution curves of ZJP-2 (A) and ZJP-5 (B) on Sepharose CL-6B column
2.2 壶瓶枣多糖ZJP-2b和ZJP-5a组分的•OH清除能力
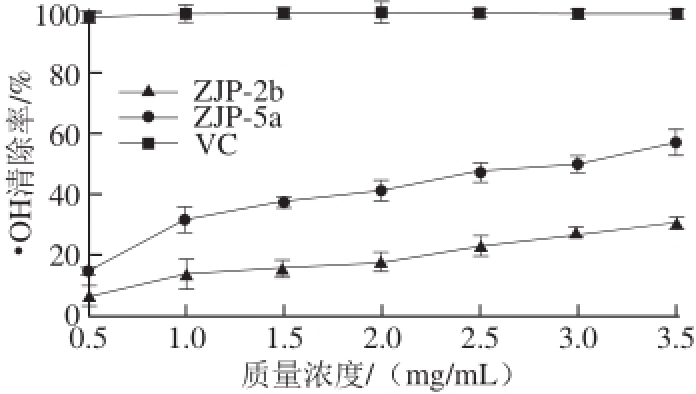
图3 ZJP-2b、ZJP-5a的·OH清除能力
Fig.3 Hydroxyl free radical scavenging capacities of ZJP-2b and ZJP-5a
由图3可知,壶瓶枣多糖ZJP-2b和ZJP-5a组分对•OH均具备较强的清除能力,清除能力的强弱与壶瓶枣多糖的质量浓度成正相关,质量浓度越高,壶瓶枣多糖ZJP-2b和ZJP-5a组分对•OH的清除能力就越强;相同质量浓度下,壶瓶枣多糖ZJP-2b和ZJP-5a组分的•OH清除能力弱于VC,ZJP-5a的•OH清除能力强于ZJP-2b,当ZJP-2b和ZJP-5a质量浓度为3.5 mg/mL时,其•OH清除率分别为30.51%和57.22%。
2.3 壶瓶枣多糖ZJP-2b和ZJP-5a组分的纯度及分子质量
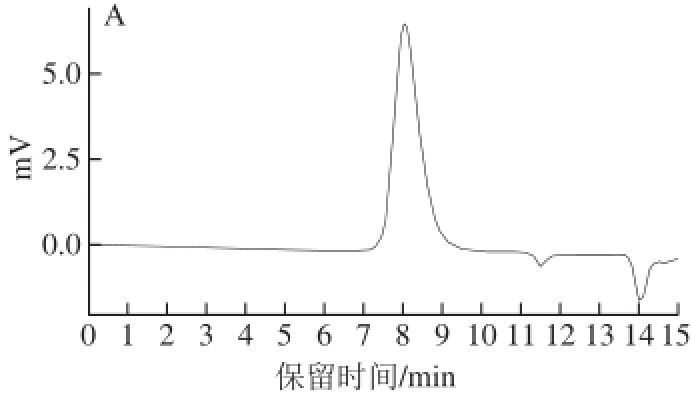
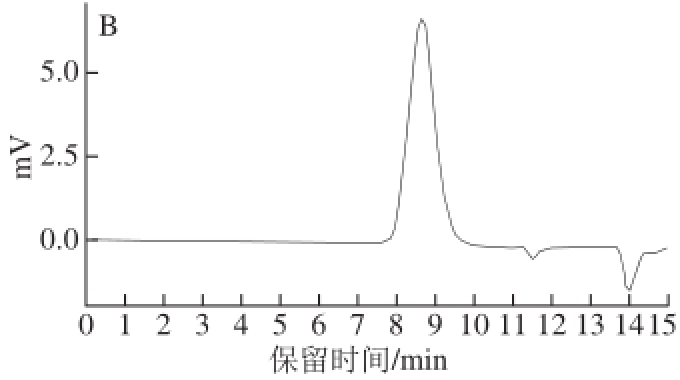
图4 ZJP-2b(A)、ZJP-5a(B)的HPLC图
Fig.4 HPLC patterns of ZJP-2b (A) and ZJP-5a (B)
HPLC技术是依据分子质量不同而对物质进行分离,其分辨率远高于常压层析柱,避免了由于分辨率低而造成高纯度假象 [19]。如图4所示,ZJP-2b和ZJP-5a的HPLC图均呈现出单一峰,说明纯化效果较好,且ZJP-2b和ZJP-5a的分子质量分别为89.21、61.60 kD。
2.4 壶瓶枣多糖ZJP-2b和ZJP-5a组分的红外光谱分析
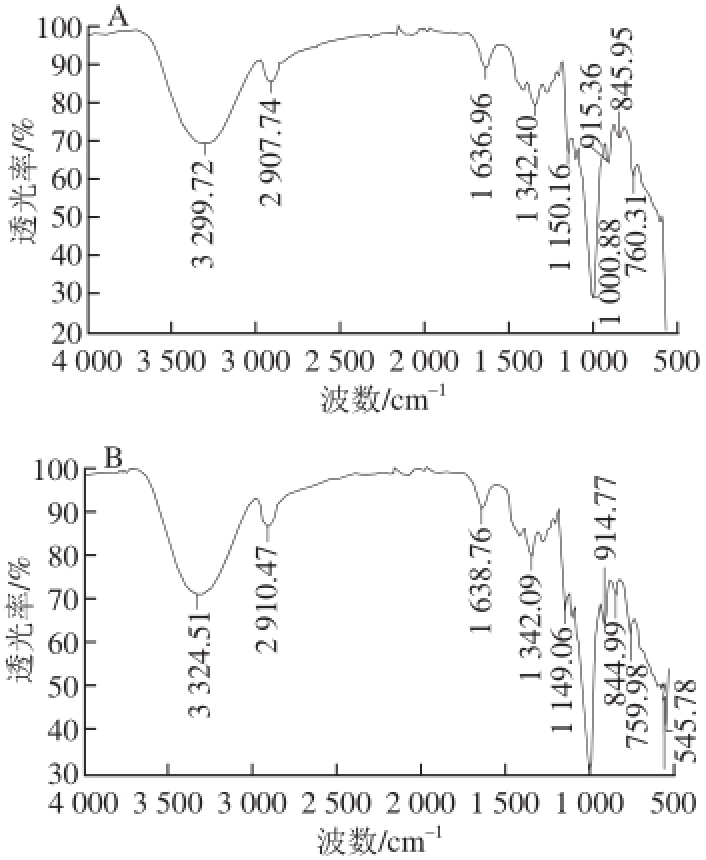
图5 ZJP-2b(A)、ZJP-5a(B)的红外光谱
Fig.5 Infrared spectra of ZJP-2b (A) and ZJP-5a (B)
对干燥后壶瓶枣多糖ZJP-2b和ZJP-5a组分进行红外光谱分析,由图5A可知,ZJP-2b在3 299 cm –1处有宽而强的吸收峰,这是—OH伸缩振动峰,在2 907cm –1处有较弱的吸收峰,为—CH伸缩振动吸收峰,这两组峰为多糖的特征吸收峰 [20];在1 636cm –1处有较弱吸收峰,为多糖分子中羰基的吸收峰 [21];在1 150~1 000 cm –1范围内有3 个吸收峰,为吡喃糖中醚键C—O—C振动产生的吸收峰 [22],说明ZJP-2b中存在吡喃型单糖;在915 cm –1处有较弱吸收峰,说明ZJP-2b中糖苷键主要以β-构型为主 [23]。
由图5B可知,ZJP-5a在3 324 cm –1处有宽而强的吸收峰,这是—OH伸缩振动峰,在2 910 cm –1处有较弱的吸收峰,为—CH伸缩振动吸收峰,这两组峰为多糖的特征吸收峰;在1 638 cm –1处有较弱吸收峰,为少量羰基的吸收峰。在1 150~1 000 cm –1范围内有3 个吸收峰,为吡喃糖中醚键C—O—C振动产生的吸收峰,说明ZJP-5a中存在吡喃型单糖。在915 cm –1处有较弱吸收峰,说明ZJP-5a中糖苷键主要以β-构型为主。
2.5 壶瓶枣多糖ZJP-2b和ZJP-5a组分的单糖组成分析
对鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖6 种单糖标准品及壶瓶枣多糖ZJP-2b和ZJP-5a组分进行GC分析,结果见图6。ZJP-2b中单糖组成主要为鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖,其物质的量比为32.4∶9.5∶9.4∶14.7∶9.7,主要成分为鼠李糖;ZJP-5a中单糖组成主要为鼠李糖、阿拉伯糖、木糖、甘露糖和半乳糖,其物质的量比为20.2∶42.9∶2.2∶7.5∶14.5,主要成分为阿拉伯糖。
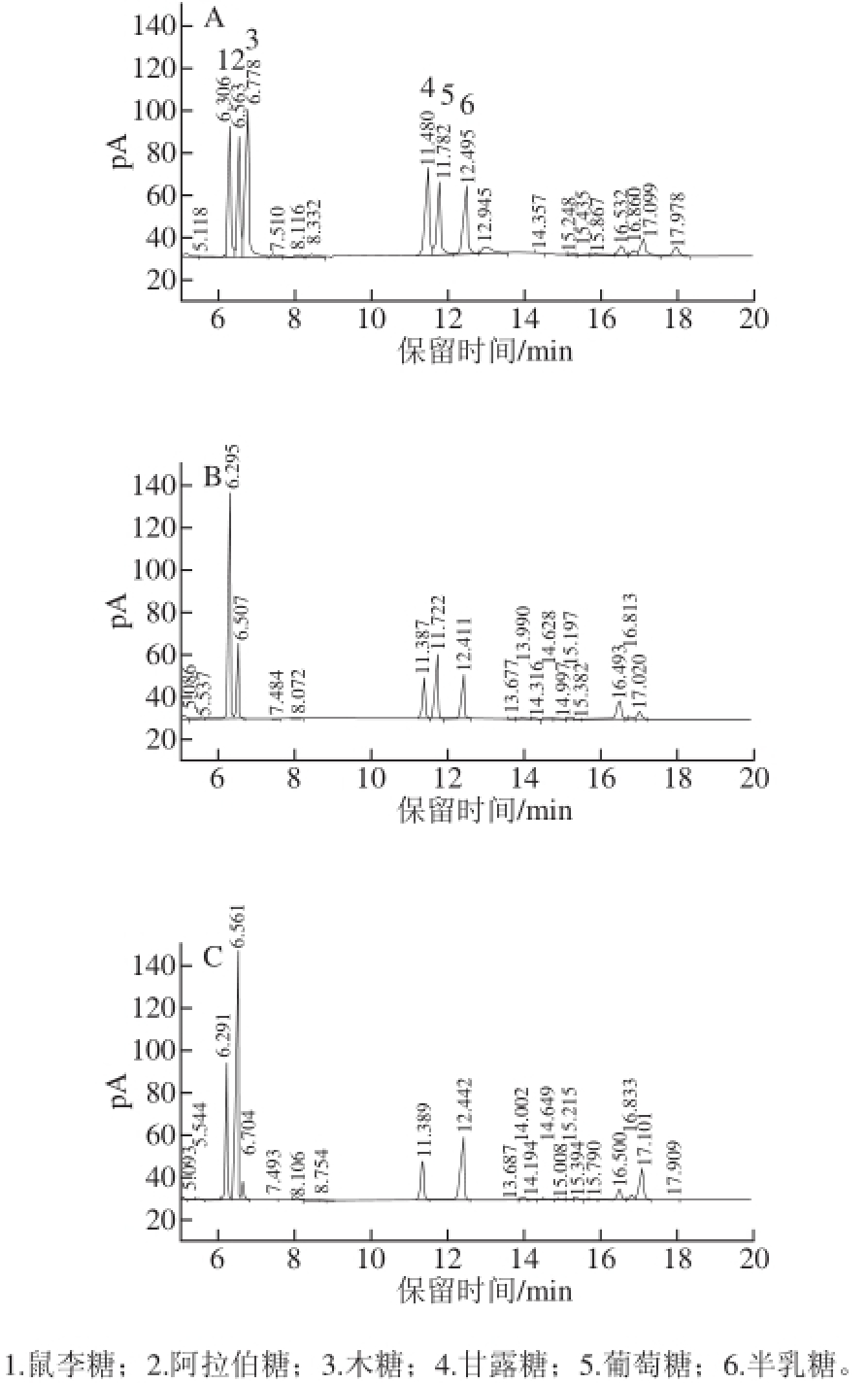
图6 单糖标准品(A)、ZJP-2b(B)、ZJP-5a(C)的气相色谱图
Fig.6 Gas chromatograms of monosaccharide standards (A), ZJP-2b (B) and ZJP-5a (C)
采用Sepharose CL-6B凝胶柱纯化壶瓶枣多糖ZJP-2和ZJP-5组分,得到ZJP-2b和ZJP-5a两种无蛋白质存在的壶瓶枣多糖组分;当质量浓度为3.5 mg/mL时,ZJP-2b和ZJP-5a的•OH清除率分别为30.51%和57.22%,均具备较强的抗氧化活性;HPLC分析表明,ZJP-2b和ZJP-5a均为单一组分,分子质量分别为89.21、61.60 kD。
红外光谱分析表明,ZJP-2b和ZJP-5a均具备多糖的特征吸收峰,且均以β-构型的吡喃糖为主;气相色谱分析表明,ZJP-2b中单糖组成主要为鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖,其物质的量比为32.4∶9.5∶9.4∶14.7∶9.7,而ZJP-5a中单糖组成主要为鼠李糖、阿拉伯糖、木糖、甘露糖和半乳糖,其物质的量比为20.2∶42.9∶2.2∶7.5∶14.5。
壶瓶枣活性多糖ZJP-2b和ZJP-5a的分子质量、活性及单糖组成与金丝小枣多糖 [24]、陕北滩枣多糖 [25]等均不同,说明品种对红枣多糖的影响较大,有必要按照不同品种对红枣多糖进行分类研究。
参考文献:
[1] 润泽. 太谷红枣硕果飘香[J]. 农产品加工, 2006( 10): 69.
[2] 方积年. 多糖研究的现状[J]. 药学学报, 1986, 21(12): 944-950.
[3] 唐洁. 植物多糖生物活性功能的研究进展[J]. 食品研究与开发, 2006, 27(5): 130-132. DOI:10.3969/j.issn.1005-6521.2006.05.051.
[4] ZHAO Z H, DAI H, WU X M, et al. Characterization of a pectic polysaccharide from the fruit of Zizyphus jujuba[J]. Chemistry of Natural Compounds, 2007, 43(4): 374-376. DOI:10.1007/s10600-007-0141-y.
[5] WANG B. Chemical characterization and Ameliorating effect of polysaccharide from Chinese jujube on intestine oxidative injury by ischemia and reperfusion[J]. International Journal of Biological Macromolecules, 2011, 48(3): 386-391. DOI:10.1016/ j.ijbiomac.2010.12.005.
[6] LI J W, SHAN L, LIU Y F, et al. Screening of a functional polysaccharide from Zizyphus jujuba cv. Jinsixiaozao and its property[J]. International Journal of Biological Macromolecules, 2011, 49(3): 255-259. DOI:10.1016/j.ijbiomac.2011.04.006.
[7] 熊双丽, 金征宇. 软骨各多糖组分的理化性质、光谱特征和自由基清除活性[J]. 中成药, 2007, 29(6): 872-874. DOI:10.3969/ j.issn.1001-1528.2007.06.029.
[8] 王涛, 赵谋明. 多糖的研究进展[J]. 现代食品科技, 2007, 23(1): 103-106. DOI:10.3969/j.issn.1673-9078.2007.01.034.
[9] 王瑞琼, 张红星, 熊利霞. 乳酸菌胞外多糖分离纯化方法研究进展[J].食品科学, 2008, 29(8): 700-703.
[10] 张耀雷, 黄立新, 张彩虹, 等. 壶瓶枣多糖的分离及其抗氧化活性[J]. 中成药, 2015, 37(6): 1268-1272. DOI:10.3969/ j.issn.1001-1528.2015.06.023.
[11] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3.
[12] 宋学伟, 任磊, 韩泳平. 大花红景天多糖RCPS分离纯化及单糖组成分析[J]. 光谱学与光谱分析, 2008, 28(3): 642-644. DOI:10.3964/ j.issn.1000-0593.2008.03.039.
[13] LI J W, FAN L P, DING S D. Isolation, purification and structure of a new water-soluble polysaccharide from Zizyphus jujuba cv. Jinsixiaozao[J]. Carbohydrate Polymers, 2011, 83(2): 477-482. DOI:10.1016/j.carbpol.2010.08.014.
[14] 席与斌, 吴允孚, 陈刚. 夏枯草多糖的分离及抗氧化活性研究[J]. 广东药学院学报, 2010, 26(6): 594-598. DOI:10.3969/ j.issn.1006-8783.2010.06.012.
[15] 戴军, 尹鸿萍, 陈尚卫. 杜氏盐藻多糖的高效体积排阻色谱的保留特性及其分析方法的研究[J]. 色谱, 2006, 24(6): 560-565. DOI:10.3321/j.issn:1000-8713.2006.06.005.
[16] 罗建平, 徐学玲, 潘利华, 等. 菠萝皮渣多糖的提取与体外抗氧化活性研究[J]. 食品科学, 2009, 30(18): 172-175.
[17] 冯宇超, 王成章, 陈文英, 等. 不同品种竹叶多糖的化学特征及其含量研究[J]. 林产化学与工业, 2009, 29(6): 81-85. DOI:10.3321/ j.issn:0253-2417.2009.06.018.
[18] 王华, 熊淑娟, 曹轩, 等. 荠菜多糖的分离纯化与单糖组成分析[J]. 中南医学科学杂志, 2015, 43(1): 82-85. DOI:10.15972/ j.cnki:43-1509/r.2015.01.021.
[19] 宋志峰, 王丽, 纪锋, 等. 正相高效液相色谱法测定维生素E保留时间稳定性的提高[J]. 化学分析计量, 2006, 15(1): 63-64. DOI:10.3969/j.issn.1008-6145.2006.01.023.
[20] 刘洋, 吴兆华, 高慧媛, 等. 金钱草多糖的分离纯化与结构研究[J]. 沈阳药科大学学报, 2008, 25(4): 282-285. DOI:10.3969/ j.issn.1006-2858.2008.04.009.
[21] 陈石良, 马青, 谷文英, 等. 灰树花胞外多糖的性质与结构[J].无锡轻工大学学报, 2002, 21(3): 244-248. DOI:10.3321/ j.issn:1673-1689.2002.03.006.
[22] 姜红霞, 聂永心, 苏延友, 等. 黄伞子实体多糖的结构初探及抗肿瘤活性研究[J]. 时珍国医国药, 2012, 23(1): 139-141. DOI:10.3969/ j.issn.1008-0805.2012.01.062.
[23] 郑德勇, 徐莉, 郑月梅, 等. 红豆杉多糖的提取与结构初探[J]. 林产化学与工业, 2012, 32(2): 102-106.
[24] ZHAO Z H, LI J, WU X M, et al. Structures and immunological activities of two pectic polysaccharides from the fruits of Zizyphus jujuba Mill. cv. Jinsixiaozao Hort.[J]. Food Research International, 2006, 39: 917-923. DOI:10.1016/j.foodres.2006.05.006.
[25] WANG D Y, ZHAO Y, JIAO Y D, et al. Antioxidative and hepatoprotective effects of the polysaccharides from Zizyphus jujube cv. Shaanbeitanzao[J]. Carbohydrate Polymers, 2012, 88: 1453-1459. DOI:10.1016/j.carbpol.2012.02.046.
Purification and Structural Analysis of Polysaccharides from Fruits of Zizyphus jujube Mill. cv. Hupingzao
ZHANG Yaolei
1, HUANG Lixin
1,*, ZHANG Caihong
1,2, XIE Pujun
1, ZHANG Qiong
1, DING Shasha
1
(1. Jiangsu Province Key Laboratory of Biomass Energy and Material, Key and Open Laboratory of Forest Chemical Engineering, State Forestry Administration, National Engineering Laboratory for Bio mass Chemical Utilization, Institute of Chemical Industry of Forest Products, Chinese Academy of Forestry, Nanjing 210042, China; 2. Research Institute of Forestry New Technology, Chinese Academy of Forestry, Beijing 100091, China)
Abstract:The polysaccharides (ZJP-2 and ZJP-5) from the fruits of Zizyphus jujube Mill. cv. Hupingzao were purifi ed by Sepharose CL-6B column chromatography, and the structures of the purifi ed active polysaccharides were studied in this investigation. The purified polysaccharides (ZJP-2b and ZJP-5a) were homogeneous, and their molecular weights were 89.21 and 61.60 kD, respectively. IR spectral analysis showed that ZJP-2b and ZJP-5a had the characteristic absorption peaks of polysaccharide, and the main structure was β-pyranose for both polysaccharides. The polysaccharide ZJP-2b was composed of rhamnose, arabinose, mannose, glucose and galactose with a molar ratio of 32.4:9.5:9.4:14.7:9.7, and ZJP-5a was composed by rhamnose, arabinose, xylose, mannose and galactose with a molar ratio of 20.2:42.9:2.2:7.5:14.5. At the concentration of 3.5 mg/mL, hydroxyl radical scavenging rates of ZJP-2b and ZJP-5a were 30.51% and 57.22%, respectively. Key words: Zizyphus jujube Mill. cv. Hupingzao; active polysaccharides; purifi cation; structure
DOI:10.7506/spkx1002-6630-201603007
中图分类号:TQ929.2
文献标志码:A
文章编号:1002-6630(2016)03-0033-05
引文格式:
张耀雷, 黄立新, 张彩虹, 等. 壶瓶枣多糖的纯化及结构初步分析[J]. 食品科学, 2016, 37(3): 33-37. DOI:10.7506/ spkx1002-6630-201603007. http://www.spkx.net.cn
ZHANG Yaolei, HUANG Lixin, ZHANG Caihong, et al. Purification and structural analysis of polysaccharides from fruits of Zizyphus jujube Mill. cv. Hupingzao[J]. Food Science, 2016, 37(3): 33-37. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603007. http://www.spkx.net.cn
收稿日期:2015-04-26
基金项目:国家林业局948技术引进项目(2012-4-12);中国林业科学研究院林业新技术研究所基本科研业务费专项资金项目(CAFINT2013C04)
作者简介:张耀雷(1989—),男,硕士研究生,主要从事农林产品深加工研究。E-mail:yaolei_zhang@163.com
*通信作者:黄立新(1967—),男,研究员,博士,主要从事天然产物提取分离纯化及新型干燥技术研究。
E-mail:l_x_huang@163.com