王洪伟 1,2,武菁菁 1,阚建全 1,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市农产品加工及贮藏重点实验室,重庆 400715)
摘 要:采用Osbron法分别提取青稞和小麦中的醇溶蛋白和谷蛋白,对这4种蛋白质进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析和红外光谱分析,并测定其表面疏水性、热稳定性、总巯基和二硫键含量。结果表明:醇溶蛋白在青稞蛋白质中的含量为16.96%,低于其在小麦蛋白质中的含量;谷蛋白在青稞蛋白质中的含量为47.83%,高于其在小麦蛋白质中的含量,但经SDSPAGE分析发现青稞中高分子质量谷蛋白亚基(high molecular weight glutenin subunit,HMW-GS)含量远低于小麦中的。青稞醇溶蛋白和谷蛋白中的二硫键和总巯基含量均低于小麦中的。4种蛋白的表面疏水性差异不大。青稞谷蛋白的热稳定性高于小麦谷蛋白,不利于其吸收水分和部分展开。红外光谱分析发现小麦醇溶蛋白和青稞醇溶蛋白的二级结构主要由β-转角和β-折叠组成,而小麦醇溶蛋白中的β-转角所占比例更高;青稞谷蛋白和小麦谷蛋白的二级结构主要以β-折叠为主。
关键词:青稞;醇溶蛋白;谷蛋白;面筋
青稞(Hordeum vulgare L. var. nudum Hook. f),又称裸大麦、元麦、 米大麦,禾本科小麦族大麦属,是一种高原谷类作物,一年生或越年生草本植物,具有耐旱、耐贫瘠、耐高寒、抗逆性等特性,主要产自中国西藏、青海、四川、云南等藏区,是藏族牧民的主食糌粑和主饮青稞酒的原料,其在藏区人民生活中不可代替 [1]。青稞符合“三高两低”(高蛋白、高纤维、高维生素、低糖、低脂肪)的饮食结构,是谷类作物中的佳品 [2]。青稞蛋白质含量较高,氨基酸种类丰富,包含人体必需8 种氨基酸,是一种优质植物蛋白资源 [3],但青稞粉无法形成面团 [4],限制了以青稞为主要原料的产品开发。
面团是指小麦粉在有适当水分(粉水比约为3∶1(m/V))存在时在室温下混合和揉搓形成强内聚力和黏弹性的糊状物,是利用小麦粉制作面制品的基础,也直接决定着后续面制品(如面包、馒头、面条等)的品质,而大麦粉、荞麦粉、燕麦粉、玉米粉等谷类粉体都无法形成面团 [5]。小麦粉能形成面团,是小麦籽粒内部各因素共同作用的结果,这包括不同种类蛋白之间,蛋白质与淀粉之间,蛋白质与脂类之间等方面的相互作用。其中,面筋蛋白的作用最重要,面筋蛋白主要包括麦醇溶蛋白和麦谷蛋白,大部分存在于小麦胚乳中,是小麦籽粒的主要贮藏蛋白,占小麦蛋白质总含量72%~85%左右。在剪切和张力作用下,面筋蛋白吸收水分和部分地展开,促进了疏水相互作用和二硫键的形成,导致线状聚合物的形成。这些线状聚合物又相互作用,通过氢键、疏水缔合和二硫交联形成能截留气体的似片状的膜。麦醇蛋白和麦谷蛋白是形成面筋的物质基础,面团吸水率、延伸度主要受麦醇蛋白的影响,而面团形成时间,稳定时间、耐揉指数、拉伸阻力、最大拉伸阻力、拉伸面积以及评价值都与谷蛋白的关系更为密切 [6]。这两种蛋白质的含量和质量决定了小麦蛋白质在面制品中的结构性能,在面制品制作过程中麦谷蛋白和麦醇溶蛋白的平衡非常重要。
本实验采用Osbron法提取青稞和小麦中的醇溶蛋白、谷蛋白,对其结构和性质进行了测定,比较两者差异,以期寻求青稞蛋白不能形成面团的机理,为青稞食品加工提供理论依据。
1.1 材料与试剂
青稞(Hordeum vulgare L. var. nudum Hook. f.)西藏龙湖工贸有限公司;小麦 山西沁县同心圆小杂粮种植专业合作社。
5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)、溴酚蓝(bromophenol blue,BPB)、过硫酸铵、牛血清白蛋白、考马斯亮蓝G-250、甘油、考马斯亮蓝R-250 北京索莱宝科技有限公司;Tris、甘氨酸(glycine,Gly)、乙二胺四乙酸二钠、尿素、β-巯基乙醇、N,N,N’,N’-甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)美国Sigma公司;其他所用试剂均为国产分析纯。
1.2 仪器与设备
FA2004 Max 200电子天平 上海精密科学仪器有限公司;Dcode TMSystem型变性梯度胶电泳仪 美国Bio-Rad公司;G: Box EF型凝胶成像系统 英国Syngene公司;UV-2450型紫外分光光度计 日本岛津公司;DSC 4000差示扫描量热仪、Spectrum 100红外光谱仪 美国PerkinElmer公司。
1.3 方法
1.3.1 蛋白质的提取
采用Osbron法 [7]提取青稞和小麦中的清蛋白、球蛋白、醇溶蛋白、谷蛋白,采用凯氏定氮法测定青稞蛋白质及其清蛋白、球蛋白、醇 蛋白、谷蛋白含量。
1.3.2 蛋白质的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
采用12%分离胶、5%浓缩胶对青稞醇溶蛋白、小麦醇溶蛋白、青稞谷蛋白、小麦谷蛋白等蛋白质进行SDS-PAGE分析。分别称取1.0 g的蛋白质样品,溶于20 mL 1 mol/L的Tris-HCl(pH 7.0)中并充分搅拌,静置,取12 mL上清液,加入3 mL电泳加样缓冲液(含250 mmol/L Tris-HCl(pH 6.8)、0.1 g/mL SDS、5 mg/mL BPB、0.5 mL/mL甘油、0.05 mL/mL β-巯基乙醇)后混匀,100 ℃沸水浴5 min,冷却后上样,上样量为15 μL(Marker上样量为10 μL)。15 mA恒流电泳,待溴酚蓝跑到分离胶中后,电流调至25 mA,电泳时间约1.5 h。考马斯亮蓝R-250染色2 h后用脱色液脱色,多次更换脱色液直至背景脱净,然后用凝胶成像系统拍摄电泳图谱,用(Version 2003.02)软件分析图谱 [8]。
1.3.3 巯基和二硫键含量的测定
分别称取2.0 g的蛋白质样品于40 mL pH 7.0的Tris-HCl溶液中,充分搅拌6 h,置于冰箱中沉淀过夜。取上清液作为蛋白液样品,采用考马斯亮蓝法测定上清液中蛋白质的含量。
1.3.3.1 游离巯基含量的测定
准确量取1.0 mL蛋白液样品,然后加入5.0 mL Tris-Gly-8 mol/L尿素溶液和0.04 mL DTNB溶液,迅速混合后于25 ℃保温反应25 min, 然后在412 nm波长处测定吸光度,并以Tris-HCl溶液代替样品作空白实验。每个样品作3 次平行实验,最终结果取其平均值,巯基含量按如下公式进行计算 [9]。
式中:73.53=10 6/(1.36×10 4),1.36×10 4为Ellman试剂的摩尔消光系数/(L/(mol·cm));A 412 nm为波长412 nm处所测得的吸光度;ρ为蛋白质样品的质量浓度/(mg/mL);D为稀释因子,对游离巯基测定中的D值取6.04。
1.3.3.2 总巯基含量的测定
准确取0.6 mL的蛋白液样品,然后加入3.0 mL Tris-Gly-10 mol/L尿素溶液和0.06 mL β-巯基乙醇,混合均匀后于2 5 ℃保温反应1 h,再加入30 mL 12%三氯乙酸溶液,继续保温反应1 h,5 000 r/min离心10 min,沉淀物用12%的三氯乙酸溶液洗涤后,溶于9.0 mL Tris-Gly-8 mol/L尿素溶液中,然后加入0.09 m L的DTNB溶液,混合均匀后于25 ℃保温反应25 min,在412 nm波长处测其吸光度,同时以Tris-HCl代替样品作空白实验。每个样品做3 次平行实验,最终结果取其平均值,总巯基含量按以下公式进行计算 [9]。
式中:D为稀释因子,取值为15;ρ为蛋白质样品的质量浓度/(mg/mL);A 412 nm为412 nm波长处所测得的吸光度。
1.3.3.3 二硫键含量的计算
二硫键含量按以下公式计算。
1.3.4 表面疏水性测定
1.3.4.1 标准曲线的绘制
取已知浓度的SDS溶液(0、0.03、0.04、0.05、0.06、0.07、0.08 mmol/L)1 mL,加入20 mL CHCl 3,混合均匀后,在CHCl 3层中加入5 mL的亚甲基蓝溶液(0.024 g/L)后充分混合均匀,2 500 r/min离心15 min,取底层SDS与亚甲基蓝的混合物,于655 nm波长处测定吸光度 [10]。其蛋白质的表面疏水性用1 mg蛋白质结合的SDS的微克数来表示。表面疏水性与吸光度的回归方程为y=6.364 5A 655 nm+0.001 0(R 2=0.993 1)。
1.3.4.2 表面疏水性的测定
取蛋白质10 mg溶解于40 mL、0.1 mmol/L的SDS溶液中,充分搅拌4 h,将上清液在蒸馏水中透析72 h后,取1 mL的透析液与20 mL CHCl 3混合均匀,然后在CHCl 3层中加入5 mL亚甲基蓝溶液(0.024 g/L)并充分混合均匀,2 500 r/min离心15 min,取底层SDS与亚甲基的混合物,于波长655 nm处测定吸光度,蛋白质表面疏水性的计算公式如下。
式中:c为根据吸光度和标准曲线计算的透析液中SDS的浓度/(mmol/L);288.38为SDS的摩尔质量/(g/mol);20为透析液中加入的CHCl 3体积/mL;10为溶解于SDS溶液中的蛋白质质量/mg。
1.3.5 热稳定性的测定
精确称取蛋白质(5 mg左右)并记录质量,将蛋白质均匀地铺在铝制坩埚中压片,然后置于差示扫描量热仪中进行升温扫描。以空铝盒为空白对照,扫描温度范围25~150 ℃,升温速率为10 ℃/min,氮气流速20.0 mL/min [11]。每个样品做3 个平行实验。
1.3.6 红外光谱分析
称取一定量的蛋白质样品与溴化钾混合(质量比1∶100),用研钵研磨成均匀粉末,压制成薄片,然后于红外光谱仪中做全波长(450~4 000 cm -1)扫描。利用PeakFit v4.12软件对酰胺Ⅰ带区域(1 600~1 700 cm -1)图谱进行分析。先基线校正,然后用Gaussian去卷积,再由二阶倒数拟合,确定各个子峰与各二级结构的对应关系,然后根据各子峰所占面积计算出各部分二级结构所占的比例 [12]。
1.4 数据分析
采用SPSS 19.0和Origin 8.6软件进行相关性和线性回归处理分析。
2.1 青稞和小麦的蛋白质组成分析
麦谷蛋白和麦醇溶蛋白的比例、含量,对面团的性质和最终产品的质量有大的影响 [13]。由表1可知,小麦蛋白和青稞蛋白中谷蛋白含量最高,分别为33.88%和47.83%;其次为醇溶蛋白,含量分别为22.68%和16.96%。青稞蛋白中醇溶蛋白和谷蛋白的比例为1∶2.820,而小麦蛋白中醇溶蛋白和谷蛋白的比例为1∶1.494。麦谷蛋白水合物具有黏结性和弹性,为面团提供强度和弹性;醇溶蛋白水合物主要为面团提供黏性和延伸性 [14]。与小麦蛋白相比,青稞蛋白的醇溶蛋白含量较低,谷蛋白含量则更高,青稞蛋白无法形成面筋,应与 青稞谷蛋白的组成和结构有关。
表1 青稞蛋白质和小麦蛋白质组成的含量分析(x±s,n==3)
Table1 Protein composition of highland barley and wheat (x±s,n=3)

注:同列小写字母不同表示组间存在显著性差异(P<0.05);清蛋白、球蛋白、醇溶蛋白、谷蛋白的含 量是指在蛋白质中的含量。
组别蛋白质清蛋白球蛋白醇溶蛋白谷蛋白其他青稞蛋白质9.46±0.23 a12.95±0.33 b12.73±0.53 b16.96±0.43 c47.83±1.10 f9.53±0.19 a小麦蛋白质10.36±0.30 a18.24±0.28 c16.51±1.03 c22.68±0.62 d33.88±0.75 e8.69±0.24 a
2.2 醇溶蛋白和谷蛋白的SDS-PAGE分析
醇溶蛋白是一种只含有分子内二硫键的单体蛋白,易溶于乙醇,占总蛋白质含量的40%~69%,富含谷氨酸和天冬氨酸(主要以酰胺基形式存在),其分子质量较小约为 30~80 kD,分子无亚基结构,无肽链间二硫键,单肽链间依靠氢键、疏水键以及分子内二 硫键 连结,形成较紧密的三维结构,呈球形,表面积小。它多由非极性氨基酸组成,较难与其他蛋白质分子交联,流动性较大,故富于黏性和膨胀性,主要提供面团的延展性。由图1可知,青稞醇溶蛋白在分子质量为30~40 kD之间比较集中,而小麦醇溶蛋白在分子质量30~40 kD之间的分布范围比青稞醇溶蛋白更宽。
麦谷蛋白是由17~20 种不同的多肽亚基通过分子间和分子内二硫键结合而成的多链蛋白,当二硫键被打断时,形成亚基。目前分析谷蛋白亚基的主要方法是SDS-PAGE,根据在SDS-PAGE中的迁移率,谷蛋白亚基可分为高分子质量谷蛋白亚基(high molecular weight glutenin subun it,HMW-GS,分子质量70 000~90 000 D,约占麦谷蛋白的10%)和低分子质量谷蛋白亚基(low molecular weight glutenin subunit,LMW-GS,分子质量30 000~45 000 D,约 占麦谷蛋白的90%) [15]。由图1可知,小麦谷蛋白的低分子质量谷蛋白和高分子质量谷蛋白亚基的条带数均高于青稞谷蛋白,尤其是高分子质量谷蛋白亚基的条带数和总量。国内外大量研究结果表明,HMW-GS虽然仅占麦谷蛋白的10%,但对加工品质起着决定性作用 [16-19],青稞高分子质量谷蛋白亚基的 数量较少,是青稞粉不能形成面团的重要原因。
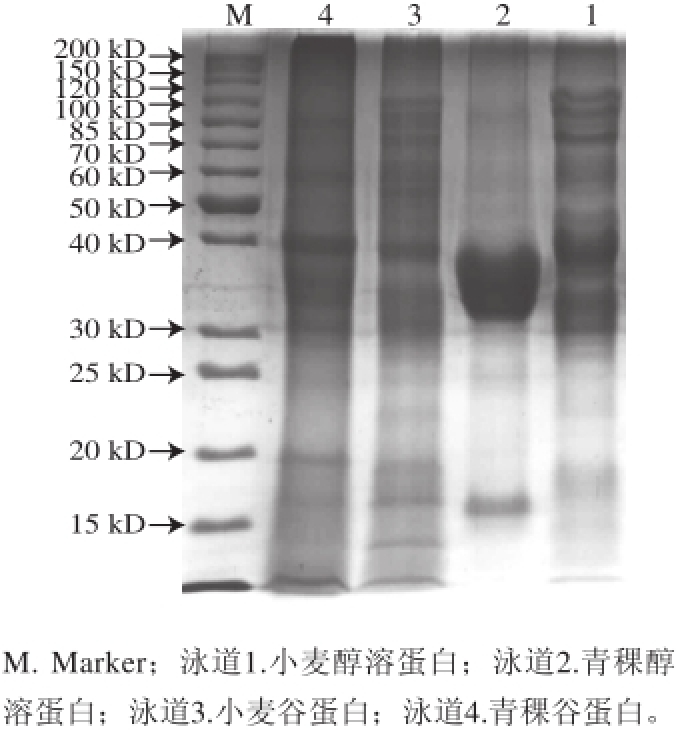
图1 青稞和小麦中醇溶蛋白和谷蛋白的SDS-PAGE(12 分离胶)
Fig.1 SDS-PAGE of gliadin and glutenin in highland barley and wheat (12% separating gel)
2.3 醇溶蛋白和谷蛋白的巯基和二硫键分析
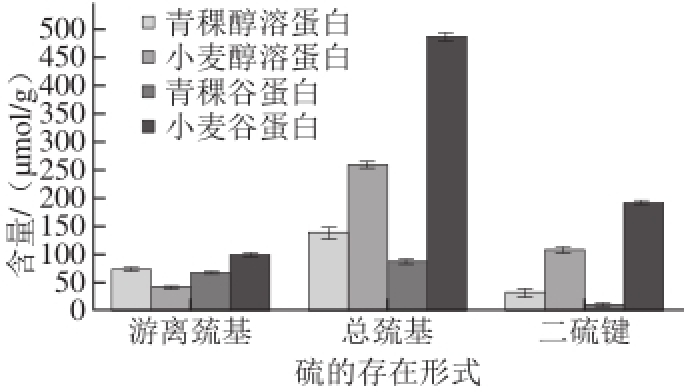
图2 醇溶蛋白和谷蛋白中巯基和二硫键含量
Fig.2 Contents of sulfydryl and disulfide bonds in gliadin and glutenin from highland ba rley and wheat
由图2可知,青稞醇 溶蛋白中的二硫键和总巯基含量分别为33.347 5 μmol/g和140.108 5 μmol/g,低于小麦醇溶蛋白中的110.003 6 μmol/g和260.760 3 μmol/g;青稞醇溶蛋白中游离巯基的含量(73.413 4 μmol/g)略高于小麦醇溶蛋白 中的(40.753 2 μmol/g)。青稞谷蛋白中的二硫键和总巯基含量分别为10.377 9 μmol/g和88.279 9 μmol/g,分别远低于小麦谷蛋白中的192.805 7 μmol/g和486.0 93 4 μmol/g;青稞醇溶蛋白中游离巯基含量(67. 5 24 1 μmol/g)低于小麦谷蛋白中的(100.482 0 μmol/g)。麦谷蛋白中二硫键对于面筋蛋白的形成具有重要作用,二硫键的还原使面筋变弱 [20]。4 种蛋白质中游离巯基含量差别较小,但青稞醇溶蛋白和谷蛋白中的二硫键含量均低于小麦,尤其青稞谷蛋白中的二硫键含量甚至不到麦谷 蛋白的1/10,这不利于青稞蛋白通过二硫键连接在一起,是青稞粉不能形成面团的重要原因。
2.4 醇 溶蛋白和谷蛋白的表面疏水性
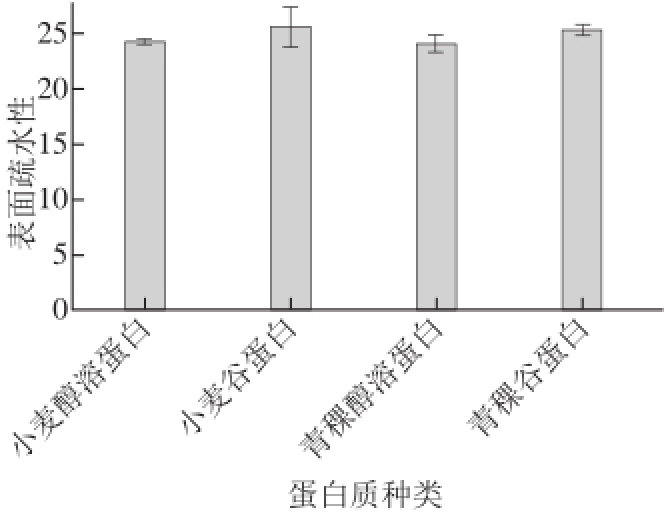
图3 青稞醇溶蛋白、谷蛋白和小麦醇溶蛋白、谷蛋白的表面疏水性
Fig.3 Hydrophobicity of gliadin and glutenin from highland barley and wheat
面筋的氨基酸残基的30%左右是疏水的,这些氨基酸使面筋能通过疏水相互作用形成蛋白质聚合体并结合脂类和其他非极性物质。由图3可知,青稞醇溶蛋白、小麦醇溶蛋白的表面疏水性差异不大,分别为24.128和24.224;青稞谷蛋白、小麦谷蛋白的表面疏水性差异不大,分别为25.284、25.666。青稞醇溶蛋白和青稞谷蛋白的疏水性对青稞粉不能形成面团的影响不大。
2.5 醇溶蛋白和谷蛋白的热稳定性

图4 青稞和小麦中的醇溶蛋白(a)和谷蛋白(b)的差示扫描量热曲线
Fig.4 Thermograms of gliadin (a) and glutenin (b) from highland barley and wheat
在小麦粉和水的混合和捏合过程中,在剪切和张力作用下,面筋蛋白吸收水分和部分展开。面筋蛋白的 部分展开会促进疏水相互作用和巯基-二硫 键交换反应,有助于蛋白质聚合形成面筋。由图4可知,青稞醇溶蛋白和小麦醇溶蛋白变性峰值温度分别为67.93 ℃和68.01 ℃,差别不大;但青稞谷蛋白变性峰值温度为71.28 ℃比小麦谷蛋白(66.81 ℃)更高,这不利于吸收水分和部分展开,不利于青稞粉形成面团。
2.6 醇溶蛋白和谷蛋白的红外光谱分析
红外光谱是目前最为常用的分析多肽和蛋白质二级结构的方法,一般蛋白质的红外光谱图谱有几组特征吸收谱带,酰胺Ⅰ(C=O)、酰胺Ⅱ(—NH变形振动和—CN伸缩振动)和酰胺Ⅲ,其波数分别对应于1 700~1 600、1 530~1 550 cm -1和1 260~1 300 cm -1的范围内。酰胺Ⅰ带能反映蛋白质的二级结构,其主要与C=O的伸缩振动有关,当蛋白质的氨基酸残基间形成的氢键较强时,C=O的电子云密度较低,仅需提供较少的能量就可以使其发生振动,C=O的吸收峰向低波数方向移动,接近1 600 cm -1,基于此原理1 610~1 640 cm -1被指认为β-折叠结构;1 640~1 650 cm -1被指认为无规卷曲结构;1 650~1 660 cm -1被指认为α-螺旋结构;1 660~1 700 cm -1被指认为β-转角结构 [21-23]。
α-螺旋是肽链主要通过氢键作用并以螺旋状的空间构象存在于蛋白质中,大多数α-螺旋结构具有两性的本质,即螺旋表面的一侧被亲水性残基占据,另一侧被疏水性残基占据,且非极性的疏水表面一般朝向蛋白质内部,参与形成疏水相互作用;β-折叠是一种具有特定几何形状的伸展结构,主要与局部的协同性氢键形成有关,在β-折叠中肽主链都处于最伸展的构象,一般β-折叠含量高的蛋白质具有较高的变性温度;β-转角是一种非重复性结构,主要与多肽链的回折、弯曲和重新定向有关,由于在改变多肽链方向的阻力比较小,β-转角的存在更有利于蛋白质生成结实、球状的结构,故β-转角大多处在蛋白质分子的表面。
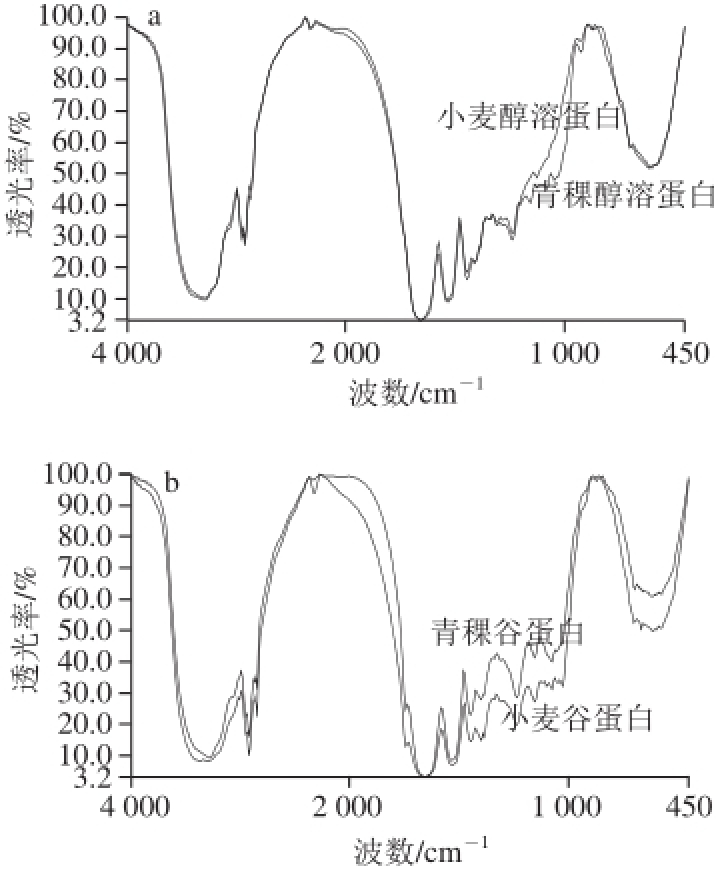
图5 青稞和小麦的醇溶蛋白(a)和谷蛋白(b)的红外光谱图
Fig.5 Infrared spectra of prolamine (a) and glutelin (b) in highland barley and wheat
由图5a可知,小麦醇溶蛋白的二级结构是由β-折叠和β-转角组成,其主要以β-转角为主,其含量为71.48%。而青稞醇溶蛋白的二级结构主要由β-折叠和β-转角组成,含量分别为43.02%和42.69%。由图5b可知,青稞谷蛋白和小麦谷蛋白的二级结构都是由β-折叠和无规卷曲组成的,但主要以β-折叠为主,含量分别为99.53%和97.38%。
青稞醇溶蛋白和小麦醇溶蛋白在蛋白质中的含量分别为16.96%和22.68%,与小麦醇溶蛋白相比,青稞醇溶蛋白亚基分子质量分布更为集中;青稞醇溶蛋白中的二硫键和总巯基含量分别为33.347 5 μmol/g和140.108 5 μmol/g,均低于小麦醇溶蛋白中的1 1 0.0 0 3 6 μ m o l/g和260.760 3 μmol/g,但游离巯基含量73.413 4 μmol/g高于小麦醇溶蛋白40.753 2 μmol/g;青稞醇溶蛋白、小麦醇溶蛋白的表面疏水性差异不大,分别为24.128和24.224;青稞醇溶蛋白二级结构中以β-折叠为主,其含量为71.48%,小麦醇溶蛋白的二级结构主要由β-折叠和β-转角组成,含量分别为43.02%和42.69%。
青稞谷蛋白和小麦谷蛋白在蛋白质中的含量分别为47.83%和33.88%,但是青稞HMW-GS的条带数远低于小麦。青稞谷蛋白中的二硫键和总巯基含量分别为10.377 9 μmol/g和88.279 9 μmol/g,远低于小麦谷蛋白中的192.805 7 μmol/g和486.093 4 μmol/g;青稞谷蛋白中的游离巯基含量67.524 1 μmol/g低于小麦谷蛋白中的100.482 0 μmol/g。青稞谷蛋白变性峰值温度为71.28 ℃高于小麦谷蛋白的66.81 ℃,热稳定性更高。青稞谷蛋白、小麦谷蛋白的表面疏水性差异不大,分别为25.284、25.666。
本实验通过比较青稞和小麦中的醇溶蛋白和谷蛋白的含量、结构和性质的差异来探讨青稞粉不能形成面筋的原因。从结果可以看出,青稞谷蛋白对于面筋能否形成起到更关键的作用。虽然青稞蛋白中谷蛋白含量高于小麦,但是青稞HMW-GS的条带数远低于小麦;青稞谷蛋白中的二硫键、游离巯基和总巯基含量均低于谷蛋白;青稞谷蛋白变性峰值温度为71.28 ℃高于小麦谷蛋白的66.81 ℃,这三方面因素会不利于青稞谷蛋白在青稞粉和水的混合和捏合过程中吸收水分,部分伸展,进而通过二硫键、氢键、疏水相互作用等作用相互交联形成面筋。
参考文献:
[1] 马寿福, 刁治民, 吴保锋. 青海青稞生产及发展前景[J]. 安徽农业科学, 2006, 34(12): 2661-2662; 2687. DOI:10.3969/ j.issn.0517-6611.2006.12.020.
[2] 臧靖巍, 阚建全, 陈宗道, 等. 青稞的成分研究及其应用现状[J]. 中国食品添加剂, 2004(4): 43-46. DOI:10.3969/ j.issn.1006-2513.2004.04.010.
[3] 谭雁文, 汪莉莎, 张甫生, 等. 不同灭酶处理对青稞的营养价值和蛋白质功能性质的影响[J]. 食品工业科技, 2014, 35(15): 147-151. DOI:10.13386/j.issn1002-0306.2014.15.022.
[4] 王婷, 李文钊, 张强. 青稞粉主要成分及其面团质构特性的研究[J]. 粮食与饲料工业, 2012(7): 41-43. DOI:10.3969/ j.issn.1003-6202.2012.07.012.
[5] 赵国华. 食品化学[M]. 北京: 科学出版社, 2014: 116.
[6] 李志西, 魏益民, 张建国, 等. 小麦蛋白质组分与面团特性和烘焙品质关系的研究[J]. 中国粮油学报, 1998, 13(3): 3-7. DOI:10.3321/ j.issn:1003-0174.1998.03.001.
[7] 张敏, 周梅, 王长远. 米糠4种蛋白质的提取与功能性质[J]. 食品科学, 2013, 34(1): 18-21.
[8] BASMAN A, KOKSEL H, NG P. Effects of transglutaminase on SDSPAGE patterns of wheat, soy, and barley proteins and their blends[J]. Journal of Food Science, 2002, 67(7): 2654-2658.
[9] RIENER C K, KADA G, GRUBER H J. Quick measurement of protein sulfhydryls with Ellman’s reagent and with 4,4’-dithiodipyridine[J]. Analytical and Bioanalytical Chemistry, 2002, 373(4/5): 266-276.
[10] 耿玮蔚, 杨光, 谢欣怡, 等. SDS结合法测定蛋白质的疏水性 [J]. 食品科学, 2009, 30(24): 416-418. DOI:10.3321/ j.issn:1002-6630.2009.24.095.
[11] XIA Yichen, WANG Yixiang, CHEN Lingyun. Molecular structure, physicochemical characterization, and in vitro degradation of barley protein films[J]. Journal of Agricultural and Food Chemistry, 2011, 59(24): 13221-13229. DOI:10.1021/jf203157a.
[12] 李涛. 青稞蛋白质的提取及其特性研究[D]. 郑州: 河南工业大学, 2010.
[13] BARAK S, MUDGIL D, KHATKAR B S. Relationship of gliadin and glutenin proteins with dough rheology, flour pasting and bread making performance of wheat varieties[J]. LWT-Food Science and Technology, 2013, 51(1): 211-217.
[14] 王怡然, 王金水, 赵谋明, 等. 小麦面筋蛋白的组成、结构和特性[J]. 食品工业科技, 2007, 28(10): 228-231. DOI:10.3969/ j.issn.1002-0306.2007.10.074.
[15] DELCOUR J A, JOYE I J, PAREYT B, et al. Wheat gluten functionality as a quality determinant in cereal-based food products[J]. Annual Review of Food Science and Technology, 2012, 3: 469-492.
[16] GAO Xin, ZHANG Qisen, NEWBERRY M P, et al. A cysteine in the repetitive domain of a high-molecular-weight glutenin subunit interferes with the mixing properties of wheat dough[J]. Amino Acids, 2013, 44(3): 1061-1071. DOI:10.1007/s00726-012-1441-5.
[17] JONDIKO T O, ALVIOLA N J, HAYS D B, et al. Effect of highmolecular-weight glutenin subunit allelic composition on wheat flour tortilla quality[J]. Cereal Chemistry, 2012, 89(3): 155-161.
[18] SHEWRY P R, GILBERT S M, SAVAGE A W, et al. Sequence and properties of HMW subunit 1Bx20 from pasta wheat (Triticum durum) which is associated with poor end use properties[J]. Theoretical and Applied Genetics, 2003, 106(4): 744-750.
[19] 吕真真, 陈洁, 龙伶俐, 等. 小麦高相对分子质量麦谷蛋白亚基及其组成对饺子皮品质的影响研究[J]. 河南工业大学学报(自然科学版), 2013, 34(3): 43-46.
[20] VERAVERBEKE W S, DELCOUR J A. Wheat protein composition and properties of wheat glutenin in relation to breadmaking functionality[J]. Critical Reviews in Food Science and Nutrition, 2002, 42(3): 179-208.
[21] 戈志成, 张燕萍. 对改性小麦面筋蛋白二级结构的红外光谱研究[J]. 中国粮油学报, 2006, 21(3): 36-38. DOI:10.3321/ j.issn:1003-0174.2006.03.009.
[22] 闫洁, 马晓军. 不同干燥方式对大豆蛋白二级结构的影响[J]. 食品工业科技, 2008, 29(5): 131-132.
[23] JACKSON M, MANTSCH H H. The use and misuse of FTIR spectroscopy in the determination of protein structure[J]. Critical Reviews in Biochemistry Molecular Biology, 1995, 30(2): 95-120.
Comparison of Structure Characteristics of Gliadin and Glutenin in Highland Barley and Wheat
WANG Hongwei
1,2, WU Jingjing
1, KAN Jianquan
1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Chongqing Key Laboratory of Produce Processing and Storage, Chongqing 400715, China)
Abstract:Gliadin and glutenin were extracted from highland barley and wheat using the Osbron method, their physicochemical properties including subunit compositions, secondary structure, surface hydrophobicity, the rmal stability, and active and total sulfydryl grou ps were measured. The results showed that gliadin content in highland barley protein was 16.96%, lower than that in wheat protein; glutenin content in highland barley protein was 47.83%, higher than that in wheat protein; however, highland barley contained less high molecular weight glutenin subunit (HMW-GS) bands wheat. The total sulfydryl and disulfide bond contents of gliadin and glutenin in highland barley were lower than those of wheat, respectively. The hydrophobicity of gliadin and glutenin from highland barley and wheat showed a similarity. Highland barley glutenin showed higher thermal stability compared with wheat glutenin. The secondary structure of gliadin and glutenin was studied by circular dichroism, and β-pleated sheet was dominant in glutenin. The major secondary structures were β-pleated sheet and β-sheet in gliadin while β-sheet content of highland barley gliadin was lower compared with wheat gliadin.
Key words:highland barley; gliadin; glutenin; gluten
DOI:10.7506/spkx1002-6630-201603009
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)03-0043-06
引文格式:
王洪伟, 武菁菁, 阚建全. 青稞和小麦醇溶蛋白和谷蛋白结构性质的比较研究[J]. 食品科学, 2016, 37(3): 43-48. DOI:10.7506/spkx1002-6630-201603009. http://www.spkx.net.cn
WANG Hongwei, WU Jingjing, KAN Jianquan. Comparison of structure characteristics of gliadin and glutenin in highland barley and wheat[J]. Food Science, 2016, 37(3): 43-48. (in Chinese with English abstract) DOI:10.7506/sp kx1002-6630-201603009. http://www.spkx.net.cn
收稿日期:2015-03-15
基金项目:中央高校基本科研业务费专项资金项目(XDJK2015C134)
作者简介:王洪伟(1978—),男,讲师,博士研究生,研究方向为食品化学与营养学、食品感官分析。E-mail:wanghwljl@qq.com
*通信作者:阚建全(1965—),男,教授,博士,研究方向为食品化学与营养学、食品生物技术、食品质量与安全。E-mail:ganjq1965@163.com