
图1 料液比对组织蛋白酶B活力的影响
Fig.1 Effect of solid/liquid ratio on the activity of cathepsin B
李 琳,王正全,张晶晶,苗晓丹,马 垒,王锡昌,刘 源*
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
摘 要:为获得暗纹东方鲀组织蛋白酶B的最佳提取工艺条件,在单因素试验的基础上,通过Plackett-Burman设计对影响组织蛋白酶B活力的因素进行筛选,结果表明:料液比、磷酸盐缓冲液pH值和硫酸铵饱和度这3 个因素显著影响酶活力,然后用响应面分析法确定了主要影响因素的最佳提取条件为:料液比1∶2.1、磷酸盐缓冲液pH 7.0、硫酸铵饱和度99.2%,在此条件下组织蛋白酶B活力的预测值为32.65 U/g,实测值为32.52 U/g,相对误差为0.39%。说明建立的模型切实可行,为进一步研究组织蛋白酶B的提取工艺提供理论依据。
关键词:暗纹东方鲀;组织蛋白酶B;Plackett-Burman设计;响应面分析法
暗纹东方鲀(Takifugu obscurus)隶属于鲀形目,鲀科,东方鲀属,俗称河鲀、河豚,属江海洄游性鱼类,其味道鲜美,肉质细腻,营养丰富 [1-2],为“长江三鲜”之一。暗纹东方鲀经过几代淡水养殖,毒性逐渐降低,可供安全食用 [3],广受国内外消费者的欢迎,具有广阔的市场前景和经济价值。内源蛋白酶是引起蛋白质水解的重要因素 [4],对食品的风味产生也具有一定贡献 [5]。蛋白质降解主要由组织蛋白酶、钙激活蛋白酶、氨肽酶等内源蛋白酶引起的 [6-8],其中组织蛋白酶的作用尤为重要,目前已从许多动物肌肉或内脏中分离纯化出多种组织蛋白酶 [9-11],在众多组织蛋白酶中,组织蛋白酶B是活性较强的一种酶 [12-13],研究表明组织蛋白酶B能够水解肌球蛋白、肌钙蛋白、原肌球蛋白和肌动蛋白。Hughes等 [14]研究发现,组织蛋白酶B对肌动蛋白有较强的水解作用,能从蛋白质的N端和C端水解得到大量的肽类,这可能对肉类食品的风味形成具有重要的作用,并可专一性地水解荧光底物N-苄氧羰基-L-精氨酰-L-精氨酸-7-氨基-4-甲基香豆素(N-Cbz-L-arginine-7-amido-4-methylcoumarin,Z-Arg-Arg-AMC) [15]。目前,已有报道从海参 [16]、鲢鱼 [17]中提取组织蛋白酶B的相关研究,但基本上以单因素试验直接确定最佳酶活性的提取条件,并没有进行进一步的优化。
本实验以暗纹东方鲀为原料,通过单因素试验、Plackett-Burman试验和响应面分析试验,以组织蛋白酶B活力大小为指标,更系统地研究组织蛋白酶B的最佳提取条件,以便建立组织蛋白酶B酶活力与肌肉蛋白质水解及与河豚风味物质形成之间的联系,并为进一步分离纯化组织蛋白酶B奠定基础。
1.1 材料与试剂
暗纹东方鲀(Takifugu obscures) 江苏中洋集团。
酰胺甲基香豆素(7-amido-4-methylcoumarin,A M C)、Z-A r g-A r g-A M C、苯甲基硫酰氟(phenylmethanesulfonyl fluoride,PMSF)、半胱氨酸(L-cystine,L-Cys)、二硫苏糖醇(dithiothreitol,DTT)、二甲基亚砜(dimethyl sulphoxide,DMSO)、聚环氧乙烷23月桂醚(polyoxyethylene 23 laurylether,Brij35)、氯乙酸钠 美国Sigma公司;其他试剂为国产分析纯。
1.2 仪器与设备
RF5301-PC荧光分光光度计 日本岛津公司;Avanti J-26XP冷冻离心机 丹麦福斯集团;T10 basic高速分散机 德国IKA公司。
1.3 方法
1.3.1 暗纹东方鲀组织蛋白酶B粗酶液提取
将肌肉样品于4 ℃条件下解冻,去除脂肪、结缔组织,用绞肉机绞碎,取(10.00±0.01) g暗纹东方鲀肌肉,加入一定体积比的磷酸盐缓冲溶液(phosphate buffer solution,PBS),在冰浴的条件下高速匀浆5 次(18 000~22 000 r/min,每次10 s,间隔2 s),然后12 000 r/min,4 ℃条件下冷冻离心30 min,用纱布过滤收集上清液,用等体积一定饱和度的(NH 4) 2SO 4盐析过夜后离心(10 000 r/min,30 min,4 ℃),所得沉淀用20 mmol/L pH 6.0的PBS溶解,并对沉淀进行充分透析,透析完成后离心(10 000 r/min,30 min,4 ℃)取上清,用滤纸过滤后再用0.45 μm的滤膜过滤,即得到组织蛋白酶B粗酶液。
1.3.2 暗纹东方鲀组织蛋白酶B活力测定
肌肉组织蛋白酶B活力的测定参考Greenbaum [9]、Aranishi [15]、Toldra [18]等的方法,并做了适当修改。反应体系由980 μL 0.1% Brij35,500 μL 50 mmol/L PBS(含5 mmol/L乙二胺四乙酸(ethylenediniteilotetraacctic acid,EDTA)、5 mmol/L L-Cys,pH 6.0),500 μL 20 μmol/L的底物Z-Arg-Arg-AMC和 20 μL酶液组成。在40 ℃条件下水浴2 min,后加入500 μL 20 μmmol/L的底物Z-Arg-Arg-AMC,在40 ℃条件下反应10 min 后,加入2 mL终止液(0.1 mol/L乙酸钠,含0.1 mol/L氯乙酸钠,pH 4. 3)终止反应。利用荧光分光光度计测定其荧光强度,所用的激发波长为370 nm,发射波长为460 nm。同时用AMC取代Z-Arg-Arg-AMC测定1 nmol/L AMC的荧光强度。
酶活力单位(U)定义为在最适反应温度(40 ℃)和pH 6.0条件下,每分钟内水解底物并释放1 nmol AMC产物的酶量(1 nmol AMC/min)。
1.3.3 单因素试验
分别以料液比、缓冲液浓度及pH值、巯基保护剂种类、巯基保护剂的浓度、PMSF浓度、硫酸铵饱和度为影响因素,以组织蛋白酶B酶活力为指标进行单因素试验。
1.3.4 Plackett-Burman试验设计
通过对单因素试验进行分析,选择各影响因子的高(+1)、低(-1)两个水平,并以组织蛋白酶B活力为考察指标,采用Plackett-Burman试验设计筛选组织蛋白酶B活力的影响因子。
1.3.5 Box-Behnken响应面试验设计
对组织蛋白酶B活力的影响因素很多,根据单因素试验和Plackett-Burman试验,采用Box-Behnken原理设计三因素三水平的响应面分析法,根据回归分析确定提取过程的影响因子,以组织蛋白酶B活力为响应值,分析最佳酶活力的提取条件。
2.1 单因素试验结果
2.1.1 料液比对组织蛋白酶B活力的影响
料液比是影响组织蛋白酶B活力的重要因素,以50 mmol/L pH 5.8 PBS为浸提缓冲液,5 mmol/L L-Cys作为巯基保护剂,0.5 mmol/L PMSF作为蛋白酶抑制剂,硫酸铵饱和度为80%,考察河豚鱼肉与缓冲液的比例(即料液比(m/V)分别为1∶1、1∶2、1∶4、1∶6、1∶8)对组织蛋白酶B活力的影响,结果见图1。

图1 料液比对组织蛋白酶B活力的影响
Fig.1 Effect of solid/liquid ratio on the activity of cathepsin B
由图1可知,组织蛋白酶B活力随料液比的增大而增大,当料液比达到1∶2时,组织蛋白酶B活力达到最大,随着料液比继续增大,组织蛋白酶B活力显著下降。这是因为随着浸提液体积的增大,提取液与河豚鱼肉的接触面积变大,从而促进河豚肉中的蛋白质成分溶出,之后随着水分子的增多,相互作用加大从而使得蛋白酶不易析出 [19],使得组织蛋白酶B活力降低,因此选择1∶2为浸提液的最佳添加量。
2.1.2 缓冲液种类对组织蛋白酶B活力的影响
缓冲液种类、浓度以及pH值是影响组织蛋白酶B活力的重要因素,以料液比为1∶2、5 mmol/L L-Cys作为巯基保护剂,0.5 mmol/L PMSF作为蛋白酶抑制剂,硫酸铵饱和度为80%,以不同的缓冲溶液(50 mmol/L乙酸钠缓冲液、pH 5.8,20 mmol/L乙酸钠缓冲液、pH 5.0,50 mmol/L乙酸钠缓冲液、pH 5.0,20 mmol/L乙酸钠缓冲液、pH 5.8,50 mmol/L PBS、pH 5.0,50 mmol/L PBS、pH 5.8)对组织蛋白酶B活力的影响做单因素试验,结果见图2。

图2 不同缓冲浸提液对组织蛋白酶B活力的影响
Fig.2 Effect of extraction solutions on the activity of cathepsin B
1. 50 mmol/L乙酸钠缓冲液、pH 5.8;2. 20 mmol/L乙酸钠缓冲液、pH 5.0;3. 50 mmol/L乙酸钠缓冲液、pH 5.0;4. 20 mmol/L乙酸钠缓冲液、pH 5.8;5. 50 mmol/L PBS、pH 5.0;6. 50 mmol/L PBS、pH 5.8。
由图2可知,缓冲液的种类、浓度及pH值都会影响组织蛋白酶B的活力,且PBS提取效果均优于乙酸钠缓冲液的提取效果,这与田甲春 [20]研究牦牛肌肉组织蛋白酶B最佳缓冲液结果相反,这可能是由于陆生动物与水生动物的栖息环境不同而导致的。比较PBS的提取效果,发现缓冲液6的提取效果最好,即pH 5.8的50 mmol/L PBS提取组织蛋白酶B的酶活力最高。
2.1.3 巯基保护剂对组织蛋白酶B活力的影响
组织蛋白酶B属于半胱氨酸蛋白酶,是巯基蛋白酶,含有—SH [4],故需要巯基保护剂对其巯基进行保护以免影响其酶活力。以料液比为1∶2、50 mmol/L pH 5.8的PBS为浸提缓冲溶液,0.5 mmol/L PMSF作为蛋白酶抑制剂;硫酸铵饱和度为80%,以不同巯基保护剂对组织蛋白酶B活力的影响做单因素试验,以EDTA、乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol bis-tetraacetic acid,EGTA)、DTT和L-Cys 4 种常见的巯基保护剂为单因素,选出最佳巯基保护剂后再进一步优化其浓度,结果见图3、4。
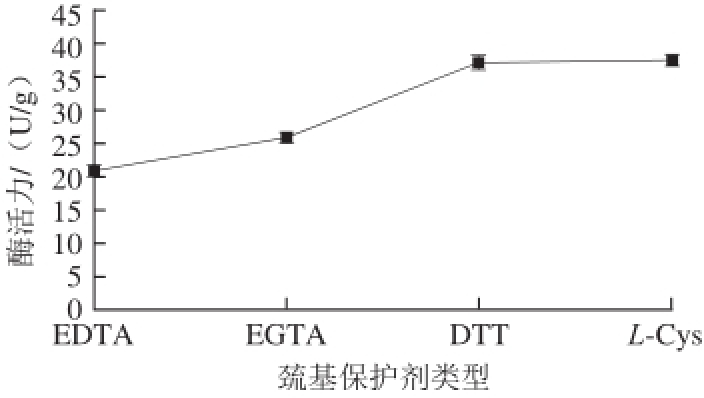
图3 不同巯基保护剂对组织蛋白酶B活力的影响
Fig.3 Effects of different thiolprotectants on the activity of cathepsin B
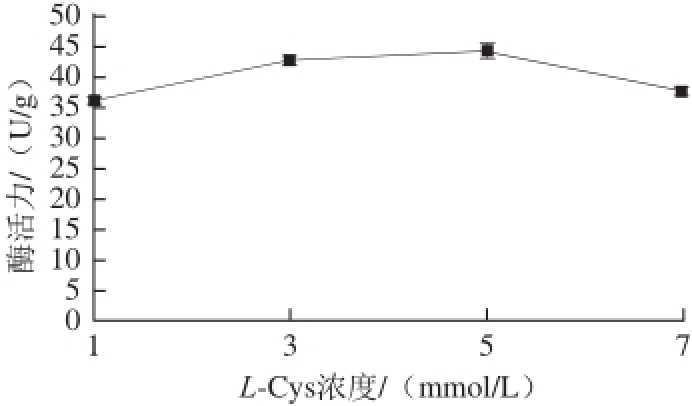
图4 L-Cys浓度对组织蛋白酶B活力的影响
Fig.4 Effects of different L-Cys concentrations on the activity of cathepsin B
由图3可知,4 种保护剂对酶活力的影响大小依次为L-Cys>DTT>EGTA>EDTA,即添加巯基保护剂L-Cys提取组织蛋白酶B活力最高。确定L-Cys为最佳巯基保护剂后,进一步优化其最佳浓度,分别取L-Cys浓度为1、3、5、7 mmol/L进行浓度优化单因素试验;由图4可知,随着L-Cys浓度的增加,组织蛋白酶B活力逐渐上升,当L-Cys浓度达到5 mmol/L时,组织蛋白酶B活力达到最大,L-Cys浓度继续增大,组织蛋白酶B活力明显下降,这与李树红 [17]研究L-Cys浓度对鲢鱼组织蛋白酶B活力影响的结果一致。最终选择5 mmol/L L-Cys作为巯基保护剂。
2.1.4 蛋白酶抑制剂PMSF对组织蛋白酶B活力的影响
PMSF是一种丝氨酸蛋白酶抑制剂,其可抑制丝氨酸蛋白酶的活力 [21],加入PMSF可以更为精准地测得组织蛋白酶B的活力。以料液比为1∶2、50 mmol/L pH 5.8 PBS为浸提缓冲溶液,5 mmol/L L-Cys作为巯基保护剂,硫酸铵饱和度为80%,取PMSF浓度为0.1、0.3、0.5、0.7 mmol/L对组织蛋白酶B活力的影响做单因素试验,结果见图5。
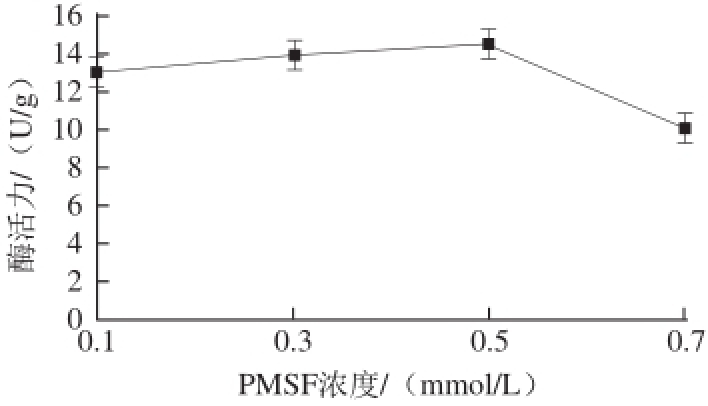
图5 不同PMSF浓度对组织蛋白酶B活力的影响
Fig.5 Effects of different PMSF concentrations on the activity of cathepsin B
由图5可知,随着PMSF浓度的增加,组织蛋白酶B活力逐渐上升,当PMSF浓度达到0.5 mmol/L时,组织蛋白酶B活力达到最大,PMSF浓度继续增大,组织蛋白酶B活力明显下降,已有研究证明低浓度的PMSF会抑制丝氨酸蛋白酶活性而轻微激活半胱氨酸蛋白酶 [20],若PMSF浓度过高,其也会抑制半胱氨酸蛋白酶的活性 [22],推测组织蛋白酶B活性中心除含有半胱氨酸残基外还含有丝氨酸残基 [23],最后综合考虑选择PMSF浓度为0.5 mmol/L。
2.1.5 硫酸铵饱和度对组织蛋白酶B酶活力的影响
在组织蛋白酶B分离纯化的过程中,硫酸铵沉淀是非常重要的一歩,其饱和度会影响组织蛋白酶B活力,以料液比为1∶2、50 mmol/L pH 5.8的PBS为浸提缓冲溶液,5 mmol/L L-Cys作为巯基保护剂,0.5 mmol/L PMSF作为蛋白酶抑制剂,以硫酸铵饱和度(20%、40%、60%、80%、90%、100%)对组织蛋白酶B酶活力的影响做单因素试验,结果见图6。

图6 硫酸铵饱和度对组织蛋白酶B酶活力的影响
Fig.6 Effects of different ammonium sulfate concentrations on the activity of cathepsin B
由图6可知,随着硫酸铵饱和度的增加,组织蛋白酶B酶活力也逐渐增加,硫酸铵饱和度在20%~60%时,由于硫酸铵饱和度低,不能将蛋白沉淀完全,从而导致测得的组织蛋白酶B酶活力很低,当硫酸铵饱和度进一步增大时,组织蛋白酶B酶活力明显增大,到硫酸铵饱和度达到100%时组织蛋白酶B酶活力达到最大,随着硫酸铵饱和度的增加蛋白沉淀更完全。所以最终将硫酸铵饱和度为100%作为盐析的最佳条件。
2.2 Plackett-Burman设计及关键影响因素的确定
2.2.1 Plackett-Burman试验设计处理及响应值
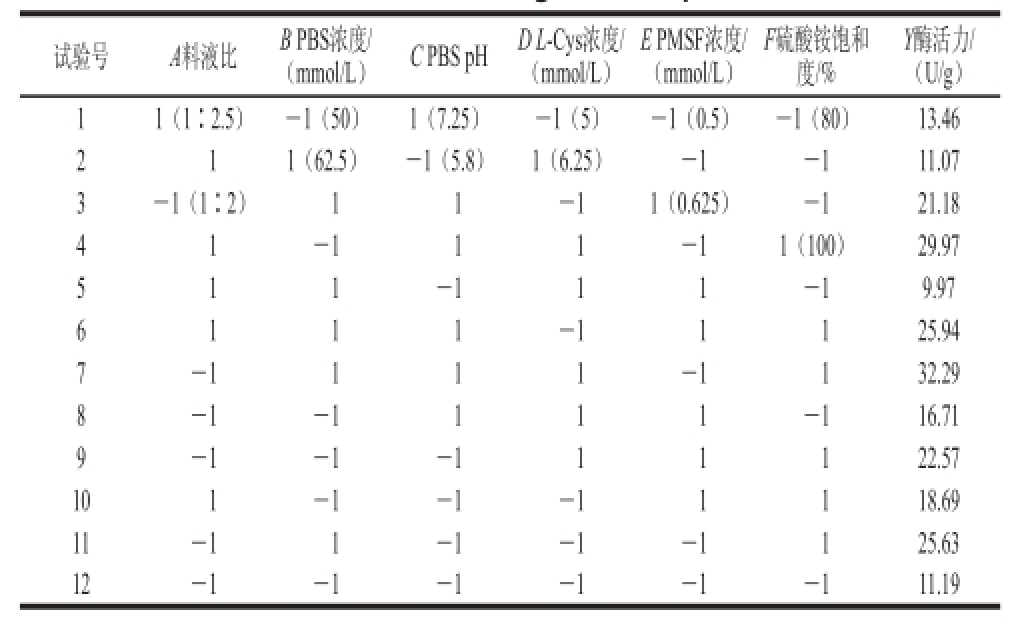
根据在单因素试验中各影响因子对组织蛋白酶B活力的影响效果,可以确定Plackett-Burman试验的高(+)、低(-)水平。采用Plackett-Burman原理设计试验对组织蛋白酶B活力影响的6 个因素进行研究,试验设计方案及结果见表1。
表1 Plackett-Burman试验设计及结果
Table1 Plackett-Burman design with experimental results
?
2.2.2 关键因素的确定
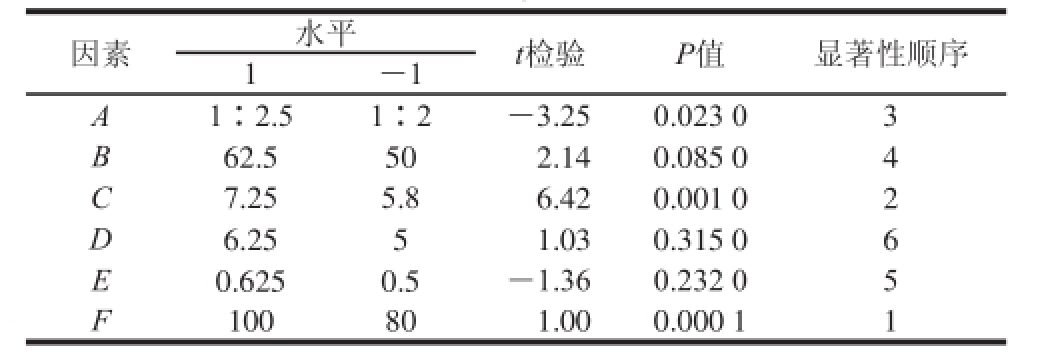
采用SPSS 20软件对表1中的数据进行逐步回归分析,得到组织蛋白酶活力的最优方程为:Y=19.890-1.707A+3.368C+5.959F(P=0.001),具有统计学意义。由主效应分析(表2)可以看出,影响组织蛋白酶B活力的主要因素为料液比、PBS pH值和硫酸铵饱和度,故在下一步响应面的分析中,重点考察这3 个因素的最优水平范围。
表2 Plackett-Burman试验各因素主效应分析( =0.05)
Table2 Analysis of the major effects of each factor in Plackett-Burman design ( = 0.05)
?
2.3 响应面试验设计优化暗纹东方鲀肌肉组织蛋白酶B提取工艺
2.3.1 Box-Behnken试验设计方案及结果
根据上述试验结果,选用料液比、PBS pH值和硫酸铵饱和度这3 个因素作为响应变量,以组织蛋白酶B的酶活力为响应值,运用Design Expert 8.0按照Box-Behnken原理进行响应面设计,以1、0、-1分别代表自变量的3 个水平,具体试验设计方案及结果见表3,方差分析见表4。
表3 Box-Behnken试验设计及结果
Table3 Box-Behnken design with response values

试验号A 料液比B PBS pH Y 酶活力/(U/g)10(1∶2)1(6.8)1(100)32.85 21(1∶3)0(5.8)128.56 3 1 0 1 24.15 4 1 10(95)23.02 C 硫酸铵饱和度/% 5 31.7 5 6 1 0-1(90)24.62 1 1 0 0-1(4.8)126.05 8-1(1∶1)0-118.94 9-1-1018.45 1000029.77 111-1024.56 120-1-121.18 1301-126.04 1400028.74 1500030.67 7
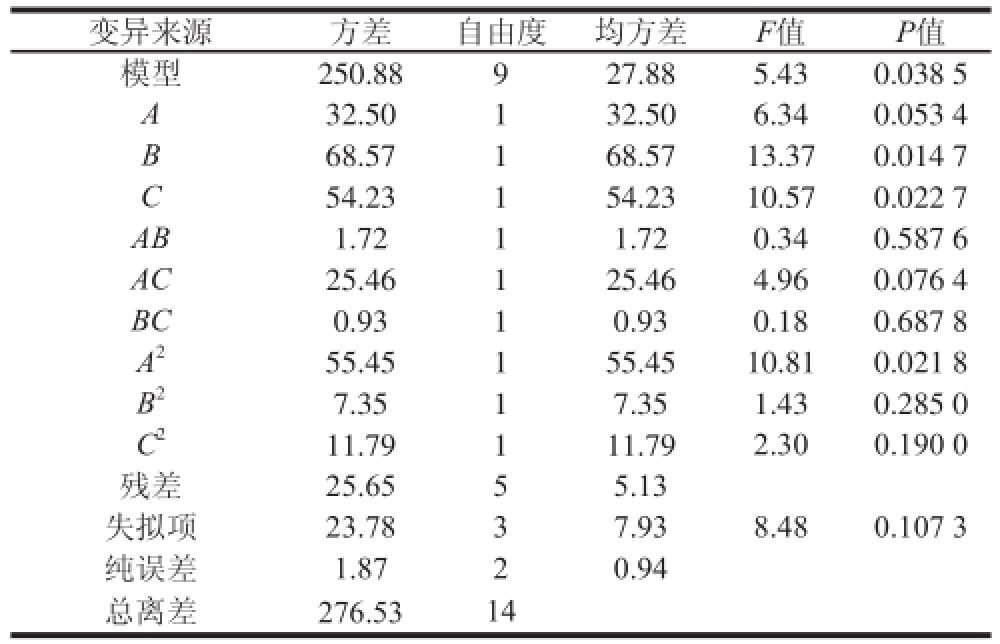
表4 回归方程方差分析
Table4 Analysis of variance of regression equation
注:P<0.05表示差异显著。
变异来源方差自由度均方差F值P值模型250.88927.885.430.038 5 A 32.50132.506.340.053 4 B 68.57168.5713.370.014 7 C 54.23154.2310.570.022 7 AB1.7211.720.34 0.587 6 AC25.46125.464.960.076 4 BC0.9310.930.180.687 8 A 255.45155.4510.810.021 8 B 27.3517.351.430.285 0 C 211.79111.792.300.190 0残差25.6555.13失拟项23.7837.938.480.107 3纯误差1.8720.94总离差276.5314
经回归拟合后,得到以组织蛋白酶B酶活力为响应值的回归方程为:Y=29.73+2.02A+2.93B+2.60C+0.66AB-2.52AC+0.48BC-3.88A 2-1.41B 2-1.79C 2,从表4的方差分析结果看,PBS pH值和硫酸铵饱和度这两个因素的P值均小于0.05,表明其对组织蛋白酶B活力的影响是显著的,料液比的P值大于0.05,表明其对组织蛋白酶B活力的影响是不显著的。整体模型的P值小于0.05,表明该二次方程模型是显著的;失拟项比的P值大于0.05,表明其对于绝对误差是不显著的,而不显著的失拟项表明方程模拟较好;决定系数为0.907 2,表明其应变量与全体自变量之间的多元回归关系显著,即说明该回归方程对试验拟合情况较好,试验误差小。
2.3.2 响应面分析
为了观察某两个因素的交互作用对组织蛋白酶B活力的影响,将其他因素保持不变,利用Design-Expert 8.0获得两两因素交互作用的响应曲面和等高线图,从而确定因素的最佳水平范围,等高线的形状反映交互效应的强弱 [24]。响应面图形是响应值对各因素(A、B、C)所构成的三维空间的曲面图,从图7~9可形象地看出各因素交互作用对响应值的影响。比较3 个图可知,硫酸铵饱和度对组织蛋白酶B活力的影响最为显著;而PBS pH值和料液比次之,曲线较为平滑。从3 个因素的两两交互等高线图可以看出,料液比和缓冲液交互作用的等高线图呈圆形,表明其交互作用影响不显著;料液比和硫酸铵饱和度交互作用的等高线图呈椭圆,表明其交互作用影响显著;硫酸铵饱和度和缓冲液pH值交互作用的等高线图呈椭圆,表明其交互作用影响显著。
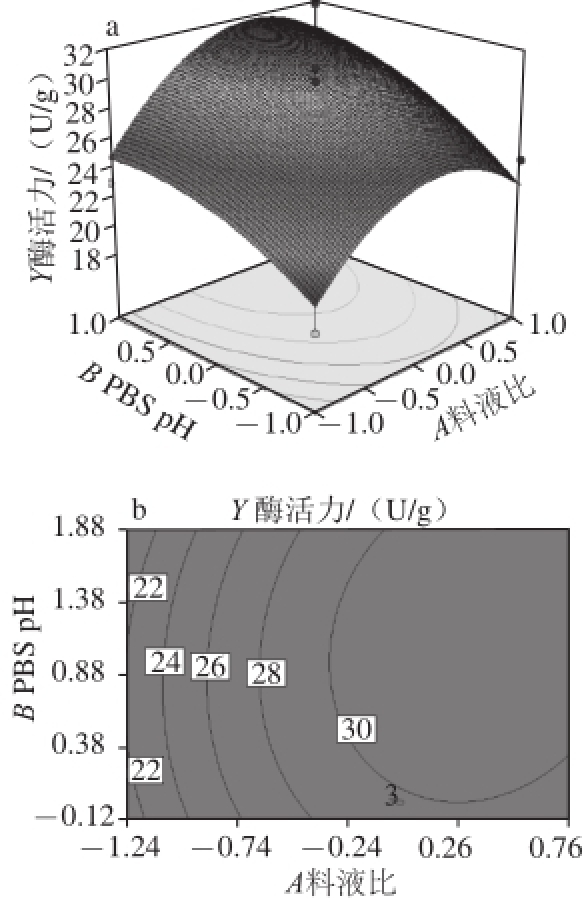
图7 料液比与浸提缓冲液pH值交互影响的响应面(a)及等高线(b)图
Fig.7 Response surface (a) and contour plots (b) for the effects of solid/ liquid ratio and extraction solution pH on the activity of cathepsin B

图8 料液比与硫酸铵饱和度交互影响的响应面(a)及等高线(b)图
Fig.8 Response surface (a) and contour plots (b) for the effects of solid/ liquid ratio and ammonium sulfate saturation on the activity of cathepsin B

图9 浸提缓冲液pH值与硫酸铵饱和度交互影响的响应面(a)及等高线(bb)图
Fig.9 Response surface (a) and contour plots (b) for the effects of extraction buffer pH and ammonium sulfate saturation on the activity of cathepsin B
2.3.3 最佳提取条件的确定
通过Design-Expert 8.0软件分析,预测出最佳酶活的提取工艺条件为:料液比1∶2.1,PBS的pH值为7.0,硫酸铵饱和度99.2%,在此条件下,组织蛋白酶B理论酶活力为32.65 U/g。
为了对模型进行验证,在以上最佳条件下,并结合单因素试验条件:PBS浓度50 mmol/L、L-Cys浓度5 mmol/L、PMSF浓度0.5 mmol/L进行验证实验,测得组织蛋白酶B活力平均值为32.52 U/g(n=3),与理论值相比,相对误差为0.39%,证明响应面分析法得到的组织蛋白酶B最优提取工艺参数真实可靠。
本研究通过单因素试验、Plackett-Burman试验和Box-Behnken响应面试验系统地优选,得到暗纹东方鲀组织蛋白酶B最佳提取条件。通过Plackett-Burman试验回归显著分析,发现暗纹东方鲀组织蛋白酶B活力影响显著的因素有料液比、PBS pH值和硫酸铵体积分数;通过Box-Behnken试验及响应面分析获得的最佳工艺参数为:料液比1∶2.1,PBS pH值为7.0,硫酸铵饱和度为99.2%,在此条件下组织蛋白酶B活力的预测值为32.65 U/g,实测值为32.52 U/g,相对误差为0.39%,说明建立的模型切实可行,能很好地预测各因素和组织蛋白酶B活力之间的关系。
参考文献:
[1] 华元渝, 李廷友, 邹宏海. 养殖型暗纹东方鲀生长与发育特性[J]. 水产学报, 2004, 28(1): 8-14. DOI:10.3321/j.issn:1000-0615.2004.01.002.
[2] 张梅秀. 养殖暗纹东方鲀滋味相关肽研究[D]. 上海: 上海海洋大学, 2013: 14-18.
[3] 刘源, 仇春泱, 王锡昌. 养殖型暗纹东方鲀肌肉中呈味肽的分离鉴定[J]. 现代食品科技, 2014, 30(8): 38-42.
[4] TOLDR F, FLORES M. The role of muscle proteases and lipases in flavor development during the processing of dry-cured ham[J]. Critical Reviews in Food Science, 1998, 38(4): 331-352. DOI:10.1080/10408699891274237.
[5] PRIPIS-NICOLAU L, de REVEL G, BERTRAND A, et al. Formation of flavor components by the reaction of amino acid and carbonyl compounds in mild conditions[J]. Journal of Agricultural and Food Chemistry, 2000, 48(9): 3761-3766. DOI:10.1021/jf991024w.
[6] 黄明, 黄峰, 黄继超, 等. 内源性蛋白酶对宰后肌肉嫩化机制研究进展[J]. 中国农业科学, 2011, 44(15): 3214-3222.
[7] TOLDR˘ F, ARISTOY M C, FLORES M. Contribution of muscle aminopeptidases to flavor development in dry-cured ham[J]. Food Research International, 2000, 33(3/4): 181-185. DOI:10.1016/S0963-9969(00)00032-6.
[8] GARC¸A-GARRIDO J A, QUILES-ZAFRA R, TAPIADOR J, et al. Activity of cathepsin B, D, H and L in Spanish dry-cured ham of normal and defective texture[J]. Meat Scie nce, 2000, 56(1): 1-6. DOI:10.1016/S0309-1740(00)00005-X.
[9] GREENBAUM L M, FRUTON J S. Purifi cation and properties of beef spleen cathepsin B[J]. Journal of Biological Chemistry, 1957, 226(1): 173-180.
[10] OKITANI A, MATSUMOTO T, KITAMURA Y, et al. Purification of cathepsin D from rabbit skeletal muscle and its action towards myofibrils[J]. Biochimica et Biophysica Acta (BBA)-Enzymology, 198 1, 662(2): 202-209. DOI:10.1016/0005-2744(81)90031-0.
[11] PANGKEY H, HARA K, TACHIBANA K, et al. Purification and characterization of cathepsin S from hepatopancreas of carp Cyprinus carpio[J]. Fisheries Science, 2000, 66(6): 1130-1137. DOI:10.1046/ j.1 444-2906.2000.00179.
[12] 陆应林. 南京板鸭加工过程中蛋白降解及风味物质的研究[D]. 南京: 南京农业大学, 2012: 25-32.
[13] FLORES M, ARISTOY M, AN TEQUERA T, et al. Effect of prefreezing hams on endogenous enzyme activity during the processing of Iberian dry-cured hams[J]. Meat Science, 2009, 82(2): 241-246. DOI:10.1016/ j.meatsci.2009.01.017.
[14] HUGHES M, O’NEILL E, MCSWEENEY P, et al. Proteolysis of bovine F-actin by cathepsin B[J]. Food Chemistry, 1999, 64(4): 525-530. DOI:10.1016/S0308-8146(98)00161-7.
[15] ARANISHI F, HARA K, OSATOMI K, et al. Purification and charact erization of cathepsin B from hepatopancreas of carp Cyprinus carpio[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecula r Biology, 1997, 117(4): 579-587. DOI:10.1016/S0305-0491(97)00191-0.
[16] 于蕾, 朱蓓薇, 孙黎明, 等. 海参肠道组织蛋白酶B粗酶提取条件的优化[J]. 大连工业大学学报, 2010, 29(6): 409-412.
[17] 李树红. 鲢鱼背肌组织蛋白酶 B, L的纯化鉴定及水解肌球蛋白的研究[D]. 北京: 中国农业大学, 2004: 11-23.
[18] TOLDRA F, RICO E, FLORES J. Cathepsin B, D, H and L activities in the processing of dry-cured ham[J]. Journal of the Science of Food and Agriculture, 1993, 62(2): 157-161. DOI:10.1002/jsfa.2740620208.
[19] SUN X H, ZHOU H M. Optimization of a novel hackwanl extraction of defatted wheat germ protein from novel hackwanl[J]. Innovative F ood Science and Emerging Technologies, 2009, 10(3): 328-333.
[20] 田甲春. 牦牛肉宰后成熟过程中组织蛋白酶 L, B, H 对肉品质及微观结构的影响[D]. 兰州: 甘肃农业大学, 2013: 24-35.
[21] JAMES G T. Inactivation of the protease inhibitor phenylmethylsulfonyl fl uoride in b uffers[J]. Analytical Biochemistry, 1978, 86(2): 574-579. DOI:10.1016/0003-2697(78)90784-4.
[22] MATSUMIYA M, MOCHIZUKI A, OTAKE S. Purification and characterization of cathepsin B from ordinary muscle of common mackerel Scomber japonicus[J]. Nippon Suisan Gakkaishi, 1989, 55(12): 2185-2190. DOI:10.2331/suisan.55.2185.
[23] ZHAO X F, WANG J X. Purifi cation and charaterization of cathepsin B-like proteinase from eggs of Antheraea pernyi[J]. Developmental & Reproductive Biology, 1996, 5(2): 41-50.
[24] 李炳辉, 陈玲, 李晓玺, 等. 超声强化响应面法优化知母多糖的提取工艺[J]. 现代食品科技, 2011, 27(4): 432-436. DOI:10.3969/ j.issn.1673-9078.2011.04.016.
Optimization of Extraction Conditions for Cathepsin B from Takifugu obscures Muscle
LI Lin, WANG Zhengquan, ZHANG Jingjing, MIAO Xiaodan, MA Lei, WANG Xichang, LIU Yuan*
(Shanghai Engineering Research Center of Aquatic-Product Processing and Preservation, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
Abstract:In order to obtain optimal conditions for the extraction of cathepsin B from Takifugu obscures, on the basis of results of single-factor experiments, some extraction parameters affecting cathepsin B activity were firstly evaluated by Plackett-Burman design, and then the main variables were optimized by response surface analysis. The results showed that the optimal extraction conditions were as follows: material/liquid ratio 1:2.1, phosphate buffer pH 7.0, and ammonium sulfate saturation 99.2%, and these three factors had significant influence on the enzyme activity. Under these conditions, the predicted value of cathepsin B activity was 32.65 U/g and its experimental value was 32.52 U/g, suggesting that the established model is feasible and can provide a theoretical basis for further studies on the extraction process of cathepsin B.
Key words:Takifugu obscures; cathepsin B; Plackett-Burman design; response surface analysis
DOI:10.7506/spkx1002-6630-201603018
中图分类号:TS201
文献标志码:A
文章编号:1002-6630(2016)03-0091-06
引文格式:
李琳, 王正全, 张晶晶, 等. 暗纹东方鲀肌肉组织蛋白酶B提取工艺优化[J]. 食品科学, 2016, 37(3): 91-96. DOI:10.7506/ spkx1002-6630-201603018. http://www.spkx.net.cn
LI Lin, WANG Zhengquan, ZHANG Jingjing, et al. Optimization of extraction conditions for cathepsin B from Takifugu obscures muscle[J]. Food Science, 2016, 37(3): 91-96. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603018. http://www.spkx.net.cn
收稿日期:2015-03-23
基金项目:国家自然科学基金面上项目(31371790;31271900);“十二五”国家科技支撑计划项目(2012BAD28B01);上海市科委工程中心建设项目(11DZ2280300);上海市教委重点学科建设项目(J50704);
作者简介:李琳(1993—),女,硕士研究生,研究方向为食品营养与品质评价。E-mail:985319795@qq.com
*通信作者:刘源(1979—),男,副教授,博士,研究方向为食品营养与品质评价。E-mail:yliu@shou.edu.cn