
图1 乳酸片球菌素PPAA--11结构基因和免疫基因的PCR扩增结果
Fig.1 PCR amplification products of structural and immunity genes of pediocin PA-1
M. 标准蛋白Marker;泳道1. PCR扩增产物。
陈信全 1,都立辉 1,鞠兴荣 1,2,*,吴学友 2,袁 建 1,何 荣 1
(1.南京财经大学食品科学与工程学院,江苏高校粮油质量安全控制及深加工重点实验室,江苏省现代粮食流通与安全协同创新中心,江苏 南京 210023;2.江南大学食品学院,江苏 无锡 214122)
摘 要:为了实现该细菌素的外源表达,本实验首先利用聚合酶链式反应从乳酸片球菌PAF中扩增出乳酸片球菌素PA-1的结构和免疫基因,然后克隆到表达载体pGEX-6p-1,构建了N端含有GST-His-DDDDK标签的重组质粒pGEX/ his-pedAB,然后转化进入大肠杆菌Rosetta(DE3)感受态细胞,经异丙基硫代半乳糖苷诱导,重组乳酸片球菌素PA-1在大肠杆菌胞内成功表达。表达的融合蛋白先经过镍亲合层析柱纯化,然后注入谷胱甘肽S-转移酶亲和色谱柱用肠激酶处理,释放出成熟的乳酸片球菌素PA-1。利用高效液相色谱和质谱技术检测乳酸片球菌素PA-1纯度。以单核细胞增生李斯特氏菌CMCC54004为指示菌,利用琼脂扩散法检验乳酸片球菌素PA-1活性。结果表明,携带GST-His-DDDDK标签的融合蛋白无活性,标签切除后其抑菌活性恢复,且其纯度达90%以上。
关键词:细菌素;乳酸片球菌素;原核表达;蛋白纯化
乳酸菌细菌素是由乳酸菌代谢过程产生的一类具有抗菌活性的多肽或蛋白质 [1]。它们可被人体生物降解和消化,对健康无害。大部分乳酸菌细菌素对热稳定,具有高等电点和亲水特性 [2]。最近将乳酸菌细菌素分为三大类:Ⅰ类细菌素为含有修饰氨基酸的多肽;Ⅱ类细菌素为不含修饰氨基酸的多肽;Ⅲ类细菌素为大分子质量蛋白质 [3]。Ⅱ类细菌素包括4 个亚类,其中Ⅱa类细菌素为目前成员最多、研究较为深入的一类细菌素 [3-4]。这类细菌素普遍对单核细胞增生李斯特氏菌有强烈抑制作用。近年来世界范围内发生多起由单核细胞增生李斯特氏菌引起的中毒事件,具有很大的危害性,使得预防和控制食品中的李斯特氏菌成为关注的热点。
乳酸片球菌素PA-1是由乳酸片球菌产生的已被广泛研究的一种典型Ⅱa类细菌素 [5-7],成熟的乳酸片球菌素PA-1是由44 个氨基酸残基和2 个二硫键组成。其操纵子包含pedA、pedB、pedC、pedD 4 个基因,即结构基因、免疫基因、分泌基因、加工基因 [8]。因其具有强烈的抗李斯特氏菌活性而获得广泛关注 [9]。天然的细菌素资源有限、纯化困难,不足以进行抑菌作用机制、构效关系及开发应用研究。化学合成的细菌素成本高、活性不稳定,难以满足细菌素相关研究和实际应用的需求。因此通过基因重组表达得到大量细菌素是低成本、高效益的方法 [10-11]。由于大肠杆菌(Escherichia coli)培养操作简单、生长繁殖快、价格低廉,且表达外源基因产物的水平远远高于其他基因表达系统。因此E. coli是目前应用最广泛的蛋白表达系统之一,采用E. coli表达系统获得细菌素已成为研究者的首选 [12]。另外,由于细菌素一般为小分子多肽,因此通常以融合蛋白的方式表达,这不仅可避免抗菌肽对宿主的毒性作用,也保护了抗菌肽免受蛋白酶降解 [13]。融合蛋白形成以后通过酶解法或化学裂解方法切除标签蛋白获得成熟细菌素。早在1998年,Miller等 [14]就利用PMAL-p2x载体在E. coli中分泌表达了麦芽糖结合蛋(maltose binding protein,MBP)-pediocin AcH,并发现该融合蛋白具有与天然乳酸片球菌素AcH相似的生物学活性。Moon等 [15]将乳酸片球菌素PA-1成熟肽基因与带有组氨酸标签蛋白His-tag的仓鼠二氢叶酸还原基因序列融合,在E. coli细胞质内成功表达了无活性的His-tag-仓鼠二氢叶酸还原酶-乳酸片球菌素PA-1,纯化后的融合细菌素经Xa因子蛋白酶酶切恢复乳酸片球菌素PA-1活性。韩烨等 [16]将乳酸片球菌素Ped-A基因克隆到pET-28a中,经诱导在E. coli中表达,表达产物对单核细胞增多症李氏杆菌有抗菌作用。
本研究采用基因工程技术,将乳酸片球菌素PA-1成熟肽基因,与表达载体pGEX-6p-1中的谷胱甘肽S-转移酶(glutathione S-transferase,GST)基因的核苷酸序列融合,在E. coli细胞质内成功表达了可溶性的融合蛋白GST-His-DDDDK-Pediocin PA-1,通过两步亲和色谱从细胞破碎液中分离获得重组乳酸片球菌素PA-1,最后用肠激酶处理除去重组乳酸片球菌素PA-1上的标签蛋白,获得具有抗李斯特氏菌活性的乳酸片球菌素PA-1,以期获得片球菌素的高效表达,对片球菌素的深入研究和广泛应用有重要意义。
1.1 材料
1.1.1 菌株、质粒与载体
乳酸片球菌PAF、E. coli DH5α菌株、表达菌株E. coli Rosetta(DE3)和表达质粒pGEX-6p-1 南京财经大学食品科学与工程学院实验室保存;单核细胞增生李斯特氏菌(Listeria monocytogenes)CMCC54004江苏省疾病预防控制中心馈赠;pEASY-Blunt载体北京全式金生物技术有限公司。
1.1.2 培养基
LB(Luria-Bertani)培养基、脑心浸液(brain heart infusion,BHI)培养基 北京陆桥技术股份有限公司。
1.1.3 试剂
透析袋 北京索莱宝科技有限公司;限制性内切酶BamHⅠ、XhoⅠ、HS TMMix、DNA Ligation Kit、感受态细胞制备试剂盒 日本TaKaRa公司;DS TM5000 DNA Marker 广州东盛生物科技有限公司;多功能DNA纯化回收试剂盒、高纯质粒小量制备试剂盒(离心柱型) 北京百泰克生物技术有限公司;氨苄青霉素美国Ameresco公司;异丙基硫代-β-D-半乳糖苷 美国BioBasic公司;宽范围彩色预染蛋白质Marker 天根生化科技(北京)有限公司;HisTrap HP、GSTrap 4B亲和色谱柱 美国GE公司;肠激酶、磷酸氢二钠、咪唑生工生物工程(上海)股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
梯度PCR仪 美国Applied Biosystems公司;DYY-6C型电泳仪 北京六一仪器厂;THZ-D型恒温振荡器 江苏太仓市强乐实验设备有限公司;高速离心机 上海安亭科学仪器厂;JY92-II超声波细胞破碎机 宁波新艺超声设备有限公司;ÄKTA蛋白纯化系统 美国GE公司;恒温金属浴 美国Torrey Pines Scientific公司;瞬时低速离心机 美国Cubee GeneReach公司;微型台式冷冻离心机 美国Thermo Fisher Scientific公司。
1.3 方法
常规生物学操作参照《分子克隆手册进行》 [17]方法进行。
1.3.1 乳酸片球菌素PA-1基因克隆
根据GenBank数据库中乳酸片球菌素PA-1基因的序列(HQ876214.1),设计引物P1:5’-AT G G C C A ATAT C AT T G G T G G TA A ATAC TAC G GTAATGGGG-3’和引物P2:5’-CCGCTCGAGT TACCACGTATTGGTAGTATCTAGC-3’,该引物由生工生物工程(上海)股份有限公司合成。以乳酸片球菌PAF新鲜过夜培养菌液为模板,从乳酸片球菌PAF中聚合酶链式反应(polymerase chain reaction,PCR)扩增PA-1的基因片段 [18],该片段由结构基因和免疫基因(pedAB)组成。PCR反应体系如下:HS TMMix 25 μL;引物P1、P2各1 μL(终浓度1 μmol/L);乳酸片球菌PAF新鲜菌液2 μL;加双蒸水至50 μL。反应条件为:95 ℃预变性30 s;95 ℃变性15 s、60 ℃退火20 s、72 ℃延伸40 s,共30 个循环;72 ℃延伸7 min。反应结束后,取5 μL PCR反应液进行1.0%的琼脂糖凝胶电泳检测,并对目的片段进行胶回收纯化后与pEASY-Blunt载体连接,构建克隆载体pEASY/pedAB。将pEASY/pedAB转化到E. coli DH5α感受态细胞中,挑选阳性克隆,接种在LB液体培养基(含50 μg/mL的氨苄青霉素)过夜培养后送生工生物工程(上海)股份有限公司测序。提取测序正确质粒pEASY/pedAB做二次PCR模板。
1.3.2 表达载体pGEX/his-pedAB的构建
根据pGEX-6p-1质粒多克隆区的酶切位点和GenBank数据库中乳酸片球菌素PA-1成熟肽基因及免疫基因序列(HQ876214.1)设计引物:P3:5’-GCTGGATCC CACCATCATCATCATCATGACGACGAC GA CAAGAAATACTACGGTAATGGGGTTACTTG TG-3’;P4:5’-CCGCTCGAGTTACCACGTATT GGTAGTATCTAGCATGTTAA-3’,下划线分别表示引入BamHⅠ和XhoⅠ酶切位点,粗体字表示His标签和肠激酶酶切位点。融合蛋白顺序为:GST-His×6-DDDDKPediocin PA-1。以测序正确pEASY/pedAB为模板,P3、P4为引物进行PCR扩增,产物回收、纯化后进行Bam HⅠ和XhoⅠ双酶切,酶切产物连接到同样双酶切的pGEX-6p-1载体,构建表达载体pGEX-6p-1/pedAB。转化E. coli DH5α感受态细胞,筛选阳性克隆,并进行PCR鉴定和酶切鉴定,将鉴定正确的重组质粒送生工生物工程(上海)股份有限公司进行测序验证。将基因测序正确的重组质粒pGEX-6p-1/pedAB转化表达宿主E. coli Rosetta(DE3)。1.3.3 重组乳酸片球菌素PA-1的诱导表达与分离纯化
将含阳性质粒pGEX-6p-1/pedAB的重组菌单菌落,接种于装有LB液体培养基(含终质量浓度为50 μg/mL的氨苄青霉素)的三角瓶中,37 ℃、200 r/min条件下振荡培养,直至OD 600 nm值为0.6~0.8。向三角瓶中加入终浓度为1 mol/L的异丙基硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)进行诱导,继续培养5 h,采集1 mL菌体悬浮液离心后取菌体进行细菌总蛋白组分的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测 [19],剩下菌液在8 000×g条件下离心5 min收集菌体,用生理盐水清洗菌体2 次。用发酵液初始体积1%的结合缓冲液(含有500 mol/L NaCl、20 mol/L Na 3PO 4和20 mol/L 咪唑的水溶液,pH 7.4)悬浮菌体,置于冰水混合物中超声破碎菌体细胞,直至菌体溶液澄清,得到菌体裂解液。将菌体裂解液离心(15 000×g,4 ℃,30 min),取上清,用0.22 μm的滤膜过滤,得到重组乳酸片球菌素PA-1粗提液,对粗提液蛋白进行SDS-PAGE分析。
粗提液上样于His Trap HP 亲和层析凝胶柱,10 mL结合缓冲液(500 mol/L NaCl、20 mol/L Na 3PO 4、20 mol/L咪唑,pH 7.4)清洗柱子,用5~10 倍体积的洗脱缓冲液(500 mol/L NaCl、20 mol/L Na 3PO 4、500 mol/L咪唑,pH 7.4)洗脱,收集洗脱峰部分的洗脱液进行第二步纯化。取100 øL进行SDS-PAGE分析及活性检验。将剩余洗脱缓冲液注入预先处理过的截留分子质量为7 000 D的透析袋中,用大量的GSTtrap 4B结合缓冲液(140 mol/L NaCl、2.7 mol/L KCl、10 mol/L Na 2HPO 4、1.8 mol/L KH 2PO 4,pH 7.4)对其进行透析过夜。透析后样品经12 000×g离心 20 min后取上清液,注入已用结合缓冲液平衡好的GSTtrap 4B亲和色谱柱。用约10 mL GSTtrap结合缓冲液洗到基线稳定,最后用约10 mL的肠激酶酶切缓冲液(25 mol/L Tris-HCl、50 mol/L NaCl、2 mol/L CaCl 2、pH 7.6)平衡柱子。将1 mL肠激酶mix(160 U肠激酶溶解在920 øL 4 ℃肠激酶酶切缓冲液里)注入GSTtrap 4B亲和色谱柱,然后将上下堵头拧上,置于25 ℃水浴16 h。将亲和色谱柱重新接上ÄKTA蛋白纯化系统,用5 mL酶切缓冲液洗脱被切下来的游离细菌素,收集到样品送到交苏州普泰生物技术有限公司,采用Nano液相色谱-电喷雾电离串联质谱(liquid chromatography electrospray ionization tandam mass spectrometry,LC-ESI-MS/MS)进行鉴定。
1.3.4 细菌素活性鉴定和纯度测定
以单核细胞增生李斯特氏菌为指示剂,采用琼脂扩散法检测表达片球菌素的活性 [20]。取10 øL样品(经0.22 øm滤膜过滤除菌)注入接种有体积分数为0.5%的新鲜过夜单核细胞增生李斯特菌菌液(37 ℃条件下培养16 h)的BHI固体平板上的琼脂孔(约3 mm)中,在超净工作台上静止1 h后,倒置于37 ℃培养箱培养10 h,观察抑菌圈。以纯化融合乳酸片球菌素PA-1为对照,检验酶切分离的乳酸片球菌素PA-1活性。
通过高效液相色谱(high performance liquid chromatography,HPLC)检测分离的乳酸片球菌素PA-1纯度。HPLC的检测条件为:色谱柱:Gemini-NX交换柱;流动相:三氟醋酸-乙腈(1∶1 000,V/V);流速:1.0 mL/min;进样量:20 μL;检测器:示差折光检测器。
2.1 乳酸片球菌素PA-1基因的克隆和表达载体构建

图1 乳酸片球菌素PPAA--11结构基因和免疫基因的PCR扩增结果
Fig.1 PCR amplification products of structural and immunity genes of pediocin PA-1
M. 标准蛋白Marker;泳道1. PCR扩增产物。
由图1可知,扩增产物琼脂糖电泳分析表明约500 bp处有明显的扩增条带,同预期目的片段(532 bp)大小相符。回收目的片段克隆至平端载体pEASY-Blunt,产生重组质粒pEASY/pedAB,转化E. coli DH5α,挑单克隆菌过夜培养送往生工生物工程(上海)股份有限公司进行测序鉴定。测序结果用DNAMAN软件与GenBank数据库比对分析,结果显示序列100%匹配,说明成功从乳酸片球菌中扩增出乳酸片球菌素PA-1结构基因及免疫基因。
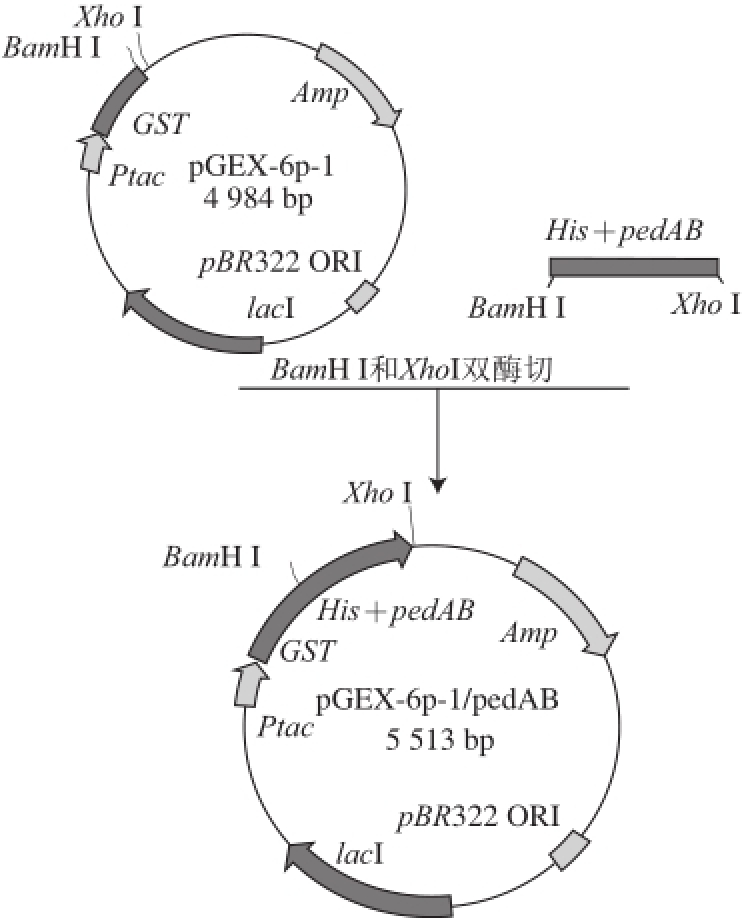
图2 表达载体pGEX-6p-1/pedAB的构建过程
Fig.2 Construction of the expression vector pGEX-6p-1/pedAB
利用克隆质粒pEASY/pedAB作为模板,进行二次PCR扩增乳酸片球菌素PA-1成熟结构基因及免疫基因且在其上下游分别引入BamHⅠ和XhoⅠ酶切位点。扩增片段经双酶切后连接入载体pGEX-6p-1构建表达载体pGEX-6p-1/pedAB(图2)。转化E. coli DH5α挑阳性单克隆菌过夜培养后提取质粒进行BamHⅠ、XhoⅠ单、双酶切鉴定,结果如图3所示:单酶切得到5 513 bp片段(泳道2和3);双酶切产生4 870 bp和550 bp两条条带(泳道4),分别对应线性表达载体pGEX-6p-1和插入目的基因大小,说明融合基因his-pedAB成功插入表达载体pGEX-6p-1。且该阳性克隆质粒经测序鉴定序列正确、无突变现象,表明乳酸片球菌素PA-1的表达载体成功构建。
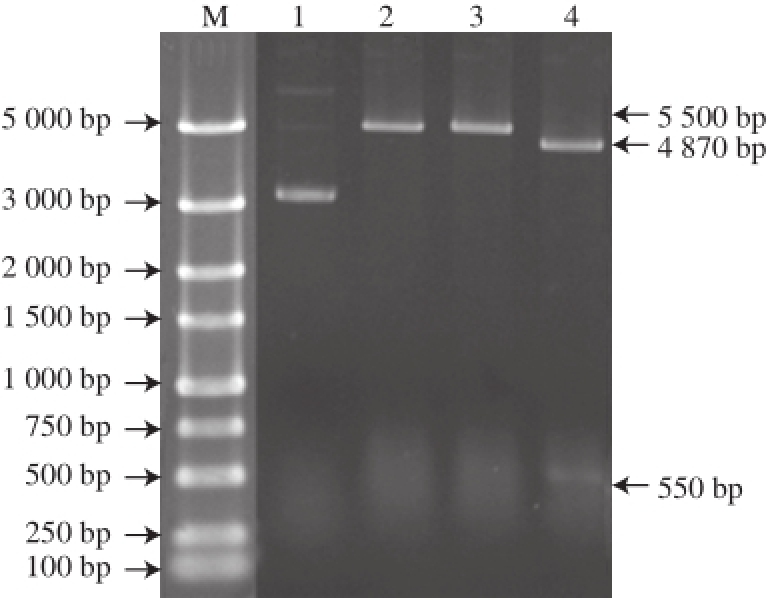
图3 重组质粒pGEX/His-pedAB的酶切鉴定结果
Fig.3 Results of double enzyme digestion of recombinant plasmid pGEX/His-pedAB
M. 标准蛋白Marker;泳道1.重组质粒pGEX-6p-1/pedAB;泳道2、3分别为BamHⅠ和XhoⅠ单独酶切产物;泳道4. Bam HⅠ和XhoⅠ双酶切产物。
2.2 重组乳酸片球菌素PA-1的诱导表达与分离纯化
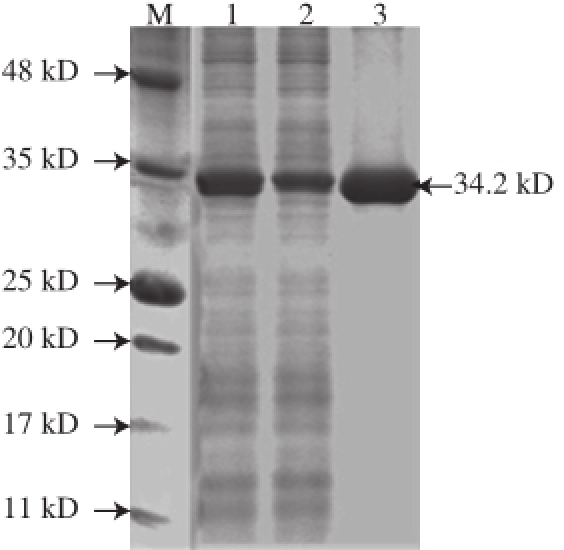
图4 融合片球菌素PA-1表达产物的SDS-PAGE分析
Fig.4 SDS-PAGE analysis of recombinant pediocin PA-1
M.彩色预染蛋白Marker;泳道1.表达菌体;泳道2.菌体破碎上清液;泳道3. HisTrap HP亲和色谱柱纯化蛋白。
对发酵液及其超声破碎上清液进行SDS-PAGE分析,结果如图4所示,泳道1和2在34 kD处有明显的表达蛋白条带,与预测的融合片球菌素大小相当,发酵液中检测出同样的蛋白条带说明表达可溶。对表达菌体的破碎上清液采用HisTrap亲和色谱柱分离纯化结果如图5所示,洗脱过程产生单一洗脱峰,说明重组菌表达了大量含His标签的融合蛋白。分离纯化后融合蛋白用SDS-PAGE分析结果如图4的泳道3,同样出现与泳道1、2大小相同的目的蛋白条带,表明融合片球菌素在E. coli成功表达。随后利用GSTtrap 4B色谱柱对HisTrap柱纯化蛋白进行第二步纯化,且对结合蛋白进行肠激酶酶处理从而分离出乳酸片球菌素PA-1。取纯化后的乳酸片球菌素PA-1样品送往苏州普泰生物技术有限公司进行Nano LCESI-MS/MS 鉴定,鉴定结果经GenBank数据库搜索比对,证实与乳酸片球菌素PA-1序列完全一致。
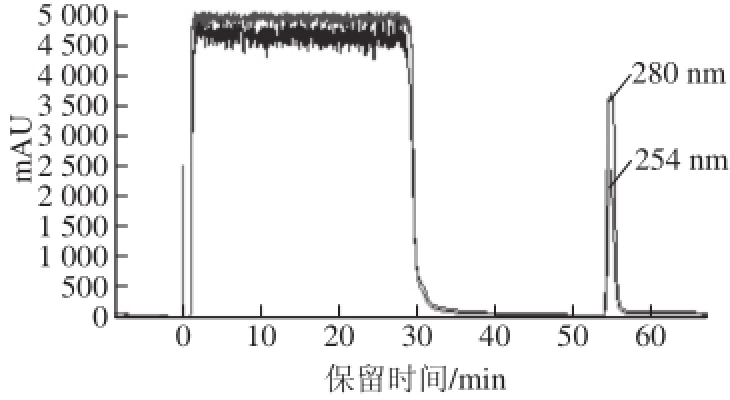
图5 融合片球菌素的PA-1 HisTrap HP柱分离色谱
Fig.5 Saparation chromatogram of recombinant pediocin PA-1 by HisTrap HP affinity column
2.3 表达细菌素活性鉴定和纯度
以单核细胞增生李斯特氏菌为指示菌,利用琼脂扩散法鉴定表达融合片球菌素PA-1和酶切分离后的完整细菌素活性。结果如图6所示,融合片球菌素并无明显抑制李斯特氏菌活性,而酶切去除标签蛋白后的片球菌素恢复抑菌活性。高效液相色谱测定经两步色谱纯化后的片球菌素纯度达到90%以上(图7)。
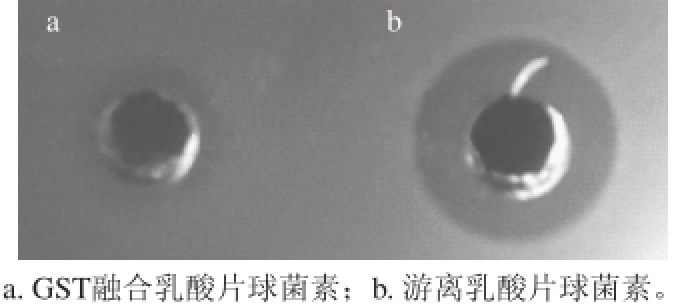
图6 表达细菌素抗单核细胞增生李斯特氏菌活性
Fig.6 Anti-Listeria activity of the expressed pediocin PA-1
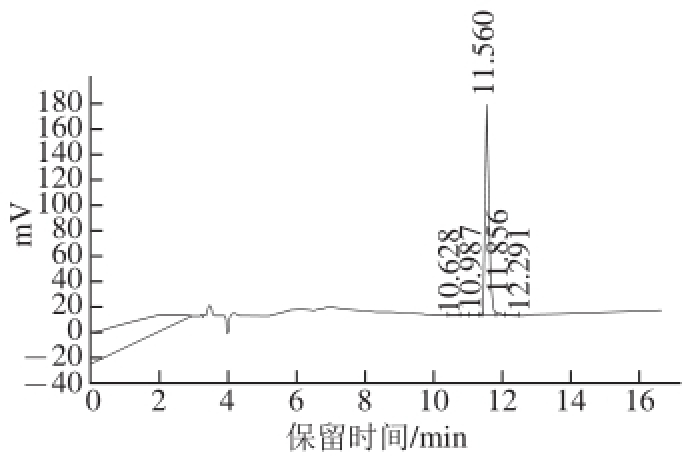
图7 片球菌素PA-1的高效液相色谱图
Fig.7 HPLC chromatogram of pediocin PA-1
E. coli是目前应用最广泛的蛋白表达系统之一,采用E. coli表达系统获得细菌素已成为研究者的首选 [12]。本实验探索了一种将GST与细菌素相融合来高效表达乳酸片球菌PA-1的新方法。GST作为融合蛋白表达载体,有助于保护重组蛋白免受胞外蛋白酶的降解,提高其稳定性、可溶性,并可作为标签,通过亲和层析纯化表达产物。通过在GST和目的蛋白间引入His标签以实现表达融合蛋白的两步纯化,使所表达片球菌素纯度达90%以上,为片球菌的结构及作用机理深入研究奠定了基础。
GST融合的片球菌素无活性,经酶切去除标签蛋白后的片球菌素恢复抑菌活性。这可能由于GST包含的半胱氨酸干扰片球菌中自身半胱氨酸间的二硫键形成,从而改变了片球菌素的原来结构。乳酸片球菌素PA-1氨基酸序列含有4 个半胱氨酸,分别在N端与C端形成一个二硫键 [21]。而研究表明二硫键对Ⅱa类细菌素的结构和活性非常关键 [6,22]。同样的现象被Gibbs [23]、Moon [15]、赵爱珍 [24]等揭示。
本研究在原核表达系统E. coli中成功实现了乳酸片球菌素PA-1的可溶性表达,为Ⅱa类细菌素的表达与纯化研究提供有力的数据支撑。
参考文献:
[1] KAUR G, SINGH T P, MALIK R K. Antibacterial efficacy of nisin, pediocin 34 and enterocin FH99 against Listeria monocytogenes and cross resistance of its bacteriocin resistant variants to common food preservatives[J]. Brazilian Journal of Microbiology, 2013, 44(1): 63-71. DOI:10.1007/s13197-011-0500-3.
[2] 吕燕妮. 广谱抗菌肽: 片球菌素pediocin PA-1[J]. 食品科技, 2011, 36(9): 41-44. DOI:10.13684/j.cnki.spkj.2011.09.039.
[3] CINTAS L M, HERRANZ C, HERN NDEZ P E, et al. Review: bacteriocins of lactic acid bacteria[J]. Food Science and Technology International, 2001, 7(4): 281-305. DOI:10.1106/R8DE-P6HU-CLXP-5RYT.
[4] DRIDER D, REBUFFAT S. Prokaryotic antimicrobial peptides: from genes to applications[M]. New York: Springer Science, 2011:75-146 .
[5] RAY B, SCHAMBER R, MILLER K W. The pediocin AcH precursor is biologically active[J]. Applied and Environmental Microbiology, 1999, 65(6): 2281-2286. DOI:0099-2240/99/$04.0010.
[6] FIMLAND G, JOHNSEN L, AXELSSON L, et al. A C-terminal disulfide bridge in pediocin-like bacteriocins renders bacteriocin activity less temperature dependent and is a major determinant of the antimicrobial spectrum[J]. Journal of Bacteriology, 2000, 182(9): 2643-2648. DOI:10.1128/JB.182.9.2643-2648.2000.
[7] JOHNSEN L, FIMLAND G, EIJSINK V, et al. Engineering increased stability in the antimicrobial peptide pediocin PA-1[J]. Applied and Environmental Microbiology, 2000, 66(11): 4798-4802. DOI:10.1128/ AEM.66.11.4798-4802.2000.
[8] SEONG M G, RYANG P Y, JUNE K W. Characterization of the pediocin operon of Pediococcus acidilactici K10 and expression of His-tagged recombinant pediocin PA-1 in Escherichia coli[J]. Journal of Microbiology and Biotechnology, 2005, 15(2): 403-411. DOI:10.1128/AEM.71.9.5630-5632.2005.
[9] REVIRIEGO C, FEMN N A, HORN N, et al. Production of pediocin PA-1, and coproduction of Nisin A and pediocin PA-1, by wild Lactococcus lactis strains of dairy origin[J]. International Dairy Journal, 2005, 15(1): 45-49. DOI:10.1016/j.idairyj.2004.05.003.
[10] 余占桥, 杨芳, 张日俊. 细菌素异源表达的研究进展[J]. 中国畜牧兽医, 2010, 37(2): 51-55. DOI:1671-7236(2010)02-0051-04.
[11] 刘国荣, 孙勇, 李平兰. IIa类乳酸菌细菌素的异源表达研究进展[J].食品科学, 2012, 33(5): 323-327. DOI:1002-6630(2012)05-0323-05.
[12] 解庭波. 大肠杆菌表达系统的研究进展[J]. 长江大学学报(自然科学版), 2008, 5(3): 77-82. DOI:10.3969/j.issn.1673-1409-B.2008.03.034.
[13] VASSILEVSKI A A, KOZLOV S A, GRISHIN E V. Antimicrobial peptide precursor structures suggest effective production strategies[J]. Recent Patents on Inflammation & Allergy Drug Discovery, 2008, 2(1): 58-63. DOI:10.2174/187221308783399261.
[14] MILLER K W, SCHAMBER R, CHEN Y, et al. Production of active chimeric pediocin AcH in Escherichia coli in the absence of processing and secretion genes from the Pediococcus pap operon[J]. Applied and Environmental Microbiology, 1998, 64(1): 14-20. DOI:0099-2240/98/$04.0010.
[15] MOON G S, PYUN Y R, KIM W J. Expression and purification of a fusion-typed pediocin PA-1 in Escherichia coli and recovery of biologically active pediocin PA-1[J]. International Journal of Food Microbiology, 2006, 108(1): 136-140. DOI:10.1016/ j.ijfoodmicro.2005.10.019.
[16] 韩烨, 周志江, 王培培, 等. 片球菌素基因的克隆及表达[J]. 华北农学报, 2009, 24(2): 32-35. DOI:10.7668/hbnxb.2009.02.007.
[17] SAMBROOK J, RUSSELL D W. Molecular cloning: a laboratory manual[M]. 3rd ed. Beijing: Cold Spring Harbor Laboratory Press, 2001: 105-117.
[18] SOMKUTI G A, STEINBERG D H. Pediocin production in milk by Pediococcus acidilactici in co-culture with Streptococcus thermophilus and Lactobacillus delbrueckii subsp. bulgaricus[J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(1): 65-69. DOI:10.1007/s10295-009-0648-2.
[19] 萨姆布鲁克 J, 拉塞尔 D W. 分子克隆实验指南[M].李载平, 译. 3版.北京: 科学出版社, 2002: 96-99.
[20] HENDERSON J T, CHOPKO A L, van WASSENAAR P D. Purification and primary structure of pediocin PA-1 produced by Pediococcus acidilactici PAC-1.0[J]. Archives of Biochemistry and Biophysics, 1992, 295(1): 5-12. DOI:10.1016/0003-9861(92)90480-K.
[21] FIMLAND G, JOHNSEN L, DALHUS B, et al. Pediocin-like antimicrobial peptides (class IIa bacteriocins) and their immunity proteins: biosynthesis, structure and mode of action[J]. Journal of Peptide Science, 2005, 11(11): 688-696. DOI:10.1002/psc.699.
[22] DERKSEN D J, BOUDREAU M A,VEDERAS J C, et al. Hydrophobic interactions as substitutes for a conserved disulfide linkage in the type IIa bacteriocins, leucocin A and pediocin PA-1[J]. ChemBioChem, 2008, 9(12): 1898-1901. DOI:10.1002/cbic.200800272.
[23] GIBBS G M, DAVIDSON B E, HILLIER A J. Novel expression system for large-scale production and purification of recombinant class IIa bacteriocins and its application to piscicolin 126[J]. Applied and Environmental Microbiology, 2004, 70(6): 3292-3297. DOI:10.1128/ AEM.70.6.3292-3297.2004.
[24] 赵爱珍, 韩文瑜, 徐兴然, 等. Enterocin A在大肠杆菌中的表达及活性检测[J]. 吉林农业大学学报, 2008, 30(1): 89-92. DOI:10.13327/ j.jjlau.2008.01.002.
Expression and Purification of Pediocin PA-1 in Escherichia coli
CHEN Xinquan
1, DU Lihui
1, JU Xingrong
1,2,*, WU Xueyou
2, YUAN Jian
1, HE Rong
1
(1. Collaborative Innovation Center for Modern Grain Circulation and Safety, Key Laboratory of Grains and Oils Quality Control and Processing of Jiangsu Higher Education Institutions, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China; 2. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Abstract:Pediocin PA-1 is a representative class IIa bacteriocin produced by Pediococci with the potential to serve as a food-grade preservative for controlling Listeria contamination. To obtain its soluble expression, Pediocin PA-1 structural and immunity gene pedAB was amplified by polymerase chain reaction (PCR) from Pediococcus acidilactici PAF, and cloned into the vector pGEX-6p-1 to construct the pGEX/his-pedAB encoding the recombinant pediocin PA-1 with GST-His-DDDDK in the N-terminal of pediocin PA-1. The plasmid pGEX/his-pedAB was then transformed into Escherichia coli Rosetta (DE3). After induction with isopropyl-β-D-thiogalactopyranoside, the recombinant pediocin PA-1 was successfully expressed in E. coli cytoplasm. The expressed fusion protein was purified by Ni-NTA metal affinity chromatography, subsequently loaded to GST affinity column and treated with recombinant bovine enterokinase. Mature pediocin PA-1 was liberated from the recombinant protein. The purity of pediocin PA-1 was detected by high-performance liquid chromatography and mass spectrometry. The antibacterial activity of pediocin PA-1 was determined by agar diffusion method using Listeria monocytogenes CMCC54004 as an indicator. The results showed that fusion pediocin PA-1 did not have bactericidal activity against Listeria monocytogenes, but when the GST-His-DDDDK in the N-terminal was removed, the cleaved pediocin PA-1 restored its bactericidal activity. The purified pediocin PA-1 had a purity above 90%.
Key words:bacteriocin; pediocin; prokaryotic expression; protein purification
DOI:10.7506/spkx1002-6630-201603019
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)03-0097-06
引文格式:
陈信全, 都立辉, 鞠兴荣, 等. 乳酸片球菌素PA-1在大肠杆菌中的表达与纯化[J]. 食品科学, 2016, 37(3): 97-102. DOI:10.7506/spkx1002-6630-201603019. http://www.spkx.net.cn
CHEN Xinquan, DU Lihui, JU Xingrong, et al. Expression and purification of pediocin PA-1 in Escherichia coli[J]. Food Science, 2016, 37(3): 97-102. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603019. http://www.spkx.net.cn
收稿日期:2015-04-24
基金项目:国家自然科学基金面上项目(31271930);江苏省研究生培养创新工程项目(KYLX_1167);江苏高校优势学科建设工程资助项目(PAPD);江苏省普通高校研究生科研创新计划项目(CXZZ13_0636)
作者简介:陈信全(1988—),男,硕士研究生,研究方向为食品微生物与生物技术。E-mail:sincher-chen@foxmail.com
*通信作者:鞠兴荣(1957—),男,教授,博士,研究方向为食品营养、功能食品及农产品精深加工。E-mail:xingrongju@163.com