王星晨 1,胡 凯 1,陶永胜 1,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
摘 要:利用课题组前期优选的具有高β-葡萄糖苷酶活性的葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)研究其与酿酒酵母(Saccharomyces cerevisiae)菌株混合发酵的动力学,为其葡萄酒增香酿造的应用提供理论和技术支持。实验选用陕西杨凌的爱格丽葡萄为原料,设计优选菌株提前酿酒酵母48 h接种和同时接种两个发酵处理,接种量1.0×10 6CFU/mL,同时用YPD液体培养基进行两个处理的模拟发酵实验,实验以纯酿酒酵母发酵为对照。发酵过程中监测不同酵母菌数量、酒精体积分数、还原糖等指标,建立动力学模型。结果表明,提前接种处理中优选菌株生存数量最多,生存时间最长,在其对数生长期酒精生成和还原糖消耗速率最慢,但整体酒精发酵正常,酒精生成量不受影响,说明发酵过程中不良副产物生成量有限。因此,优选菌株提前酿酒酵母接种的混合发酵具有葡萄酒增香酿造的应用可能。
关键词:有孢汉逊酵母;β-葡萄糖苷酶;酿酒酵母;混合酒精发酵;动力学
葡萄酒工业生产过程中应用纯种酿酒酵母(Saccharomyces cerevisiae)的活性干粉启动酒精发酵越来越普遍,单一菌种发酵在带来发酵纯正、酒精生成率高的同时,也引起葡萄酒风味特征同质化现象,因此混合菌种发酵逐渐受到酿酒师们的关注。事实上,葡萄自然酒精发酵过程是由非酿酒酵母(non-Saccharomyces)触发的 [1],一些非酿酒酵母菌种的发酵会给葡萄酒质量带来消极影响,比如醋酸、乙醛、甲硫醇含量的升高 [2-3]。但进一步研究表明,某些非酿酒酵母可以增加葡萄酒感官质量特征的复杂性 [4],有效接种优选非酿酒酵母与酿酒酵母进行混合酒精发酵对提升葡萄酒感官质量有重要意义。有研究揭示了某些非酿酒酵母具有高活性的糖苷酶,能够有效促进葡萄香气前体物质的水解,生成游离的活性香气成分,提升葡萄酒香气质量 [5]。不同非酿酒酵母菌株的活动对香气物质生成的贡献有差异,如美极梅奇酵母(Metschnikowia pulcherrima)可促进中链脂肪酸、苯乙醇、乙酸异戊酯等的生成 [6],戴尔凯氏有孢圆酵母(Torulaspora delbrueckii)可以产生更多的苯乙醇和多糖以及更低的挥发酸 [7],有孢汉逊酵母(Hanseniaspora uvarum)、季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)和嗜高压有孢汉逊酵母(Hanseniaspora osmophila)等可发酵产生更高的乙酸酯类化合物,如乙酸苯乙酯和乙酸异戊酯 [8-9]。尽管有研究将β-葡萄糖苷酶从非酿酒酵母中提取出来用于酿酒实验并且取得了良好效果 [10-12],但是并不能完全体现相应菌株在酿酒实验中的效果。因此,有研究筛选优良的非酿酒酵母菌种,与酿酒酵母混合酒精发酵,报道其提高葡萄酒风味成分和感官质量的数据 [13-14],但是有关非酿酒酵母与酿酒酵母混合发酵的动力学的研究较少,非酿酒酵母混合发酵过程中有效活动的数据缺乏。
本研究前期工作筛选获得一株高产β-葡萄糖苷酶的葡萄汁有孢汉逊酵母,本实验研究其与酿酒酵母混合酒精发酵的动力学,目的是从理论上揭示混合发酵过程中优选菌株生存数量、生存时间,糖消耗和酒精产率的规律,推断其应用于葡萄酒增香酿造的可能性。
1.1 材料
爱格丽(Ecolly)葡萄,2014年8月采自陕西杨凌西北农林科技大学酿酒葡萄官村基地,含糖量185.6 g/L、含酸量6.7 g/L(以酒石酸计)。
1.2 菌种与培养基
葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),其在WL固体培养基中的菌落形态光滑、绿色、扁平状,并带有透明环,基因库登录序列号:JQ678682.1,中国典型培养物保藏中心(保藏号CCTCC M 2013658);酿酒酵母(F33型号酿酒酵母活性干粉) 法国Laffort公司。
YPD培养基(均为质量分数):葡萄糖2%、蛋白胨2%、酵母浸粉1%,培养72 h,取其培养物上清液的β-葡萄糖苷酶,测得其酶活力为0.075 U/mL。
1.3 混合发酵接种方案
1.3.1 葡萄汁酒精发酵
爱格丽葡萄经除梗破碎后装罐,同时加入50 mg/L的二氧化硫,在5 ℃条件下浸渍24 h后压榨取汁,加入1.0 g/L膨润土下胶澄清,澄清汁接种酵母菌。
提前接种:首先接种1.0×10 6CFU/mL优选菌株(H.uvarum),48 h后接种1.0×10 6CFU/mL酿酒酵母(酵母菌干粉经30 min活化,下同);同时接种:1.0×10 6CFU/mL的H. uvarum和1.0×10 6CFU/mL的酿酒酵母同时接种;纯酿酒酵母:只接种1.0×10 6CFU/mL酿酒酵母。其中H. uvarum采用YPD培养基浓缩菌悬液形式培养接种。
发酵温度控制在18~20 ℃,待相对密度低于0.996,残糖含量低于4 g/L时,终止发酵。
1.3.2 模拟酒精发酵
在250 mL的三角瓶中装入等量的YPD液体培养基,在20 ℃条件下恒温静止进行模拟发酵。
模拟酒精发酵接种方案:提前接种、同时接种、纯酿酒酵母,接种方案同1.3.1节。
1.4 指标检测及处理方法
1.4.1 取样方法
接种酵母菌后,每隔24 h于发酵液中取一定体积酒样。其中葡萄汁发酵液中取上层液体,模拟发酵体系取样前进行摇瓶,使沉淀的菌体均匀分布在发酵液中,然后取样。
1.4.2 微生物计数方法
微生物菌落总数采用血球计数法,各菌种的数量采用WL固体培养基平板菌落计数法 [15]。WL固体培养基配方参考文献[16]方法。
1.4.3 酒精体积分数及还原糖含量测定
酒精体积分数采用密度瓶法测定;还原糖含量采用斐林试剂法测定 [15]。
1.5 发酵模型建立方法 [17-20]
菌体生长模型采用Monod模型,使用Logistic方程进行非线性拟合,Logistic方程:
式中:X为t时刻的菌体浓度/(10 7CFU/mL);X m为最大菌体浓度/(10 7CFU/mL);B为常数;t为发酵时间/d;k为最大比生长速率/d -1。
酵母菌的厌氧发酵产物生成动力学模型使用Luedeking-Piret模型建立:
式中:C为发酵产物酒精的体积分数/%;α为与生长偶联的产物形成系数;β为非生长偶联的相关系数。
由于酒精是酵母菌生长的初级代谢产物,故其生长速率与菌体生长直接相关,所以酒精的生成属于偶联型,因此α≠0,β=0。所以酒精生成方程可用Logistic方程直接进行拟合:
式中:C为酒精生成体积分数/%;C m为酒精体积分数最大值/%;D为常数;μ为酒精生成最大比生成速率/d -1。1.6 数据统计
描述性统计量使用SPSS 18.0(SPSS Inc., Chicago IL, USA)进行计算,OriginPro 9.0进行非线性拟合。
2.1 发酵过程中不同酵母菌生长趋势的变化


图1 爱格丽葡萄汁酒精发酵中提前接种(A)、同时接种(B)和纯酿酒酵母(C)体系的不同酵母菌生长趋势变化
Fig.1 Evolution of different yeasts during alcohol fermentation of grape juice in asynchronous (A), simultaneous inoculation (B), and pure S. cerevisiae (C) treatments
图1 A提前接种处理中,在酿酒酵母接种前,H. uvarum生长繁殖迅速,在接种48 h时种群数量达到大约2.0×10 7CFU/mL,并在24 h后达到极大值约3.0×10 7CFU/mL,此后随着酿酒酵母数量的增多,H. uvarum数量开始波动,并缓慢降低,但是直至发酵结束H. uvarum的数量仍维持在1.0×10 7CFU/mL左右。图1B中,两种酵母菌同时接种到葡萄汁中,H. uvarum只在接种后的24 h内迅速生长繁殖且速率明显大于在提前接种处理中的速率,其最大浓度为2.0×10 7CFU/mL,但是此后H. uvarum菌体数量开始逐渐减少并在发酵第8天消失。
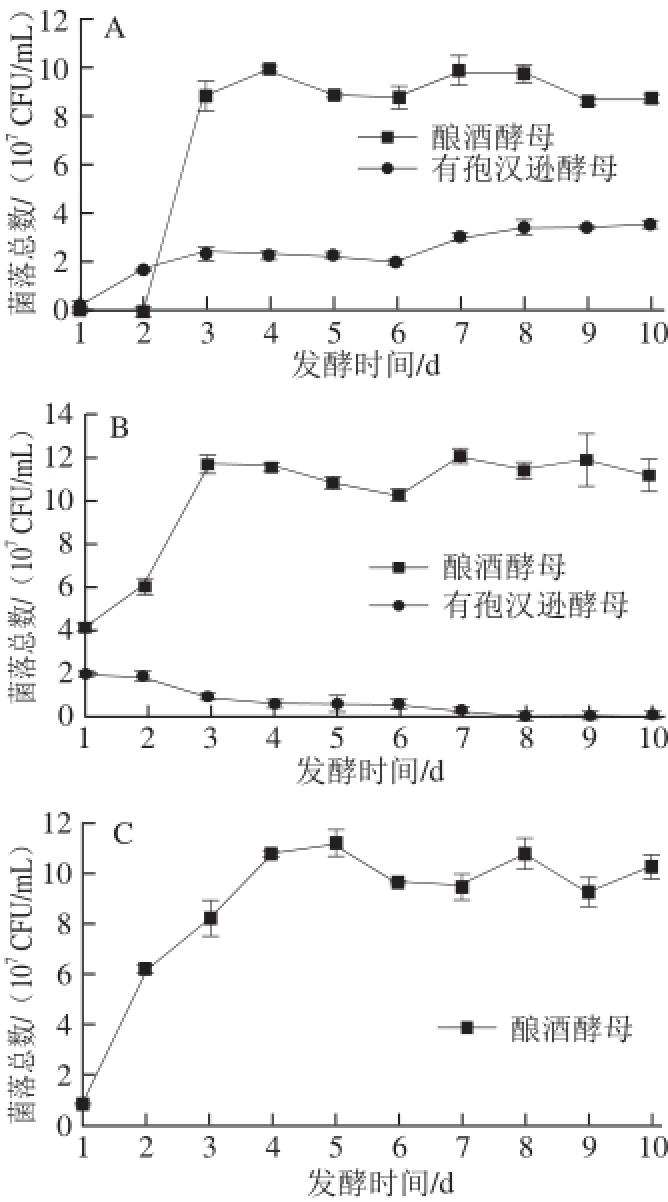
图2 模拟体系酒精发酵中提前接种(A)、同时接种(B)、纯酿酒酵母(C)体系的不同酵母菌生长趋势变化
Fig.2 Evolution of different yeasts during alcohol fermentation of YPD medium in asynchronous (A), simultaneous inoculation (B), and pure S. cerevisiae (C) treatments
YPD培养基模拟酒精发酵过程中的各个接种处理不同酵母菌的数量变化过程见图2。在模拟发酵体系中,H. uvarum表现了与在葡萄汁中相似的对比结果,H. uvarum的数量在提前接种处理中总体呈现增长的趋势,且最大值达到了3.5×10 7CFU/mL(图2A),而在同时接种处理中,H. uvarum的数量在开始时最大,为2.0×10 7CFU/mL,此后便一直呈现下降趋势,并在发酵第8天消失(图2B)。模拟发酵与葡萄汁发酵所得的相似的结果证明H. uvarum在提前接种混合发酵体系中比在同时接种混合发酵体系中存在的时间更长,数量更多,表明提前接种处理的发酵液更有潜力获得更多的β-葡萄糖苷酶,进而更有可能水解更多的香气糖苷,因此具有葡萄酒增香酿造的应用可能。
2.2 酵母菌生长动力学
图3A是葡萄汁酒精发酵过程中3 种接种方式的酵母菌生长动力学曲线,模型使用发酵前5 d的数据进行拟合,后6 d未进行拟合。图3B是模拟体系3 种接种方式的酵母菌生长动力学曲线。葡萄汁发酵和模拟体系发酵各个处理的酵母菌生长动力学拟合的相关参数见表1。

图3 葡萄汁酒精发酵(A)和模拟体系酒精发酵(B)微生物生长动力学拟合
Fig.3 Yeast growth kinetics for alcohol fermentation of grape juice (A) and YPD medium (B)
由图3A可知,与其他两种接种方式相比,提前接种处理差异明显,具体表现为细胞数量在接种初期增加缓慢,从第2天进入对数期,且对数期细胞繁殖速率明显高于另外两个体系,第4天时进入平衡期,在平衡期细胞最大浓度为12.6×10 7CFU/mL。在细胞数衰减阶段,提前接种处理的衰减速率最慢,且在发酵结束后的菌体浓度大约是4.0×10 7CFU/mL。同时接种和纯酿酒酵母发酵体系中酵母菌生长模型在发酵前3 d类似,即接种后的第2天进入对数期,第4天进入平衡期,差别在于平衡期两个发酵体系的细胞最大浓度分别为12.0×10 7CFU/mL和10.0×10 7CFU/mL,平衡期后细胞基本同步衰减直至发酵结束,发酵结束时的细胞浓度大约是1.0×10 7CFU/mL,明显低于提前接种处理。结合图1,在平衡期时提前接种处理的总酵母菌数量最多,且H. uvarum占总酵母菌数的比例大于同时接种处理的,因此提前接种处理中,H. uvarum对葡萄酒质量的影响更大。
表1 葡萄汁与模拟体系酒精发酵酵母菌生长动力学参数
Table1 Kinetic parameters of yeast growth during alcohol fermentation of grape juice and YPD medium
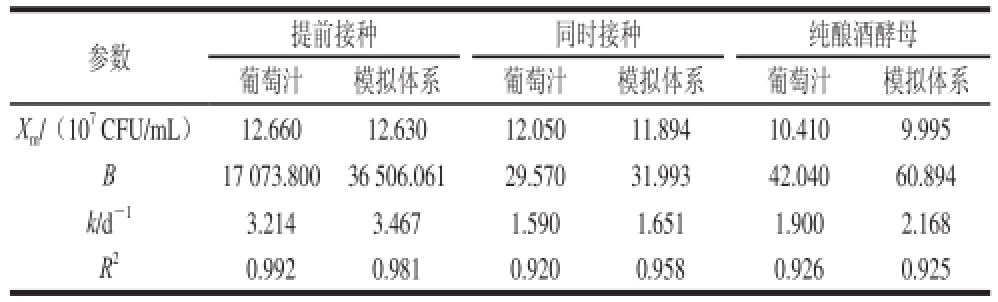
参数提前接种同时接种纯酿酒酵母葡萄汁模拟体系葡萄汁模拟体系葡萄汁模拟体系X m/(10 7CFU/mL)12.66012.63012.05011.89410.4109.995 B17 073.80036 506.06129.57031.99342.04060.894 k/d -13.2143.4671.5901.6511.9002.168 R 20.9920.9810.9200.9580.9260.925
2.3 产物生成动力学和底物消耗动力学

图4 葡萄汁酒精发酵产物生成动力学(A)和底物消耗动力学(B)拟合图
Fig.4 Kinetics of ethanol production (A) and substrate consumption (B) during alcohol fermentation of grape juice
由图4A可知,各处理酒精生成的最终结果相近,但累积过程差异明显。提前接种处理的酒精累积速率最慢,在发酵开始的48 h内,H. uvarum数量小,因而酒精的累积速率非常低,而随着酿酒酵母的接种以及体系中总酵母菌数量的增加,酒精累积速率迅速升高并在发酵结束时达到最大值。由图4B可知,还原糖消耗动力学中同样是提前接种处理最慢,在发酵开始的48 h内,还原糖以微弱的速率被消耗,而随后的2 d内还原糖含量快速降低,此后以较为平缓的速率被消耗直到发酵结束。结合图3中微生物群体演变规律,可以发现酵母菌数量的变化过程正是酒精体积分数累积速率和还原糖消耗速率变化的直接原因。
表2是酒精生成动力学参数拟合结果,3 个发酵体系最终拟合的最大酒精体积分数均大约为11.5%,表明H. uvarum的接种生长并没有显著地影响到底物糖的代谢和产物酒精的生成,产生不良风味副产物的可能性很小。
表2 酒精生成动力学拟合参数
Table2 Kinetic parameters for alcohol production

参数提前接种同时接种纯酿酒酵母C m/%11.47711.53511.452 D 59.40532.5132.868 μ/d -10.9640.9161.020 R 20.9930.9970.995
在葡萄酒酒精发酵过程中,采用干质量法测定的酵母菌生长趋势变化规律遵循典型的“S”形曲线 [21],但是自发酵平衡期末,酵母菌总数量包括活菌体和死亡菌体,死亡菌体对于酒精发酵速率没有直接贡献。因此,本实验中爱格丽葡萄汁酒精发酵过程中酵母菌的数量变化采用WL固体培养基计数,显示了活酵母菌在酒精发酵中的数量演变过程,有助于揭示不同接种发酵处理的发酵过程中酵母菌变化的差异,从而以此判断优选酵母菌株对葡萄酒质量可能的影响。
在单一酵母菌的酒精发酵实验中,酵母菌总数一般在第3天便达到最大值 [21-22],本实验结果亦显示酵母菌数量在第3天达到最大值。有研究发现,在酿酒酵母与季也蒙有孢汉逊酵母(H. guilliermondii)和异常毕赤酵母(P. anomala)的混合酒精发酵处理中,酿酒酵母在发酵第5天便占据主导地位,且两种非酿酒酵母完全消失 [22]。而本实验的接种处理中,葡萄汁有孢汉逊酵母(H. uvarum)在同时接种处理中第8天消失,但是在提前接种处理的发酵过程中一直存活,表明H. uvarum在酿酒酵母前48 h接种有助于其自身的生长繁殖和生存。
Comitini等 [6]研究发现非酿酒酵母对于发酵液中酵母菌生长动力学的影响可能与它的细胞浓度和存活的时间有关系,当非酿酒酵母与酿酒酵母的接种体积比是1∶1时,酿酒酵母的生长不受影响,而当比例提高时(100∶1或者10 000∶1),非酿酒酵母就会对酿酒酵母的生长产生显著的影响。本实验中,同时接种处理和纯酿酒酵母发酵体系中酵母菌生长曲线相似,同样说明当非酿酒酵母与酿酒酵母接种数量接近时,酿酒酵母的生长不受非酿酒酵母的影响。Yamaoka等 [23]在酿酒酵母与乳酸克鲁维酵母(Kluyveromyces lactis)的混合发酵过程中,发现后者代谢产生的甘油、丙氨酸等物质可以改变酿酒酵母细胞内氨基酸水平,延长其细胞生命周期。由此推断,本实验提前接种处理表现出最高的细胞浓度以及后期较低的衰减速率和较少的衰减数量,极有可能是由于H. uvarum在发酵前期产生并积累了的一些物质,使得酵母菌生长周期延长。发酵后期较高的菌群密度可以有效避免葡萄酒酒精发酵的意外终止,同时酵母菌总体中H. uvarum的高比例和更长的存活时间会提高发酵液中β-葡萄糖苷酶的含量,从而有利于香气前体物质的水解释放。
此前有研究得出,非酿酒酵母和酿酒酵母混合酒精发酵在平衡期的酵母菌总数多于纯酿酒酵母发酵的处理,但是前者的发酵速率和产酒精率低于后者 [24-25]。研究 [26]发现,将酿酒酵母接种到非酿酒酵母发酵一段时间的葡萄汁中,所酿葡萄酒与同时接种的混合发酵所酿葡萄酒在最终风味产物上大不一样,前者香气更为复杂。本实验中不同酵母菌的接种处理并不影响酒精发酵的正常进行,虽然H. uvarum提前接种处理开始的糖消耗和酒精生成率较低,但随着酵母菌数量的增加,底物消耗和产物生产的速率与对照开始接近,最终不同接种处理的发酵过程在底物消耗量和产物生成量上没有显著差别。
以上优选葡萄汁有孢汉逊酵母和酿酒酵母混合酒精发酵的动力学分析显示,在酒精发酵全过程中,提前接种处理的优选菌株生存数量最多,生存时间最长,虽然在其对数生长期酒精生成和还原糖消耗速率最慢,但整体酒精发酵正常,酒精生成量不受影响,说明优选菌株发酵过程中产生不良气味副产物的可能性较小,优选菌株提前酿酒酵母48 h接种进行混合酒精发酵具有葡萄酒增香酿造的应用潜力。
参考文献:
[1] 李华, 王华, 袁春龙, 等. 葡萄酒工艺学[M]. 北京: 科学出版社, 2007: 68-73; 165-178.
[2] ANFANG N, BRAJKOVICH M, GODDARD M R. Co-fermentation with Pichia kluyveri increases varietal thiol concentrations in Sauvignon Blanc[J]. Australian Journal of Grape and Wine Research, 2009, 15(1): 1-8. DOI:10.1111/j.1755-0238.2008.00031.x.
[3] MOREIRA N, MENDES F, HOGG T, et al. Alcohols, esters and heavy sulphur compounds production by pure and mixed cultures of apiculate wine yeasts[J]. International Journal of Food Microbiology, 2005, 103(3): 285-294. DOI:10.1016/j.ijfoodmicro.2004.12.029.
[4] HONG Y A, PARK H D. Role of non-Saccharomyces yeasts in Korean wines produced from Campbell Early grapes: potential use of Hanseniaspora uvarum as a starter culture[J]. Food Microbiology, 2013, 34(1): 207-214. DOI:10.1016/j.fm.2012.12.011.
[5] CHAROENCHAI C, FLEET G H, HENSCHKE P A, et al. Screening of non-Saccharomyces wine yeasts for the presence of extracellular hydrolytic enzymes[J]. Australian Journal of Grape and Wine Research, 1997, 3(1): 2-8. DOI:10.1111/j.1755-0238.1997.tb00109.x.
[6] COMITINI F, GOBBI M, DOMIZIO P, et al. Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J]. Food Microbiology, 2011, 28(5): 873-882. DOI:10.1016/j.fm.2010.12.001.
[7] RENAULT P, MIOT-SERTIER C, MARULLO P, et al. Genetic characterization and phenotypic variability in Torulaspora delbrueckii species: potential applications in the wine industry[J]. International Journal of Food Microbiology, 2009, 134(3): 201-210. DOI:10.1016/ j.ijfoodmicro.2009.06.008.
[8] MOREIRA N, MENDES F, GUEDES de PINHO P P, et al. Heavy sulphur compounds, higher alcohols and esters production profile of Hanseniaspora uvarum and Hanseniaspora guilliermondii grown as pure and mixed cultures in grape must[J]. International Journal of Food Microbiology, 2008, 124(3): 231-238. DOI:10.1016/ ijfoodmicro.2008.03.025.
[9] VIANA F, GIL J V, VALLÉS S, et al. Increasing the levels of 2-phenylethyl acetate in wine through the use of a mixed culture of Hanseniaspora osmophila and Saccharomyces cerevisiae[J]. International Journal of Food Microbiology, 2009, 135(1): 68-74. DOI:10.1016/j.ijfoodmicro.2009.07.025.
[10] WANG Yuxia, XU Yan, LI Jiming. A novel extracellular β-glucosidase from Trichosporon asahii: yield prediction, evaluation and application for aroma enhancement of Cabernet Sauvignon[J]. Journal of Food Science, 2012, 77(8): 505-515. DOI:10.1111/j.1750-3841.2012.02705.x.
[11] PALOMO E S, HIDALGO D M, GONZ˘LEZ M ˘, et al. Aroma enhancement in wines from different grape varieties using exogenous glycosidases[J]. Food Chemistry, 2004, 92(4): 627-635. DOI:10.1016/ j.foodchem.2004.08.025.
[12] 陶永胜, 牟含, 李国, 等. 野生胶红酵母糖苷酶水解媚丽新酒中香气糖苷研究[J]. 农业机械学报, 2014(12): 249-254. DOI:10.6041/ j.issn.1000-1298.2014.12.037.
[13] SADINENI V, KONDAPALLI N, OBULAM V S R. Effect of co-fermentation with Saccharomyces cerevisiae and Torulaspora delbrueckii or Metschnikowia pulcherrima on the aroma and sensory properties of mango wine[J]. Annals of Microbiology, 2012, 62(4): 1353-1360. DOI:10.1007/s13213-011-0383-6.
[14] CLEMENTE J J M, MINGORANCE C L, MART¸NEZ R S, et al. Influence of sequential yeast mixtures on wine fermentation[J]. International Journal of Food Microbiology, 2004, 98(3): 301-308. DOI:10.1016/j.ijfoodchem.2004.06.007.
[15] 王华. 葡萄酒分析检验[M]. 北京: 中国农业出版社, 2011: 113-135; 201-204.
[16] 程雷, 李梓, 王军. 葡萄自然发酵过程中酵母菌的研究[J]. 中国食品学报, 2010, 10(2): 131-137.
[17] 曹军卫, 马辉文, 张甲耀. 微生物工程[M]. 2版. 北京: 科学出版社, 2007: 167-184.
[18] 张卉. 微生物工程[M]. 北京: 中国轻工业出版社, 2010: 84-89.
[19] 戚以政, 汪叔雄. 生物反应动力学与反应器[M]. 3版. 北京: 化学工业出版社, 2007: 54-75.
[20] 许赣荣, 胡鹏刚. 发酵工程[M]. 北京: 科学出版社, 2013: 127-134.
[21] WANG D, XU Y, HU J, et al. Fermentation kinetics of different sugars by apple wine yeast Saccharomyces cerevisiae[J]. Journal of the Institute of Brewing, 2004, 110(4): 340-346. DOI:10.1002/j.2050-0416.2004.tb00630.x.
[22] ROJAS V, JOSÉ V G, PIÑAGA F, et al. Acetate ester formation in wine by mixed cultures in laboratory fermentations[J]. International Journal of Food Microbiology, 2003, 86(1): 169-180. DOI:10.1016/ S0168-1605(03)00255-1.
[23] YAMAOKA C, KURITA O, KUBO T. Improved ethanol tolerance of Saccharomyces cerevisiae in mixed cultures with Kluyveromyces lactis on high-sugar fermentation[J]. Microbiological Research, 2014, 168(12): 907-914. DOI:10.1016/j.micres.2014.04.007.
[24] ANDORR¤ I, BERRADRE M, ROZ˚S N, et al. Effect of pure and mixed cultures of the main wine yeast species on grape must fermentations[J]. European Food Research and Technology, 2010, 231(2): 215-224. DOI:10.1007/s00217-010-1272-0.
[25] CIANI M, BECO L, COMITINI F. Fermentation behaviour and metabolic interactions of multistarter wine yeast fermentations[J]. International Journal of Food Microbiology, 2006, 108(2): 239-245. DOI:10.1016/j.ijfoodmicro.2005.11.012.
[26] ROMANO P, FIORE C, PARAGGIO M, et al. Function of yeast and strains in wine flavour[J]. International Journal of Food Microbiology, 2003, 86(1/2): 169-180. DOI:10.1016/S0168-1605(03)00290-3.
Kinetics of Alcohol Fermentation by Mixed Cultures of Hanseniaspora uvarum and Saccharomyces cerevisiae
WANG Xingchen
1, HU Kai
1, TAO Yongsheng
1,2,*
(1. College of Enology, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Engineering Research Center for Viti-Viniculture, Yangling 712100, China)
Abstract:A strain of Hanseniaspora uvarum with high activity β-glucosidase has been isolated in our previous study. In this work we conducted a ki netic study on alcohol fermentation by mixed cultures of the isolate and Saccharomyces cerevisiae with the aim to find out the theoretical basis and technical support for the application of the strain of Hanseniaspora uvarum in winemaking for aroma enhancement. Ecolly grapes in Yangling, Shaanxi were used as raw materials for winemaking. Two treatments, inoculation of the isolate 48 h earlier than S. cerevisiae and simultaneous inoculation, were designed. The inoculation amount of the isolate was 1.0 × 10 6CFU/mL. The fermentation of these two treatments with YPD liquid medium as grape juice model system was also performed. The fermentation with S. cerevisiae alone was set as the control. During fermentation, the amount of different yeast strains, alcohol production and residual sugar were recorded. Then the kinetic equations were built. Results showed that, in the asynchronous inoculation treatment, the live isolate subsisted for a longer time and its amount was higher than that in the other treatment and the control. In the logarithmic period of the isolate, alcohol production and sugar consumption were both lower than those in the other treatment and the control. In addition, its alcohol fermentation was normal and the final alcohol production was the same as that in two other treatments. It could be concluded that inoculation of the isolate 48 h earlier than S. cerevisiae could show better hydrolysis of aroma precursors by β-glucosidase during winemaking, and it will have promising applications in winemaking for aroma enhancement.
Key words:Hanseniaspora uvarum; β-glucosidase; Saccharomyces cerevisiae; mixed culture fermentation; kinetics
DOI:10.7506/spkx1002-6630-201603020
中图分类号:TS261.4
文献标志码:A
文章编号:1002-6630(2016)03-0103-06
引文格式:
王星晨, 胡凯, 陶永胜. 葡萄汁有孢汉逊酵母和酿酒酵母的混合酒精发酵动力学[J]. 食品科学, 2016, 37(3): 103-108. DOI:10.7506/spkx1002-6630-201603020. http://www.spkx.net.cn
WANG Xingchen, HU Kai, TAO Yongsheng. Kinetics of alcohol fermentation by mixed cultures of Hanseniaspora uvarum and Saccharomyces cerevisiae[J]. Food Science, 2016, 37(3): 103-108. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201603020. http://www.spkx.net.cn
收稿日期:2015-09-29
基金项目:国家自然科学基金面上项目(31371724)
作者简介:王星晨(1990—),男,硕士研究生,主要从事葡萄酒酿造技术研究。E-mail:xing-chenwang@qq.com
*通信作者:陶永胜(1977—),男,副教授,博士,主要从事葡萄酒酿造与风味化学研究。E-mail:taoyongsheng@nwsuaf.com.cn