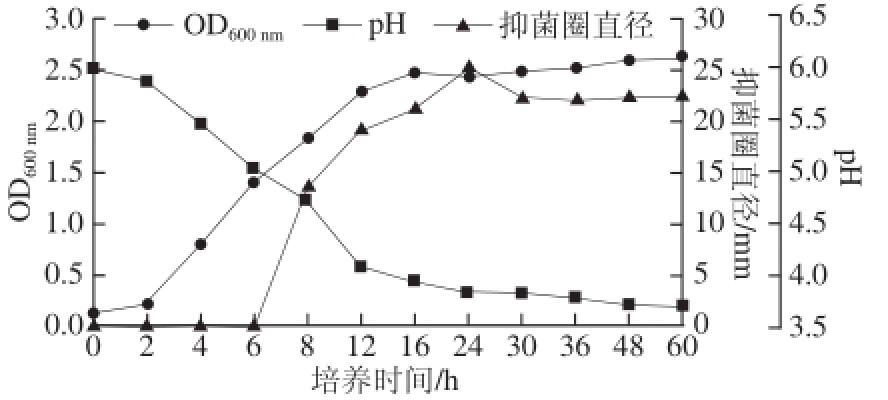
图1 菌株S1-4生长曲线及抑菌活性曲线
Fig.1 Growth and antibacterial activity curves of strain S1-4
苏日娜,双 全*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010000)
摘 要:通过单因素及正交试验对戊糖乳杆菌S1-4产抑菌 物质的发酵条件进行了优化,并其对敏感菌株的抑菌效果进行了探讨。结果表明,戊糖乳杆菌S1-4产抑菌物质的最佳培养条件为:接种量2.0%, 培养基初始pH 5.5,32 ℃培养26 h,其抑菌圈平均直径可达(3 0.08±0.69) mm,优化前其抑菌圈平均直径为(24.41±0.25)mm,优化后抑菌活性提高了0.23倍。菌株S1-4所产抑菌物质对所试12 种G +和G -致病菌的生长都起到抑制作用,呈现出较广谱的抑菌特性。因此,菌株S1-4具有可作为食品生物防腐剂的潜在应用价值。
关键词:戊糖乳杆菌;抑菌物质;发酵条件优化
食品的保鲜防腐在食品工业中始终是一个需要解决的重要问题 [1]。人们使用了很多种保藏食品的方法,其中最常用的一种是添加化学防腐剂 [2]。经长期的研究发现一些合成防腐剂有诱癌性、致畸性和易引起食物中毒等问题 [3]。所以开发出广谱、高效、稳定、安全的天然食品防腐剂是食品工业发展的必然趋势 [4]。
乳酸菌是众多发酵食品的生物基础 [5],它们对腐败菌及病原菌的抑制作用可能依靠其代谢产物,比如有机酸(乳酸和醋酸)、过氧化氢和细菌素 [6]。细菌素(bacteriocin)是细菌在代谢过程中通过核糖体合成机制产生的一种具有抑菌活性的代谢产物,通常是低分子质量的多肽或者蛋白类物质 [7]。尤其是乳酸菌所产生的细菌素有耐高温、高效、无毒、无残留、水溶性好、不影响食品风味等优点,可作为天然绿色防腐剂,在食品保存方面有巨大的应用价值 [8]。
乳酸菌细菌素具有广谱的抑菌特性,它们不仅对革兰氏阳性细菌有抑制作用,而且对革兰氏阴性细菌,如大肠杆菌、单核细胞增生李斯特菌、绿脓假单胞杆菌、福氏志贺氏菌都有不同程度的抑制作用 [9]。在我国,乳酸菌细菌素的理论和应用研究主要针对Nisin,然而,通过研究发现Nisin主要是抑制革兰氏阳性菌,不抑制革兰氏阴性菌、霉菌和酵母菌,因此目前选育出具有广谱抑菌性的乳酸菌是有非常重要的意义 [10]。
乳酸菌代谢产生抑菌物质能力的大小,受多种因素影响。除了受菌株自身特性外,还受发酵条件,比如培养基的初始pH值、培养温度、培养时间等因素的影响 [11-13]。本实验对前期实验中筛选到的一株戊糖乳杆菌S1-4的发酵条件进行优化,通过单因素和正交试验分析确定其最佳产抑菌物质的培养温度、培养时间、接种量和培养基初始pH值,并研究其产抑菌物质的抑菌效果,为后续的提纯与应用提供实验依据。
1.1 菌株
供试菌株:戊糖乳杆菌(Lactobacillus pentosus)S1-4,分离自内蒙古东部地区传统发酵酸菜汁液。
指示菌:大肠杆菌(Escherichia coli)、绿脓假单胞杆菌(Pseudomonas aeruginosa)、鼠伤寒沙门氏菌(Salmonella typhimurium)、金黄色葡萄球菌(Staphylococcus aureus)、蜡状芽孢杆菌(Bacillus cereus)、枯草芽孢杆菌(Bacillus subtilis)、肠沙门氏菌肠亚种(Salmonella enterica subsp. enterica)、单核细胞增生李斯特菌(Listeria monocytogenes)、荧光假单胞菌(Pseudomonas fluorescens)标准菌株由内蒙古农业大学微生物实验室提供。
1.2 培养基
戊糖乳杆菌培养基:脱脂乳培养基、MRS培养基;指示菌培养基:LB液体培养基;抑菌活性的检测培养基:水琼脂培养基、营养琼脂培养基。配制方法见参考文献[14]。
1.3 仪器与设备
W-CJ-2D双人单面垂直净化工作台 苏州智净净化设备有限公司;HPS-250生化培养箱 上海一恒科学仪器有限公司;SX-500高压灭菌锅 德国Tomy公司;OHAUS EX623电子天平 奥豪斯仪器(上海)有限公司;PHS-25型数显酸度计 杭州雷磁分析仪器厂;SK-1快速混匀器 常州国华电器有限公司。
1.4 方法
1.4.1 菌株S1-4发酵上清液的制备
将已经恢复活力至正常的菌株S1-4按体积分数2%接入MRS液体培养基中,37 ℃发酵24 h,离心(6 000 r/min、15 min)取上清,用0.22 μm微孔滤菌器过滤,去除上清液中的菌体细胞,得到植物乳杆菌 的无 细胞提取液,放置在4 ℃冰箱保藏待用。
1.4.2 抑菌活性的测定 [15]
乳酸菌发酵上清液的抑菌活性测定采用双层琼脂扩散法,先以1%的无菌琼脂水溶液在培养皿底层打底,待琼脂凝固后在上面均匀摆放牛津杯,再倒20 mL带有指示菌的固体培养基,待培养基凝固后取牛津杯,在其形成的孔内加0.2 mL发酵上清液,在37 ℃条件下培养24 h后测其抑菌圈直径。
1.4.3 戊糖乳杆菌S1-4产抑菌物质的单因素试验
1.4.3.1 培养时间对戊糖乳杆菌S1-4产抑菌物质的影响
将菌株S1-4按2%的接种量接种于MRS培养基中,37 ℃培养。每隔2 h 取样(0~60 h),测定OD 600 nm、pH值和上清液抑菌活性,各设3 个平行。
1.4.3.2 培养温度对戊糖乳杆菌S1-4产抑菌物质的影响
将复筛选出的菌株按2%接种于MRS培养基中,分别以30、34、37、40、42 ℃恒温培养24 h,并测定其OD 600 nm值和抑菌活性,确定最适发酵温度。
1.4.3.3 接种量对戊糖乳杆菌S1-4产抑菌物质的影响
将复筛选出的菌株分别以1%、1.5%、2%、2.5%、3%的接种量接入MRS培养基中,37 ℃恒温培养24 h、并测定其OD 600 nm值和抑菌活性,确定最适的接种量。
1.4.3.4 初始pH值对戊糖乳杆菌S1-4产抑菌物质的影响
用NaOH、HCl调节MRS培养基至初始pH值为4.0、4.5、5.0、5.5、6.0、6.5、7.0、8.0,将复筛选出的菌株以2%接种量分别接入上述不同初始pH值的MRS培养基中,37 ℃恒温培养24 h,并测定其OD 600 nm值和抑菌活性,确定最适初始pH值范围。
1.4.4 正交试验优化戊糖乳杆菌S1-4产抑菌物质的主要发酵条件
在单因素试验的基础上,选择培养时间、培养温度、接种量和初始pH值为主要影响因素进行正交试验,从而确定最优发酵条件组合。
1.4.5 戊糖乳杆菌S1-4产抑菌物质的抑菌谱
选用内蒙古农业大学微生物实验室保存的革兰氏阳性细菌和革兰氏阴性细菌作为检测的指示菌,采用双层琼脂扩散法测定各指示菌的抑菌作用,以确定其抑菌谱。
2.1 戊糖乳杆菌S1-4产抑菌物质发酵条件的优化

图1 菌株S1-4生长曲线及抑菌活性曲线
Fig.1 Growth and antibacterial activity curves of strain S1-4
2.1.1 培养时间对戊糖乳杆菌S1-4产抑菌物质的影响由图1可知,戊糖乳杆菌S1-4在培养至3、4 h即进入对数生长期,此时pH值显著下降,到16~18 h左右进入稳定期,发酵22 h后pH值趋于稳定,从整个发酵过程可以看出菌株产酸能力较强,最终pH值为3.8左右。图上未见明显的衰亡期。从其抑菌活性看,在8 h左右开始产生抑菌物质,且在24 h时产量达到最大值,抑菌圈直径可达(25.37±0.82) mm,抑菌活性达到最高。通常认为菌株的生长和抑菌物质的产生是有关联的,有的抑菌物质在细胞开始生长时即可产生,而有的抑菌物质——植物乳杆菌P158 [16]则在对数生长后期产抑菌物质,在生长到一定时间后抑菌活性降低,可能是由于细菌素吸附到产生菌细胞表面导致发酵液中细菌素活性的下降,也可能是细菌素发生降解而失活 [17]。
2.1.2 培养温度对戊糖乳杆菌S1-4产抑菌物质的影响
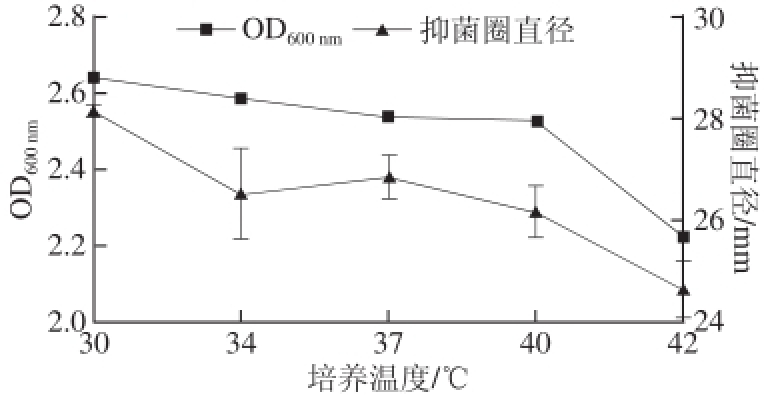
图2 培养温度对菌株S1-4抑菌活性的影响
Fig.2 Effect of culture tempera ture on antibacterial activity of strain S1-4
由图2可知,培养温度在30 ℃时菌体生长最好,随着培养温度的升高,抑菌物质的产量开始下降。这与资料报道的某些细菌素在低于最适培养温度条件下有较高细菌素产量的结论不一致,说明细菌素的产生是一种复杂生理代谢过程,与多种因素有关 [18]。所以不同温度对戊糖乳杆菌S1-4产抑菌物质的影响也不同。总的来说戊糖乳杆菌S1-4的最适培养温度为30 ℃。
2.1.3 接种量对戊糖乳杆菌S1-4产抑菌物质的影响
由图3可知,随着接种量的改变菌株S1-4的抑菌活性变化很大,菌体密度(OD 600 nm)变化也大,接种量为2%时的OD 600 nm值明显高于其他接种量,对指示菌的抑菌效果也最明显,有利于细菌的快速生长和细菌素的分泌和积累。因此选择2%接种量作为戊糖乳杆菌S1-4产抑菌物质的最适接种量。当接种量超过2%时,菌株S1-4的抑菌活性有所下降,可能是因为随着接种量的增大,培养基内乳酸菌之间生长竞争加剧,培养基性质改变,环境条件恶化,使乳酸菌群体生长下降,因而抑菌物质产量下降 [19]。
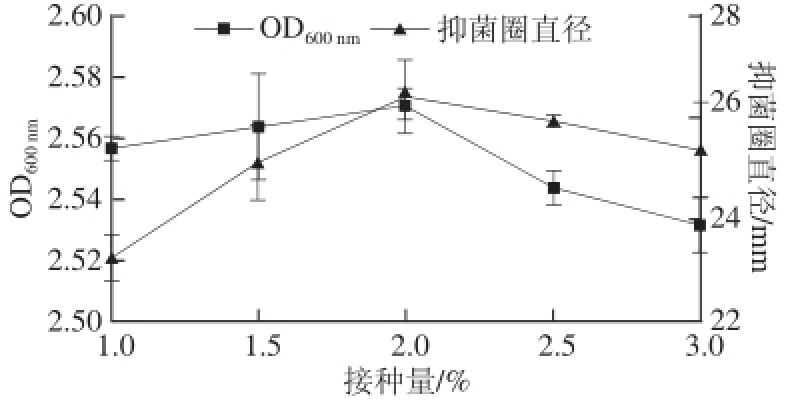
图3 不同接种量对菌株S1-4抑菌活性的影响
Fig.3 Effect of inoculum size on antibacterial activity of strain S1-4
2.1.4 初始pH值对戊糖乳杆菌S1-4产抑菌物质的影响
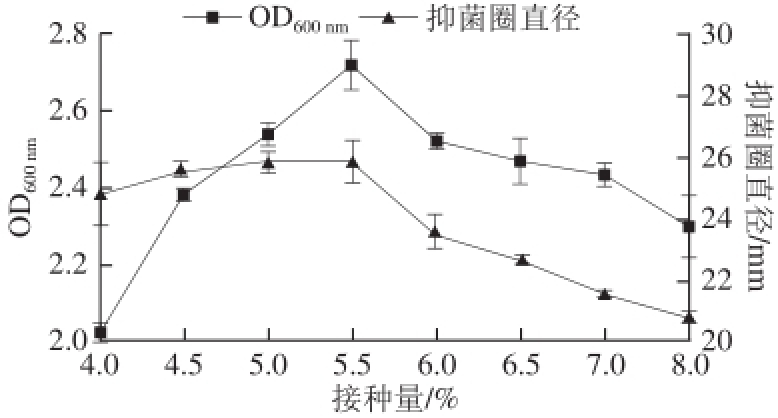
图4 培养基初始pH值对菌株S1-4抑菌活性的影响
Fig.4 Effect of initial pH of medium on antibacterial activity of strain S1-4
由图4可知,pH值在4.0~8.0之间菌株均能产抑菌物质,并且在pH值为5.5时,对指示菌的抑菌活性最大,产抑菌物质最多,其抑菌圈直径可达(26.28±0.17) mm左右,同上pH值为5.5时菌株S1-4达到了菌体富集的最大值,这也说明抑菌物质的产生与细胞生长成正相关 [20]。因此选择pH 5.5作为戊糖乳杆菌S1-4产抑菌物质的最适培养基初始pH值。
2.2 戊糖乳杆菌S1-4产抑菌物质的主要发酵条件的优化
采用正交试验L 9(3 4)对培养温度、培养时间、接种量和培养基初始pH值4 个主要因素进行优化,从而确定菌株产抑菌物质的最佳发酵条件。
戊糖乳杆菌S1-4的正交试验结果及极差分析见表1。极差R大小表明各个因素对菌株产抑菌物质的影响程度,即培养温度>培养时间>接种量>初始pH值,说明培养温度影响最大,其次是培养时间、接种量,最后是初始pH值。菌株S1-4的最佳发酵条件组合是A 3B 3C 2D 2,即培养温度32 ℃、培养时间26 h、接种量2.0%、初始pH 5.5。在此条件下得到戊糖乳杆菌S1-4所产抑菌物质的抑菌圈直径为(30.08±0.69) mm,比9 组试验组中抑菌圈直径最大值(27.81 mm)要大,故经验证确定戊糖乳杆菌S1-4的最佳发酵条件组合是A 3B 3C 2D 2。
表1 菌株S1-4产抑菌物质的发酵条件正交试验方案及结果
Table1 Orthogonal array design with experimental results for optimization of fermentation conditions
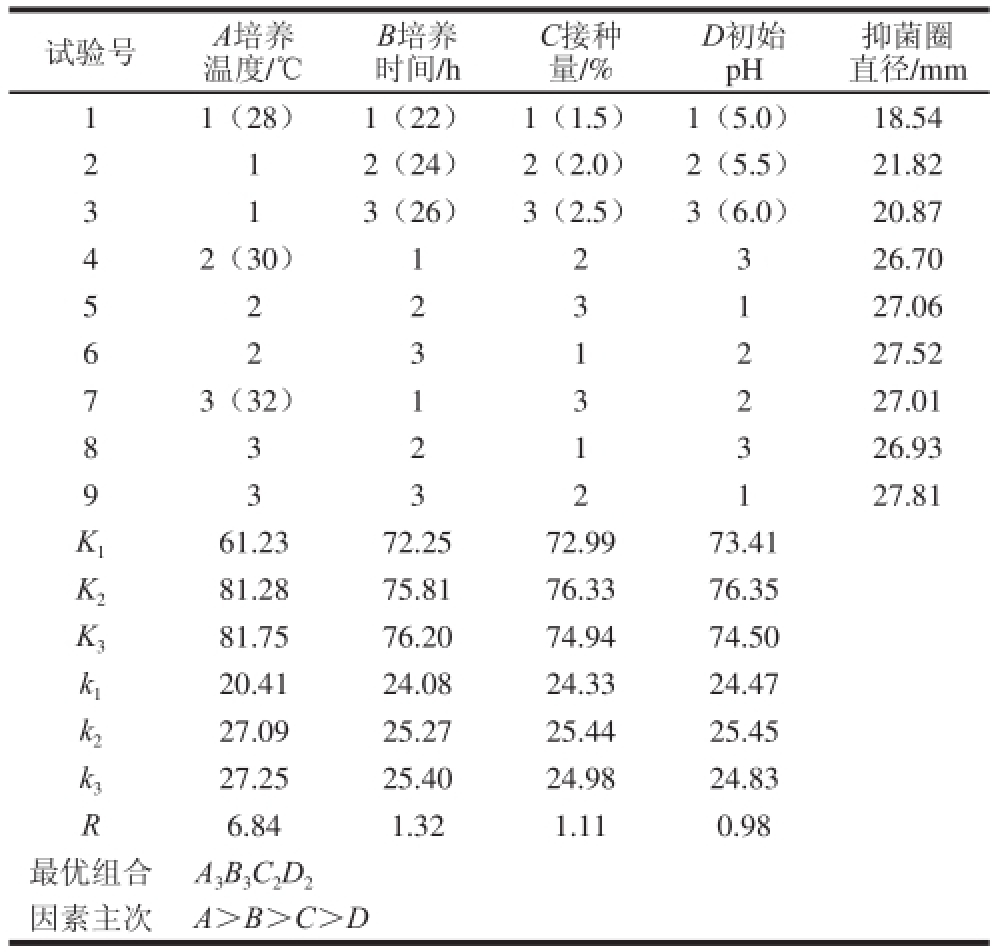
试验号A培养温度/℃抑菌圈直径/mm 11(28)1(22)1(1.5)1(5.0)18.54 2 12(24)2(2.0)2(5.5)21.82 3 13(26)3(2.5)3(6.0)20.87 42(30)12326.70 5 2 2 3 127.06 B培养时间/h C接种量/% D初始pH 6 227.52 73(32)13227.01 8 3 2 1 326.93 2 3 1 127.81 K 161.2372.2572.9973.41 K 281.2875.8176.3376.35 K 381.7576.2074.9474.50 k 120.4124.0824.3324.47 k 227.0925.2725.4425.45 k 327.2525.4024.9824.83 R6.841.321.110.98最优组合A 3B 3C 2D 2因素主次 A>B>C>D 9 3 3 2
2.3 戊糖乳杆菌S1-4的抑菌谱
利用戊糖乳杆菌S1-4所产的抑菌物质对选取的12 株具有代表性的革兰氏阳性细菌和革兰氏阴性细菌做抑菌实验。由表2、图5可知,戊糖乳杆菌S1-4所产抑菌物质不仅可以较好地抑制革兰氏阳性菌(金黄色葡萄球菌、枯草芽孢杆菌、蜡状芽孢杆菌、单核细胞增生李斯特菌等),更重要的是能够抑制革兰氏阴性细菌(大肠杆菌、沙门氏菌、荧光假单胞菌、绿脓假单胞杆菌、鼠伤寒沙门氏菌)。综合上述结果可以得出戊糖乳杆菌S1-4所产抑菌物质具有较广泛的抑菌谱,具有潜在的开发与应用前景。
表2 菌株S1-4无细胞上清液的抑菌谱
Table2 Antimicrobial spectra of strain S1-4
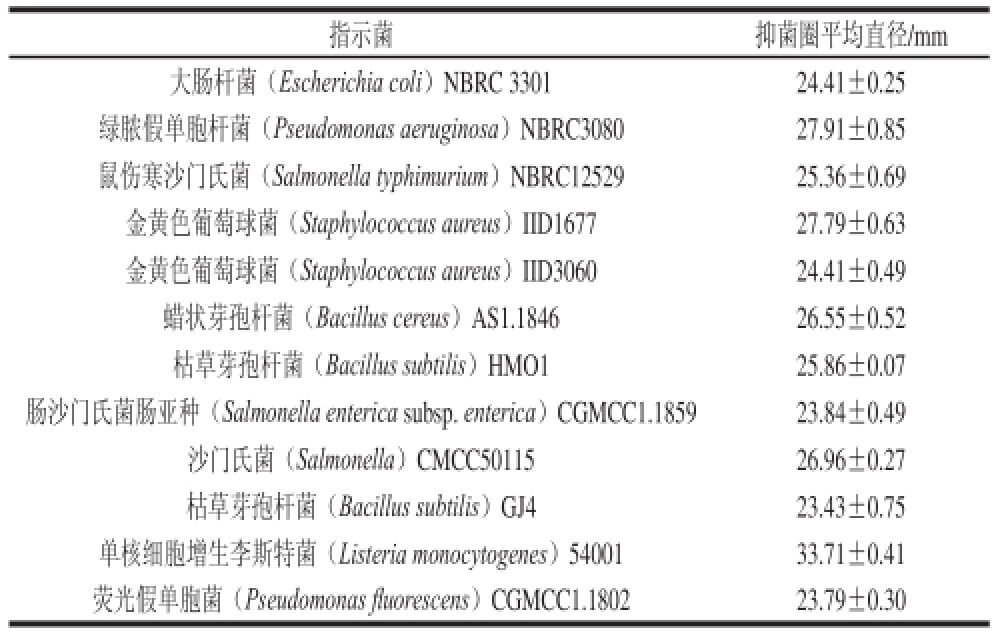
指示菌抑菌圈平均直径/mm大肠杆菌(Escherichia coli)NBRC 330124.41±0.25绿脓假单胞杆菌(Pseudomonas aeruginosa)NBRC3080 27.91±0.85鼠伤寒沙门氏菌(Salmonella typhimurium)NBRC12529 25.36±0.69金黄色葡萄球菌(Staphylococcus aureus)IID167727.79±0.63金黄色葡萄球菌(Staphylococcus aureus)IID306024.41±0.49蜡状芽孢杆菌(Bacillus cereus)AS1.184626.55±0.52枯草芽孢杆菌(Bacillus subtilis)HMO125.86±0.07肠沙门氏菌肠亚种(Salmonella enterica subsp. enterica)CGMCC1.185923.84±0.49沙门氏菌(Salmonella)CMCC5011526.96±0.27枯草芽孢杆菌(Bacillus subtilis)GJ423.43±0.75单核细胞增生李斯特菌(Listeria monocytogenes)5400133.71±0.41荧光假单胞菌(Pseudomonas fl uorescens)CGMCC1.180223.79±0.30

图5 菌株S1-4产抑菌物质对部分指示菌的抑菌效果
Fig.5 Antibacterial effects of strain S1-4 against indicator bacteria
A.枯草芽孢杆菌(Bacillus subtilis)GJ4;B.金黄色葡萄球菌(Staphylococcus aureus)IID1677;C.鼠伤寒沙门氏菌(Salmonella typhimurium)NBRC12529;D.单核细胞增生李斯特菌(Listeria monocytogenes)54001。
通过单因素及正交试验对戊糖乳杆菌S1-4产抑菌物质的发酵条件进行了优化。结果表明,戊糖乳杆菌S1-4产抑菌物质的最佳培养条件为:接种量2.0%、培养基初始pH 5.5,32 ℃培养26 h,其抑菌圈平均直径可达(30.08±0.69)mm,优化前其抑菌圈平均直径为(24.41±0.25)mm,优化后抑菌活性提高了0.23倍。
戊糖乳杆菌S1-4所产抑菌物质抑菌效果较好,能抑制多数革兰氏阳性菌和阴性菌的生长,是一株很有开发潜力并代替化学防腐剂的菌株。菌株所产细菌素抑菌谱是反映抑菌范围和能力大小的重要参数。于雷雷等 [21]报道的戊糖乳杆菌素pentocin LPEM818对枯草芽孢杆菌没有抑菌作用,吕燕妮等 [22]报道的戊糖乳杆菌31-1对沙门氏菌和大肠杆菌没有抑制作用,而戊糖乳杆菌S1-4所产抑菌物质对上述菌株均有强烈的抑制作用。可见,戊糖乳杆菌S1-4所产抑菌物质不仅对金黄色葡萄球菌、枯草芽孢杆菌、蜡状芽孢杆菌、单核细胞增生李斯特菌等革兰氏阳性菌有明显抑制作用,同时还对大肠杆菌、沙门氏菌、荧光假单胞菌、绿脓假单胞杆菌、鼠伤寒沙门氏菌这些革兰氏阴性菌也表现出抑菌活性。这与部分文献[23-24]报道一致。综合上述结果可以得出戊糖乳杆菌S1-4所产抑菌物质具有较广泛的抑菌谱,具有作为食品防腐剂的开发与应用前景。
参考文献:
[1] 万素英, 李琳, 王慧君. 食品防腐与食品防腐剂[M]. 北京: 中国轻工业出版社, 1998: 25-84.
[2] OHLSSON T, BENGTSSON N. Minimal processing technologies in the food industry[M]. Boca Raton, USA: CRC Press, 2000: 49-90.
[3] 陈祥奎. 保证食品安全的抗菌剂[J]. 中国食品添加剂, 1995(3): 16-26.
[4] 汤凤霞, 乔长晟. 天然生物食品防腐剂的研究与应用[J]. 世界农业, 2002(2): 34-36. DOI:10.3969/j.issn.1002-4433.2002.02.014.
[5] LASAGNO M, BEOLETTO V, SESMA F, et al. Selection of bacteriocin producer strains of lactic acid bacteria from a dairy environment[J]. Microbiologia, 2002, 25(1): 37-44.
[6] ENNAHAR S, SASHIHARA T, SONOMOTO K, et al. Class IIa bacteriocins: biosynthesis, structure and activity[J]. FEMS Microbiology Reviews, 2000, 24(1): 85-106.
[7] NETTLES C G, BAREFOOT S F. Biochemical and genetic characteristics of food-associated lactic acid bacteria[J]. Food Protection, 1993, 50(4): 338-356.
[8] 宋连花, 王彦文. 乳链菌肽(Nisin)研究进展[J]. 食品研究与开发, 2004, 25(5): 18-21. DOI:10.3969/j.issn.1005-6521.2004.05.006.
[9] BEN-GURION R, HERTMAN I. Bacteriocin-like material produced by Pasteurella pestis[J]. Journal of General and Applied Microbiology, 1958, 19(2): 289-297. DOI:10.1099/00221287-19-2-289.
[10] 陈静, 何连芳, 张玉苍. 嗜酸乳杆菌产细菌素培养基及培养条件 的优化[J]. 中国酿造, 2010(12): 75-79. DOI:10.3969/ j.issn.0254-5071.2010.12.022.
[11] 苏芳, 李莉, 罗斌, 等. 戊糖乳杆菌WH12-2-1产细菌素条件的优化[J]. 中国乳品工业, 2010, 38(3): 10-15. DOI:10.3969/ j.issn.1001-2230.2010.03.003.
[12] 吕燕妮, 李兰平, 周伟. 戊糖乳杆菌31-1菌株产细菌素发酵条件优化[J]. 微生物学通报, 2005, 32(3): 13-19. DOI:10.3969/ j.issn.0253-2654.2005.03.003.
[13] 郭晨, 岳喜庆, 闵钟熳. 产IIa类细菌素乳酸菌生物特性与发酵条件优化[J]. 食品研究与开发, 2011, 32(7): 144-147. DOI:10.3969/ j.issn.1005-6521.2011.07.044.
[14] 沈萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 1999: 214-222.
[15] RIIHINEN K, JAAKLA L, KRENLAMPI S, et al. Organ specific distribution of phenolic compounds in bilberry (Vaccinium myrtillus) and ‘northblue’ blueberry (Vaccinium corymbosum v. angustifolium)[J]. Food Chemistry, 2008, 110: 156-160.
[16] 刘书亮, 张艾青. 植物乳杆菌P158的生长曲线及其细菌素的特性[J].核农学报, 2009, 23(6): 1021-1025.
[17] PARENTE E, RICCIARDI A. Production, recovery and purification of bacteriocins from lactic acid bacteria[J]. Appllied Microbiology and Biotechnology, 1999, 52: 628-638.
[18] 张国强, 师俊玲, 杨自文. 乳酸杆菌SD-22产类细菌素发酵条件的优化[J]. 中国食品学报, 2009, 9(1): 137-142. DOI:10.3969/ j.issn.1009-7848.2009.01.023.
[19] 解俊梅, 文汉. 植物乳酸菌类细菌素特性研究及其产生条件的优化[J]. 食品工业科技, 2011, 32(11): 93-100. DOI:10.13386/ j.issn1002-0306.2011.11.068.
[20] 崔德凤, 周波, 杨桂梅, 等. 产Enterocin E5细菌素粪肠球菌发酵条件的优化[J]. 中国兽药杂志, 2011, 45(3): 13-17. DOI:10.3969/ j.issn.1002-1280.2011.03.004.
[21] 于雷雷, 王超, 施波, 等. 戊糖乳杆菌素pentocin LPEM818的初步纯化及特性研究[J]. 食品与发酵工业, 2013, 39(2): 17-23. DOI:10.13995/j.cnki.11-1802/ts.2013.02.030.
[22] 吕燕妮, 李平兰, 孙成虎, 等. 戊糖乳杆菌31-1菌株所产细菌素的理化及生物学特性[J]. 中国农业大学学报, 2006, 11(1): 39-43. DOI:10.3321/j.issn.1007-4333.2006.01.008.
[23] 张艾青, 刘书亮, 敖灵. 产广谱细菌素乳酸菌的筛选和鉴定[J]. 微生物学通报, 2007, 34(4): 539-542. DOI:10.3969/ j.issn.0253-2654.2007.04.032.
[24] 侯运华, 孔健, 郝运伟, 等. 一株乳酸菌产类细菌素Enteriocin LK-S1的初步研究[J]. 山东大学学报(理学版), 2002, 37(5): 463-466. DOI:10.3969/j.issn.1671-9352.2002.05.022.
Optimal Fermentation Conditions for and Antibacterial Spectrum of Antibacterial Substance Produced by Lactobacillus pentosus S1-4
SU Rina, SHUANG Quan*
(College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010000, China)
Abstract:Using single factor and orthogonal array designs, the optim al fermentation conditions for antibacterial substances produced by Lactobacillus pentosus S1-4 and their antibacterial spectrum were studied. The results showed an inoculum amount of 2.0%, an initial pH of 5.5, and 26 h cultivation at 30 ℃ proved optimal. The average diameter of inhibition zones against Lactobacillus brevis under the optimized culture conditions was (30.08 ± 0.69) mm, and the bacteriostatic activity was increased by 1.23 times over that before optimization. The antibacterial substances produced by Lactobacillus pentosus S1-4 were effective against 12 strains of Gram-positive and Gram-negative bacteria, indicating a wide antibacterial spectrum. In conclusion, S1-4 has potential applications as a bio-preservative to improve the safety of food products.
Key words:Lactobacillus pentosus; antibacterial substance; fermentation conditions optimization
DOI:10.7506/spkx1002-6630-201603021
中图分类号:TS201.3
文献标 志码:A
文章编号:1002-6630(2016)03-0109-05
引文格式:
苏日娜, 双全. 戊糖乳杆菌S1-4产抑菌物质发酵条件的优化及其抑菌谱[J]. 食品科学, 2016, 37(3): 109-113. DOI:10.7506/spkx1002-6630-201603021. http://www.spkx.net.cn
SU Rina, SHUANG Quan. Optimal fermentation conditions for and antibacterial spectrum of antibacterial substance produced by Lactobacillus pentosus S1-4[J]. Food Science, 2016, 37(3): 109-113. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603021. http://www.spkx.net.cn
收稿日期:2015-03-17
基金项目:国家自然科学基金地区科学基金项目(31460443)
作者简介:苏日娜(1989—),女,硕士研究生,研究方向为食品科学。E-mail:surina_nana@128.com
*通信作者:双全(1964—),男,教授,博士,研究方向为食品科学。E-mail:shuangquan@imau.edu.cn