詹少德 1,邱昌将 2,朱 盼 3,吴志华 1,*,陈红兵 1
(1.南昌大学 食品科学与技术国家重点实验室,中德联合研究院,江西 南昌 330047;2.浙江纺织服装职业技术学院,浙江 宁波 315200;3.广东省疾病 预防控制中心,广东 广州 510300)
摘 要:本实验首先从花生中提取总RNA,利用反转录聚合酶链式反应技术克隆了花生过敏原蛋白Ara h 6全cDNA,并以此为模板扩增出Ara h 6目的基因。将目的基因与pMD19-T Simple质粒进行重组后转入BL21(DE3)宿主表达菌中,异丙基-β-D-硫代吡喃半乳糖苷诱导产物表达,并利用镍离子亲和层析纯化表达产物。DNA测序结果显示Ara h 6基因片段全长为438 bp,编码145 个氨基酸,与已知该蛋白DNA序列 97%相同;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果显示表达产物分子质量为24 kD,与融合组氨酸标签的重组Ara h 6蛋白理论分子质量相符;质谱鉴定结果表明重组蛋白的一级结构与天然Ara h 6匹配度为100%;Western blotting结果显示融合蛋白能够为抗Ara h 6多克隆抗体所识别,具有免疫原性。
关键词:花生;过敏原;Ara h 6;基因克隆表达;质谱鉴定
食物过敏是人体对某些食物产生的变态反应,可导致多种临床病症,严重的会引起过敏性休克甚至死亡等 [1-2]。据相关的流行病学研究表明,食物过敏影响约5%儿童及3%~4%成年人的健康,且呈增长趋势 [3]。90%食物过敏反应是由花生、鱼、贝类、奶、蛋、大豆、坚果和小麦等八类高致敏性食物引起 [4]。
花生作为食物配料的应用十分广泛,其研究也一直都受到国内外的广泛关注。目前已发现的花生13 种过敏蛋白中 [5],Ara h 6属于2S白蛋白家族,约占花生蛋白总含量的4.5% [5],其分子质量约为14.5 kD,生物信息学研究发现Ara h 6与花生另一种主要过敏原Ara h 2有59%的氨基酸序列同源性,存在交叉反应,可以协同增加致敏性 [6]。Ara h 6结构包括由10 个半胱氨酸残基构成的5 个二硫键 [7],Ara h 6的线性优势区域集中在肽段AA10~15、45~48、53~60、116~118区域;Ara h 6的构象型表位优势区有4 个,它们存在的区域为AA1~13、35~51、53~59、89~105,而在序列同源性、线性表位和构象型表位上,Ara h 6与Ara I 6、落花生conglutin、Ara d 6和落花生conglutin 8都有很高的相似性,它们之间发生交叉反应的概率高达100% [8-9]。
近年来,Ara h 6已经成为人们研究花生过敏领域的重要方面,而获取高纯度的过敏原是研究其结构和性质的材料基础。当前以生花生为材料进行Ara h 6分离纯化的研究工作较多,如Marsh [10]和罗春萍 [11]等对花生种子进行研磨、粗提、柱层析等步骤纯化出了高纯度的Ara h 6。而作为制备食物过敏原的另一种重要的手段,重组过敏蛋白的研究也越来越受到重视。相比较天然Ara h 6进行规模化和标准化制备会受到材料来源的限制,如不同地区、不同种类花生品种中过敏蛋白含量的差别,重组花生Ara h 6的制备具有更为稳定的材料来源。此外,有大量文献表明 [12-14],重组食物过敏原是天然过敏原的一种替代物,可以应用于食物过敏原的检测以及食物过敏的诊断与治疗等方面,因而重组过敏原Ara h 6的制备工作具有一定实际应用价值。
本实验通过反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)获得花生过敏原Ara h 6蛋白基因,原核表达带有His标签的Ara h 6蛋白,利用镍离子亲和层析(nickel affinity chromatography,Ni-NTA)进行纯化获得融合蛋白,实现了花生过敏原Ara h 6的生物制备。
1.1 材料
花生(江西南昌,湘花品种) 市售。
1.2 兔抗Ara h 6血清的制备
本血清参考罗春萍等 [12]方法自制并保存,效价约为1∶100 000。
1.3 质粒、菌株与试剂
质粒pMD19-T-Simple、大肠杆菌E. coli DH5α、表达菌株BL21(DE3)-RIPL、Taq DNA聚合酶、限制性内切酶BamHⅠ、EcoRⅠ、T4连接酶、DNA Marker(DL2000) 日本TaKaRa公司;RT-PCR cDNA第一链合成试剂盒 德国Qiagen公司;质粒小量提取试剂盒、琼脂糖凝胶回收试剂盒 美国Omega公司;Ni亲和层析预装柱(5 mL)、羊抗兔IgG酶标二抗 美国Sigma公司;硝酸纤维素膜 美国Millipore公司;氨苄青霉素、卡那霉素(kan)、异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG) 南昌精科生物工程有限公司。
1.4 方法
1.4.1 引物的设计合成
根据GenBank已报道的花生过敏原Ara h 6的基因序列,设计好一对扩增引物,为了便于克隆与表达,在上游引物5’端引入了BamHⅠ酶切位点,下游引物5’端引入了EcoRⅠ酶切位点。扩增的目的基因长度为438 bp,对应的蛋白质的理论分子质量约16.9 kD。为了使限制性内切酶能够有效识别酶切位点,切断DNA,分别在上游引物和下游引物的5’端加入CGC和CCG保护性碱基(酶切位点用下划线表示)。上游引物:5’-CGCGGATCCATGGC CAAGTCCACCATCC-3’(BamHⅠ),下游引物:5’-CC GGAATTCTTAGCATCTGCCGCCACTC-3’(EcoRⅠ)。
1.4.2 花生种子总RNA的提取
参照胡纯秋等 [13]的方法进行RNA的提取。
1.4.3 花生Ara h 6基因的RT-PCR扩增
按照Skramo等 [14]的扩增方法,首先进行cDNA的合成,反应体系:10×Reaction Buffer 2.0 øL、MgCl 2(25 mmol/L)4.0 øL、dNTP(10 mmol/L)2.0 øL、Oligo(dT)Primer(0.8 øg/øL)引物2.0 øL、RNase Inhibitor(50 U/øL) 1.0 øL、AMV逆转录酶(≥2.5 U/øL)0.8 øL、无RNase水5.2 øL、总RNA样品3.0 øL。反应条件为:37 ℃孵育60 min,合成cDNA,然后99 ℃变性5 min,最后4 ℃放置5 min。再以此反转录产物为模板进行PCR扩增,扩增条件:95 ℃变性1 min;68.7 ℃退火1 min;73 ℃延伸1 min,共40 个循环,反应体系:10×Reaction Buffer 2.5 μL、dNTP(2.5 mmol/L)2.0 μL、上游引物(25 μmol/L)和下游引物(25 μmol/L)各2.0 μL,cDNA 2.0 μL、ddH 2O 14.2 μL、Taq酶(5 U/μL)0.3 μL。最后以DNA回收试剂盒纯化PCR产物,并1%凝胶电泳对产物进行鉴定。
1.4.4 Ara h 6基因的克隆和测序 [15]
将纯化的PCR产物经琼脂糖电泳鉴定纯度后,与pMD19-T Simple载体连接,并转入经CaCl 2处理的E. coli DH5α感受态细胞,构建克隆载体pMD19-T-Ara h 6,之后再通过含氨苄青霉素的平板过夜培养,筛选阳性克隆子。克隆载体采用EcoRⅠ和BamHⅠ双酶切鉴定,对酶切产物和重组质粒进行1.0%琼脂糖凝胶电泳鉴定。
1.4.5 Ara h 6基因pET-28a表达载体的构建
根据Morris等 [16]的方法,将测序正确的克隆载体及表达载体pET-28a,分别用EcoRⅠ和BamHⅠ 双酶切,之后通过凝胶电泳的方法回收小片段及酶切后的载体。同时使用T4连接酶对两个回收片段进行相互连接,并转入E. coli DH5α感受态细胞后,构建重组表达质粒,通过含卡那霉素的LB平板进行筛选,挑菌扩大培养,提取阳性质粒,进行双酶切鉴定,并将阳性克隆质粒,送交生工生物工程(上海)股份有限公司进行DNA测序,使用DNAMan软件(版本号6.0.3.99)对结果进行序列对比分析。
1.4.6 表达载体在E. coli BL21(DE3)中的表达及检测
表达过程参考Guo等 [17]的方法,具体操作为:将表达载体转入E. coli BL21(DE3)中,转化成功后挑取抗卡那霉素阳性菌落于4 mL LB培养基中,37 ℃振荡过夜培养。第2天取1.5 mL的过夜培养菌液接种于75 mL新鲜培养基中,并继续37 ℃振荡培养,于600 nm波长处测定光密度(OD)值为0.6~0.7,取1 mL菌液作为诱导前的对照,然后加入0、0.05、0.1 mmol/L的IPTG进行诱导。离心分别收集培养2、3、4、9 h的菌体,经磷酸盐缓冲液洗涤3 次后,再用该缓冲液溶解和等体积十二烷基硫酸钠(sodium dodecyl sulfate,SDS)悬浮,100 ℃水浴5 min,SDS-聚丙烯酰胺凝胶电泳(SDS-polyacryl amide gel electrophoresis,SDS-PAGE)检测。
1.4.7 重组产物的纯化
将诱导表达后的重组质粒菌液进行超声波破碎细胞,并在4 ℃、10 000 r/min离心30 min,取上清,选择Ni-NTA纯化目的蛋白,利用亲和柱中镍离子对组氨酸特异亲和作用结合上样蛋白液中的目的蛋白,然后使用咪唑洗脱缓冲液(300 mmol/L)洗脱亲和柱,收集洗脱液,具体方法按照Amersham公司操作手册进行,分别收取洗脱峰液,SDS-PAGE检测纯化结果。
1.4.8 质谱检测重组产物
采用串联质谱对融合蛋白氨基酸序列 [18-19]与天然Ara h 6氨基酸序列进行对比分析。将纯化的重组蛋白进行SDS-PAGE分析,考马斯亮蓝染色,将目的条带割下,加入灭菌蒸馏水,密封,冷冻保存,并送至暨南大学生命与健康工程研究院功能蛋白质中心进行基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of fl ight mass spectrometry,MALDI-TO F/MS)鉴定。
1.4.9 重组产物的Western blotting检测
采用Western blotting将融合蛋白转移到膜上 [20],然后使用抗Ara h 6抗体进行检测,获得融合蛋白与Ara h 6抗体的结合能力,反映出其免疫原性 [21-22]。参考Wang Hua等 [22]的方法,将纯化产物经SDS-PAGE分析后,进行转移电转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,条件为:恒流40 mA,1 h;然后将膜取出,用5%的脱脂乳封阻,37 ℃温育1 h;用TBST洗涤3 次,每次洗涤10 min,加入1∶3 000稀释的兔抗Ara h 6血清将膜浸没,37 ℃温育1 h;洗涤;加入1∶5 000稀释的辣根过氧化物酶(horse radish peroxidase,HRP)标羊抗兔IgG二抗,37 ℃温育1 h;洗涤;最后加入4-氯-1-萘酚显色5 min。
2.1 Ara h 6基因PCR扩增产物、克隆载体、表达载体的鉴定
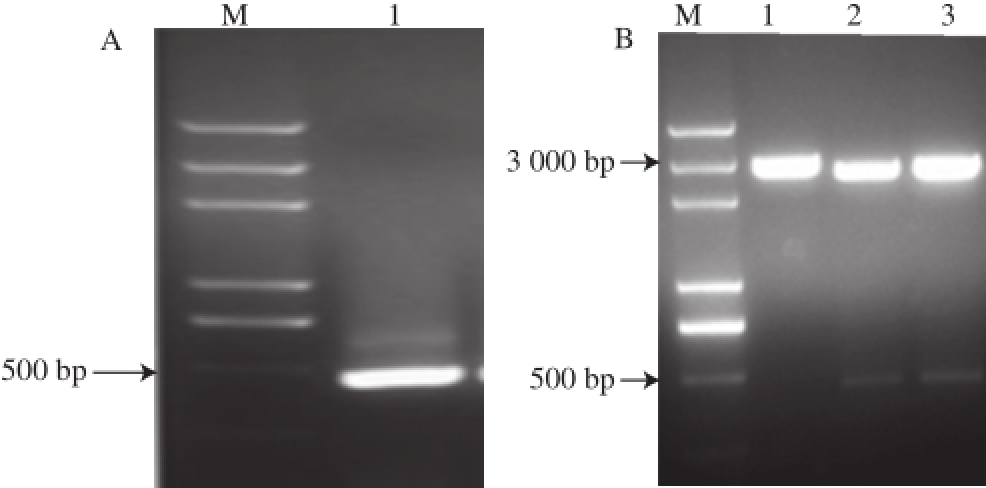
采用1.0%琼脂糖电泳检测Ara h 6基因的RT-PCR的扩增情况,结果如图1A所示,分子质量在500 bp左右出现了一条较为明亮的条带,为目的产物条带,其大小与预计Ara h 6基因大小相符合,初步确定为Ara h 6的cDNA片段,且纯度很高。对构建的pMD19-T-Ara h 6载体进行EcoRⅠ和BamHⅠ酶切鉴定(图1B),结果发现酶切所得的小片段条带与图1A中RT-PCR目的电泳条带一致,分子质量接近500 bp,片段大小正确,另一片段载体大小约为3 000 bp,采用DNAMan软件对送检阳性克隆质粒的基因测序结果进行序列对比分析,结果显示序列与已公布的Ara h 6基因序列相似度为97%,由此可证明基本克隆到正确的Ara h 6基因,进一步证明实验中重组质粒构建成功。

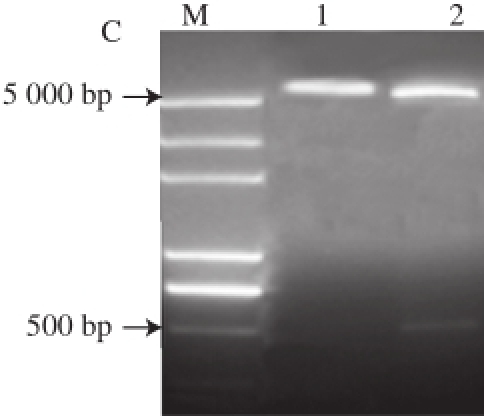
图1 琼脂糖凝胶电泳鉴定Ara h 6a h 6基因表达体系
Fig.1 Agarose gel electrophoresis for identification of the expression system for Ara h 6 gene
M. DL2000 DNA Marker,A. RT-PCR产物电泳结果,泳道1. PCR产物;B. 重组质粒的酶切鉴定,泳道1. pMD19-T-Ara h 6,泳道2和3. pMD19-T-Ara h 6经EcoRⅠ和BamHⅠ双酶切产物;C. pET-28a(+)-Ara h 6表达载体的双酶切鉴定结果,泳道1. pET-28a(+)-Ara h 6,泳道2. pET-28a(+)-Ara h 6经EcoRⅠ和BamHⅠ双酶切产物。
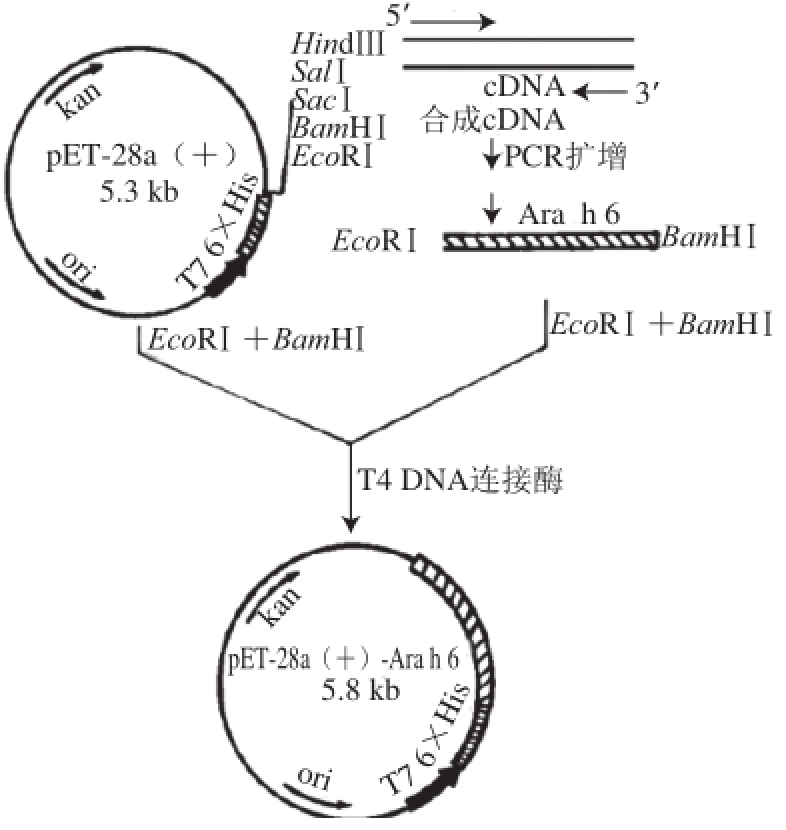
图2 2 Ara h 6a h 6基因表达质粒的构建
Fig.2 Construction of plasmid pET-28a(+)-Ara h 6
使用限制性内切酶EcoRⅠ和BamHⅠ酶切重组表达载体pET-28a(+)-Ara h 6,构建简图见图2。产物经1.0%琼脂糖凝胶电泳鉴定(图1C),切出的两条带中有分子质量接近500 bp大小的酶切片段,与目的基因片段大小相符,另一片段为表达载体大小,可以认为Ara h 6的编码基因正确的融合到表达载体上,无其他的基因插入,表明表达载体构建成功。
2.2 Ara h 6基因的诱导表达及产物纯化
将培养在IPTG 37 ℃、220 r/min诱导表达2、3、4、9 h的菌液进行破碎,并进行SDS-PAGE分析,结果如图3A所示。与未经诱导的对照样相比,含IPTG诱导的样品,在约26 kD处有明显的表达蛋白条带,由于该基因诱导表达的产物连接有pET-28a(+)上的His-Tag,去掉pET-28a(+)载体的N端含有的硫氧环蛋白和His标签,近似为Ara h 6蛋白大小16 kD,与理论值相符。另外,也可以看出使用IPTG诱导时间不同,其表达量也有所不同。通过QuantityOne凝胶成像软件分析结果,显示使用IPTG诱导2 h有明显目的蛋白表达;在诱导4 h后随着时间增加,目的蛋白含量无明显变化。因此可以认为使用0.1 mmol/L IPTG对表达菌进行诱导4 h可以获得较多表达产物。
基于诱导表达的重组Ara h 6蛋白为带有His标签的融合蛋白,利用亲和柱中镍离子对组氨酸特异亲和作用结合上样蛋白液中的目的蛋白,取各洗脱液进行SDS-PAGE分析,结果如图3B所示。使用QuantityOne软件进行灰度扫描分析显示了获得的重组目的蛋白纯度在80%左右。

图3 重组Ara h 6 SDS-PAGE分析
Fig.3 SDS-PAGE of recombinant Ara h 6
M.标准蛋白Marker;A. 重组蛋白Ara h 6的诱导表达产物,泳道1~6分别表示诱导0、2、3、4、4(IPTG用量减为0.05 mmol/L)、9 h,泳道7.包涵体,泳道8.超声破碎后上清液;B. 亲和层析纯化获得蛋白组分SDS-PAGE分析,泳道1.平衡洗脱获得组分,泳道2.特异性洗脱获得组分。
2.3 Ara h 6基因重组产物的鉴定
对融合蛋白样品进行了MALDI-TOF/MS分析,结果见图4。通过对质谱数据进行分析和在数据库中进行检索比对,结果发现本实验纯化所得的蛋白与花生过敏原Ara h 6相匹配,重组蛋白的一级结构与Ara h 6匹配度为100%。
图4 重组蛋白Ara h 6质谱鉴定
Fig.4 MALDI-TOF/MS spectrum of recombinant Ara h 6

图5 重组Ara h 6蛋白Western blotting分析
Fig.5 Western blotting analysis of recombinant Ara h 6
亲和层析纯化的融合蛋白经过转膜之后与兔抗天然Ara h 6血清反应,在目标蛋白处有明显特异性印迹,而与兔阴性血清反应无任何印迹出现(图5),该结果表明该重组蛋白具有免疫原性,保持生物活性。
花生过敏反应是人体对花生过敏原产生的由IgE介导的Ⅰ型超敏反应,对于过敏患者具有终身过敏的特点 [17]。鉴于融合花生过敏蛋白可以作为天然过敏原的一种替代物,特别是用于过敏蛋白标准物的制备,因此研究中获得结构和性质与天然产物高度一致的融合过敏蛋白Ara h 6具有重要的意义。
大肠杆菌表达系统是开发最早、技术最成熟的外源蛋白原核表达系统 [20]。pET系列质粒因其克隆表达融合蛋白的高效性以及带有多种可选择的融合标签,是目前应用最广泛的原核表达载体系统 [23]。pET-28a作为其中一种质粒其效果稳定、灵敏度高尤其表达产物的量多,因此本实验中采用该质粒作为表达载体。本实验利用琼脂糖凝胶电泳分别对RT-PCR扩增的基因产物、克隆载体pMD19-T-Ara h 6以及表达载体pET-28a(+)-Ara h 6进行鉴定(图1),皆可见低于500 bp大小的特异性扩增条带,与目的基因大小符合,表明成功获得Ara h 6基因、Ara h 6克隆载体以及Ara h 6表达载体。基因序列对比进一步确定得到的克隆载体具有正确的Ara h 6基因序列,表明成功构建Ara h 6基因表达体系,为融合Ara h 6蛋白的表达纯化奠定了基础。
本实验选择大肠杆菌BL21(DE3)作为工程菌,并探索IPTG诱导时间对融合蛋白的表达的影响,结果显示0.1 mmol/L IPTG于37 ℃诱导4 h,培养的工程菌可以获得较高量的融合蛋白的表达。表达的融合蛋白因其上携带His的标签,本研究采用Ni-NTA进行亲和纯化,提纯目的蛋白,SDS-PAGE结果显示纯化后的目的蛋白的纯度可达到80%。为进一步确定表达出的融合产物的蛋白的结构,可以选择质谱进行蛋白质结构的检测 [24]。Wu Zhihua等 [25]在融合花生Ara h 1的研究中运用此技术,将表达的融合蛋白与Ara h 1一级结构进行比对,进一步确定表达出融合花生Ara h 1蛋白。本实验中利用质谱对纯化的融合蛋白进行检测,通过与数据库中Ara h 6结构进行比较,结果发现融合蛋白的一级结构与Ara h 6匹配度为100%,这表明研究成功合成融合Ara h 6蛋白。另一方面,Western blotting可以检测抗原抗体之间的特异性结合能力 [26]。选择相应的抗体用来确定过敏原蛋白与之结合能力的强弱,用来反映获得的目的蛋白的生物活性和免疫原性。本实验中以抗Ara h 6兔血清为抗体,检测纯化的融合蛋白与其特异性结合能力,结果发现该融合和蛋白与抗Ara h 6兔血清有很强的结合能力,表明表达的融合蛋白具有非常好的免疫原性。
因此,本研究成功表达出了花生Ara h 6融合蛋白,该融合蛋白与兔抗Ara h 6有较好的特异性结合能力。研究成果对利用融合蛋白进行免疫检测、食物过敏的诊断以及过敏原标准物质的制备有积极的意义。
参考文献:
[1] LIU Zhigang, BAI Yu, JI Kunmei, et al. Detection of dermatophagoides farinae in the dust of air conditioning fi lters[J]. International Archives of Allergy and Immunology, 2006, 144(1): 85-90. DOI:10.1159/000102619.
[2] van REE R, CHAPMAN M D, FERREIRA F, et al. EU Forum: The CREATE Project: development of certified reference materials for allergenic products and validation of methods for their quantifi cation[J]. Allergy, 2008, 63(3): 310-326. DOI:10.1111/j.1398-9995.2007.01612.x.
[3] PANTEGHINI M, BUNK D M, CHRISTENSON R H, et al. Standardization of troponin I measurements: an update[J]. Clinical Chemistry and Laboratory Medicine, 2008, 46(11): 1501-1506. DOI:10.1515/CCLM.2008.291.
[4] BURKS A W, TANG M, SICHERER S, et al. ICON: food allergy[J]. Journal of Allergy and Clinical Immunology, 2012, 129(4): 906-920. DOI:10.1016/j.jaci.2012.02.001.
[5] 隗啸南, 高金燕, 李欣, 等. 花生过敏原蛋白分离纯化方法研究进展[J].食品科学, 2011, 32(17): 371-375.
[6] van WIJK F, NIERKENS S, HASSING I, et al. The effect of the food matrix on in vivo immune responses to purified peanut allergens[J]. Toxicological Sciences, 2005, 86(2): 333-341. DOI:10.1093/toxsci/kfi 187.
[7] 韩远龙, 吴志华, 闫飞, 等. 花生过敏原检测方法研究进展[J]. 食品科学, 2012, 33(13): 305-308.
[8] PEDROSA M, BOYANO-MARTÍNEZ M T, GARCÍA-ARA M C, et al. Importance of Ara h 6 in peanut allergy diagnosis[J]. Clinical and Translational Allergy, 2014, 4(2): 1. DOI:10.1186/2045-7022-4-S2-O16.
[9] 朱盼, 陈红兵, 胡纯秋, 等. 基于表位预测的花生过敏原 Ara h 6免疫交叉反应性研究[J]. 食品科学, 2010, 31(17): 318-322.
[10] MARSH J, RIGBY N, WELLNER K, et al. Purification and characterisation of a panel of peanut allergens suitable for use in allergy diagnosis[J]. Molecular Nutrition & Food Research, 2008, 52(Suppl 2): 272-285. DOI:10.1002/mnfr.200700524.
[11] 罗春萍, 高金燕, 胡纯秋, 等. 花生过敏原Ara h 6的分离纯化及鉴定[J].食品科学, 2010, 31(15): 76-80.
[12] 罗春萍. 热加工, 辐照及超高压微射流对花生过敏原Ara h 6结构与抗原性的影响[D]. 南昌: 南昌大学, 2011.
[13] 胡纯秋, 高金燕, 陈红兵. 一种提取花生种子中总RNA的简易方法[J].食品科学, 2007, 28(10): 373-375.
[14] SKRAMO S, HERSLETH H P, HAMMERSTAD M, et al. Cloning, expression, purification, crystallization and preliminary X-ray diffraction analysis of a ferredoxin/flavodoxin-NADP (H) oxidoreductase[J]. Acta Crystallographica Section F: Structural Biology Communications, 2014, 70(6): 777-780. DOI:10.1002/ mnfr.200700524.
[15] 刘忠芳, 陈林, 殷晓佳, 等. FimH重组蛋白的原核表达及纯化[J]. 口腔医学研究, 2013(10): 893-896.
[16] MORRIS W L, HANCOCK R D, DUCREUX L J M, et al. Day length dependent restructuring of the leaf transcriptome and metabolome in potato genotypes with contrasting tuberization phenotypes[J]. Plant, Cell & Environment, 2014, 37(6): 1351-1363. DOI:10.1111/pce.12238.
[17] GUO R, SHI X, WHITE B, et al. Allergenicity of peanut proteins is retained following enzymatic hydrolysis[J]. Journal of Allergy and Clinical Immunology, 2012, 129(2): AB367. DOI:10.1111/pce.12238.
[18] 马燕林, 马建忠, 王永刚. 拟南芥abi5基因的分子克隆及其在原核细胞中的表达和纯化[J]. 植物生理学报, 2014, 50(2): 185-191.
[19] 何彰华, 王洋, 叶丙雨, 等. 红霉素大环内酯合成通路在大肠杆菌中的重建[J]. 生物工程学报, 2012, 28(2): 222-232.
[20] RAMOS M L, HUNTLEY J J, MALEKI S J, et al. Identification and characterization of a hypoallergenic ortholog of Ara h 2.01[J]. Plant Molecular Biology, 2009, 69(3): 325-335. DOI:10. 1007/ s11103-008-9428-z.
[21] 曾东柱, 李慧, 孔汉金, 等. 多杀性巴氏杆菌HN06株磷酸甘油酸变位酶gpmA基因的序列分析及其原核表达[J]. 中国兽医科学, 2015(1): 57-60.
[22] WANG Hua, FANG Yan, BAO Zhongzan, et al. Identification of a Bombyx mori gene encoding small heat shock protein BmHsp27.4 expressed in response to high-temperature stress[J]. Gene, 2014, 538(1): 56-62. DOI:10.1016/j.gene.2014.01.021.
[23] CHATTERJEE D K, LONGO M C, FLYNN E, et al. Methods of production of proteins: 7,265,206[P]. 2007-09-04.
[24] DELGADO T, VADILLO J M, LASERNA J J. Primary and recombined emitting species in laser-induced plasmas of organic explosives in controlled atmospheres[J]. Journal of Analytical Atomic Spectrometry, 2014, 29(9): 1675-1685.
[25] WU Zhihua, YAN Fei, WEI Xiaonan, et al. Purification and recombinant expression of major peanut allergen Ara h 1[J]. Preparative Biochemistry and Biotechnology, 2015, 45(5): 438-446. DOI:10.1080/10826068.2014.940972.
[26] HARKANY T, HAGNER-McWHIRTER Å. Quantitative Western blotting: improving your data quality and reproducibility[J]. Science, 2015, 347: 1022. DOI:10.1126/science.347.6225.1022-1023.
Gene Cloning and Prokaryotic Expression of Peanut Allergen Ara h 6
ZHAN Shaode
1, QIU Changjiang
2, ZHU Pan
3, WU Zhihua
1,*, CHEN Hongbing
1
(1. State Key Laboratory of Food Science and Technology, Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China; 2. Zhejiang Fashion Institute of Technology, Ningbo 315200, China; 3. Center for Disease Control and Prevention of Guangdong Province, Guangzhou 510300, China)
Abstract:Ara h 6 is one of the major peanut allergens. Ara h 6 cDNA was synthesized from total RNA using Oligo primers by reverse transcription-polymerase chain reaction (RT-PCR) in order to provide a template for the PCR amplifi cation of Ara h 6 gene. The target gene was cloned into pMD19-T vector to construct a recombinant vector. Then the recombinant vector was transferred into the bacterial expression host BL21 (DE3). IPTG was used t o induce protein expression, and the expressed product was purifi ed by Ni affi nity chromatography. DNA sequence analysis showed that the full-length gene fragment of Ara h 6 was 438 bp and encoded 145 amino acids, which was 97% identical to the known DNA sequence. Sodium dodecyl sulfate-polyacryl amide gel electrophoresis (SDS-PAGE) results showed that the molecular weight of the expressed fragment was 24 kD, which matched with the theoretical value of the His-tagged fusion recombinant protein Ara h 6. Mass spectrometric results showed that the matching degree of structure was 100% between the recombinant protein and natural Ara h 6. Western blotting indicated that the protein could be recognized by anti-Ara h 6 polyclonal antibody, and has strong immunogenicity.
Key words:peanut; allergen; Ara h 6; recombinant expression; mass spectrometry
DOI:10.7506/spkx1002-6630-201603024
中图分类号:TS207.2
文献标志码:A
文章编号:1002-6630(2016)03-0125-06
引文格式:
詹少德, 邱昌将, 朱盼, 等. 花生过敏原蛋白Ara h 6基因克隆和原核表达[J]. 食品科学, 2016, 37(3): 125-130. DOI:10.7506/spkx1002-6630-201603024. http://www.spkx.net.cn
ZHAN Shaode, QIU Changjiang, ZHU Pan, et al. Gene cloning and prokaryotic expression of peanut allergen Ara h 6[J]. Food Science, 2016, 37(3): 125-130. (in Chinese with English abstract) DOI:10.7506/spkx1002-6 630-201603024. http://www.spkx.net.cn
收稿日期:2015-03-26
基金项目:“十二五”国家科技支撑计划项目(2011BAK10B03);国家高技术研究发展计划(863计划)项目(2013AA102205);江西省科技支撑计划项目(20133BBF60004)
作者简介:詹少德(1990—),男,硕士研究生,研究方向为食品安全。E-mail:universitync@163.com
*通信作者:吴志华(1976—),男,教授,博士,研究方向为食品科学。E-mail:wuzhihua@ncu.edu.cn