表1 驯化培养基的制备
Table1 Preparation of culture media for domestication of Lactobacillus plantarum

培养基编号123456金银花凉茶添加量/mL01020304050 10 g/100 mL脱脂乳粉液添加量/mL50403020100金银花凉茶含量/%020406080100
陈 康 1,Oh Young Joo 2,李洪军 1,Tae Seok Kim 2,贺稚非 1,*,Ik Hyun Yeo 2
(1.西南大学食品科学学院,重庆 400715;2.韩国圃美多有限责任公司,首尔 120-749,韩国)
摘 要:该研究的目的在于探究植物乳杆菌发酵金银花凉茶的工艺条件。以金银花为原料,通过单因素试验和正交试验,研究植物乳杆菌PMO接种量、发酵温度、发酵时间和糖添加量对金银花凉茶发酵过程的影响,并对发酵工艺条件进行优化。结果表明,植物乳杆菌PMO经过驯化过程,其在金银花凉茶中具有优良的增殖活性;金银花凉茶中绿原酸含量受发酵过程影响较小,始终稳定在29.20 mg/g左右;金银花凉茶最佳发酵工艺条件为植物乳杆菌PMO接种量3%、发酵温度37 ℃、发酵时间14 h、糖添加量7%。
关键词:金银花凉茶;植物乳杆菌PMO;发酵;工艺条件;绿原酸
金银花(honeysuckle)是忍冬科植物忍冬(Lonicera japonica Thunb.)的干燥花蕾及初开的花 [1]。它作为一种“药食同源”的传统中药材,被广泛用于茶饮料生产 [2]。金银花含有绿原酸、木犀草素-7-O-葡糖苷、挥发油、黄酮、皂苷、多糖和多酚化合物,药理学研究表明,金银花具有广泛生物学活性,如抗菌、抗病毒、抗氧化、解热及保肝作用等 [3]。目前,将金银花等原料制作成凉茶已有研究,如林露等 [4]采用金银花、红枣和胖大海等原料配制无糖凉茶饮料,宋照军等 [5]采用金银花、菊花和甘草为原料制作复合保健凉茶饮料等,但是将纯金银花凉茶用于乳酸菌发酵的系统研究还较少。随着乳酸菌应用于饮料加工中的研究日益广泛和深入,寻求将金银花凉茶的营养、保健成分与乳酸菌的保健功能相结合成为可能。
乳酸菌是人体肠道的正常菌群,益于人体健康 [6-7]。乳酸菌具有重要的生理功能,维持肠道菌群的生态平衡、减肥、抗感染及炎症、提高机体免疫力等 [8]。例如Wu等 [9]研究表明,植物乳杆菌C06与薏仁、大豆及牛奶制成发酵饮料,能够显著提高其抗炎效果,其机制是通过阻断核转录因子κB(nuclear factor-kappa B,NF-κB)信号通路,进而减少一氧化氮(nitric oxide,NO)、前列腺素E 2(prostaglandin E 2,PGE 2)和活性氧簇(reactive oxygenspecies,ROS)等炎症因子的释放。将乳酸菌作为微生态制剂应用于金银花凉茶中,不仅能改善凉茶口感单一、颜色单调等缺点,还能赋予金银花凉茶特殊的营养因子,从而增强其保健功效,如调节机体免疫、维持肠道菌群的微生态平衡、改善炎症和感染性疾病等。相较于发酵饮料,尤其在预防感染性疾病等方面的作用为保健凉茶的研发提供了新的思路。本研究针对目前纯金银花凉茶发酵系统研究的空白,以金银花、菊花、夏枯草及鱼腥草为原料,植物乳杆菌PMO为菌种,在单因素试验的基础上,利用正交试验分析法对生产乳酸菌发酵金银花凉茶条件进行优化,旨在开发一款兼具高绿原酸含量和乳酸菌发酵饮料双重优点的发酵凉茶饮料,为拓展乳酸菌应用范围、发酵凉茶的生产及其功能性研究提供技术参考和理论依据。
1.1 材料、菌种与培养基
金银花、菊花、夏枯草及鱼腥草 市售;脱脂奶粉内蒙古伊利实业集团股份有限公司。
植物乳杆菌PMO(Lactobacillus plantarum NO.07)韩国圃美多有限责任公司。
MRS培养基 市售。
1.2 试剂与仪器
绿原酸标准品(纯度≥98%) 上海金穗生物科技有限公司;乙腈、甲醇(均为色谱纯) 国药集团化学试剂有限公司;冰醋酸(色谱纯) 成都市科龙化工试剂厂;其他试剂均为国产分析纯。
DHP-9272型电热恒温培养箱、DHG-9240A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;SS-325型高压灭菌锅 日本Tomy公司;LC-AD型液相色谱仪、SPD-M20A二极管阵列检测器 日本岛津公司;UB-7型pH计 德国Sartorius AG公司;SB-5200DT超声波清洗机 宁波新艺超声设备有限公司。
1.3 方法
1.3.1 工艺流程
原料→洗净→60 ℃烘干至恒质量→按料液比1∶32(m/V)加蒸馏水→在78 ℃浸提71 min→过滤→按比例添加糖源→杀菌→冷却至40 ℃以下接种驯化后的植物乳杆菌PMO→发酵→装罐→成品
1.3.2 操作要点
1.3.2.1 金银花凉茶的制备
选取优质的原料,用蒸馏水洗净并在60 ℃烘干至恒质量,准确按金银花、菊花、夏枯草、鱼腥草质量比为10∶6∶6∶3称量,按料液比1∶32添加水,在78 ℃条件下浸提71 min,浸提2 次,合并2 次浸提滤液,分别加6%糖(葡萄糖与蔗糖质量比为3∶2)于50 mL浸提液中,备用。
1.3.2.2 金银花凉茶加热杀菌
在70 ℃条件下,水浴加热灭菌30 min,以杀灭金银花凉茶中有害微生物。
1.3.2.3 菌种的活化与驯化
在无菌环境下,挑取少量纯菌粉接种于质量浓度为10 g/100 mL的灭菌脱脂乳粉液中,在35 ℃条件下培养活化,并扩大培养3 次。将活化好的菌种接种于不同比例的脱脂乳粉与金银花凉茶的混合液中逐步驯化,见表1。
表1 驯化培养基的制备
Table1 Preparation of culture media for domestication of Lactobacillus plantarum

培养基编号123456金银花凉茶添加量/mL01020304050 10 g/100 mL脱脂乳粉液添加量/mL50403020100金银花凉茶含量/%020406080100
1.3.2.4 接种、发酵和冷藏
将灭完菌的金银花凉茶冷却至40 ℃以下,接入经驯化培养后的植物乳杆菌PMO发酵剂,在37 ℃恒温发酵14 h后置于4 ℃冰箱中冷藏。
1.3.3 金银花凉茶发酵的单因素试验
1.3.3.1 接种量对金银花凉茶发酵的影响
按照1.3.2.1节方法制备金银花凉茶,70 ℃水浴灭菌30 min后,冷却到40 ℃以下,分别按照1%、2%、3%、4%、5%、6%的比例将发酵剂接种于金银花凉茶中,37 ℃恒温培养12 h,然后对发酵凉茶的活菌数、总酸含量、pH值、绿原酸含量及感官评定值进行测定并综合分析,以确定较为适宜的植物乳杆菌PMO的接种量。
1.3.3.2 发酵温度对金银花凉茶发酵的影响
按照1.3.2.1节方法制备金银花凉茶,70 ℃水浴灭菌30 min后,冷却到40 ℃以下,按照3%的比例将发酵剂接种于金银花凉茶中,分别在35、37、39、41、43 ℃条件下恒温培养12 h,然后对发酵凉茶的活菌数、总酸含量、pH值、绿原酸含量及感官评定值进行测定并综合分析,以确定较为适宜的发酵温度。
1.3.3.3 发酵时间对金银花凉茶发酵的影响
按照1.3.2.1节方法制备金银花凉茶,70 ℃水浴灭菌30 min后,冷却到40 ℃以下,按照3%的比例将发酵剂接种于金银花凉茶中,在37 ℃恒温条件下,分别培养8、10、12、14、16、18、20、22、24 h,然后对发酵凉茶的活菌数、总酸含量、pH值、绿原酸含量及感官评定值进行测定并综合分析,以确定较为适宜的发酵时间。
1.3.3.4 糖添加量对发酵的影响
分别准确称取3%、4%、5%、6%、7%、8%、9%、10%的糖(蔗糖与葡萄糖质量比为3∶2)加入50 mL浸提液中,70 ℃水浴灭菌30 min后,冷却到40 ℃以下,按照3%的比例将发酵剂接种于金银花凉茶中,37 ℃恒温培养14 h,然后对发酵凉茶的活菌数、总酸含量、pH值、绿原酸含量及感官评定值进行测定并综合分析,以确定较为适宜的糖添加量。
1.3.4 发酵工艺条件的优化
通过上述单因素试验,确定接种量、发酵温度、发酵时间和糖添加量是影响金银花凉茶发酵的主要因素,故设计L 9(3 4)正交试验,以活菌数和感官评定值确定最优发酵工艺条件。
1.3.5 测定指标及其方法
总酸的测定参考GB/T 12456—2008《食品中总酸的测定》中的电位滴定法 [10];pH值用采用UB-7型酸度计测定;乳酸菌活菌数测定参考GB 4789.35—2010《食品微生物学检验 乳酸菌检验》中的平板计数法 [11];绿原酸含量的测定参考GB/T 22250—2008《保健食品中的绿原酸的测定》中的高效液相色谱法 [12];感官评定值参考GB/T 12315—2008《感官分析》 [13],其感官评分标准见表2。
表2 金银花发酵凉茶感官评定标准
Table2 Sensory evaluation standards for fermented honeysuckle tea

?
2.1 菌种的驯化
驯化是将乳酸菌从纯脱脂乳培养基过渡至纯金银花凉茶中发酵,使乳酸菌逐渐适应其生长环境。由图1可知,随着驯化培养基中金银花凉茶比例的增加,总酸含量和活菌数逐渐下降。脱脂乳粉中富含植物乳杆菌所需要的各种生长因子 [14],而金银花凉茶中相对较少,植物乳杆菌在金银花凉茶中的产酸量和活菌数较难达到脱脂乳粉中的水平。当驯化至4号培养基即在含60%的金银花浸提液培养基中驯化时,植物乳杆菌PMO在培养基中的产酸量和活菌数已经高于驯化前。当驯化至6号培养基时即在100%的金银花浸提液中驯化,植物乳杆菌PMO产酸量为0.53 g/100 g,比驯化前提高了近1 倍;活菌数达4.90×10 7CFU/mL,较驯化前提高了15 倍,表明其在金银花凉茶中具有优良的增殖活性。

图1 驯化培养基的总酸含量(a)和活菌数(b)变化
Fig.1 Changes in acidity (a) and viable count (b) before and after domestication in different culture media
2.2 金银花凉茶发酵的单因素试验结果
2.2.1 接种量对金银花凉茶发酵的影响
乳酸菌接种量在一定范围内能够直接影响其产酸速率。葛磊 [15]研究表明乳酸菌接种量过低,产酸易受抑制且不稳定,易形成不利于乳酸菌生长的环境;接种量适中,有利于菌种的定殖,能够加快产酸速率;接种量超出一定范围时,酸度上升太快,不利于风味物质的形成,从而影响乳酸菌发酵饮料的风味。如图2a所示,随着植物乳杆菌PMO接种量的增加,金银花发酵凉茶的pH值逐渐下降,总酸含量呈上升趋势。可能由于植物乳杆菌PMO接种量的增加,使得初始添加的植物乳杆菌活菌数增加,发酵过程中产酸量也就增加 [16]。如图2b、2c所示,活菌数随着接种量的增加而升高,当接种量为3%时,活菌数趋于平稳并且感官评定值出现最高,而绿原酸作为衡量金银花品质的重要指标 [17],其含量始终稳定在29.20 mg/g左右,因此,不受菌种接种量的变化而影响。综上,当接种量为3%时,菌种产酸速率适中,活菌数较高,既不影响发酵进程,又不影响感官品质,为最佳接种量。
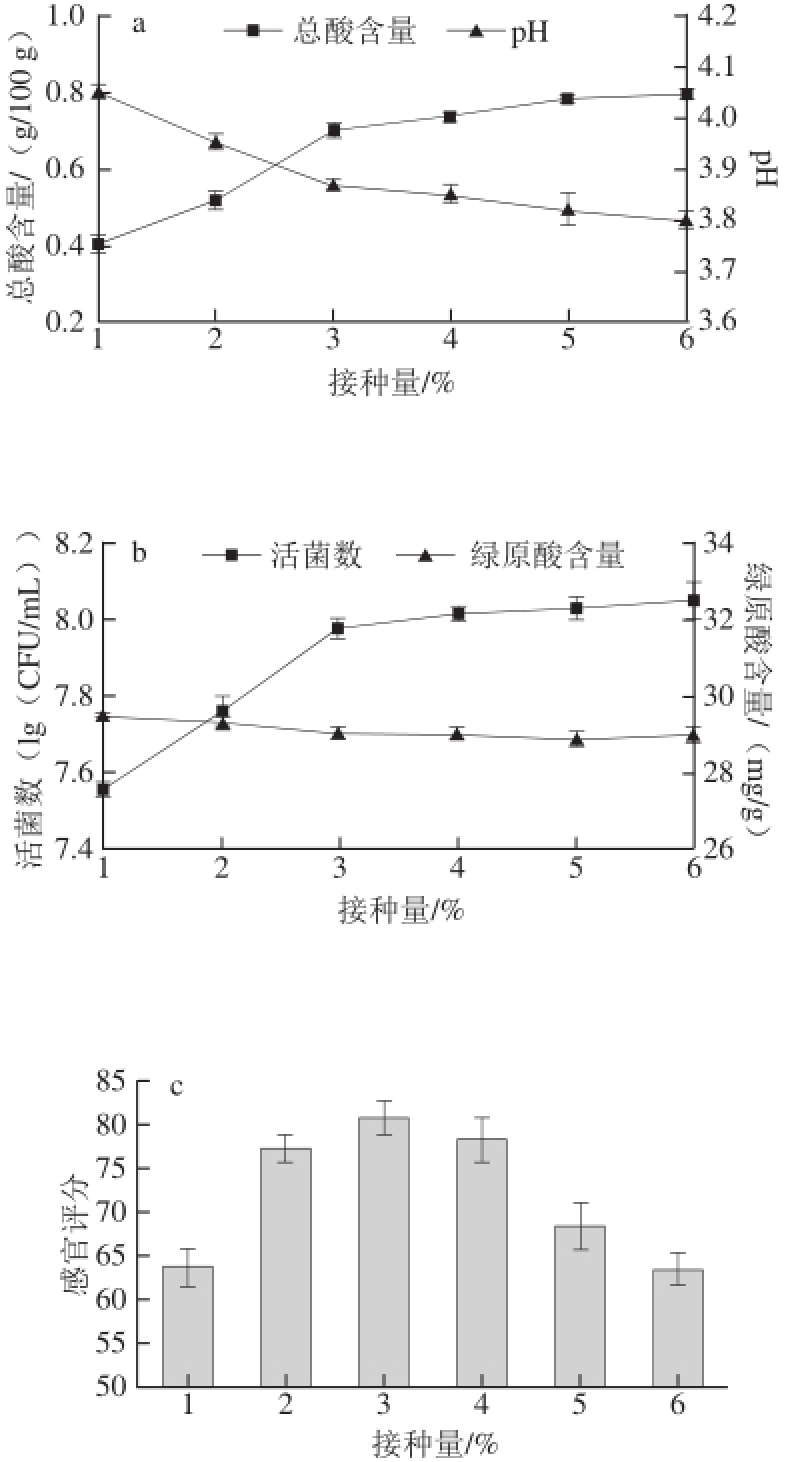
图2 不同接种量对金银花凉茶发酵的总酸含量、pH值(a),活菌数、绿原酸含量(b)和感官评定值(c)的影响
Fig.2 Effect of inoculum amount on acidity, pH (a), viable cell count, chlorogenic acid (b) and sensory evaluation (c)
2.2.2 发酵温度对金银花凉茶发酵的影响


图3 不同发酵温度对金银花凉茶发酵的总酸含量、pH值(a),活菌数、绿原酸含量(b)和感官评定值(c)的影响
Fig.3 Effect fermentation temperature on acidity, pH (a), viable cell count, chlorogenic acid (b) and sensory evaluation (c)
由图3a可知,酸度随着发酵温度的升高呈先升高后降低趋势,pH值则相反。可能原因是,随着发酵温度的增加,植物乳杆菌的代谢旺盛,产酸量增加;当温度过高时,菌种生长缓慢,使其产酸能力下降。由图3b可知,植物乳杆菌PMO的活菌数在35 ℃时出现最高,因为35 ℃较接近乳酸菌生长的最适温度,在发酵凉茶中生长旺盛 [18]。但发酵温度较高时,能够增强乳酸菌的产酸能力,产酸加快,在短时间内能够达到产品所需酸度,缩短发酵时间 [19]。由于绿原酸结构式含有不饱和键,易被氧化分解,绿原酸的含量则随着发酵温度的升高呈缓慢降低的趋势。由图3c可知,37 ℃时,植物乳杆菌PMO发酵金银花凉茶的风味、口感等最佳。综合考虑,37 ℃时,菌种在发酵凉茶中的产酸量适中,活菌数相对较高,并且感官评定值出现最高,为最佳发酵温度。
2.2.3 发酵时间对金银花凉茶发酵的影响
乳酸菌发酵时间对金银花凉茶饮料的品质有较大影响,发酵时间短,产酸不足,口感和风味差;发酵时间长,产酸过多,酸味重。由图4a可知,随着发酵时间的增加,植物乳杆菌不断产酸,造成总酸含量不断上升,pH值不断下降,而发酵液pH值对菌株有较大影响,pH值过低会抑制乳酸菌的生长繁殖 [20]。金银花凉茶经植物乳杆菌发酵24 h后,总酸含量达到1.16 g/100 g,pH值仅为3.67。如图4b、4c可知,金银花凉茶中绿原酸的含量随着发酵后时间的增加呈现稍降低的趋势,活菌数则呈现先升高后平稳的趋势,并在20 h后活菌数出现急剧下降,可能原因是发酵液中营养物质远不如发酵初期充足,植物乳杆菌PMO进入衰亡期,其生长速率低于死亡速率,并且金银花发酵液的低pH值环境在一定程度上抑制了菌种的生长与发酵。在14 h活菌数达到最高,为8.37 (lg(CFU/mL)),此时,金银花发酵凉茶的风味与口感较佳。因此,当发酵14 h时,菌种在发酵凉茶中的产酸量适中,活菌数为最高,并风味与口感较佳,为最佳发酵时间。
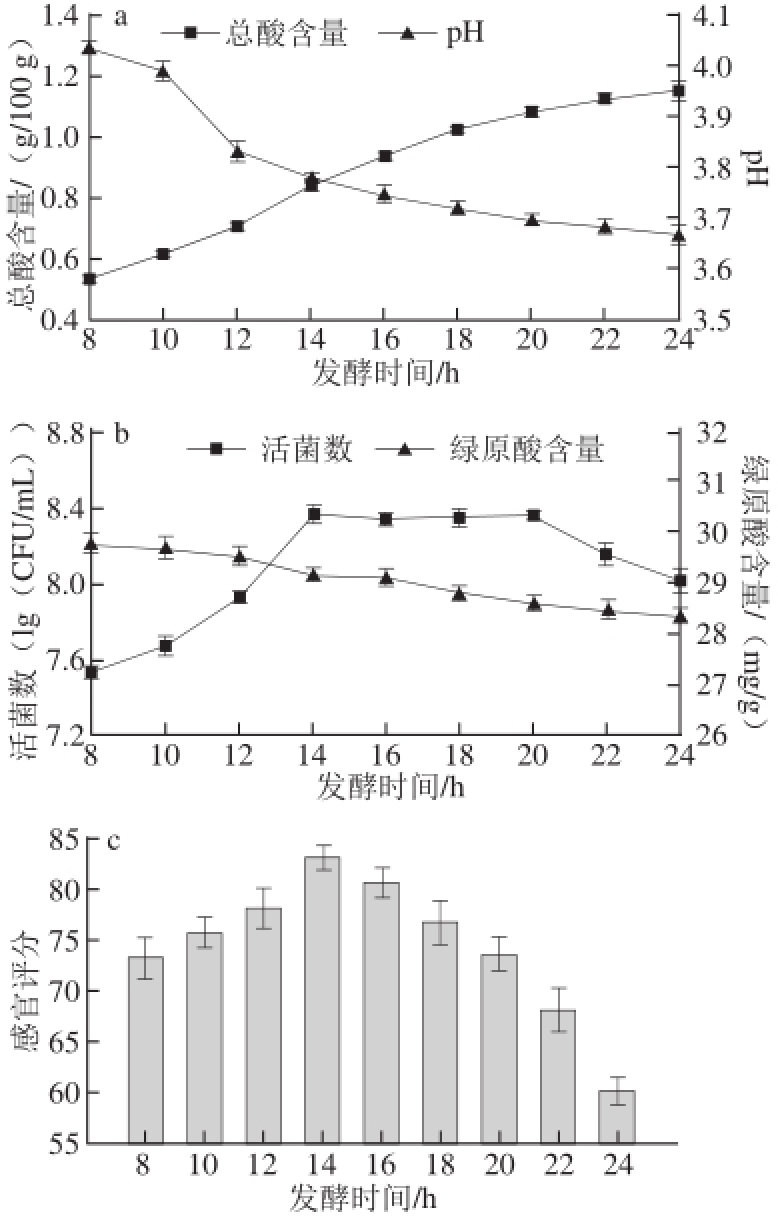
图4 不同发酵时间对金银花凉茶发酵的总酸含量、pH值(a),活菌数、绿原酸含量(b)和感官评定值(c)的影响
Fig.4 Effect of fermentation time on acidity, pH (a), viable cell count, chlorogenic acid (b) and sensory evaluation (c)
2.2.4 糖添加量对金银花凉茶发酵的影响
葡萄糖与蔗糖能够为乳酸菌的生长提供碳源 [21]。同时,蔗糖与饮料中的蛋白质亲和性高,能防止其蛋白质聚沉,从而提高饮料的稳定性。由图5a可知,随着糖添加量的增加,发酵凉茶的酸度呈上升趋势,添加量大于5%时,酸度增加量变缓,添加量大于8%时,产酸量出现下降,可能原因是金银花凉茶中糖的添加量超过一定范围,植物乳杆菌PMO的生长繁殖受到抑制,pH值则呈相反趋势。如图5b、5c可知,植物乳杆菌PMO的活菌数与产酸量趋势一致,绿原酸含量始终稳定在29.20 mg/g左右,因此,不受糖添加量变化的影响。在糖添加量超过7%时,感官评定值呈逐渐下降趋势,饮料口感过甜,风味不加。综上,糖添加量为6%时,产酸量适中,活菌数较高,并感官评定值分别出现最高,为最佳糖添加量。


图5 不同糖添加量对金银花凉茶发酵的总酸含量、pH值(a),活菌数、绿原酸含量(b)和感官评定值(c)的影响
Fig.5 Effect of sugar concentration on acidity, pH (a), viable cell count, chlorogenic acid (b) and sensory evaluation (c)
2.3 发酵工艺条件的优化
表3 金银花凉茶发酵工艺条件正交试验设计及结果
Table3 Orthogonal array design with experimental results for optimization of fermentation conditions for honeysuckle tea
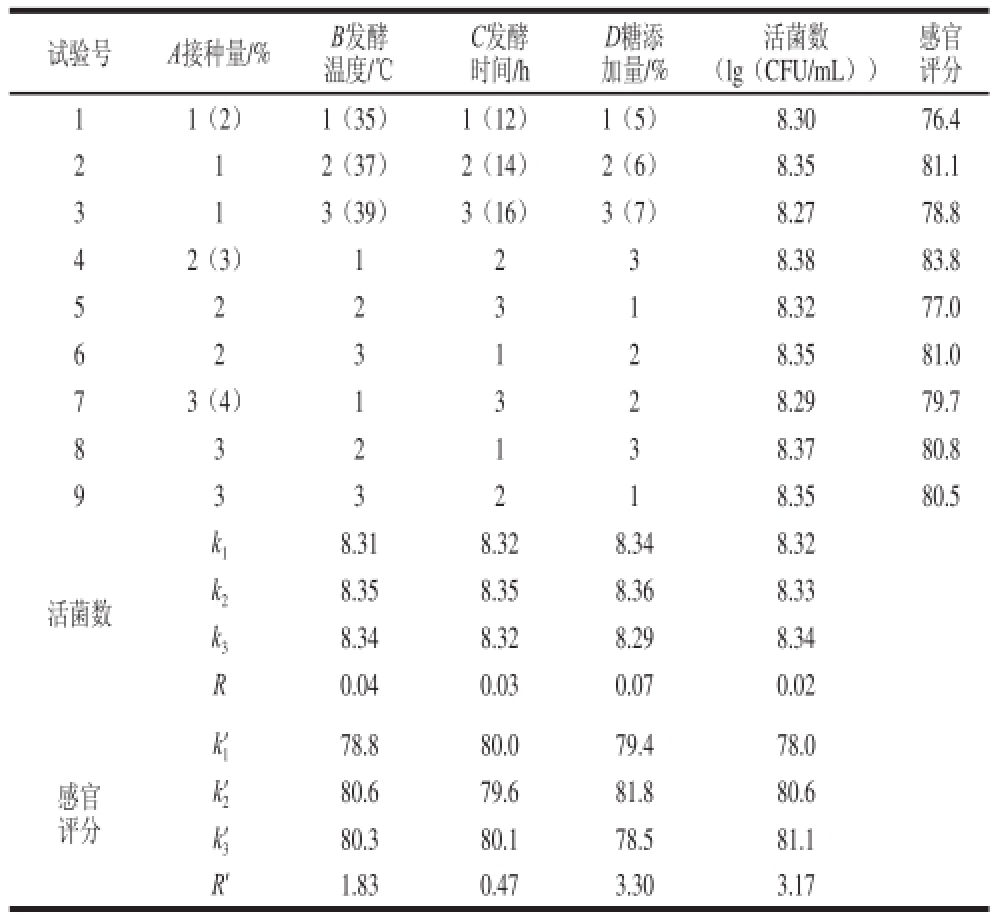
试验号A接种量/%B发酵温度/℃感官评分11(2)1(35)1(12)1(5)8.3076.4 2 12(37)2(14)2(6)8.3581.1 3 13(39)3(16)3(7)8.2778.8 42(3)1238.3883.8 5 2 2 3 1 8.3277.0 C发酵时间/h D糖添加量/%活菌数(lg(CFU/mL))6 8.3581.0 73(4)1328.2979.7 8 3 2 1 3 8.3780.8 2 3 1 2 9 3 3 2 1 8.3580.5活菌数k 18.318.328.348.32 k 28.358.358.368.33 k 38.348.328.298.34 R0.040.030.070.02感官评分k 1’78.880.079.478.0 k 2’80.679.681.880.6 k 3’80.380.178.581.1 R’1.830.473.303.17
以活菌数和感官评定值为正交试验的指标,利用直观分析法,由表3中活菌数极差值大小可知,影响金银花发酵凉茶的因素主次顺序是:发酵时间(C)>接种量(A)>发酵温度(B)>糖添加量(D)。最优配方组合为A 2B 2C 2D 3,即植物乳杆菌接种量3%、金银花凉茶发酵温度37 ℃、发酵时间14 h、糖添加量7%。
由表3中感官评定值极差值大小可知,影响金银花发酵凉茶的因素主次顺序是:发酵时间(C)>糖添加量(D)>接种量(A)>发酵温度(B)。最优配方组合为A 2B 3C 2D 3,即植物乳杆菌接种量3%、金银花凉茶发酵温度39 ℃、发酵时间14 h、糖添加量7%。
由于最优组合A 2B 2C 2D 3和A 2B 3C 2D 3均不在表3的9 组试验中,因此,对两组结果分别进行验证实验,采用最优组合A 2B 2C 2D 3实验,测得金银花发酵凉茶的活菌数为8.41(lg(CFU/mL)),感官评定值为83.4分;而采用最优组合A 2B 3C 2D 3实验,测得金银花发酵凉茶的活菌数为8.29(lg(CFU/mL)),感官评定值为83.8分。因此,最终优化配方组合为A 2B 2C 2D 3,即植物乳杆菌接种量3%、金银花凉茶发酵温度37 ℃、发酵时间14 h、糖添加量7%。
植物乳杆菌PMO经过渐进驯化培养后,在纯的金银花凉茶中的产酸量为0.53 g/100 g,比驯化前提高了近1 倍;活菌数达4.90×10 7CFU/mL,较驯化前提高了15 倍,表明其在金银花凉茶中具有优良的增殖活性。
绿原酸作为衡量金银花品质的重要指标,鉴于此,研究发酵过程对金银花凉茶中绿原酸的影响显得尤其重要。结果表明,绿原酸含量在发酵过程中始终稳定在29.20 mg/g左右,可能原因是植物乳杆菌PMO在金银花凉茶中生长繁殖不能分解利用绿原酸。仅发酵时间和发酵温度会对绿原酸含量造成影响,随着发酵时间和发酵温度的增加呈现稍降低的趋势,可能原因是绿原酸有酯键和不饱和双键,性质不稳定,长时间在光照或高温下容易被氧化分解 [22-23]。
发酵工艺中接种量、发酵温度、发酵时间和糖添加量4 个单因素对金银花发酵凉茶品质包括总酸含量、pH值、活菌数、感官品质皆有影响。在此基础上,设计L 9(3 4)正交试验,以活菌数和感官评定值为正交试验的指标,利用直观分析法,得到最终优化配方组合为植物乳杆菌接种量3%、金银花凉茶发酵温度37 ℃、发酵时间14 h、糖添加量7%,此时,金银花发酵凉茶的活菌数为8.41 (lg(CFU/mL)),感官评定值为83.4 分。
参考文献:
[1] LI J, JIN S, ZU Y G, et al. Rapid preparative extraction and determination of major organic acids in Honeysuckle (Lonicera japonica Thunb.) tea[J]. Journal of Food Composition and Analysis, 2014, 33(2): 139-145. DOI:10.1016/j.jfca.2013.12.007.
[2] WANG X Q, WEI F Y, WEI Z F, et al. Homogenate-assisted negativepressure cavitation extraction for determination of organic acids and flavonoids in Honeysuckle (Lonicera japonica Thunb.) by LC-MS/MS[J]. Separation and Purification Technology, 2014, 135: 80-87. DOI:10.1016/j.seppur.2014.07.046.
[3] HU F L, DENG C H, LIU Y et al. Quantitative determination of chlorogenic acid in Honeysuckle using microwave-assisted extraction followed by nano-LC-ESI mass spectrometry[J]. Talanta, 2009, 77(4): 1299-1303. DOI:10.1016/j.talanta.2008.09.003.
[4] 林露, 谢志镭. 无糖凉茶饮料的生产工艺研究[J]. 食品工业, 2010(2): 73-76.
[5] 宋照军, 蔡超, 刘玺, 等. 金银花·菊花·甘草复合保健凉茶饮料的工艺研究[J]. 安徽农业科学, 2009, 37(24): 11714-11716.
[6] HIRAMATSU Y, SATHO T, HYAKUTAKE M, et al. The antiinflammatory effects of a high-frequency oligodeoxynucleotide from the genomic DNA of Lactobacillus casei[J]. International Immunopharmacology, 2014, 23(1): 139-147. DOI:10.1016/ j.intimp.2014.08.013.
[7] LIU Y W, SU Y W, ONG W K, et al. Oral administration of Lactobacillus plantarum K68 ameliorates DSS-induced ulcerative colitis in BALB/c mice via the anti-inflammatory and immunomodulatory activities[J]. International Immunopharmacology, 2011, 11(12): 2159-2166. DOI:10.1016/j.intimp.2011.09.013.
[8] JANG S E, HAN M J, KIM S Y, et al. Lactobacillus plantarum CLP-0611 ameliorates colitis in mice by polarizing M1 to M2-like macrophages[J]. International Immunopharmacology, 2014, 21(1): 186-192.
[9] WU S J, FANG J Y, NG C C, et al. Anti-inflammatory activity of Lactobacillus-fermented adlay-soymilk in LPS-induced macrophages through suppression of NF-kappa B pathways[J]. Food Research International, 2013, 52(1): 262-268. DOI:10.1016/ j.foodres.2013.02.053.
[10] 中国食品发酵工业研究院. GB/T 12456—2008食品中总酸的测定[S].北京: 中国标准出版社, 2008.
[11] 中国疾病预防控制中心营养与食品安全所. GB 4789.35—2010食品微生物学检验 乳酸菌检验[S]. 北京: 中国标准出版社, 2010.
[12] 中国疾病预防控制中心营养与食品安全所. GB/T 22250—2008保健食品中绿原酸的测定[S]. 北京: 中国标准出版社, 2008.
[13] 中国标准化研究院、北京工商大学、中国人民解放军总后勤部军需装备研究生、今麦郎食品有限公司. GB/T 12315—2008感官分析[S]. 北京: 中国标准出版社, 2010.
[14] 王子娜. 核桃乳酸菌发酵饮料的工艺研究[D]. 北京: 北京林业大学, 2012.
[15] 葛磊. 燕麦发酵饮料的研制[D]. 无锡: 江南大学, 2012.
[16] 李加兴, 孙金玉, 陈双平, 等. 猕猴桃果醋发酵工艺优化及质量分析[J].食品科学, 2012, 33(24): 306-310.
[17] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2010: 205.
[18] 张庆, 王凤, 黄卫宁, 等. 植物乳杆菌发酵对燕麦蛋白溶解度和营养特性的影响[J]. 食品科学, 2011, 32(17): 204-209.
[19] 杜冰, 姜龙波, 刘长海, 等. 木瓜发酵乳酸饮料的研究[J]. 食品科学, 2009, 30(11): 752-755.
[20] 贾慧, 钟思琼, 孙勇, 等. 藏灵菇源乳酸菌复合发酵剂分批发酵条件的优化[J]. 食品科学, 2012, 33(7): 242-246.
[21] 徐安书, 胡敏, 何军. 茎瘤芥叶胡萝卜混合汁复合乳酸菌发酵饮料的研制[J]. 食品科学, 2012, 33(14): 321-325.
[22] 沈奇, 赵厚民, 张卫明, 等. 蒲公英绿原酸提取分离工艺的研究[J].食品科学, 2006, 27(7): 140-144.
[23] 王云峰, 陆兔林, 毛春芹, 等. 通关藤浸膏中绿原酸的稳定性考察[J].中国药房, 2008, 19(12): 916-918.
Development of Honeysuckle Herbal Tea by Fermentation with Lactobacillus plantarum
CHEN Kang
1, OH Young Joo
2, LI Hongjun
1, TAE Seok Kim
2, HE Zhifei
1,*, IK Hyun Yeo
2
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Korea Pulmuone Holdings Co. Ltd., Seoul 120-749, Korea)
Abstract:The purpose of this study was to explore the processing conditions for the production of honeysuckle herbal tea fermented by Lactobacillus plantarum PMO. An orthogonal array design based on single factor experiments was employed to examine the influence of inoculum amount, temperature, time and the concentration of sugar added to aqueous extract of honeysuckle flowers on the fermentation process and optimize the fermentation conditions. Results showed that the domesticated strain of Lactobacillus plantarum PMO grew well in honeysuckle tea. The content of chlorogenic acid in honeysuckle tea was little affected by the fermentation process, where it always remained at approximately 29.20 mg/g. The optimal fermentation conditions were determined as fermentation of honeysuckle extract containing 7% sugar added at 37 ℃for 14 h with an inoculum amount of 3%.
Key words:honeysuckle tea; Lactobacillus plantarum PMO; fermentation; processing condition; chlorogenic acid
DOI:10.7506/spkx1002-6630-201603025
中图分类号:TS275.2
文献标志码:A
文章编号:1002-6630(2016)03-0131-06
引文格式:
陈康, Oh Young Joo, 李洪军, 等. 金银花乳杆菌发酵凉茶的研制[J]. 食品科学, 2016, 37(3): 131-136. DOI:10.7506/ spkx1002-6630-201603025. http://www.spkx.net.cn
CHEN Kang, OH Young Joo, LI Hongjun, et al. Development of honeysuckle herbal tea by fermentation with Lactobacillus plantarum[J]. Food Science, 2016, 37(3): 131-136. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603025. http://www.spkx.net.cn
收稿日期:2015-02-10
基金项目:西南大学国际合作项目(20131220);国家自然科学基金面上项目(31071566)
作者简介:陈康(1989—),男,硕士研究生,研究方向为食品微生物与发酵工程。E-mail:445684997@qq.com
*通信作者:贺稚非(1960—),女,教授,博士,研究方向为食品微生物学与食品安全。E-mail:zfhe2003@aliyun.com