孙 晔,顾欣哲,王振杰,胡鹏程,屠 康,潘磊庆*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:利用高光谱成像系统获取真菌在马铃薯葡萄糖琼脂板上培养期间的高光谱图像,采用400~1 000 nm全波段光谱响应值,并计算全波段的平均值、波峰7 16 nm处的光谱值和全波段内光谱值第1主成分的得分值,利用这3 种参数计算方法构建真菌生长模拟模型。结果表明,3 种方法建立的模型测试集的决定系数(R 2)为0.722 3~0.991 4,均方误差和均方根误差分别为2.03×10 -4~5.34×10 -3、0.011~0.756。建立的生长模型与传统菌落计数法建立的生长模型之间的相关系数为0.887~0.957。另外,主成分分析和偏最小二乘法判别分析可以区分3 种不同菌种。其中,偏最小二乘法判别分析模型对 培养36 h的3 种真菌及对照组的区分准确率为97.5%。 高光谱图像技术能够用来对真菌生长进行模拟和真菌的种类区分。
关键词:腐败真菌;高光谱图像;生长拟合;偏最小二乘法判别分析;区分
在水果的采后运输及贮藏过程中由腐败真菌引起的腐烂会造成巨大的经济损失,并且会危害消费者的健康。由真菌引起的采后病害主要有:灰霉病、根霉病、炭疽病等。灰葡萄孢霉能损伤花和果实,在病害处长出一层灰色菌斑,在个别果实发病后,会导致周围完整果实发病 [1-2]。匍枝根霉能在空气、土壤和各种工具的表面存活,并极易感染受损伤的水果 [3],然后在水果上生长成熟,并产生子囊孢子和孢子感染周围的正常水果。炭疽菌会在病果表面形成棕色同心圆 [4]。为了减少经济损失,提高水果的质量和安全,水果中腐败真菌的生长检测尤为重要。
目前,已有相关文献报道了与食品安全相关的微生物统计模型。预测微生物学一般涉及数学、微生物学及化学工程学等相关学科,用以开发出相关数学模型来预测特定环境下的微生物生长 [5]。微生物的生长模型描述了微生物数量与生长时间之间的数学公式或数学函数 [6]。在特定的培养条件下,传统的微生物初级模型主要描述微生物的总活菌数、毒数、代谢物等与生长时间的关系,微生物的二级模型主要解决微生物的延滞期长短、最大生长速率等微生物生长信息 [7-8]。上述传统的微生物建模技术需要检测微生物总活菌数、毒素、代谢物等,检测步骤繁琐、耗时耗力,而且需要破坏样本,因此亟需开发一种快速无损的方法,为腐败真菌的监测和控制提供支持。高光谱图像是新一代光电检测技术,集成了光谱检测和图像检测的优点,具有超多波段、光谱高分辨率和图谱合一的特点,可以获得系列波长下的光谱和图像信息 [9-10]。目前已有少量研究利用光谱学等非破坏性技术实现简单、快速的方法来检测真菌和毒素污染的谷物 [11]。微生物生长过程中的颜色、形状、培养基的化学成分等都会影响光谱吸收,因此,能通过光学技术检测微生物生长。Delwiche等 [12]利用高光谱图像技术检测被污染的小麦,通过选取近红外波长处的两个波段用来分离被链格孢霉污染的小麦粒。Gómez-Sanchis等 [13]研究发现高光谱图像技术能够检测由青霉引起的柑橘类的损伤点。del Fiore等 [11]利用高 光谱图像技术检测玉米黄曲霉毒素的早期污染。综上所述,高光谱图像技术能够用于微生物的检测。
目前,还没有关于利用高光谱图像技术模拟真菌生长及类型区分的报道。本研究选取了3种典型的果蔬采后腐败真菌作为研究对象,即灰葡萄孢霉(Botrytis cinerea)、匍枝根霉(Rhizopus stolonifer)、炭疽菌(Colletotrichum acutatum),以期利用高光谱图像建立3 种腐败真菌的较佳生长模型,并且利用光谱响应构建真菌类型区分的模型。
1.1 菌种与培养基
灰葡萄孢霉(Botrytis cinerea)、匍枝根霉(Rhizopus stolonifer)、炭疽菌(Colletotrichum acutatum)由南京农业大学食品科技学院实验室提供。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,组分为马铃薯浸粉5 g、葡萄糖20 g、NaCl 5 g、琼脂15 g、氯霉素0.1 g,水1 000 mL,pH 5.8~6.2。每个培养皿含有的培养基体积为(20±2) mL,培养基厚度为(2.5±0.5) mm。
将保藏的3 种菌分别接种到PDA培养基上,在28 ℃、75%相对湿度条件下活化7 d,重新接种进行二次培养。1 周后,对二次培养的菌种用无菌水反复冲洗,制成菌悬浮液,将一滴菌液滴到血球计数板上,在显微镜下计数。根据计数,进行换算得出菌液浓度,并稀释至浓度为4×10 4CFU/mL的菌悬液,然后进行样本制备。
1.2 仪器与设备
本实验采用高光谱图像系统装置,包括ImSpector V10E型成像光谱仪 芬兰Specim公司;Bobcat ICL-1620型CCD摄像机、EKE-ER型功率可调卤钨灯(0~150 W)、移动平台、图像采集软件 台湾五铃光学股份有限公司。
1.3 样本制备与分组
共制备660 个培养基,对照组设150 个培养基样本(CK);匍枝根霉(R. stolonifer)、炭疽菌(C. cutatum)组各150 个;灰葡萄孢霉组(B. cinerea)210 个。其中,匍枝根霉和炭疽菌各培养48 h,而灰葡萄孢霉生长较为缓慢,为得到其完整的菌落生长曲线图,培养时间为72 h。培养过程中,各组每12 h(0、12、24、36、48、60、72 h)取出30 个培养基样本进行高光谱检测和菌落数计算。
1.4 高光谱图像采集
高光谱图像检测系统采用反射模式获取各组真菌培养基高光谱图像。为避免外界光线对光谱采集的影响,检测装置整体置于暗箱中,背景为黑色,不反光 [14-15]。高光谱成像单元包括一个CCD摄像机,一个成像光谱仪(分辨率2.8 nm),有效波长范围为400~1 000 nm。实验参数为:相机镜头和线光源距离样本分别为30 cm和20.5 cm,光照强度为67.5 W,以45 °对准样本,曝光时间为4 ms、输送速率为2.5 mm/s。
将培养基放置于移动平台上,运行高光谱图像系统采集样本的高光谱图像信息,分别采集到的是400~1 000 nm之间共420 个波长处的图像。当次检测完后,将用过的样本丢弃。实验中共获得660 个样本的高光谱图像数据。由于相机暗电流的存在和外界因素的影响,图像含有一定噪声,需要对获得的高光谱图像进行校正。用黑色不透明的镜头盖盖在相机镜头上可以全黑的反射图像,采集聚四氟乙烯白板(反射率99%)得到白色反射图像 [16-17]。根据如下公式计算出校正后的相对图像R c。校正后的图像被用来提取光谱信息,选择有效的波段,建立最佳的拟合模型和区分真菌的不同生长阶段。高光谱图像校正公式为:
式中:R 0为原始高光谱透射图像;D为用黑色不透明的镜头盖盖在相机镜头上得到的全黑的标定图像;W为用聚四氟乙烯白板(反射率99%)得到的全白标定图像;R c为标定后高光谱透射图像。
1.4 菌落计数
高光谱图像采集后,立即对每个平板参照GB 4789.15—2010《食品安全国家标准 食品微生物学检验 酵母和霉菌计数》方法进行菌落计数 [18],取平均值。1.5 数据处理
将获取的高光谱图像信息利用ENVI 4.8系统软件、MATLAB7.1统计工具箱和SPSS 18.0软件处理,用于高光谱图像对3 种真菌的生长预测及3 种菌的区分。
ENVI(The Environment for Visualizing Images)是由遥感领域的科学家开发的一套功能强大的、完整的遥感图像处理软件。如今凭借其各种各样的影像处理和信息提取工具,ENVI已经是高光谱图像处理的必备软件,其中的波谱分析工具能够快速准确地从高光谱影像中提取各种目标信息 [19-20]。利用ENVI软件,选择培养基中菌落生长的地方大小约1 000 个像素点的区域做感兴趣区域;在早期阶段,菌落没有长出时选取培养基中间部分。计算高光谱图像ROI区域平均光谱值。光谱波段范围为400~1 000 nm,共有420 个波段。实验中采用3 种方法提取高光谱图像特征信息,方法Ⅰ为全波段400~1 000 nm光谱响应的平均值;方法Ⅱ为波峰处的光谱值;方法Ⅲ为400~1 000 nm波段内光谱值第1主成分的得分值。
将每种菌各个时间点的30 个样本随机选取20 个作为训练集,取平均值进行建模拟合,剩下10 个作为测试集。通过MATLAB7.1软件建立腐败真菌随光谱值变化的生长曲线 [21-22]并利用Gompertz模型 [23-24]以拟合3 种菌的生长。通过模型的决定系数(R 2)、均方误差(sum of the squared errors,SSE)及均方根误差(root mean square error,RMSE)来评判模型的拟合性能。高光谱参数建立的生长模型与传统菌落计数法建立的生长模型之间的相关系数来评价模型准确性。
由于高光谱图像数据包含了大量的冗余信息,因此可以利用主成分分析(principal compenent analysis,PCA)将数据降维,以消除重叠信息。PCA将方差的大小作为衡量信息量多少的标准,认为方差越大提供的信息越多,反之提供的信息就越少。其基本思想是通过线形变换保留方差大、含信息多的分量,丢掉信息量少的方向,从而降低数据的维数。在光谱的判别分析中,偏最小二乘判别分析法(partial least squares-discriminant analysis,PLS-DA)是常用的一种方法,PLS-DA法是基于PLS回归的一种判别分析方法,在构造因素时考虑到了辅助矩阵以代码形式提供的类成员信息 [25]。本实验中,利用PCA的结果来区分不同真菌,PLS-DA建立判别模型,区分3 种真菌及对照组。
2.1 不同生长阶段腐败真菌的高光谱图像
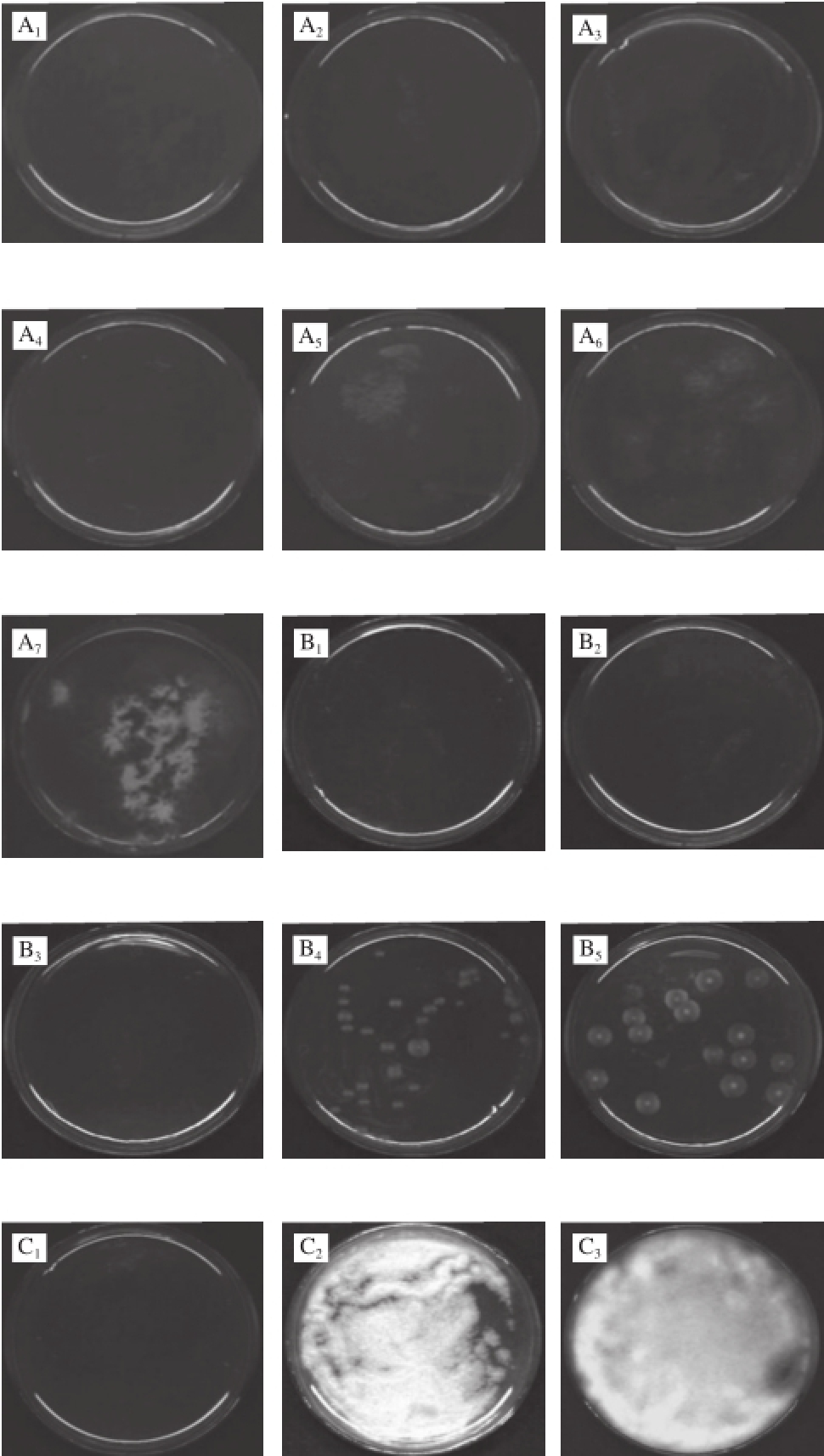
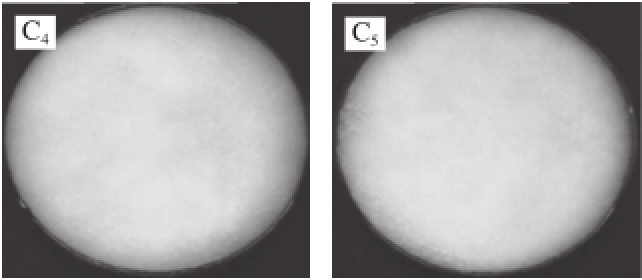
图1 不同菌种的高光谱图像
Fig.1 Typical reflectance hyperspectral images of different fungi
A. 灰葡萄孢霉(B. cinerea),下脚标1~7.培养时间 分 别为0、12、24、36、48、60、72 h;B. 炭疽菌(C. acutatum),下脚标1~5.培养时间分别为0、12、24、36、48 h;C. 匍枝根霉(R. stolonifer),下脚标1~5.培养时间分别为0、12、24、36、48 h。
图1是高光谱图像技术采集的不同真菌RGB图像,其中R为662 nm波长处图像,G为554.5 nm波长处图像,B为450 nm波长处图像。可以看出匍枝根霉生长最快,在第24小时菌丝已遍布平板,在第36小时平板上已完全长满菌丝。灰葡萄孢霉生长最慢,到36 h才能用肉眼观察到菌丝。炭疽菌的菌落呈现光滑圆形,到24 h才能用肉眼观察到菌落。3 种真菌在检测期间菌丝呈现白色,属于生长早期,在生长中后期,不同菌种会产生各自的特征颜色。
2.2 不同真菌的光谱特征

图2 不同菌种的光谱特征
Fig.2 Average original spectra of fungi
A.灰葡萄孢霉(B. c i n e r e a);B.炭疽菌(C. acutatum);C.匍枝根霉(R. stolonifer)。图3同。
图2为灰葡萄孢霉、炭疽菌、匍枝根霉在不同培养时间的典型反射光谱图。在400~1 000 nm的波长范围内,3 种菌的光谱值随时间的延长都是呈上升趋势,最大反射光谱值出现在波长为716 nm处的波峰。由于3 种真菌在生长早期菌丝呈现白色,随着时间的推移,白色菌丝更明显,对光的反射也就更大,光谱值随着生长时间的延长而增大。如图2A所示,灰葡萄孢霉的光谱响应值从48~60 h有一个较大的升高,这是由于菌落在此阶段达到对数生长期,生长迅速。同样,炭疽菌(图2B)及匍枝根霉(图2C)分别在24~36、12~24 h迅速升高。由此可看出光谱值的变化反映了真菌的生长状态。
2.3 真菌生长模型的拟合
2.3.1 基于菌落计数法对3 种真菌生长模型的拟合

图3 传统菌落计数法建立的生长模型
Fig.3 Growth curve of colony-forming unit versus culture time
由图3A可知,通过国标法检测得到的灰葡萄孢霉7 个生长阶段的菌落数分别为:4.0×10 4、9.0×10 4、2.5×10 5、1.5×10 6、1.3×10 7、3.0×10 7、4.0×10 7CFU/mL;炭疽菌的菌落数分别为:4×10 4、5×10 5、3.5×10 7、8×10 8、1.5×10 9CFU/mL(图3B);匍枝根霉的菌落数分别为:4×10 4、4.5×10 6、9.5×10 7、3.3×10 8、7×10 8CFU/mL(图3C)。3 个模型拟合的决定系数分别为:0.997 5、0.999 5、0.984 1,SSE分别为:2.268×10 -2、8.62 ×10 -3、0.191 1,RMSE分别为:0.106 5、0.061 2、0.288 2,由此可知模型与数据拟合较好。
2.3.2 高光谱图像特征参数对3 种真菌生长模型的拟合利用1.5节所述的3 种方法处理的高光谱图像数据,将得到的3 种参数分别对3 种真菌建立生长模型,所得生长模型如图4所示,模型相关参数见表1。
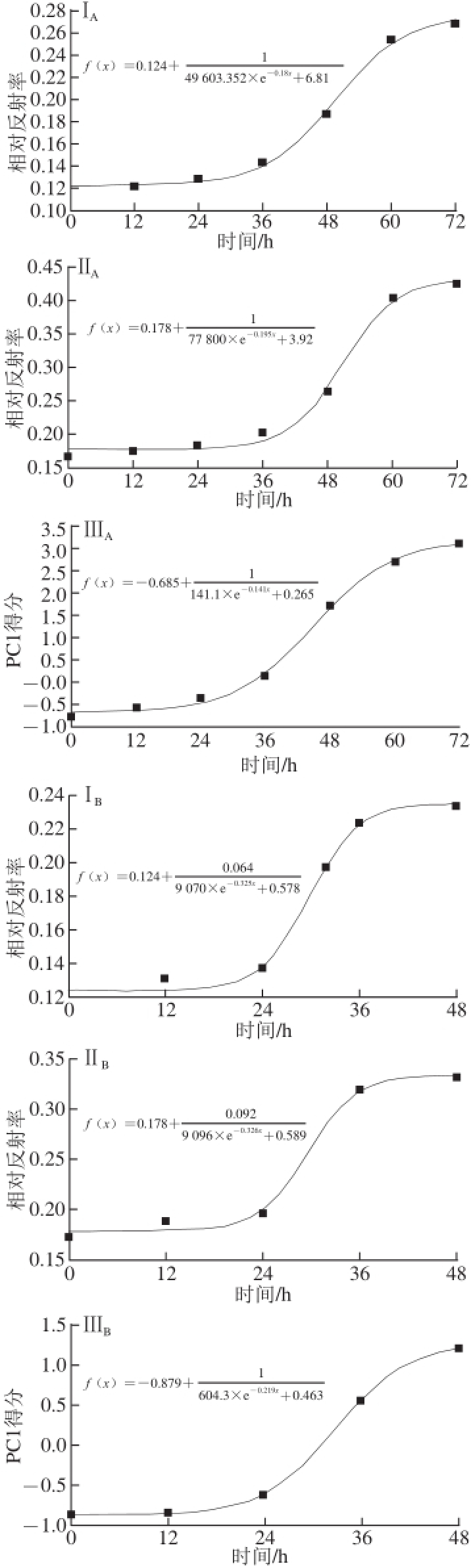
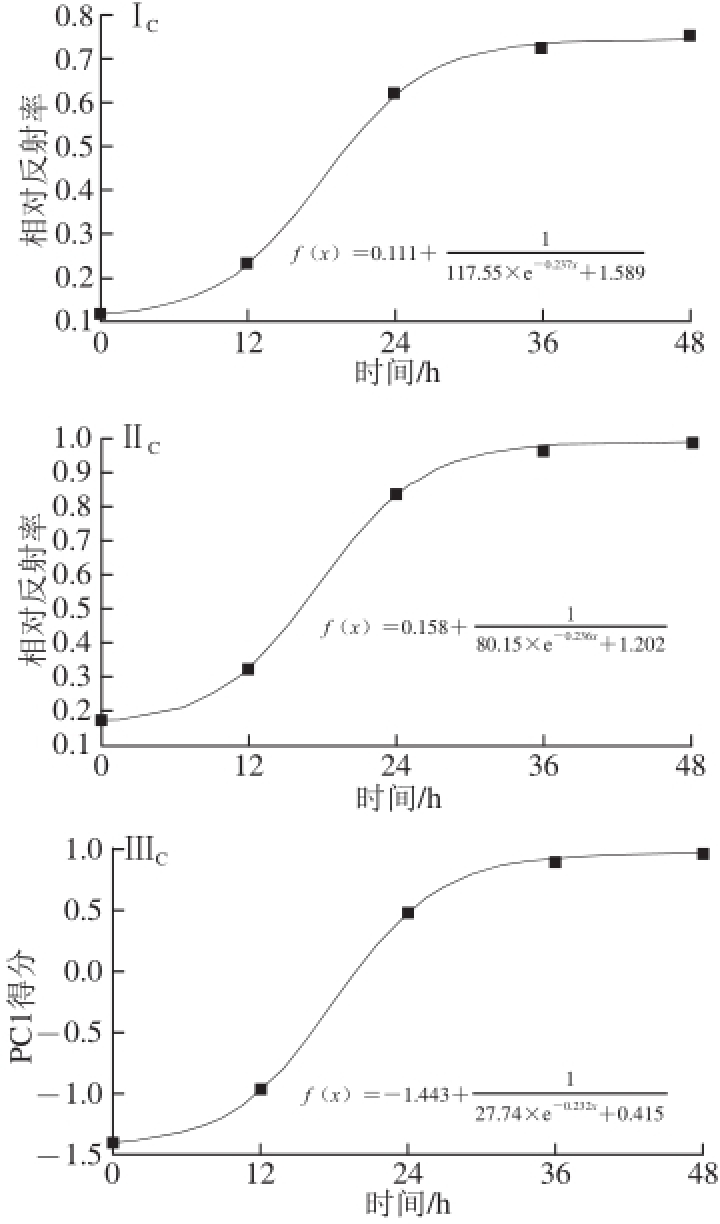
图4 高光谱参数建立的生长模型
Fig.4 Growth curves of fungi established by Matlab
Ⅰ.全波段光谱响应的平均值;Ⅱ.波峰处光谱响应值;Ⅲ.全波段PC1贡献率;下脚标A、B、C分别为灰葡萄孢霉(B. cinerea)、炭疽菌(C. acutatum)、匍枝根霉(R. stolonifer)。
图4Ⅰ A、4Ⅱ A、4Ⅲ A是灰葡萄孢霉的生长拟合曲线及方程。图4Ⅰ A是利用全波段光谱响应平均值(方法Ⅰ)得到的拟合方程及生长曲线,训练集与测试集R 2、SSE、RMSE分别为0.995 9、0.99×10 -4、0.007和0.722 3、53.40×10 -4、0.023。图4Ⅱ A是由716 nm波长处的波峰光谱值(方法Ⅱ)建立生长曲线及拟合方程,训练集的R 2高达0.994 8,SSE、RMSE分别为3.79×10 -4、0.011。测试集R 2、SSE、RMSE分别为0.791 0、3.34×10 -4、0.057。方法Ⅲ将400~1 000 nm波长范围的光谱响应值进行主成分分析,得到的前3 个主成分贡献率分别为90.2%、6.9%、0.9%,选取主成分1(PC1)建模,各时间点得到的PC1得分为:-0.789、-0.598、-0.372、0.123、1.692、2.701、3.003,得到的拟合模型如图4Ⅲ A所示,训练集的R 2、SSE、RMSE分别为0.997 9、3.3 4×1 0 -2、0.1 0 6,测试集分别为0.7 8 9 7、4.65×10 -4、0.254。由表1中3 个模型测试组的R 2及SSE可知,模型拟合效果均一般,其中方法Ⅱ利用波峰光谱值建模测试集的R 2最高(R 2=0.791 0),因此方法Ⅱ模拟效果最好。3 种高光谱参数建立的生长模型与传统菌落计数法建立的生长模型之间的相关系数分别为:0.898、0.941、0.932,相关性均高于0.89,说明以高光谱参数建立的生长模型具有较高的准确性,其中以方法Ⅱ建模的相关性最高。
图4Ⅰ B、4Ⅱ B、4Ⅲ B是炭疽菌的生长拟合曲线及方程。方法Ⅰ利用5 个时间点全波段的光谱平均值建立了生长模型,训练集与测试集的参数R 2、SSE、RMSE分别为0.990 3、1.67×10 -4、0.025和0.936 7、8.77×10 -4、0.756。方法Ⅱ选取716 nm波长处的波峰光谱值建模,训练集的R 2高达0.993 9,SSE、RMSE为1.48×10 -4、0.014,模型拟合效果好,测试组的R 2、SSE、RMSE分别为0.936 8、7.74×10 -4、0.044,由此可知该模型能较好地模拟炭疽菌的生长。方法Ⅲ将400~1 000 nm处的光谱响应值进行主成分分析,得到的前3 个主成分贡献率分别为97.8%、1.1%、0.4%,选取PC1建模,各时间点得到的PC1得分为:-0.877、-0.856、-0.602、0.569、1.207,得到的拟合模型如图4Ⅲ B所示,训练集的R 2、SSE、RMSE分别为0.981 3、6.82×10 -2、0.261,测试集分别为0.868 7、1.48×10 -3、0.504。如表1所示,炭疽菌3 种模型测试组的R 2及SSE可知,模型拟合效果均较好,其中方法Ⅱ利用波峰光谱值建模的测试集R 2最大(R 2=0.936 8),SSE及RMSE最小,说明利用波峰建模模拟效果最好。另外,3 种高光谱参数建立的生长模型与传统菌落计数法建立的生长模型之间的相关系数分别为:0.899、0.900、0.887,方法Ⅱ的相关系数为3 种方法中最大,说明方法Ⅱ利用波峰光谱值建模具有较高的准确性。
图4Ⅰ C、4Ⅱ C、4Ⅲ C是匍枝根霉的生长拟合曲线及方程。图4Ⅰ C是利用全波段光谱响应平均值(方法Ⅰ)得到匍枝根霉的拟合方程及生长曲线,训练集与测试集的R 2、SSE、RMSE分别为0.999 6、1.23×10 -4、0.013和0.981 5、3.76×10 -4、0.019。图4Ⅱ C是选取716 nm波长处的波峰光谱值(方法Ⅱ)建立的生长曲线及拟合方程,训练集的R 2高达0.996 0,SSE、RMSE分别为2.48×10 -4和0.016,测试集的R 2、SSE、RMSE为0.991 4、2.03×10 -4、0.011。方法Ⅲ将400~1 000 nm波长范围内的光谱响应值进行主成分分析,得到的前3 个主成分贡献率分别为99.7%、0.2%、0.05%,选取PC1建模,各时间点得到的PC1得分为:-1.406、-0.979、0.476、0.894、0.989。得到的拟合模型如图4Ⅲ C所示,训练集的R 2、SSE、RMSE分别为0.999 6、1.82×10 -3、0.043,测试集分别为0.990 6、3.32×10 -4、0.129。由表1可知,匍枝根霉3 个模型测试组的R 2均在0.98以上,SSE及RMSE都较小,可知模型拟合效果很好,其中方法Ⅱ利用波峰建模得到的测试集R 2最大(R 2=0.991 4),SSE和RMSE最小(SSE=2.03×10 -4,RMSE=0.011),可知方法Ⅱ模拟效果最好。3 种高光谱参数建立的生长模型与传统菌落计数法建立的生长模型之间的相关系数分别为:0.954、0.957、0.955,3 种方法的相关性均高于0.95,说明以高光谱参数建立的生长模型具有很高的准确性,其中以方法Ⅱ波峰建模的相关性最高。
表1 灰葡萄孢霉、炭疽菌、匍枝根霉生长模型模拟结果
Table1 Results of exponential models for the growth of B. cineerreeaa,, C. acutatum
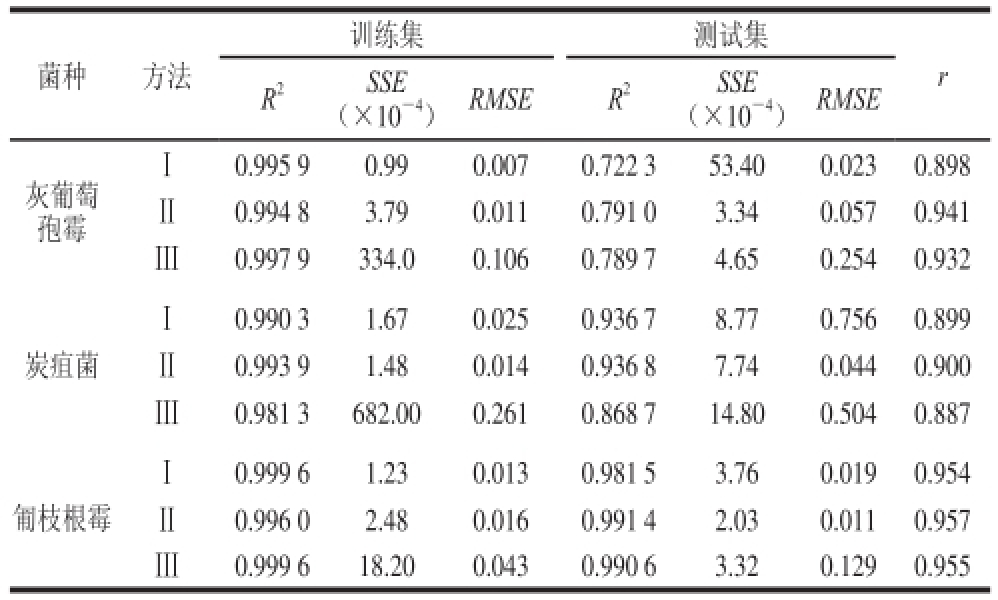
注:r. 高光谱参数建立的生长模型与传统菌落计数法建立的生长模型之间的相关系数。
训练集测试集菌种方法R 2SSE(×10 -4)RMSER 2SSE(×10 -4)RMSE r灰葡萄孢霉Ⅰ0.995 90.990.0070.722 353.400.0230.898Ⅱ0.994 83.790.0110.791 03.340.0570.941Ⅲ0.997 9334.00.1060.789 74.650.2540.932炭疽菌Ⅰ0.990 31.670.0250.936 78.770.7560.899Ⅱ0.993 91.480.0140.936 87.740.0440.900Ⅲ0.981 3682.000.2610.868 714.800.5040.887Ⅰ0.999 61.230.0130.981 53.760.0190.954Ⅱ0.996 02.480.0160.991 42.030.0110.957Ⅲ0.999 618.200.0430.990 6 3.320.1290.955匍枝根霉
2.3.3 3 种建模方法比较
图4所示的基于高光谱图像特征参数对3 种真菌的生长拟合曲线均呈现“S”型,与图3所示的基于菌落计数法对3 种真菌的生长拟合模型基本相似,都包含了延滞期、指数期和稳定期。由表1可知,拟合模型的训练集和测试集的R 2分别为0.981 3~0.999 6和0.722 3~0.991 4,SSE和RMSE均接近于0,由此可知模型对数据的拟合较好,其中方法Ⅱ的R 2最大,SSE、RMSE最小。对比高光谱参数建立的生长模型与传统菌落计数法建立的生长模型之间的相关系数,可知方法Ⅱ与传统菌落计数法相关性更高,建立的生长模型更可靠。另外,方法Ⅱ选取波峰光谱值相对于其他两种方法更易获取,因此选取波峰建立生长模型更为合理。
2.4 3 种真菌高光谱响应值主成分分析
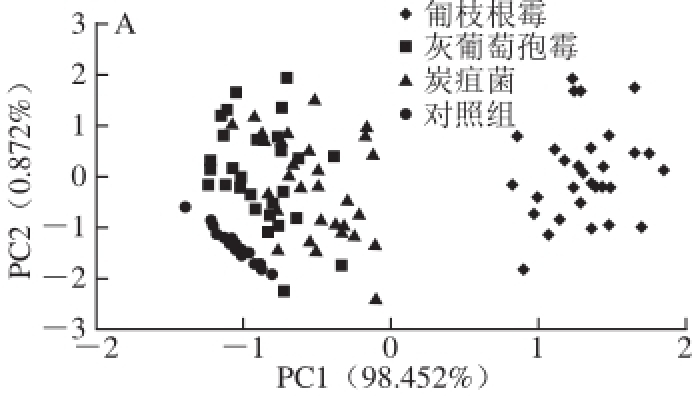
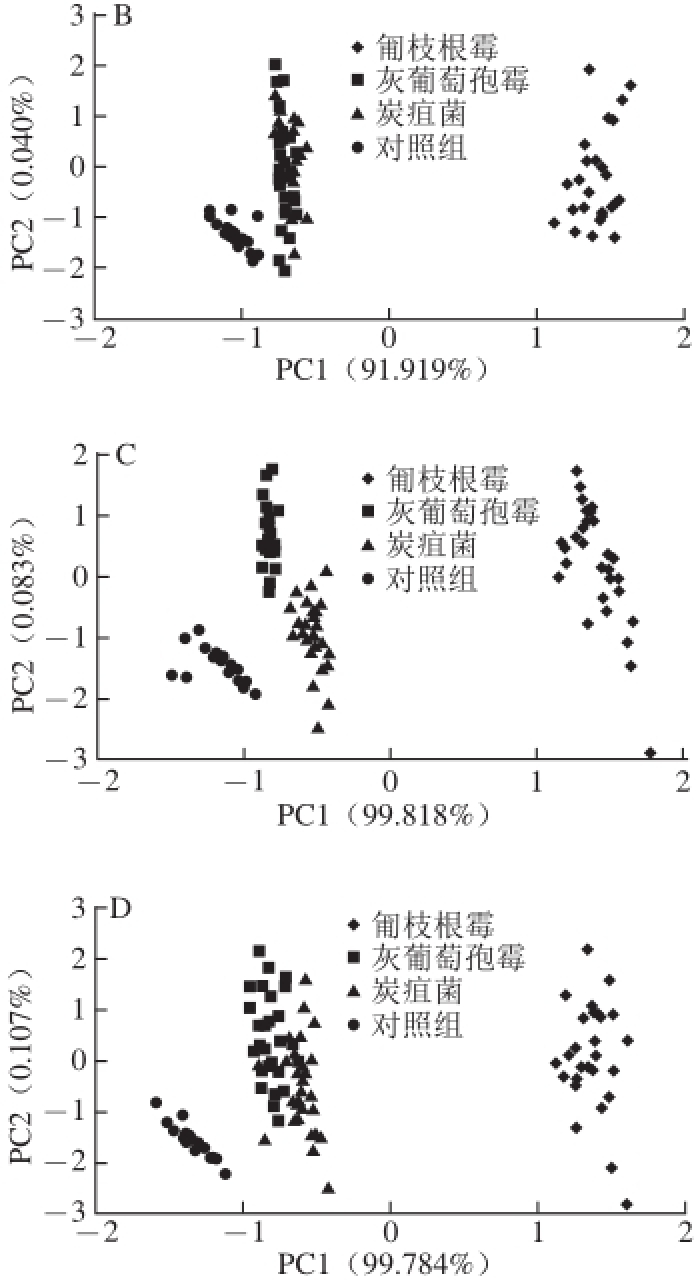
图5 基于不同菌种高光谱全波段响应值的主成分分析
Fig.5 PCA for different fungi at the same culture times
A~D分别为接种后12、24、36、48 h。
在全波段范围内,由于光的色散现象导致真菌的光谱值随菌落的生长而增大,光的色散随着菌丝的生长而产生,不同菌丝间色散程度会存在差异 [26-27],因此通过光学方法可以区分不同菌种。如图5所示,对不同培养时间的全波段(400~1 000 nm)光谱值进行PCA分析,以区分不同菌种和对照组。结果显示,匍枝根霉与其他3 组区分最为显著,这是因为匍枝根霉生长最快,与其他组区分最明显。灰葡萄孢霉和炭疽菌仅能在36 h区分开,这是由于两种菌生长速率缓慢,并且表面颜色相近。灰葡萄孢霉和炭疽菌在12 h(图5A)、24 h(图5B)、48 h(图5D)相互重叠,而4 个实验组在36 h区分最为明显(图5C),因此可以利用光谱响应值来区分培养36 h的3 种菌及对照组。
2.5 PLS-DA区分不同菌种
根据PCA分析的结果,本实验选取培养36 h的菌种加以建模区分,PLS-DA模型区分结果如表2所示。灰葡萄孢霉、炭疽菌、匍枝根霉和对照组测试集的区分准确率分别为100%、100%、100%和90%,对照组与3 种菌之间的平均区分准确率达97.5%。上述结果与2.4节中PCA结果一致。匍枝根霉训练集与测试集区分准确率最高,这是由于匍枝根霉生长速率明显高于其他几组,与其他几组区分明显。上述结果表明,高光谱图像技术能够区分3 种不同真菌。在后续实验中,可以找出区分3 种真菌的特征波长以获得更高的区分准确率;进一步利用高光谱参数建立一个标准菌种生长模型库,未知菌种通过对比标准生长模型得以区分鉴定。
表2 PLS-DA模型区分培养36 h菌落的判别结果
Table2 PLS-DA models for fungi cultured for 36 h
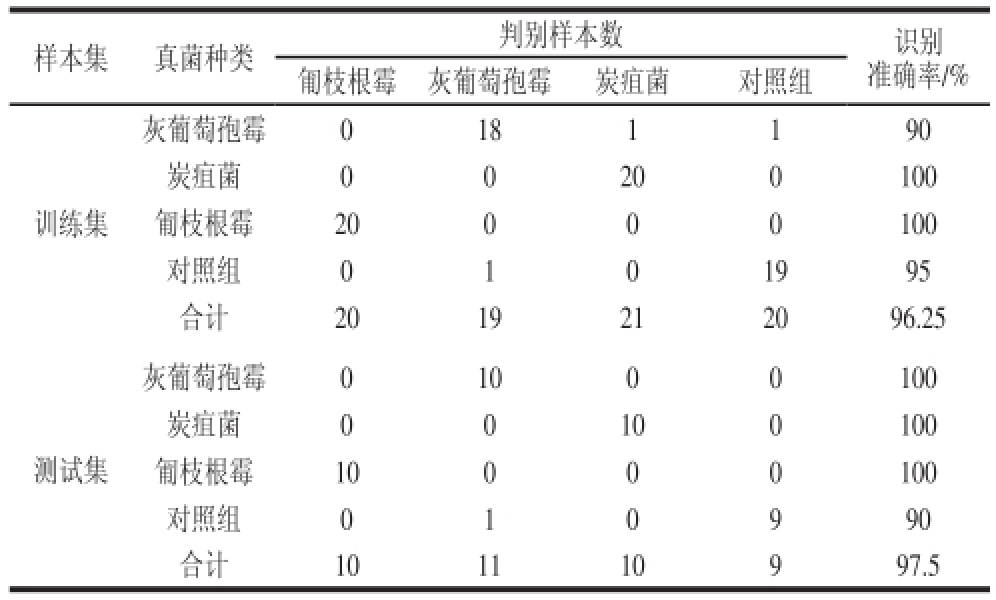
样本集真菌种类判别样本数识别准确率/%匍枝根霉灰葡萄孢霉炭疽菌对照组训练集灰葡萄孢霉0181190炭疽菌00200100匍枝根霉20000100对照组0101995合计2019212096.25测试集灰葡萄孢霉01000100炭疽菌00100100匍枝根霉10000100对照组010990合计101110997.5
本实验开发一种新的方法模拟果蔬上几种常见腐败真菌(如灰葡萄孢霉、炭疽菌和匍枝根霉)的生长模型,并加以区分。结果显示,利用高光谱参数建立的生长模型测试组的R 2范围为0.722 3~0.991 4,与传统菌落计数法建立的生长模型的相关系数范围为0.887~0.957。另外,利用高光谱反射光谱的全波段信息做PCA分析能区分不同菌种,而PLS-DA模型对培养36 h的3 种菌的区分准确率达100%。上述结果表明高光谱图像技术能够作为模拟微生物生长及区分不同菌种的一项技术。
参考文献:
[1] 金鹏. 桃果实采后病害和冷害调控及其机理研究[D]. 南京: 南京农业大学, 2009.
[2] 田世平, 范青. 控制果蔬采后病害的生物学技术[J]. 植物学通报, 2000(3): 211-217. DOI:10.3969/j.issn.1674-3466.2000.03.003.
[3] 韦莹莹, 毛淑波, 屠康. 果蔬采后病害生物防治的研究进展[J]. 南京农业大学学报, 2012(5): 183-189. DOI:10.7685/j.issn.1000-2030.2012.05.020.
[4] GHAOUTH A E, WILSON C, WISNIEWSKI M, et al. Biological control of postharvest diseases of fruits and vegetables[J]. Journal of Tropical and Subtropical Botany, 2002, 2(2): 219-238. DOI:10.1016/ S1874-5334(02)80012-0.
[5] KARL M, SUN Dawen. Predictive food microbiology for the meat industry: a review[J]. International Journal of Food Microbiology, 1999, 52(1/2): 1-27. DOI:10.1016/S0168-1605(99)00126-9.
[6] MCMEEKIN T A, OLLEY J, RATKOWSKY D A, et al. Predictive microbiology: towards the interface and beyond[J]. International Journal of Food Microbiology, 2002, 73(2/3): 395-407. DOI:10.1016/ S0168-1605(01)00663-8.
[7] WHITING R C, BUCHANAN R L. A classification of models for predicti ve microbiology[J]. Food Microbiology, 1993, 1 0: 175-177. DOI:10.1006/fmic.1993.1034.
[8] WHITING R C, BUCHANAN L R. Microbial modeling[J]. Food Technology, 1994, 48: 113-120.
[9] 张嫱, 潘磊庆, 陈蒙, 等. 基于高光谱图像技术的油桃早期冷害无损检测[J]. 食品工业科技, 2014, 35( 20): 53-56. DOI:10.13386/ j.issn.1002-0306.2014.20.002.
[10] 陈思. 基于高光谱图像技术的水蜜桃表面缺陷检测方法研究[D].杭州: 浙江大学, 2013.
[11] del FIORE A, REVERBE RI M, RICELLI A, et al. Early detection of toxige nic fungi on maize by hyperspectral imaging analysis[J]. International Journal of Food Microbiology, 2010, 144(1): 64-71. D OI:10.1016/j.ijfoodmicro.2010.08.001.
[12] DELWICHE S R, KIM M S. Hyperspectral imaging for detection of scab in wheat[J]. Biological Quality and Precision Agriculture II, 2000, 6(8): 13-20. DOI:10.1117/12.411752.
[13] GŁMEZ-SANCHIS J, MOLTŁ E, GOMEZ-CHOVA L, et al. Hyperspectral computer vision system for the detection of Penicillium digitatumin citrus packing lines[C]//2004 CIGR Int ernational Conference. Beijing, 2004.
[14] 张伟, 潘磊庆, 屠康. 利用高光谱透射图像检测鸡种蛋早期孵化[J]. 农业工程学报, 2012, 28(21): 149-155. DOI:10.3969/ j.issn.1002-6819.2012.21.021.
[15] 赵杰文. 食品、农产品检测中的数据处理和分析方法[M]. 北京: 科学出版社, 2012: 55-70.
[16] TAKIZAWA K, NAKANO K, OHASHI S, et al. Development of nondestructive technique for detecting internal defects in Japanese radishes[J]. Journal of Food Engineering, 2014, 126: 43-47. DOI:10.1016/j.jfoodeng.2013.10.041.
[17] 邓书斌. ENVI遥感图像处理方法[M]. 北京: 科学出版社, 2010: 115-117.
[18] GB 4789.15—2010 食品安全国家标准 食品微生物学检验 酵母和霉菌计数[S].
[19] 李爽, 李小娟. 遥感制图过程精度评价[C]//中国地理学会2008年学术年会. 长春, 2008.
[20] 吴琼, 田越, 周春平, 等. 遥感图像超分辨率研究的现状和发展[J]. 测绘科学, 2008(6): 66-69. DOI:10.3771/j.issn.1009-2307.2008.06.022.
[21] 陈秋莲, 王成栋. 基于Matlab遗传算法工具箱的优化计算实现[J].现代电子技术, 2007(2): 124-126. DOI:10.3969/j.issn.1004-373X.2007.02.042.
[22] 倪博溢, 萧德云. MATLAB环境下的系统辨识仿真工具箱[J].系统仿 真学报, 2006(6): 1493-1496. DOI:10.3969/j.issn.1004-731X.2006.06.020.
[23] 孙波, 迟玉杰, 徐宁, 等. 液全蛋与杀菌液全蛋中微生物预测模型的建立[J]. 食品科学, 2009, 30(19): 173- 176. DOI:10.3321/ j.issn:1002-6630.2009.19.038.
[24] 李飞燕, 张一敏, 王秀江, 等. 贮藏过程中冷却牛肉微生物模型的 建立[J]. 食品与发酵工业, 2011, 37(7): 220-224.
[25] 江泽慧, 费本华, 杨忠. 光谱预处理对近红外光谱预测木材纤维素结晶度的影响[J]. 光谱学与光谱分析, 2007(3): 435-438. DOI:10.3321/j.issn:1000-0593.2007.03.006.
[26] BIRTH G S, HECHT H G. The physics of near-infrared refl ectance[M]//WILLIAMS P, NORRIS K. Near-infrared technology in the agriculture and food industries. St. Paul/Minnesota, USA: American Association of Cereal Chemists, 1987: 1-15.
[27] DOWELL F E, PEARSON T C, MAGHIRANG E B, et al. Refl ectance and transmittance spectroscopy applied to detecting Fumonisin in single corn kernels infected with Fusarium verticillioides[J]. Cereal Chemistry, 2002, 79: 222-226.
Growth Simulation and Discrimination of Botrytis cinerea, Rhizopus stolonifer and Colletotrichum acutatum by Using Hyperspectral Reflectance Imaging Technique
SUN Ye, GU Xinzhe, WANG Zhenjie, HU Pengcheng, TU Kang, PAN Leiqing*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:This study used a hyperspectral imaging system (HIS) to measure the spectral response of fungi inoculated on potato dextrose agar plates. In this work, three methods for calculating HIS parameters, including the mean of whole spectral response values covering the range of 400–1 000 nm, the spectral response value of the wave peak at 716 nm, and the score of the firs t principal component in the whole spectral range of 400–1 000 nm using principal component analysis (PCA), were used to simulate the growth of fungi. The results showed that the coefficients of determination (R 2) of the simulation models for test datasets of three fungi, Botrytis cinerea, Rhizopus stolonifer and Colletotrichum acutatum, were 0.722 3–0.991 4, and the sum square error (SSE) and root mean square error (RMSE) were in a range of 2.03 × 10 -4–5.34 × 10 -3and 0.011–0.756, respectively, based on the three methods. The correlation coefficients between HIS parameters and colony forming units of fungi were high ranging from 0.887 to 0.957. In addition, fungal species can be discriminated by PCA and partial least squares-discrimination analysis (PLS-DA) based on the spectral information in the full wavelength range. The classification accuracy of the test dataset by PLS-DA models for fungi cultured for 36 h was 97.5% among Botrytis cinerea,Rhizopus stolonifer, Colletotrichum acutatum, and the control. This paper offers a new technique and useful information for further study into modeling the growth of fungi and detecting fruit spoilage caused by fungi based on HIS.
Key words:spoilage fungi; hyperspectral imaging; growth simulation; partial least squares-discriminant analysis (PLS-DA); discrimination
DOI:10.7506/spkx1002-6630-201603026
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)03-0137-08
引文格式:
孙晔, 顾欣哲, 王振杰, 等. 高光谱图像对灰葡萄孢霉、匍枝根霉、炭疽菌的生长拟合及区分[J]. 食品科学, 2016, 37(3): 137-144. DOI:10.7506/spkx1002-6630-201603026. http://www.spkx.net.cn
SUN Ye, GU Xinzhe, WANG Zhenjie, et al. Growth simulation and discrimination of Botrytis cinerea, Rhizopus stolonifer and Colletotrichum acutatum by using hyperspectral reflectance imaging technique[J]. Food Science, 2016, 37(3): 137-144. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603026. http://www.spkx.net.cn
收稿日期:2015-03-24
基金项目:公益性行业(农业)科研专项(201313002-01);“十二五”国家科技支撑计划项目(2015BAD19B03)
作者简介:孙晔(1992—),女,硕士研究生,研究方向为农产品无损检测。E-mail:2013108067@njau.edu.cn
*通信作者:潘磊庆(1980—),男,副教授,博士,研究方向为农产品无损检测。E-mail:pan_leiqing@njau.edu.cn