
陈荫楠 1,陈 华 1,石贤爱 1,2,*,叶小军 3,樊海平 3
(1.福州大学生物科学与工程学院,福建 福州 350108;2.福建省医疗器械和医药技术重点实验室,福建 福州 350002;3.福建省淡水水产研究所,福建 福州 350002)
摘 要:为实现呋喃唑酮(furazolidone,FZD)的快速定量检测,本研究制备了抗FZD全抗原的单克隆抗体,建立了抗FZD的单克隆抗体酶联免疫检测方法。结果表明,FZD单克隆抗体在质量浓度为10~500 ng/mL范围具有较好的线性,IC 50值为0.06 μg/mL,最低检测限为6.92 ng/mL,对于其他硝基呋喃类抗生素及其代谢物均不存在交叉反应。该方法重现性较好,平均误差为6.54%,回收率为76.84%~88.31%。
关键词:呋喃唑酮;单克隆抗体;酶联免疫检测
硝基呋喃类药物是一类人工合成的具有5-硝基呋喃结构的广谱抗生素,其中呋喃唑酮(furazolidone,FZD)主要用于治疗肠道感染和球虫病 [1-2]。它们作用于微生物酶系统,抑制乙酰辅酶A,干扰微生物糖类代谢,起到很好的抑菌、杀菌作用 [3],被广泛应用于家禽、水产等动物传染病的预防与治疗 [4]。在长期的实验研究过程中发现,硝基呋喃类药物和代谢物均可以使实验动物发生癌变和基因突变 [5]。我国于2002年3月发布《食品动物禁用的兽药及其它化合物清单》将呋喃唑酮列为禁用药 [6]。
国内外报道的呋喃唑酮残留量检测方法主要有分光光度法 [7]、高效液相色谱(high performance liquid chromatography,HPLC)法 [8-9]、液相色谱-质谱联用法 [10-11]、酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA) [12-13]法、荧光免疫法 [14-15]等。近年来,基于ELISA检测法快速、灵敏、设备简便、特异性强等优点,已被广泛应用于农兽药残留的快速检测 [16]。如国外学者Vass等 [17]采用ELISA快速测定鸡蛋中呋喃西林代谢物,经酸衍生化后的样品通过酶联免疫反应,得到回收率在77.8%~110%,检出限为0.13 μg/kg。Pimpitak等 [18]采用ELISA测定虾中3-氨基-2-恶唑烷酮(3-amino-2-oxazolidinone,AOZ),检出限为0.16 μg/kg。国内学者们也对呋喃唑酮代谢物的ELISA检测做了许多研究。徐蓓等 [6]用对醛基苯甲酸对呋喃唑酮代谢物AOZ衍生后,再与载体蛋白连接进行免疫,得到针对AOZ与4-羧基苯甲醛的反应产物3-((4-羧基苯亚甲基)-氨基)-2-恶唑烷酮(3-{[(4-carboxyphenyl)methylene]-amino}-2-oxazolidinone,CPAOZ)的多克隆抗体,其抗体通过直接竞争酶联免疫法检测,可得检出限为0.2 μg/L,且与其他抗生素药物无交叉反应。汪莉等 [19]利用多克隆抗体构建了ELISA检测法定量检测食品中呋喃唑酮,回收率为87.3%~107.5%。罗杰等 [20]以呋喃唑酮多克隆抗体建立了水产品中呋喃唑酮的ELISA检测法,该方法对水产品中FZD的检测限为1.0 ng/g,但IC 50值较高,且得到的抗体对呋喃西林有43%的交叉反应率。
开发具有自主知识产权的快速、准确、灵敏的呋喃唑酮检测试剂盒有利于从养殖业源头上解决呋喃唑酮使用的问题,具有重要意义。然而多克隆抗体批间差异大,检测灵敏度较低,且往往伴随高交叉反应率,容易增加假阳性的概率,不利于开发性能稳定的快速检测产品 [21-23]。因此,为了提高灵敏度及特异性,单克隆抗体的研制已成为发展趋势。由于呋喃唑酮是小分子物质 [24],结构简单,难以制备免疫原性强、能刺激机体产生高亲和力、高效价的抗呋喃唑酮特异性抗体,因此,目前国内外关于制备抗呋喃唑酮单克隆抗体的报道较少 [25]。本实验室利用重氮法成功制备了基于FZD的人工抗原并获得了具有高特异性的抗FZD的单克隆抗体,并在此基础上建立了酶联免疫检测试剂盒并应用于实际样品检测,证明了该试剂盒具有诸多优势且展示了良好的应用前景。
1.1 材料与试剂
FZD单克隆抗体 自制。
呋喃唑酮、呋喃它酮(furaltadone,FTD)、呋喃妥因(nitrofurantion,NFT)、呋喃西林(nitrofurazone,NFZ)、氨基脲(semicarbazide,SEM)、3-氨基-2-恶唑烷酮德国Dr.Ehrenstorfer GmbH公司;亚硝酸钠、锌粉 西陇化工股份有限公司;25%戊二醛 美国Alfa Aesar公司;牛血清白蛋白(bovine serum albumin,BSA)、卵清白蛋白(ovalbumin,OVA) 美国Worthington公司;葡聚糖凝胶G-25(Sephadex G-25) 美国Pharmacia公司;含吐温-20的磷酸盐缓冲液(phosphate buffered saline with Tween-20,PBST) 美国Amresco公司;四甲基联苯胺(tetramethylbenzidine,TMB)北京天根生化科技公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗小鼠IgG 美国Thermo Fisher Scientific公司;UV-1800紫外分光光度仪 日本岛津公司。
1.2 仪器与设备
SH-1000全波长酶标仪 日本Corona公司;Z323高速冷冻离心机 德国Hermle公司;BS224S电子天平 德国Sartorius公司;DKZ-1电热恒温振荡水槽上海精宏实验设备有限公司;1525高效液相色谱仪 美国Waters公司。
1.3 实验动物
3 只8 周龄的雌性BALB/c小鼠 福建省医科大学。1.4 方法
1.4.1 FZD-BSA单克隆抗体的制备
1.4.1.1 重氮法合成人工抗原
1)称取呋喃唑酮2 mg,溶解于100 μL的乙腈和甲醇中,再加入2 mL 1 mol/L的盐酸,搅拌并加入1 mg锌粉,振荡混匀。将混合液置于80 ℃的水浴中加热20 min,取上清冷却至4 ℃。取冷却后的呋喃唑酮还原液2 mL,用1 mol/L的盐酸调pH值至1~2;往上述溶液中逐滴加入0.5 mol/L的亚硝酸钠溶液并搅拌,直至淀粉碘化钾试纸检验呈灰蓝色时,停止滴加 [20];2)称取10 mg BSA,溶解于1 mL 0.01 mol/L pH 7.4的PBS中,冷却至4 ℃;将1)中溶液逐滴加入到BSA溶液中并搅拌混匀;往上述混合液中加入适量1 mol/L的氢氧化钠溶液,pH值调为8.5;所得混合液在避光条件下振荡1 h后,放置在4 ℃冰箱过夜,得到FZD-BSA偶联产物。用OVA代替BSA制备检测抗原。
1.4.1.2 偶联产物的紫外扫描检测
采用紫外分光光度仪,分别对FZD、BSA和OVA标准品溶液进行全波长扫描(190~800 nm),确定各物质的特征吸收波长。对经Sephadex G-25凝胶层析柱分离纯化后的偶联物进行紫外扫描,检测偶联物在该波长附近范围的特征吸收峰情况,并收集第一个洗脱峰。
1.4.1.3 偶联产物的液相色谱分析
色谱柱为Thermo SEC-300(300 mm×7.8 mm,10 μm);二极管阵列检测器(diode-array detector,DAD),双通道检测,检测波长分别为278 nm和364 nm,其中278 nm是蛋白的吸收峰波长,364 nm是FZD的特征吸收峰波长之一;流动相为0.01 mol/L PBS;流速1.0 mL/min。
1.4.1.4 偶联产物的红外光谱检测
采用红外光谱检测法对偶联产物的结构进行进一步的确认,具体操作如下:将纯品KBr放入研钵中研细,压片,装入红外光谱仪,进行红外扫描检测,作为空白;分别将BSA、OVA标准品及冻干的偶联产物与KBr按质量比100∶1放入研钵中研细,压片;将样品的薄片固定好,装入红外光谱仪,在500~4 000 cm -1范围分别对BSA、OVA标准品及偶联产物进行红外扫描检测,获得各样品的红外光谱图。
1.4.1.5 动物免疫
选取8 周龄的雌性BALB/c小鼠,用免疫抗原FZD-BSA进行免疫。免疫剂量以相同的呋喃唑酮量计算,每只小鼠每次免疫剂量为3.0 μg的呋喃唑酮。首次免疫将人工免疫抗原与等体积的弗氏完全佐剂混合,振荡至完全乳化,对小鼠进行腹腔注射。此后每隔14 d加强免疫一次,将免疫原与等体积的弗氏不完全佐剂混合,免疫方法同首次免疫,共免疫5 次 [21]。每次加强免疫前,对小鼠尾静脉采血,采用间接非竞争ELISA检测多抗的效价,直至抗血清效价大于5×10 4,进行加强免疫,4 d后取小鼠脾脏细胞与骨髓瘤细胞采用50%聚乙二醇(分子质量4 000 D)进行融合。
1.4.1.6 间接竞争ELISA检测方法
采用重氮法制备的FZD-OVA作为检测抗原,测定多抗血清中抗FZD多克隆抗体的特异性。检测抗原FZD-OVA与免疫抗原FZD-BSA采用相同的制备方法。
具体操作如下:包被:用碳酸盐缓冲液稀释抗原FZD-OVA至蛋白质量浓度为20 μg/mL,包被于酶标孔板条,100 μL/孔,4 ℃反应过夜。洗涤:倾去包被液,洗涤3 次,4 min/次,扣干。封闭:每孔加入5%脱脂奶200 μL,37 ℃封闭3 h;倾去封闭液,洗涤3 次。竞争反应:取还原后的FZD 1 mg,溶解于1 mL 的甲醇-乙腈溶液中,倍比稀释到质量浓度为:80 000、40 000、8 000、4 000、800、400、80、40、8、4、2 ng/mL的标准液。分别将各质量浓度标准品溶液与适当浓度的多抗血清等体积混合,每孔加入混合液100 μL,同时设置阳性对照组、阴性对照组和空白对照组,37 ℃孵育2 h;倾去抗血清,洗涤3 次,扣干。加入酶标二抗:加入稀释好的HRP-羊抗小鼠IgG,每孔100 μL,37 ℃孵育1 h;倾去酶标二抗,洗涤3 次,扣干。显色反应:每孔加入100 μL的底物TMB,37 ℃避光反应30 min;终止反应:每孔加入100 μL的终止液,用酶标仪测定450 nm波长处的吸光度(A 450 nm)。
结果判定:以结合率为纵坐标,以FZD质量浓度的对数值为横坐标,绘制竞争曲线,观察抗FZD抗体与FZD的竞争反应情况,判断抗体的特异性。以抗FZD特异性抗体对FZD的竞争抑制率为纵坐标,以FZD质量浓度的对数值为横坐标,绘制标准竞争曲线。在标准竞争曲线上计算出抑制率为50%时混合液中FZD的标准质量浓度作为竞争抑制率IC 50。

式中:A为加入不同质量浓度的底物FZD的A 450 nm值;A 0为不加底物FZD的A 450 nm值;A 空白对照为不加底物FZD、不加抗血清的A 450 nm值。
1.4.1.7 腹水单克隆抗体(monoclonal antibody,mAb)的制备
杂交瘤细胞株经筛选和克隆化后,往BALB/c小鼠腹腔接种0.5 mL液体石蜡,7 d后收集杂交瘤细胞,用无完全培养液调整细胞密度至2×10 6个/mL,每只小鼠腹腔注射0.5 mL。观察小鼠腹部,若腹部明显膨大,即可用针筒采集腹水。
1.4.1.8 腹水mAb效价的测定
以FZD-OVA包被酶标板,将收集到的腹水3 000 r/min离心20 min,弃去脂肪层和细胞残渣等,吸取澄清部分,采用间接非竞争ELISA检测腹水效价。
1.4.1.9 单抗的分离纯化
为了进一步除去脂肪粒、小颗粒物质、细胞及其残渣等,可在单抗纯化之前,采用二氧化硅吸附法对腹水进行预处理。得到澄清的腹水后于4 ℃条件下向腹水中滴加硫酸铵饱和加至45%,4 ℃冰箱放置过夜,隔天,3 000 r/min离心20 min,收集沉淀。用4 倍原体积的PBS溶解。将此样品立即用Sephadex G-25凝胶过滤进行脱盐,收集第1个洗脱峰,冻干后重新溶解、测定。
1.4.1.10 单抗免疫球蛋白的类别和亚类鉴定
采用间接ELISA的方法鉴定单抗Ig类和亚类。对比不同类别及亚类的HRP标记的羊抗小鼠IgG1、IgG2a、IgG2b、IgG3、IgA和IgM作用下的显色结果,以显色与否判定该株杂交瘤细胞分泌的单抗所属类别及亚类。
1.4.1.11 纯化后mAb纯度的鉴定
采用聚丙烯酰胺凝胶电泳对纯化后的单抗进行纯度鉴定。
1.4.2 间接非竞争ELISA测定纯化前后单抗的效价
包被:用碳酸盐缓冲液稀释抗原FZD-OVA至蛋白质量浓度为20 μg/mL,包被于酶标孔板条,100 μL/孔,4 ℃反应过夜。洗涤:倾去包被液,每孔用300 μL PBST洗涤3 次,4 min/次,扣干。封闭:每孔加入5%脱脂奶200 μL,37 ℃封闭3 h;倾去封闭液,洗涤3 次。加一抗:每孔加入100 μL经PBS倍比稀释的小鼠抗血清,37 ℃孵育2 h;倾去抗血清,洗涤3 次,扣干。加二抗:每孔加入100 μL经PBS稀释2 000 倍的HRP-羊抗小鼠IgG,37 ℃孵育1 h;倾去酶标二抗,洗涤3 次,扣干。显色:每孔加入100 μL TMB,37 ℃避光反应30 min;加入2 mol/L H 2SO 4,100 μL/孔以终止反应。检测:测定450 nm波长处的吸光度(A 450 nm)。结果判定:当2.1×(A 阴性对照-A 空白对照)≤(A 阳性血清-A 空白对照),且阴性对照的A 450 nm大于0.1时,此时的抗体稀释倍数即是抗体的效价。
1.4.3 ELISA试剂盒最佳工艺的确定
1.4.3.1 最佳包被抗原及单抗工作质量浓度的确定
采用方阵实验法,将包被抗原和抗呋喃唑酮单克隆抗体分别作系列稀释,抗原质量浓度分别稀释为10、5、2、1、0.2 μg/mL,单抗稀释倍数分别为1 000、5 000、10 000、50 000、100 000、500 000。以重氮化法制备的FZD-OVA作为检测抗原,其余步骤同间接竞争ELISA。根据检测得到的A 450 nm值,确定实验最佳的包被抗原质量浓度和单抗的最佳稀释倍数。
1.4.3.2 单抗与标准品加入次序及最佳时间的确定
将抗呋喃唑酮单克隆抗体与FZD标准品按等体积比混合,采用间接竞争ELISA法对检测效果进行观察。方案A:抗呋喃唑酮单克隆抗体与FZD板外反应60 min后,板内反应60 min;方案B:呋喃唑酮单克隆抗体与FZD板外反应90 min后,板内反应30 min;方案C:呋喃唑酮单克隆抗体与FZD混合后直接板内反应120 min。
1.4.3.3 间接竞争ELISA标准曲线的绘制
采用重氮化法制备的FZD-OVA作为检测抗原,包被质量浓度为5 μg/mL,4 ℃包被过夜;倾去包被液,洗涤后用5%的脱脂奶封闭过夜。
FZD:取还原后的FZD 1 mg,溶解于1 mL的甲醇-乙腈中,用PBS倍比稀释到质量浓度为:10 000、5 000、1 000、500、100、50、10、5、1、0.1 ng/mL的标准液。分别将各质量浓度标准品溶液与适当溶度的多抗血清等体积混合,37 ℃孵育一定时间后加板,每孔加入混合液100 μL,同时设置阳性对照组、阴性对照组和空白对照组,继续37 ℃孵育一定时间,反应时间根据1.4.3.2节确定;倾去混合液倾去抗血清,用300 μL PBST洗涤3 次,每次间隔4 min,扣干。其余步骤同1.4.2节。
1.4.3.4 检测方法的最低检测限分析
从包被的10 块板中随机选择10 个孔,加入50 μL零标准品和50 μL稀释到工作质量浓度的抗呋喃唑酮单克隆抗体,应用建立的间接竞争ELISA法测定450 nm波长处的吸光度。求得10 个孔的标准差(s),在标准曲线上对应3s/A 0的标准品质量浓度即为此方法的最低检测限。

式中:A 0为不加底物FZD的A 450 nm值;A i为加底物FZD的不同孔的A 450 nm值;n为孔数,取值10。
1.4.3.5 间接竞争ELISA检测方法的精密度测定
取3 个不同质量浓度的呋喃唑酮标准品,进行间接竞争ELISA分析,每个质量浓度每天做一次分析,综合5 次测定的抑制率,求出变异系数。
1.4.3.6 交叉反应率的确定
分别将FTD、NFT、NFZ、SEM以及AOZ这5 种结构类似物标准液倍比稀释,每个质量浓度分别取50 μL与等体积稀释到最适工作质量浓度的单抗于37 ℃温育反应60 min,再加入到包被封闭好的96 孔内反应60 min,其余步骤同间接竞争ELISA。最后以FTD、NFT、NFZ、SEM和AOZ的IC 50与FZD的IC 50百分比可得该单抗与各结构类似物的交叉反应率。
式中:IC 50, FZD为当FZD对抗血清抑制率为50%时,FZD的标准质量浓度/(μg/mL);IC 50, 结构类似物为FZD结构类似物对抗血清抑制率达到50%时,FZD结构类似物的标准质量浓度/(μg/mL)。
1.4.4 样品加标回收率的测定
将空白饲料样本研磨粉碎,过筛备用。取适量样品于50 mL离心管中,按10.0、50.0、100.0 μg/g的添加量分别加入适量的FZD标准品。然后加入甲醇-乙腈(3∶7,V/V)提取液,剧烈振荡30 min。静置一段时间后,离心取上清液进行还原。待冷却至室温后采用间接竞争ELISA法进行检测。最后,根据FZD竞争抑制标准曲线,计算加标回收率。
2.1 FZD人工抗原的制备与鉴定
2.1.1 偶联产物的液相色谱分析
按照1.4.1.1节所述制备的FZD-BSA人工抗原,经Sephadex G-25柱层析分离纯化后进行液相色谱分析,结果如图1所示。偶联产物FZD-BSA的出峰时间为8.283 min,比BSA的出峰时间(8.929 min)略早一点,符合色谱柱分离原理,因为偶联反应后的蛋白分子质量增大。同时在FZD-BSA的HPLC图中未观察到FZD的吸收峰(15.531 min),表明经过Sephadex G-25凝胶分离纯化后的偶联物中不含有游离的FZD。
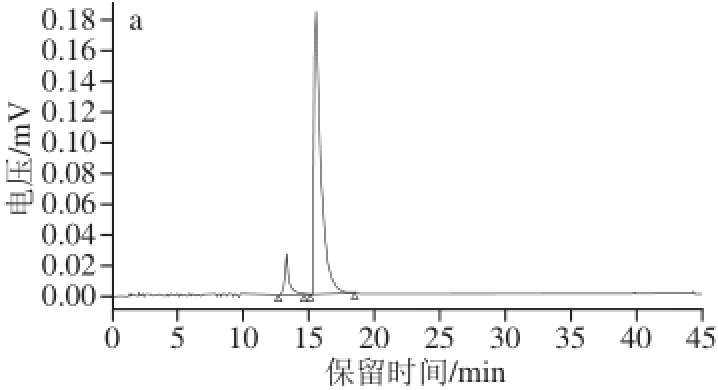

图1 FZD(a)、BSA(b)及FZD-BSA(c)的HPLC图
Fig.1 HPLC chromatograms of FZD (a), BSA (b) and FZD-BSA (c)
2.1.2 偶联产物的紫外分析
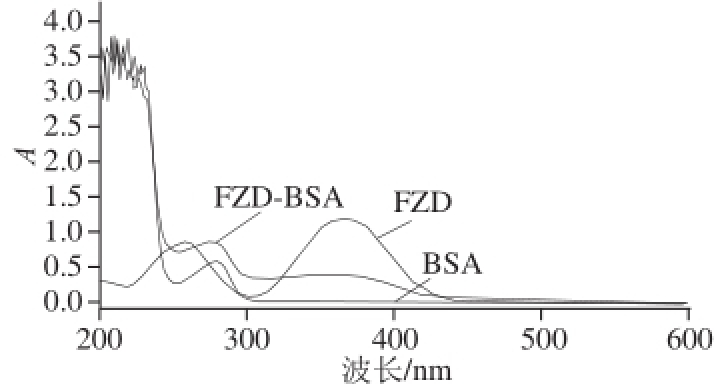
图2 BSA、FZD和FZD-BSA紫外扫描图
Fig.2 UV absorption spectra of BSA, FZD and FZD-BSA
通过紫外全波长扫描结果(图2)可知,BSA在278 nm波长处有最大吸收峰;FZD在258 nm和364 nm波长处有主要特征吸收峰;而偶联抗原除了在278 nm波长处有明显的特征吸收峰外,在360~364 nm波长处还存在明显肩峰,这是偶联产物中FZD的特征吸收峰,进一步证明FZD与载体蛋白BSA偶联成功。
2.1.3 偶联产物的红外光谱分析
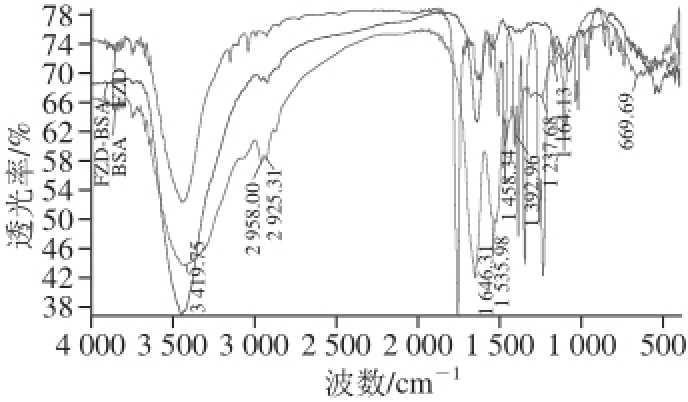
图3 FZD、BSA和FZD-BSA红外光谱图
Fig.3 IR absorption spectra of FZDFZD, BSA, and FZDFZD-BSA
由图3可知,BSA分别在1 500~1 700 cm -1区域、2 958~2 925 cm -1区域以及2 800~3 400 cm -1区域存在蛋白质中酰胺基和胺基伸缩的特征吸收峰。FZD在500~1 700 cm -1区域有一系列的特征吸收峰,主要为在3 450 cm -1和1 760 cm -1有C=O特征峰;1 233 cm -1处有C—O—C的特征峰,1 511、1 470、1 388、1 348 cm -1有—NO 2特征峰;857、963、1 025、1 106、1 233、1 638 cm -1处有呋喃环的特征吸收峰。而FZD-BSA除具有上述蛋白质的特征吸收峰外,在3 450、500~1 700 cm -1区域出现与FZD相类似的特征吸收峰,分别在3 452、1 638、1 160、1 074、861 cm -1。说明FZD-BSA偶联抗原成功制备。
2.2 FZD-BSA单克隆抗体的制备
2.2.1 FZD-BSA抗原免疫小鼠
将制备得到的偶联抗原免疫小鼠,5 次免疫后获得的多克隆抗体的最高效价为1∶306 000,进行细胞融合。2.2.2 重氮化法制备抗原获得抗体的特异性分析
对重氮化法制备的人工抗原免疫小鼠后获得的抗血清,采用间接竞争ELISA方法,对多克隆抗体针对FZD的特异性分析。分别加入不同质量浓度的FZD还原溶液与检测抗原FZD-OVA竞争抗体的结合位点,结果见图4。

图4 抗FZD特异性抗体竞争结合曲线
Fig.4 Competitive inhibition standard curve of anti-FZD antibody
由图4可知,加入还原后的FZD,游离的FZD对小鼠多抗与检测抗原的结合产生了一定的竞争抑制,且随着FZD质量浓度的不断增大,其与FZD-OVA的竞争结合能力不断下降,当游离的FZD质量浓度达到8 000 ng/mL后,继续增加游离抗原质量浓度,FZD与FZD-OVA竞争结合能力开始趋于平缓,下降不再明显。
同时由图4可看出,当FZD质量浓度在40~8 000 ng/mL时,抑制率呈一定的线性关系。以抑制率为纵坐标,FZD质量浓度的对数值为横坐标,拟合标准曲线后得到的线性方程为y=32.147x-45.712(R 2=0.992 2)。以抑制率为50%时对应的质量浓度为IC 50,FZD的IC 50值为0.93 μg/mL,最低检测限为53.70 ng/mL。由此可见,以重氮化法制备的FZD-BSA人工抗原可刺激小鼠产生抗FZD的特异性抗体。
2.2.3 杂交瘤细胞的筛选
将FZD-BSA人工抗原免疫得到的小鼠的脾细胞与骨髓瘤细胞SP2/0进行融合。以SP2/0细胞培养的上清液作阴性对照,阳性的鼠血清作阳性对照,采用间接非竞争ELISA法对杂交瘤细胞上清进行检测,以A 450 nm值大于1.4为阳性克隆孔。选择阳性较强的单克隆细胞孔内的杂交瘤细胞进行克隆化。重复上述步骤,直至得到稳定分泌抗FZD的杂交瘤细胞株。经过间接非竞争ELISA检测后,细胞融合率为83.75%,阳性率为50.00%。采用有限稀释法,对A 450 nm值较高,且融合细胞团较少的孔进行克隆化培养细胞。通过3 次克隆化,得到稳定分泌FZD的杂交瘤细胞株。命名为C2-H5。
2.2.4 杂交瘤细胞培养上清液mAb效价、亚类分析
以骨髓瘤细胞上清液为空白对照、空白小鼠血清为阴性对照。采用ELISA法测定杂交瘤细胞株培养上清液mAb效价,测得C2-H5的效价为1∶1 892。
采用间接非竞争ELISA方法测定抗FZD单克隆抗体的亚类,结果如图5所示。杂交瘤细胞分泌的单克隆抗体与不同类别的亚类二抗显色结果有着明显差异,其中与IgG2b二抗的A 450 nm值最高,与IgG1、IgG2a、IgG3的二抗微弱显色,而与IgA和IgM二抗几乎不显色,该细胞分泌的抗体类型以IgG2b为主。

图5 单抗类别及亚类的测定结果
Fig.5 Subclass composition of monoclonal antibody
2.2.5 单克隆抗体的制备及纯化细胞株C2-H5分泌的腹水mAb效价平均可达1∶2.49×10 6。分别将未经任何处理和经过预处理的腹水采用硫酸铵沉淀法进行纯化,后者纯化效果略优于前者,但后者抗体效价损失较大。C2-H5纯化后的聚丙烯酰胺凝胶电泳图中均有2 条带,一条为IgG的重链,分子质量约65 kD,另一条为轻链,分子质量约为25 kD。
2.3 包被抗原及单抗工作质量浓度的确定包被抗原和单抗质量浓度是ELISA测定方法中影响灵敏度的重要因素,因此选择合适的包被抗原质量浓度和单抗质量浓度能有效提高ELISA测定的重要指标。采用了方阵滴定法来确定最佳的包被抗原质量浓度与抗体稀释倍数。通过非间接竞争ELISA表明FZD-OVA
最佳抗原工作质量浓度为2 μg/mL。在此包被质量浓度下,抗体稀释倍数在1∶10 000时A 450 nm值在1.0附近,故选择1∶10 000作为抗体最佳稀释倍数。
2.4 单抗与标准品加入次序及最佳作用时间的确定
本实验设计了板内外竞争的3 种方案。结果如表1所示,方案A产生的抑制率明显优于方案B与方案C,所以确定将呋喃唑酮与单抗等体积混合后,于板外反应60 min,再将混合液加入封闭后洗涤好的酶标板上竞争反应60 min。
表1 FZD标准品与单抗加入次序及作用时间的确定(A450 nm)
Table1 Determination of the addition sequence and reaction time of FZD and mAb (

方案标准品质量浓度/(ng/mL)010501005001 000 A1.0471.0010.8490.6270.3970.214 B1.0431.0120.8830.6980.4340.263 C1.0321.0170.9970.8690.6120.374
2.5 间接竞争ELISA标准曲线
当FZD质量浓度在10~500 ng/mL范围时,抑制率呈现较好的线性关系。以抑制率为纵坐标,FZD添加质量浓度的对数值为横坐标,拟合标准曲线后得到线性方程为y=42.027x-26.143(R 2=0.998 4)。以抑制率为50%时对应的质量浓度为IC 50,FZD的IC 50值为0.06 μg/mL。
2.6 最低检测限
在包被好的酶标板中随机挑选10 孔,按建立好的间接竞争性ELISA模式做零标准的实验。求所得12 个A 450 nm值的标准差s,3s位置相应的抑制率为9.34%,对应于标准曲线上FZD的质量浓度为6.92 ng/mL,即最低检测限为6.92 ng/mL。
2.7 间接竞争ELISA检测方法的精密度
按照1.4.3.5节的方法,重复做5 次呋喃唑酮的竞争抑制曲线,每次做3 个质量浓度,每个质量浓度做3 个平行孔,以平行孔的均值作为每次每个质量浓度下的抑制率,得出每个质量浓度下的变异系数均小于10%,平均误差为6.54%。实验表明,该方法具有较好的重现性。
2.8 交叉反应率
以重氮化法制备的FZD-OVA作为包被抗原,将FTD、NFT、NFZ、SEM和AOZ分别稀释成梯度质量浓度的标准品,采用间接竞争ELISA法检测,得出抗呋喃唑酮单克隆抗体与各FZD结构类似物的IC 50,计算出交叉反应率,得出抗呋喃唑酮单克隆抗体对5 种硝基呋喃抗生素的交叉反应率均低于0.01%,说明筛选到的单抗具有很高的特异性,可有效避免假阳性问题的出现。
2.9 样品加标回收率
往不含呋喃唑酮的饲料中分别加入FZD使其添加量为10.0、50.0、100.0 μg/g,样品经提取后进行ELISA检测,每个质量浓度重复检测3 次,计算加标回收率,结果见表2。FZD样品的加标回收率为76.84%~88.31%,变异系数9.36%~15.79%。
表2 呋喃唑酮加标回收率
Table2 Recovery rates of FZD from blank samples

FZD添加量/(μg/g)变异系数/% 10.08.8388.3115.79 50.041.3282.6312.92 100.076.8476.849.36检出量平均值/(μg/g)平均回收率/%
以重氮化法制备的FZD-BSA为免疫抗原免疫小鼠,获得的脾细胞与骨髓瘤细胞SP2/0进行融合,筛选到一株稳定分泌抗FZD单克隆抗体的杂交瘤细胞C2-H5。采用动物体内生产单抗的方法,获得腹水,并进行纯化。其细胞培养上清液效价为1∶1 892;获得的鼠腹水效价为1∶2.49×10 6,蛋白质含量为43.36 mg/mL。采用硫酸铵沉淀法对腹水进行纯化,纯化后抗体效价为1∶7.06×10 5,蛋白回收率为16.79%。
对筛选到的抗呋喃唑酮单抗进行了特性鉴定。该单抗为IgG2b类,其重链约65 kD,轻链约25 kD。筛选到的单抗具有良好的特异性,与5 种硝基呋喃抗生素及其代谢物(FTD、NFT、NFZ、SEM、AOZ)的交叉反应率均低于0.01%。
建立了基于抗FZD单克隆抗体的间接竞争ELISA检测方法。实验得最佳抗原工作质量浓度为2 μg/mL,最佳抗体稀释度为1∶10 000,检测范围为10~500 ng/mL,IC 50值为0.06 μg/mL,最低检测限为6.92 ng/mL。本实验建立的检测方法重现性较好,平均误差为6.54%。样品加标回收率为76.84%~88.31%,变异系数为9.36%~15.79%。
参考文献:
[1] 崔效亮, 薛克友, 王玉莲, 等. 我国兽药研究开发的现状及发展趋势[J]. 中国兽药杂志, 2005, 39(7): 16-19. DOI:10.3969/ j.issn.1002-1280.2005.07.004.
[2] 侯韦莲, 胡世莲. 中国食品安全现状与控制措施[J]. 安徽预防医学杂志, 2007, 13(5): 363-365.
[3] 王习达, 陈辉, 吴光红, 等. 水产品中硝基呋喃类药物残留的检测与控制[J]. 现代农业科技, 2007, 36(18): 152-154. DOI:10.3969/ j.issn.1007-5739.2007.18.120.
[4] 张玲, 王鑫, 丁国婵, 等. 动物肝脏中呋喃唑酮残留量的快速检测与评价[J]. 上海畜牧兽医通讯, 2008(5): 44-45. DOI:10.3969/ j.issn.1000-7725.2008.05.025.
[5] 王荣艳, 贾丽, 贾东芬, 等. UPLC-MS/MS法快速测定水产品中硝基呋喃类代谢物残留[J]. 分析试验室, 2010, 29(增刊1): 368-370.
[6] 徐蓓, 徐志祥, 王凤侠, 等. 动物性食品中呋喃唑酮代谢物酶联免疫检测方法的研究[J]. 食品研究与开发, 2007, 28(12): 145-148. DOI:10.3969/j.issn.1005-6521.2007.12.044.
[7] 中华人民共和国药典委员会. 中华人民共和国药典(二部)[M]. 北京: 化学工业出版社, 1977: 206.
[8] GALEANO D T, LOPEZ M L. Rapid determination of nitrofurantoin, furazolidone and furaltadone in formulations feed and milk by high performance liquid chromatography[J]. Journal of Liquid Chromatography, 1994, 17(2): 457-475. DOI:10.1080/10826079408013364.
[9] KANIOU L, ZACHARIADIS G, KALLOGAS G. Separation and determination of carbadox, nitrofurazone, nitrofuratoin,furazolidone,f uraltadone in their mixtures by thin layer and high performance liquid chromatography[J]. Journal of Liquid Chromatography, 1994, 17: 1385-1398. DOI:10.1080/10826079408013771.
[10] 朱坚. 高效液相色谱-质谱法检测肉和水产品中硝基呋喃类药物的代谢物残留量[J]. 质谱学报, 2003, 24(增刊1): 121-122. DOI:10.3969/j.issn.1004-2997.2003.z1.061.
[11] 葛宝坤, 王云凤, 贺信. 高效液相色谱法测定鸡肉、水产品中呋喃西林和呋喃唑酮残留量的研究[J]. 中国卫生检验杂志, 2002, 12(6): 661-662. DOI:10.3969/j.issn.1004-8685.2002.06.008.
[12] 徐顺清, 刘衡川. 免疫学检验[M]. 北京: 人民卫生出版社, 2006: 64-78.
[13] 王重庆. 分子免疫学基础[M]. 北京: 北京大学出版社, 2003: 231-233.
[14] 朱海, 范放, 吕敬章, 等. 呋喃唑酮代谢物荧光纳米颗粒免疫层析法的建立[J]. 畜牧与饲料科学, 2009, 30(6): 32-34. DOI:10.3969/ j.issn.1672-5190.2009.06.015.
[15] 范放, 朱海, 洪小柳, 等. O139群霍乱弧菌荧光纳米颗粒试纸条的研制[J]. 分子诊断与治疗杂志, 2010, 2(1): 9-12. DOI:10.3969/ j.issn.1674-6929.2010.01.003.
[16] 常超, 伍金娥, 袁宗辉. 呋喃唑酮残留标示物人工抗原合成与抗体制备[J]. 食品科学, 2008, 29(4): 444-448. DOI:10.3321/ j.issn:1002-6630.2008.12.100.
[17] VASS M, DIBLIKOVA I, KOK E, et al. In-house validation of an ELISA method for screening of semicarbazide in eggs[J]. Food Additives and Contaminants, 2008, 25(8): 930-936. DOI:10.1080/02652030701883203.
[18] PIMPITAK U, PUTONG S, KOMOLPIS K. Development of a monoclonal antibody-based enzyme-linked immunosorbent assay for detection of the furaltadone metabolite, AMOZ, in fortified shrimp samples[J]. Food Chemistry, 2009, 116: 785-791. DOI:10.1016/ j.foodchem.2009.03.028.
[19] 汪莉, 杨湘霞, 霍雪霞. HPLC和ELISA法检测食品中呋喃唑酮[J]. 实用预防医学, 2009, 16(4): 1258-1260. DOI:10.3969/ j.issn.1006-3110.2009.04.117.
[20] 罗杰. 呋喃唑酮间接竞争ELISA(ciELISA)检测法的建立和氯霉素抗血清制备的研究[D]. 青岛: 中国海洋大学, 2005.
[21] 徐顺清, 刘衡川. 免疫学检验[M]. 北京: 人民卫生出版社, 2006: 64-78.
[22] 张远, 刘璞. 动物性食品中兽药残留问题及对策[J]. 中国动物检疫, 2005, 22(6): 31-33. DOI:10.3969/j.issn.1005-944X.2005.06.012.
[23] 刁石强, 吴燕燕, 李来好, 等. 高效液相色谱法测定水产养殖底泥中呋喃唑酮残留量的研究[J]. 南方水产, 2010, 6(2): 53-58. DOI:10.3969/j.issn.1673-2227.2010.02.009.
[24] 陈孝煊, 吴志新, 罗宇良, 等. 呋喃唑酮对饲养水体及草鱼体表粘液中菌群的影响[J]. 华中农业大学学报, 1999, 18(1): 68-71. DOI:10.3321/j.issn:1000-2421.1999.01.018.
[25] 景立新, 孙武平, 杨钦德, 等. 分光光度法快速测定海虾中呋喃唑酮残留量[J]. 光谱实验室, 2006, 23(3): 547-549. DOI:10.3969/ j.issn.1004-8138.2006.03.038.
Preparation and Application of Monoclonal Antibody against Furazolidone
CHEN Yinnan
1, CHEN Hua
1, SHI Xianai
1,2,*, YE Xiaojun
3, FAN Haiping
3
(1. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350108, China; 2. Fujian Key Laboratory of Medical Instrument and Pharmaceutical Technology, Fuzhou 350002, China; 3. Fresh Water Fisheries Research Institute of Fujian Province, Fuzhou 350002, China)
Abstract:Based on the hapten of furazolidone (FZD), a monoclonal (mAb)-based enzyme-linked immunosorbent assay (ELISA) method for the detection of FZD was established after the preparation of mAb against FZD-bovine serum albumin (BSA). The linear range for furazolidone detection was 10–500 ng/mL, and the IC 50was 0.06 μg/mL with a lowest detection limit of 6.92 ng/mL. Meanwhile, the mAb showed almost no cross reactivity with other nitrofurans or their metabolites. This method had good reproducibility, with an average error of 6.54%. In tested samples, the recovery for furazolidone addition was 76.84%–88.31%.
Key words:furazolidone (FZD); monoclonal antibody (mAb); enzyme-linked immunosorbent assay (ELISA)
DOI:10.7506/spkx1002-6630-201603029
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)03-0157-07
引文格式:
陈荫楠, 陈华, 石贤爱, 等. 抗呋喃唑酮单克隆抗体的制备及其应用[J]. 食品科学, 2016, 37(3): 157-163. DOI:10.7506/ spkx1002-6630-201603029. http://www.spkx.net.cn
CHEN Yinnan, CHEN Hua, SHI Xianai, et al. Preparation and application of monoclonal antibody against furazolidone[J]. Food Science, 2016, 37(3): 157-163. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603029. http://www.spkx.net.cn
收稿日期:2015-02-15
基金项目:国家海洋公益性行业科研专项(201205022-3);福建省科技重大专项(2013NZ0003);福建省海洋与渔业厅重点项目(闽海渔合同[2010]2-27号)
作者简介:陈荫楠(1991—),女,硕士,研究方向为酶制剂的研发与产业化。E-mail:165456164@qq.com
*通信作者:石贤爱(1971—),男,教授,博士,研究方向为高灵敏度生物检测。E-mail:shixa@fzu.edu.cn