β-淀粉酶的表达与酶学性质
张萧萧
1,牛丹丹
1,2,*,沈 微
3,李 玉
1,路福平
1
(1.天津科技大学生物工程学院,天津 300457;2.福州大学生物科学与工程学院,福建 福州 350108;3.江南大学生物工程学院,江苏 无锡 214036)
摘 要:本研究在构建重组表达质粒pPIC-BBA的基础上,构建并筛选获得了高分泌表达大麦β-淀粉酶的重组巴斯德毕赤酵母GS-BBA。重组酵母在摇瓶发酵条件下,能够分泌表达180 U/mL的β-淀粉酶酶活力。进一步对该重组酶的酶学性质进行了分析,重组β-淀粉酶的最适作用温度为55 ℃,最适作用pH值为5.0,在不高于55 ℃和在pH 3.0~10.0之间有良好的热稳定性和pH值稳定性。重组酶水解淀粉的主要产物为麦芽糖,在普鲁兰酶的协助下,其水解淀粉形成麦芽糖的最大转化率为78.28%。
关键词:β-淀粉酶;表达;酶学性质;麦芽糖
β-淀粉酶(β-amylase,BBA,EC3.2.1.2)是一种外切淀粉酶,作用于淀粉时,从α-1,4-糖苷键的非还原性末端顺次切下一个麦芽糖单位。β-淀粉酶水解直链淀粉分子时,水解产物主要是麦芽糖;β-淀粉酶作用于支链淀粉时,水解产物为麦芽糖和β-极限糊精。该酶作用底物时发生沃尔登转位反应,使产物由α型变为β型麦芽糖故名β-淀粉酶
[1-5]。
β-淀粉酶在食品加工等工业体系中的核心应用价值是麦芽糖制造
[6]。后者不仅是糖果糕点、啤酒发酵、医药辅料等多种工业加工中的基本原(辅)料,同时也是多种主要新型糖品如海藻糖、麦芽糖醇、低聚麦芽糖等生产中的重要或主要原料
[7-8]。
β-淀粉酶最早发现于高等植物中,主要包括大麦、小麦、甘薯、大豆等高等植物的种子内
[9-10]。现今,已经发现有报道微生物产生β-淀粉酶
[11]。目前,工业上来源的β-淀粉酶主要是通过植物提取获得,在目前已知的β-淀粉酶中,大麦来源的β-淀粉酶认识最清楚,使用最多,也是目前唯一商业化供应的β-淀粉酶,大麦来源的β-淀粉酶在酶学性质,特别是很好的最适作用pH值与最适作用温度,使其有利于其工业化应用
[12-13]。但由于植物来源的β-淀粉酶在植物中的含量较低,提取成本偏高,且所有这些酶制剂提取物都或多或少含有其他无关淀粉水解酶活,如α-淀粉酶、糖化酶等,影响其使用效果(麦芽糖浆中含有较高浓度的葡萄糖)。此外,微生物来源的β-淀粉酶尽管较早即有报道,但因为产酶水平太低以及其最适作用温度偏低,一直未能实现工业化生产
[14]。最近,国外有酶制剂企业在试图实施大豆β-淀粉酶的重组表达与高效制备
[15]。
为此,本研究运用巴斯德毕赤酵母(Pichia pastoris)表达系统,探索其分泌表达大麦β-淀粉酶的可行性,并在研究重组酶的酶学性质基础上,分析其水解淀粉后相应产物的组成特征。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
巴斯德毕赤酵母(Pichia pastoris)GS115用作表达宿主,质粒pPIC9K用作表达载体构建质粒,大肠杆菌(Escherichia coli)JM109用于质粒构建,由天津科技大学酶与应用微生物实验室保藏。质粒pMD-BBA由本实验室前期保藏,内含有编码大麦β-淀粉酶的人工合成基因序列。
1.1.2 试剂
限制性内切酶EcoRⅠ、NotⅠ、SalⅠ 立陶宛Fermentas公司;T4 DNA连接酶、聚合酶链式反应(polymerase chain reaction,PCR)扩增引物 生工生物工程(上海)股份有限公司;质粒小提试剂盒、产物纯化回收试剂盒和DNA胶回收试剂盒 美国Axygen公司;G418 美国Invitrogen公司;酵母氮基 美国BBI公司;DNA分子参照 宝生物工程(大连)有限公司;β-淀粉酶参照品及其糖品参照标准、真菌α-淀粉酶、普鲁兰酶 江苏锐阳生物科技有限公司;其他生化试剂均为国产分析纯。
1.1.3 培养基及其配制方法
LB、YPD、MD、G418-YPD、BMGY、BMMY等培养基及其配制方法参考美国Invitrogen公司的毕赤酵母表达手册
[16]。
1.2 方法
1.2.1 表达质粒pPIC-BBA的构建
以pMD-BBA质粒DNA为模板,以分别添加EcoRⅠ、NotⅠ酶切位点的寡核苷酸序列BBA-F:5’-CGGAATTCG ACAACGTCTTCCC AGACAAG-3’和BBA-R:5’-TTGCG GCCGCCTATTAGTCGAATGGGTTA-3’为引物,PCR扩增出β-淀粉酶成熟肽基因序列。PCR扩增条件设定为:95 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 2 min,30 个循环;72 ℃ 10 min。
将上述PCR产物用PCR产物纯化试剂盒纯化,再用EcoRⅠ、NotⅠ双酶切并纯化,将此酶切后PCR产物克隆入pPIC9 K的EcoRⅠ、NotⅠ位点,重组质粒pPIC-BBA在E. coli JM109中鉴定与保藏。
1.2.2 重组毕赤酵母的构建
将重组质粒pPIC-BBA经SalⅠ线性化后,电击转化入毕赤酵母GS115,涂布MD平板,30 ℃培养至转化子长出筛选His
+表型,将长出的转化子点种至补加有G418的YPD平板(G418质量浓度分别为0.5、2 mg/mL),30 ℃培养2 d,观察其生长,筛选多拷贝转化子,同时点至YPD淀粉检测平板,30 ℃培养2 d观察透明圈,挑选透明圈较大且生长良好的重组菌进行后续摇瓶发酵实验。
1.2.3 β-淀粉酶的诱导表达与酶活力测定
将上述透明圈较大且生长良好的重组菌株,按照毕赤酵母手册
[16]进行摇瓶发酵实验,诱导表达阶段每隔24 h补加甲醇至终体积分数为0.5%,期间每隔24 h取样,8 000 r/min离心10 min后对上清液中的β-淀粉酶活力进行测定。
β-淀粉酶酶活力测定采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法。酶活力单位定义为:1 mL酶液在pH 5.5、60 ℃的条件下,1 h水解可溶性淀粉产生1 mg麦芽糖即为一个酶活力单位,以U/mL表示。
测定步骤为:取9.0 mL 1.0 g/100 mL淀粉溶液含20 mmol/L磷酸氢二钠-柠檬酸(pH 5.5)于试管中,60 ℃预热5 min后加入1.0 mL的酶液准确反应30 min,立即移取0.5 mL反应液至装有1.5 mL DNS溶液的具塞比色管中,沸水浴15 min,取出,冷却至室温,加入10.5 mL蒸馏水摇匀并于550 nm波长处进行比色(OD
550
nm),空白管以失活的酶液代替原酶液。
绘制标准曲线:以OD
550
nm值为纵坐标,以葡萄糖毫克数为横坐标,绘制标准曲线。
测得OD
550
nm值后,由标准曲线计算出相应的葡萄糖毫克数,得常数K,再乘以1.9 倍,即为麦芽糖毫克数。
酶活力/(U/mL)=K×n×2×20×1.9
式中:K为根据标准曲线和OD
550
nm值计算得出的葡萄糖毫克数;n为稀释倍数;2为反应30 min换算成1 h;20为将吸取0.5 mL反应液换成10 mL;1.9为葡萄糖换算成麦芽糖系数。
1.2.4 酶学性质的测定
1.2.4.1 最适反应温度
分别在不同的温度(40、45、50、55、60、65、70 ℃)下按照1.2.3节中的方法测定β-淀粉酶酶活力,以最高酶活力为100%,计算其他温度下的相对酶活力,以确定其最适反应温度。
1.2.4.2 最适作用pH值
分别在不同pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0),缓冲液体系为20 mmol/L磷酸氢二钠-柠檬酸缓冲液下测定酶活力,以最高酶活力为100%,计算其他作用pH值下的相对酶活力,以确定β-淀粉酶的最适作用pH值。
1.2.4.3 热稳定性
将粗酶液分别放到50、55、60、65、70 ℃保温1 h,每隔15 min取样,在冰上放置10 min后测定酶活力,以未进行热处理的酶液的酶活力为100%,计算相对酶活力,确定β-淀粉酶的热稳定性。
1.2.4.4 pH值稳定性
将粗酶液用不同pH值缓冲液稀释(pH 3.0~8.0为20 mmol/L磷酸氢二钠-柠檬酸缓冲液,pH 9.0为20 mmol/L Tris-HCl缓冲液,pH 10.0~11.0 20 mmol/L碳酸氢钠-氢氧化钠缓冲液),在30 ℃保温1 h后测定酶活力,以未进行pH值作用的酶液的酶活力为100%计算残余酶活力,确定β-淀粉酶的pH值稳定性。
1.2.4.5 金属离子的影响
在底物中加入不同金属离子至终浓度分别为1 mmol/L和5 mmol/L,按照1.2.3节的方法测定酶活力,以不添加任何其他金属离子下测得的酶活力为100%,计算相对酶活力以比较不同金属离子对β-淀粉酶酶活力的影响。
1.2.5 制糖实验
称取适量麦芽糊精,配制成20 g/100 mL的溶液。调节pH值至5.0,预热后按50 U/g(干基)加入β-淀粉酶或按50 U/g(干基)加入β-淀粉酶和0.5 U/g(干基)加入普鲁兰酶,同时采用商品酶β-淀粉酶及真菌α-淀粉酶作为对照,分别按50 U/g(干基)及15 U/g(干基)的加酶量密封,于恒温水浴锅中进行糖化,温度维持在55 ℃,糖化反应50 h。糖化结束后取样,用高效液相色谱进行分析。
1.2.6 糖液组分的高效液相色谱分析
糖液样本用70%的无水乙醇沉淀预处理,4 ℃静置4 h后,离心20 min,取上清液用0.45 øm微孔滤膜过滤。色谱条件:Agilent ZORBAX NH
2氨基柱(4.6 mm×250 mm,5 øm),示差折光检测器,流动相:乙腈-水(68∶32,V/V),流速:0.7 mL/min,柱温:室温。麦芽糖标准参照品用纯净水配制成0.5~2.5 mg/mL;以保留时间定性出峰组成,以外标法通过峰面积计算糖液中麦芽糖含量。麦芽糖生成率定义为单位麦芽糊精(绝干)在酶促反应后的麦芽糖生成量,用质量分数表示。
2 结果与分析
2.1 重组菌的构建与鉴定
通过电转化法将线性化的重组质粒DNA转化入毕赤酵母GS115中,分别经过营养互补筛选、G418抗性复筛、PCR扩增验证以及淀粉平板水解圈筛选,获得具有较好分泌β-淀粉酶的重组酵母,将其命名为GS-BBA。由图1可知,GS-BBA在MD平板上生长良好,可以在含2 mg/mL的G418平板上生长,在淀粉平板上经甲醇诱导后可以形成清澈的淀粉水解圈,表明大麦β-淀粉酶已经在毕赤酵母GS115中成功实现分泌表达。
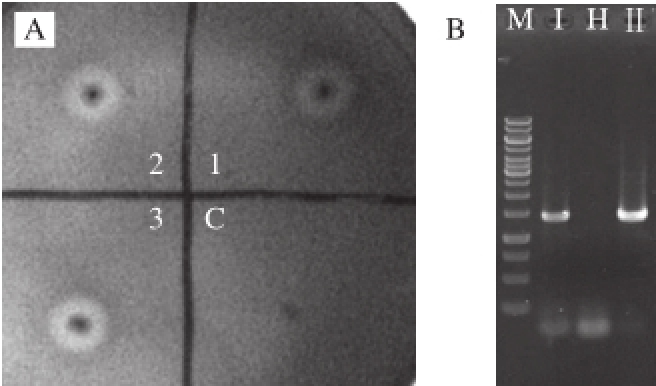
图1 重组酵母GS-BBA水解淀粉的能力
Fig.1 Starch hydrolysis activity of recombinant strain GS-BBA
A.重组酵母在含甲醇诱导的淀粉平板上生长及透明圈情况,1、2、3.携有β-淀粉酶基因的重组酵母GS-BBA,C.对照菌(含有空质粒pPIC9K的GS115);B.重组酵母染色体DNA的PCR鉴定,M. DNA Marker,Ⅰ和Ⅱ.分别以重组酵母GS-BBA 1、2的染色体DNA为模板的PCR扩增产物有目的条带,H.以对照菌GS115(pPIC9k)染色体DNA为模板的PCR扩增产物无目的条带。
2.2 重组酵母GS-BBA的发酵产酶进程
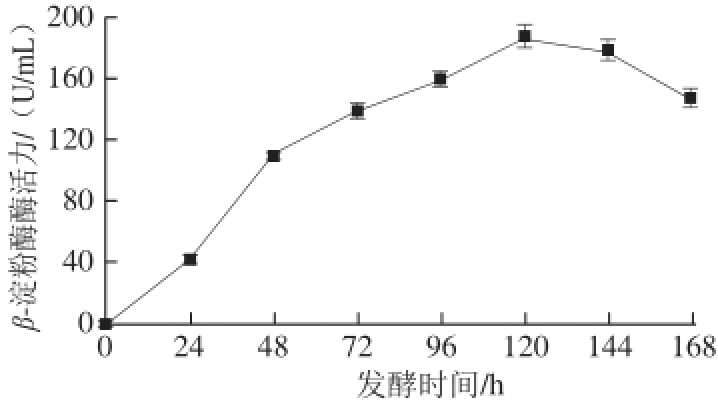
图2 重组菌摇瓶发酵产酶过程
Fig.2 β-Amylase produced by recombinant strain in shaking flask culture
诱导型表达摇瓶发酵实验按毕赤酵母操作手册进行
[16]。在250 mL三角瓶中进行甲醇诱导摇瓶发酵实验,定时取样分析酶活力,结果如图2所示。重组菌GS115-BBA在甲醇的诱导下能够持续合成与分泌β-淀粉酶,在发酵进行到120 h时,其产酶水平达到最高,为180 U/mL。
2.3 重组酶的酶学性质
2.3.1 最适反应温度
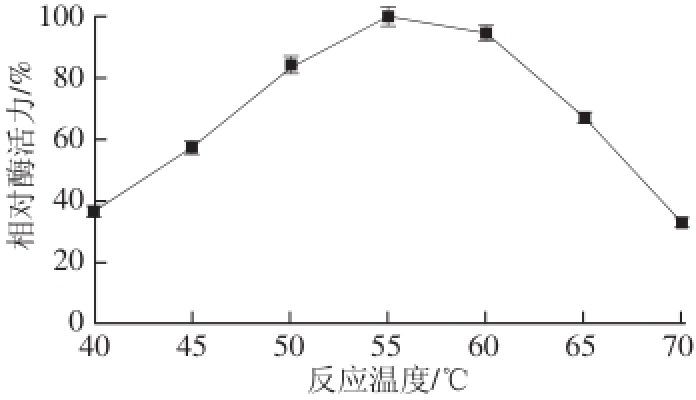
图3 重组-淀粉酶的最适温度
Fig.3 Optimal temperature of recombinant β-amylase
由图3可知,重组β-淀粉酶在低于55 ℃时,酶活力随着温度升高而升高,到55 ℃时酶活力达到最大值;高于55 ℃后酶活力则随着温度升高而下降,70 ℃时酶活力仅为最高酶活力的30%左右。可见,重组酶的最适反应温度为55 ℃,在50~60 ℃间皆具有较高的酶活力。
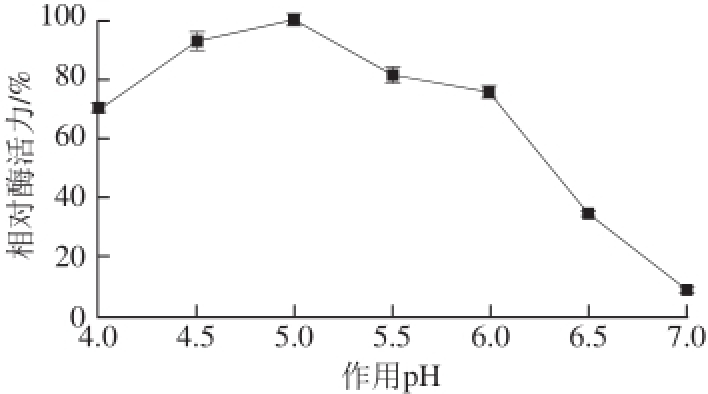
图4 重组β-淀粉酶的最适ppHH值
Fig.4 Optimal pH of recombinant β-amylase
2.3.2 最适作用pH值由图4可知,重组β-淀粉酶在pH 5.0条件下表现出最高酶活力,在pH 4.5~5.5之间具有很好的酶活力,pH 6.0之后则酶活力下降明显。
2.3.3 热稳定性
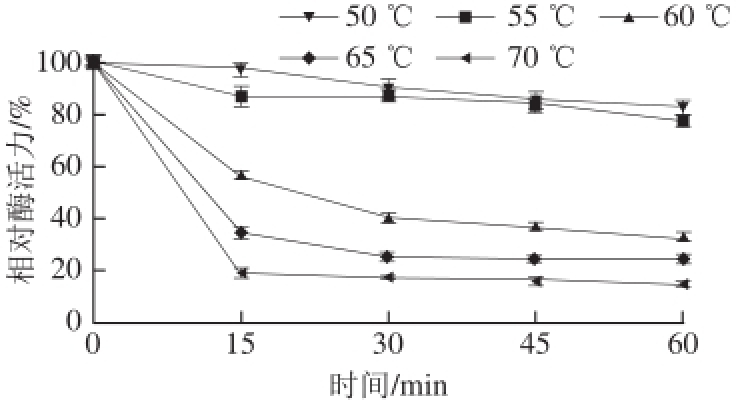
图5 重组β-淀粉酶的热稳定性
Fig.5 Thermostability of recombinant β-amylase
为进一步测定重组酵母分泌表达的β-淀粉酶的热稳定性,将重组酶酶液分别在50、55、60、65、70 ℃条件下保温1 h,每隔15 min取样,在冰上放置10 min后测定酶活力,以未进行热处理的酶液酶活力为100%,计算相对酶活力,结果见图5。重组β-淀粉酶在50 ℃和55 ℃保温1 h后酶活力仍保存80%左右,而65 ℃和70 ℃保温1 h后酶活力分别仅残留30%和20%左右。
2.3.4 pH值稳定性
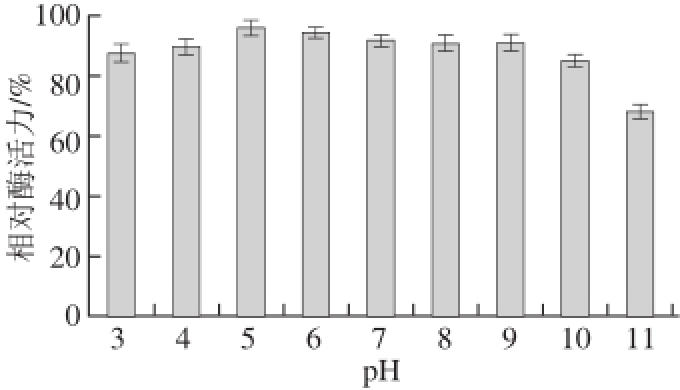
图6 重组β-淀粉酶的pH值稳定性
Fig.6 pH stability of recombinant β-amylase
重组毕赤酵母分泌表达的β-淀粉酶的pH值稳定性结果如图6所示,在pH 3.0~10.0缓冲液处理1 h后酶活力仍能保持85%以上,pH 10.0以后酶活力迅速降低。可见,重组β-淀粉酶具有良好的pH值稳定性。
2.3.5 金属离子对β-淀粉酶酶活力的影响
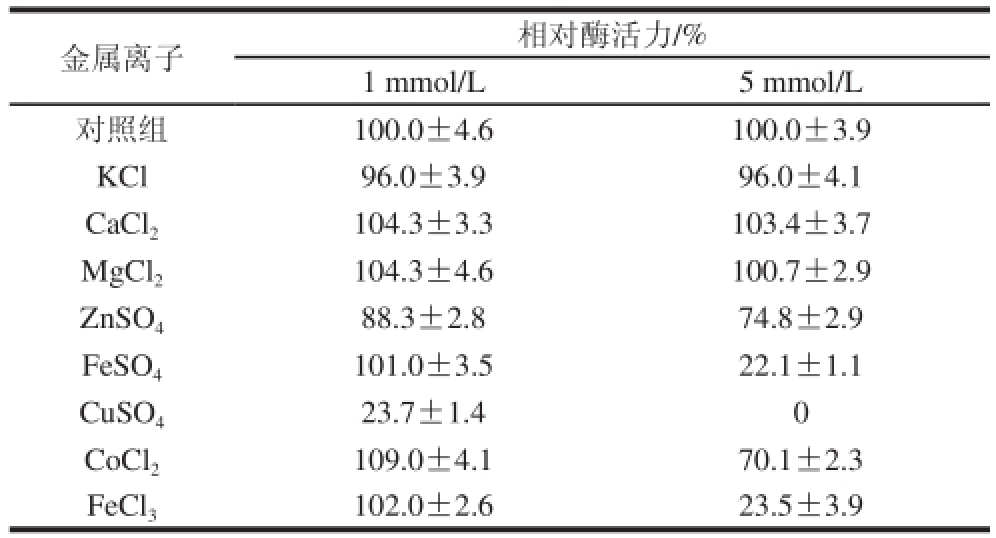
表1 金属离子对β-淀粉酶酶活力的影响
Table1 Effect of metal ions on the activity of recombinant β-amyyllaassee
金属离子相对酶活力/% 1 mmol/L5 mmol/ L对照组100.0±4.6100.0±3.9 KCl96.0±3.996.0±4.1 CaCl
2104.3±3.3103.4±3.7 MgCl
2104.3±4.6100.7±2.9 ZnSO
488.3±2.874.8±2.9 FeSO
4101.0±3.522.1±1.1 CuSO
423.7±1.40 CoCl
2109.0±4.170.1±2.3 FeCl
3102.0±2.623.5±3.9
由表1可知,与对照组相比,Ca
2+、Mg
2+、Co
2+、Fe
2+、Fe
3+添加浓度为1 mmol/L时会使β-淀粉酶酶活力有所升高,其余金属离子添加浓度为1 mmol/L时会降低其酶活力,而Cu
2+对β-淀粉酶有强烈抑制作用。而当金属离子的添加浓度为5 mmol/L时,除Ca
2+、Mg
2+会使β-淀粉酶酶活力有所升高外其余金属离子都会使β-淀粉酶酶活力降低。
2.4 淀粉水解实验及其产物分析
在含量20 g/100 mL的反应体系中分别考察单独使用重组β-淀粉酶和组合使用重组β-淀粉酶与普鲁兰酶进行糖化实验,同时采用商品酶β-淀粉酶及真菌淀粉酶作为对照。糖液中麦芽糖含量采用外标法用高效液相色谱分析进行定量检测,结果见图7。重组β-淀粉酶水解生成麦芽糖的能力与从植物提取的β-淀粉酶相似而明显优于真菌淀粉酶的作用,普鲁兰酶添加则同样有助于高含量麦芽糖的生成。在相同条件下,重组β-淀粉酶可以最高58.53%的转化率转化底物形成麦芽糖,真菌淀粉酶则仅以最高42.36%的转化率转化底物形成麦芽糖;在普鲁兰酶的协助下,重组β-淀粉酶可以最高78.28%的转化率转化底物形成麦芽糖。可见,此重组β-淀粉酶完全可以替代植物来源的β-淀粉酶及真菌淀粉酶,用于高麦芽糖浆的生产。

图7 酶促转化生成麦芽糖的过程
Fig.7 Maltose formation from maltodextrin by enzymatic hydrolysis
3 讨 论
大麦来源的β-淀粉酶的生产方式包括:1)以大麦或大麦麸皮为原料,经过水浸泡后,再进行分离、浓缩等工序制得。产品酶活力单一性好,转化淀粉为麦芽糖的转化率高,葡萄糖含量低;但提取效率低、废水量大、产品成本高。2)从大麦麦芽提取获得。产品收得率高,但酶系复杂,包含液化酶(α-淀粉酶)、糖化酶等酶活力,转化淀粉为麦芽糖时,会附带产生一定量的葡萄糖。除了β-淀粉酶外,可以满足麦芽糖浆生产的另外一种酶为糖化型真菌α-淀粉酶(真菌淀粉酶),糖化速率快是其最大的优点,但反应中葡萄糖生产量也较高,不利于高纯度麦芽糖的制备。本研究报道了重组大麦β-淀粉酶的制备及其应用属性,研究结果显示其具有良好的麦芽糖制造应用属性,可为通过发酵途径获得大麦β-淀粉酶提供理论支撑与技术支持。
Pichia表达系统已经成功应用于多种重要酶 制剂的工业化生产,其外源蛋白表达水平最高可达10 g/L
[17]。但其与其他酵母系统相似,在表达淀粉水解酶系时表达水平皆不高甚至不被表达
[18],机理尚不清楚。同样,大麦β-淀粉酶基因的异源高表达一直以来是困难的。日本学者曾报道将大麦β-淀粉酶基因在大肠杆菌中进行了异源表达,研究显示植物来源的大麦β-淀粉酶可在大肠杆菌中实现活性表达
[19];但同时发现,所表达的β-淀粉酶很容易被降解而失去活力(作者未发表数据)。另有报道,通过定点突变或化学修饰等,可以将大麦β-淀粉酶的耐热性与热稳定性提升
[20-23]。本研究将密码子优化的大麦β-淀粉酶基因在Pichia系统中成功实现了表达,表达水平已经具备一定的工业化应用前景。但与Pichia系统表达植酸酶、木聚糖酶等酶制剂的表达水平相比,产酶水平明显偏低。进一步提高其表达水平,可在如下三方面深入研究:1)通过定点突变,改变大麦β-淀粉酶的氨基酸序列中相关糖基化位点,降低糖基化负荷;2)通过分子进化获得高酶比活的β-淀粉酶突变体;3)研究并优化α-因子信号肽与β-淀粉酶成熟肽之间的适配性。
此外,近期的研究还显示,β-淀粉酶还可以经过一定的工艺条件应用于人造多分支淀粉(糊精)等新型食品添加剂的研制与生产
[24-25],本研究β-淀粉酶是否具有这方面的作用尚不清楚,将在后续的研究中进一步完善。
参考文献:
[1] KAPLAN F, GUY C L. β-Amylase induction and the protective role of maltose during temperature shock[J]. Plant Physiology, 2004, 135(3): 1674-1684. DOI:10.1104/pp.104.040808.
[2] DICKO M H, LEEUWEN S V, BELDMAN G, et al. Purification and characterization of β-amylase from Curculigo pilosa[J]. Applied Microbiology and Biotechnology, 1999, 52(6): 802-805. DOI:10.1007/ s002530051595.
[3] KAPLAN F, DONG Y S, GUY C L. Roles of β-amylase and starch breakdown during temperatures stress[J]. Physiol Plantarum, 2006, 126: 120-128. DOI:10.1111/j.1399-3054.2006.00604.x.
[4] HEINZ V, BUCKOW R, KNORR D. Catalytic activity of betaamylase from barley in different pressure/temperature domains[J]. Biotechnology Progress, 2005, 21(6): 1632-1638. DOI:10.1021/ bp0400137.
[5] TETLOW I J, EMES M J. A review of starch-branching enzymes and their role in amylopectin biosynthesis[J]. International Union of Biochemistry and Molecular Biology Life, 2014, 66(8): 546-558. DOI:10.1002/iub.1297.
[6] 陈淘声, 胡学智. 酶制剂生产技术[M]. 北京: 化学工业出版社, 1994: 274-288.
[7] ABDUL MANAS N H, PACHELLES S, MAHADI N M, et al. The characterisation of an alkali-stable maltogenic amylase from Bacillus lehensis G1 and improved malto-oligosaccharide production by hydrolysis suppression[J]. PLoS ONE, 2014, 9(9): e106481. DOI:10.1371/journal.pone.0106481.
[8] SHI Miaomiao, ZHANG Z hiheng, YU Shujuan, et al. Pea starch (Pisum sativum L.) with slow digestion property produced using β-amylase and transglucosidase[J]. Food Chemistry, 2014, 164: 317-323. DOI:10.1016/j.foodchem.2014.05.045.
[9] DIAZ A, SIEIRO C, VILLA T G. Production and partial characterization of a β-amylase by Xanthophyllomyces dendrorhous[J]. Letters in Applied Microbiology, 2003, 36: 203-207. DOI:10.1046/ j.1472-765X.2003.01289.x.
[10] SWANSTON J S, MOLINA-CANO J L. Beta-amylase activity and thermostability in two mutants derived from the malting barley cv. Triumph[J]. Journal of Cereal Science, 2001, 33: 155-161. DOI:10.1006/jcrs.2000.0364.
[11] 王惠权, 何秉旺. 微生物β-淀粉酶研究进展[J]. 微生物学通报, 1994, 21(1): 44-47. DOI:10.13344/j.microbiol.china.1994.01.012.
[12] MONROE J D, STORM A R, BADLEY E M, et al. β-Amylase1 and β-amylase 3 are plastidic starch hydrolases in Arabidopsis that seem to be adapted for different thermal, pH, and stress conditions[J]. Plant Physiology, 2014, 166: 1748-1763. DOI:10.1104/pp.114.246421.
[13] ZHANG Haitao, CHEN Tianlong, ZHANG Binglin, et al. Variation in β-amylase activity and thermostability in Tibetan annual wild and cultivated barley genotypes[J]. Journal of Zhejiang University: SCIENCE B, 2014, 15(9): 801-808. DOI:10.1631/jzus.B1400026.
[14] 张剑, 林庭龙, 秦瑛, 等. β-淀粉酶研究进展[J]. 中国酿造, 2009(4): 5-8. DOI:10.3969/j.issn.0254-5071.2009.04.002.
[15] TOTSUKA A, FUKAZAWA C. Expression and mutation of soybean beta-amylase in Escherichia coli[J]. European Journal of Biochemistry, 1993, 214: 787-794. DOI:10.1111/j.1432-1033.1993.tb17981.x.
[16] Pichia Expression Kit (Version F). A manual of methods for expression of recombinant proteins in Pichia pastoris[M]. U.S. Headquarters: Invitrogen Corporation. Catalog No.: K1710-01:1-62.
[17] CEREGHINO J L, CREGG J M. Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J]. FEMS Microbiology Reviews, 2000, 24(1): 45-66. DOI:10.1111/j.1574-6976.2000. tb00532.x.
[18] LI S, SUREN S, WANG Z X. Improved expression of Rhizopus oryzae α-amylase in the methylotrophic yeast Pichia pastoris[J]. Protein Expression and Puri cation, 2011, 79: 142-148. DOI:10.1016/ j.pep.2011.05.007.
[19] YOSHIGI N, OKADA Y, MAEBA H, et al. Construction of a plasmid used for the expression of a sevenfold-mutant barley β-amylase with increased thermostability in Escherichia coli and properties of the sevenfold mutant β-amylase[J]. Journal of Biochemistry, 1995, 118: 562-567.
[20] DABA T, KOJIMA K, INOUYE K. Chemical modification of wheat β-amylase by trinitrobenzenesulfonic acid, methoxypolyethylene glycol, and glutaraldehyde to improve its thermal stability and activity[J]. Enzyme and Microbial Technology, 2013, 53: 420-426. DOI:10.1016/j.enzmictec.2013.09.006.
[21] MA Y F, EVANS D E, LOGUE S J, et al. Mutations of barley betaamylase that improve substrate-binding affinity and thermostability[J]. Molecular Genetics and Genomics, 2001, 266: 345-352. DOI:10.1007/ s004380100566.
[22] MA Y F, EGLINTON J K, EVANS D E, et al. Removal of the four C-terminal glycine-rich repeats enhances the thermostability and substrate binding affinity of barley beta-amylase[J]. Biochemistry, 2000, 39(44): 13350-13355. DOI:10.1021/bi000688s.
[23] MIKAMI B, YOON H J, YOSHIGI N. The crystal structure of the sevenfold mutant of barley beta-amylase with increased thermostability at 2.5 A resolution[J]. Journal of Molecular Biology, 1999, 285: 1235-1243. DOI:10.1006/jmbi.1998.2379.
[24] WU A C, RAL J P, MORELL M K, et al. New perspectives on the role of α-and β-amylases in transient starch synthesis[J]. PLoS ONE, 2014, 9(6): e100498.1-e100498.10. DOI:10.1371/journal.pone.0100498.
[25] KITTISUBAN P, LEE B H, SUPHANTHARIKA M, et al. Slow glucose release property of enzyme-synthesized highly branched maltodextrins differs among starch sources[J]. Carbohydrate Polymers, 2014, 107: 182-191. DOI:10.1016/j.carbpol.2014.02.033.
Expression and Enzymatic Properties of β-Amylase
ZHANG Xiaoxiao
1, NIU Dandan
1,2,*, SHEN Wei
3, LI Yu
1, LU Fuping
1
(1. College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China; 2. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350108, China; 3. School of Biotechnology, Jiangnan University, Wuxi 214036, China)
Abstract:In this research, a recombinant Pichia pastoris strain GS-BBA overexpressing barley β-amylase was developed using the recombinant expression plasmid pPIC-BBA. Strain GS-BBA could produce approximately 180 U/mL β-amylase in shaking flask culture. The biochemical properties of the recombinant β-amylase were examined. The maximum activity was achieved under the conditions of pH 5.0 and 55 ℃. Meanwhile, its excellent thermostability and pH stability was observed at a temperature not exceeding 55 ℃ and in the pH range of 3.0–10.0. The recombinant enzyme could hydrolyze starch to form maltose as the major product. With the aid of pullulanase, it hydrolyzed starch to form maltose with a conversion efficiency up to 78.28%.
Key words:β-amylase; expression; enzymatic properties; maltose
DOI:10.7506/spkx1002-6630-201603030
中图分类号:Q814
文献标志码:A
文章编号:1002-6630(2016)03-0164-06
引文格式:
张萧萧, 牛丹丹, 沈微, 等. β-淀粉酶的表达与酶学性质[J]. 食品科学, 2016, 37(3): 164-169. DOI:10.7506/spkx1002-6630-201603030. http://www.spkx.net.cn
ZHANG Xiaoxiao, NIU Dandan, SHEN Wei, et al. Expression and enzymatic properties of β-amylase[J]. Food Science, 2016, 37(3): 164-169. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603030. http://www.spkx.net.cn
收稿日期:2015-03-11
基金项目:天津市应用基础与前沿技术研究计划(青年基金)项目(14JCQNJC09200);国家高技术研究发展计划(863计划)项目(2013AA102101)
作者简介:张萧萧(1989—),女,硕士研究生,研究方向为轻工技术与工程。E-mail:1058216362@qq.com
*通信作者:牛丹丹(1980—),女,助理研究员,博士,研究方向为工业菌种选育,酶制剂开发与应用。E-mail:ndd2002@126.com







