表1 感官评定标准
Table1 Sensory analysis standards

指标新鲜(10 分)不新鲜(6 分)腐败(3 分)严重腐败(0 分)外观黏液稀薄而透明,色泽鲜亮黏液变稀薄但严重混浊,无色泽气味有鱼腥味,蒸后有鱼香味黏液增多并稍显混浊,色泽暗淡黏液浓稠并混浊,色泽消失无鱼腥味,蒸后无鱼香味有酸腐味,蒸后有腐臭味有浓重的酸腐味,蒸后有浓重的腐臭味
唐文静,王楚文,柳云龙,宁喜斌*
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
摘 要:分离鉴定4 ℃冷藏条件下海鲈鱼的优势腐败菌,通过选择性培养基筛选获得单一菌株,对各菌株进行致腐能力的测定,确定冷藏海鲈鱼的优势腐败菌。对冷藏海 鲈鱼的优势腐 败菌进行菌落形态观察及部分生理生化实验、16S rDNA分子鉴定。结果表明,有4 株冷藏海鲈鱼优势腐败菌,其中1 株为草莓假单胞菌(Pseu domonas fragi),1 株为腐败希瓦氏菌(Shewanella putrefaciens),其余2 株为假单胞菌(Pseudomonas sp.)。在4 ℃冷藏条件下,草莓假单胞菌的致腐能力最强,其次是腐败希瓦氏菌和假单胞菌。
关键词:海鲈鱼;冷藏;优势腐败菌;分离;鉴定
鱼类在栖息、捕捞、贮运、加工等过程中受到微生物的污染,腐败微生物在鱼体上生长繁殖是引起鱼肉腐败变质的主要原因,鱼类的货架期受此影响而大大缩短 [1]。为了抑制腐败微生物的活动,目前应用较为广泛的保鲜方法是冷藏。但是,鱼类在冷藏过程中依然深受优势腐败菌(specifi c spoilage organism,SSO)的影响,鱼体上SSO的生长繁殖主导着鱼肉腐败变质的程度 [2]。因此,对冷藏鱼肉中SSO的确定,并进行靶向抑制对研究鱼肉保鲜显得尤为重要 [3]。经研究发现,鱼类的栖息环境和贮运条件影响着鱼体上SSO的组成和变化,在有氧冷藏条件下贮藏的鲜鱼SSO主要为希瓦氏菌(Shewanella)和(或)假单胞菌(Pseudomonas spp.) [4]。
海鲈鱼是我国沿海地区均产的一种重要的经济鱼类 [5],不仅肉质细腻鲜美、少有鱼骨,且具有较高的营养价值 [6]。随着海鲈鱼产量的逐年提升,依靠活鱼销售的方式已经远远不能适应市场的需求,因此海鲈鱼在保鲜方面的研究显得尤为重要,然而目前相关研究还尚少 [7],对冷藏海鲈鱼中SSO的研究也鲜有报道。鱼类SSO的筛选及鉴定的传统方法是使用各种选择性培养基筛选和生理生化实验的鉴定,随着检测技术的发展,研究人员开始使用分子检测技术检测鉴定鱼类的SSO。Lan Weiqing等 [8]利用聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCRDGGE)检测了在4 ℃有氧包装条件下带鱼的SSO;Macé等 [9]利用时间温度梯度凝胶电泳(temporal temperature gradient gel electrophesis,TTGE)检测了在不同温度条件下使用气调包装大马哈鱼的SSO;Wilson等 [10]使用了PCR-限制性片段长度多态性(restriction fragment length polymorphism,RFLP)检测了鳕鱼在不同季节不同水域里的SSO。
本研究通过使用选择性培养基和测定菌株的致腐能力确定冷藏海鲈鱼的优势腐败菌,利用菌落形态观察及部分生理生化实验、16S rDNA分子鉴定对冷藏海鲈鱼优势腐败菌进行鉴定。本实验可为冷藏海鲈鱼的腐败机理、抑制冷藏海鲈鱼的腐败、冷藏海鲈鱼的保鲜研究提供依据。
1.1 材料与培养基
海鲈鱼(0.6~0.8 kg/尾),购于上海铜川路水产批发市场。
假单胞菌选择性CFC琼脂培养基、铁琼脂培养基、结晶紫胆盐葡萄糖中性红琼脂(VRBGA)培养基、MRS琼脂培养基 山东青岛海博生物技术有限公司。
1.2 试剂与仪器
营养肉汤、MgO、硼酸、盐酸(均为分析纯) 国药集团化学试剂有限公司;Ezup柱式基因组DNA抽提试剂盒 生工生物工程(上海)股份有限公司。
Kjeltec2300 凯氏定氮仪 丹麦FOSS公司。
1.3 方法
1.3.1 菌落的分离和纯化
将鲜活海鲈鱼冰猝致死,放置于4 ℃条件下冷藏至腐败,于无菌条件下称取25.0 g腐败鱼肉充分研磨,加入225 mL无菌生理盐水中摇匀制成样品菌悬液,进行梯度稀释,选取适宜的稀释度吸取0.1 mL于各选择性培养基平板上均匀涂布,假单胞菌选择性CFC琼脂培养基平板、铁琼脂培养基平板和VRBGA培养基平板分别置于30、28、37 ℃条件下培养,MRS琼脂培养基平板置于37 ℃条件下厌氧培养,均培养24~48 h。挑选各典型菌落,反复进行平板划线,得到纯化的单菌落后保存。
1.3.2 优势腐败菌的筛选
对各菌株进行致腐能力的测定以确定冷藏海鲈鱼的优势腐败菌,致腐能力的测定由感官评定和挥发性盐基氮(TVB-N)含量的测定组成。
将保存的各菌株活化后分别制成菌悬液,通过预实验涂平板确定菌浓度,调整菌浓度为10 5~10 6CFU/mL。将无菌海鲈鱼块浸入各菌株的菌悬液中10 s后取出,置于无菌培养皿中,于4 ℃条件下冷藏,分别在0、2、4、6、8 d后进行感官评定,确定疑似优势腐败菌。
将疑似优势腐败菌活化后分别制成菌悬液,通过预实验涂平板确定菌浓度,调整菌浓度为10 5~10 6CFU/mL。将无菌海鲈鱼块浸入各疑似优势腐败菌株的菌悬液中10 s,取出置于无菌培养皿中,放于4 ℃条件下冷藏,在0、2、4、6、8 d时测定TVB-N含量,确定优势腐败菌。
1.3.3 无菌鱼块的制备
海鲈鱼去鳞、去内脏、清净后,于无菌条件下,用无菌水冲洗,用75%酒精擦拭鱼体,用无菌解剖刀切取背脊部内部无污染鱼肉,保持鱼块大小厚度基本一致,每块无菌鱼块为5 g左右 [11-12]。
1.3.4 感官评定
选择5 名经培训的感官评定员,对鱼块的外观和气味进行评价,感官评定标准如表1所示 [13-14]。
表1 感官评定标准
Table1 Sensory analysis standards

指标新鲜(10 分)不新鲜(6 分)腐败(3 分)严重腐败(0 分)外观黏液稀薄而透明,色泽鲜亮黏液变稀薄但严重混浊,无色泽气味有鱼腥味,蒸后有鱼香味黏液增多并稍显混浊,色泽暗淡黏液浓稠并混浊,色泽消失无鱼腥味,蒸后无鱼香味有酸腐味,蒸后有腐臭味有浓重的酸腐味,蒸后有浓重的腐臭味
1.3.5 TVB-N含量的测定
使用Kjeltec2300凯氏定氮仪进行测定,方法参考FOSS应用子报 [15]。以40 g/L硼酸为吸收液,0.1 mol/L盐酸滴定,精确称取5 g左右碾碎样品于到750 mL的蒸馏管中,加入1 g MgO和少许去离子水,连接到定氮仪进行测定 [16]。
1.3.6 优势腐败菌的形态特征和生理生化特征鉴定
对优势腐败菌的单菌落进行形态特征观察和生理生化特征鉴定。生理生化实验根据《伯杰氏系统细菌学手册》 [17]和《常见细菌系统鉴定手册》 [18]选择鉴定项目。具体生理生化实验方法参照《现代细菌学培养基和生化试验手册》 [19]。
1.3.7 优势腐败菌的分子生物学鉴定
将各优势腐败菌培养至对数期,使用E z u p柱式基因组D N A抽提试剂盒提取各菌株的总DNA,作为16S rDNA序列扩增反应模板。PCR扩增细菌的16S rDNA基因,PCR体系为引物27f(5’-AGAGTTTGATCCTGGCTCAG-3’)、1492r(5’-GGTTACCTTGTTACGACTT-3’)和模板各1 μL,2×Master Mix 12.5 μL,ddH 2O 9.5 μL。PCR反应程序:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,完成30 个循环,最后72 ℃延伸5 min,4 ℃保存。取5 μL 16S rDNA 扩增产物进行1%的琼脂糖凝胶电泳检验。将PCR扩增产物送至生工生物工程(上海)股份有限公司测序。使用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)中的BLAST对各菌株序列分析比对,选取同源性在99%以上的菌株序列,利用MEGA 6.05软件进行多重序列对比,并构建Neighbor-Joining系统发育树 [20-21]。
2.1 优势腐败菌的分离
样品 通过稀释涂布平板和平板划线分离方法,在假单胞菌选择性CFC琼脂培养基平板上依据菌落形态不同分离出5 株菌,编号为P1~P5,铁琼脂培养基平板上依据菌落形态不同分离出1 株菌,编号为S1,结晶紫胆盐葡萄糖中性红琼脂培养基平板上依据菌落形态不同分离出菌落形态各异的2 株菌,编号为V1、V2,MRS琼脂培养基平板上依据菌落形态不同分离出菌落形态各异的2 株菌,编号为L1、L2。
2.2 优势腐败菌的腐败特性
将上述10 株菌活化后制成菌悬液分别接种到无菌海鲈鱼块上,研究冷藏时间对接种各菌株的海鲈鱼块感官评定的影响,结果见图1。实验组的感官评定分值均比对照组低,其中接种菌株P2、P3、P4、S1鱼块的感官评分均极显著(P<0.01)低于接种其他6 株菌的鱼块。冷藏第4天时,接种菌株P2、P3、P4和S1的鱼块的感官 评分均极显著(P<0.01)下降;冷藏第8天时,接种菌株P2、P3、P4和S1的鱼块的感官评分均极显著(P<0.01)低于其他接种菌株的鱼块,接种菌株P4的鱼块的感官评分最低,为0.72 分,其次是接种菌株S1的鱼块,为0.76 分。经对比分析,确定菌株P2、P3、P4、S1为冷藏海鲈鱼的疑似优势腐败菌。

图1 冷藏时间对接种各菌株的海鲈鱼块感官评定的影响
Fig.1 Effect of refrigeration time on sensory analysis of sea bass piece inoculated with various bacteria
将冷藏海鲈鱼疑似优势腐败菌P2、P3、P4、S1制成菌悬液接种于无菌海鲈鱼块上,研究冷藏时间对接种疑似优势腐败菌的海鲈鱼块TVB-N含量的影响,结果见图2。根据GB/T 18108—2008《鲜海水鱼》 [22]规定,鲜海水鱼的TVB-N含量≤15 mg N/100 g为一级品,TVB-N含量≤20 mg N/100 g为二级品,TVB-N含量≤30 mg N/ 100 g为三级品。

图2 冷藏时间对接种疑似优势腐败菌的海鲈鱼块TVB-N含量的影响
Fig.2 Effect of refrigeration time on TVB-N value of sea bass piece inoculated with suspected dominant spoilage bacteria
由图2可知,冷藏第4天时,接种菌株P2、P3、P4、S1鱼块的TVB-N含量极显著(P<0.01)大于对照鱼块,分别为68.81、21.61、95.35、76.52 mg N/100 g;冷藏第6天时,接种菌株P3鱼块的TVB-N含量迅速上升,为121.19 mg N/100 g;冷藏第8天时,接种菌株P2、P3、P4、S1鱼块的TVB-N含量极显著(P<0.01)高于对照鱼块,远远超过标准规定,且接种菌株P4鱼块的TVB-N含量最高,其次是接种菌株S1、P3、P2的鱼块。经对比分析,确定菌株P2、P3、P4、S1为冷藏海鲈鱼的优势腐败菌。
2.3 优势腐败菌的鉴定
2.3.1 优势腐败菌的形态特征及生理生化鉴定观察冷藏海鲈鱼的4 株优势腐败菌的形态特征,并进行生理生化实验,根据《伯杰氏系统细菌学手册》 [17]和《常见细菌系统鉴定手册》 [18]判定结果,结果见表2。
表2 冷藏海鲈鱼的优势腐败菌的形态特征及生理生化特征
Table2 Morphological and physiological characteristics of dominant spoilage bacteria in chilled sea bass
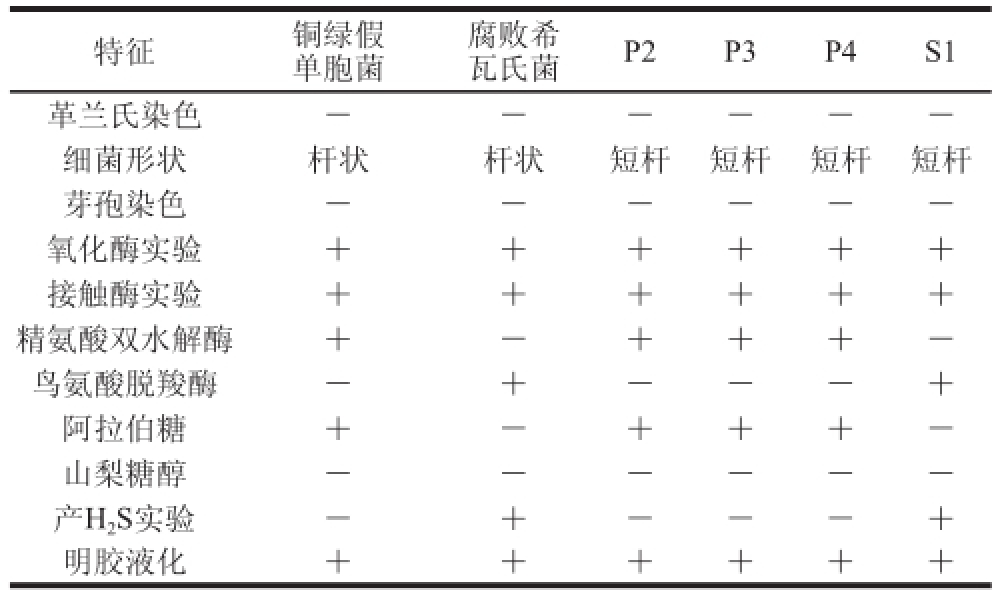
注:“+”.结果为阳性,“-”.结果为阴性。
特征铜绿假单胞菌腐败希瓦氏菌P2P3P4S1革兰氏染色------细菌形状杆状杆状短杆短杆短杆短杆芽孢染色------氧化酶实验++++++接触酶实验++++++精氨酸双水解酶+-+++-鸟氨酸脱羧酶-+---+阿拉伯糖+-+++-山梨糖醇------产H 2S实验-+---+明胶液化++++++
2.3.2 优势腐败菌的分子鉴定
利用1%的琼脂糖凝胶电泳检测4 株冷藏海鲈鱼优势腐败菌的16S rDNA扩增产物,均得到特异性条带,片段大小为1 500 bp左右,电泳图谱如图3所示。

图3 4 株冷藏海鲈鱼优势腐败菌的16S rDNA电泳图谱
Fig.3 Electropherogram of 16S rDNA genes from four dominant spoilage bacteria in chilled sea bass
将冷藏海鲈鱼的4 株优势腐败菌未纯化16S rDNA扩增产物送检测序后,使用NCBI的BLAST分析,选取同源性在99%以上的菌株序列,利用MEGA 6.05软件进行多重序列对比、构建Neighbor-Joining系统发育树,细菌系统发育树见图4。菌株P2、P3与Pseudomonas sp.亲缘关系最近,菌株P4与Pseudomonas fragi亲缘关系最近,菌株S1与Shewanella sp.亲缘关系最近。

图4 基于16S rDNA序列同源性的4 株优势腐败细菌系统发育树
Fig.4 Phylogenetic tree of four dominant spoilage bacteria based on 16S rDNA sequences
结合4 株优势腐败菌的菌落形态及部分生理生化实验和分子鉴定,可判定菌株P2、P3、P4为假单胞菌属(Pseudomonas sp.),其中菌株P4为草莓假单胞菌(Pseudomonas fragi),菌株S1为腐败希瓦氏菌(Shewanella putrefaciens)。故4 株优势腐败菌分别为Pseudomonas P2、Pseudomonas P3、Pseudomonas fragi P4、Shewanella putrefaciens S1。
本研究得出冷藏海鲈鱼的优势腐败菌主要为假单胞菌和腐败希瓦氏菌,与其他相关研究结果相似。蓝蔚青等 [23]对冷藏鲳鱼贮藏期间的细菌种群变化进行了研究,研究发现荧光假单胞菌与腐败希瓦氏菌为鲳鱼冷藏期间的优势腐败菌。崔正翠等 [24]研究了冷藏大菱鲆细菌组成变化和优势腐败菌,结果表明在0~10 ℃冷藏过程中大菱鲆的优势腐败菌是腐败希瓦氏菌,其次是假单胞菌。郭全友等 [25]对冷藏罗非鱼优势腐败菌进行了鉴定,确定了假单胞菌为0~10 ℃贮藏罗非鱼的优势腐败菌。本课题组将对冷藏海鲈鱼分离出的优势腐败菌进行深入研究,探索各优势腐败菌的特征及抑制生长方法,为冷藏海鲈鱼的保鲜作参考。
本研究从腐败冷藏海鲈鱼肉中获得10 株形态各异的菌株,经过菌株致腐能力测定确定菌株P2、P3、P4、S1为冷藏海鲈鱼的优势腐败菌。在4 ℃冷藏条件下,优势腐败菌P4的致腐能力最强,其次是优势腐败菌S1、P3,优势腐败菌P2的致腐能力最弱。对冷藏海鲈鱼的优势腐败菌P2、P3、P4、S1进行16S rDNA分子鉴定、菌落形态观察及部分生理生化实验鉴别,得到4 株优势腐败菌,分别为2 株假单胞菌、1 株草莓假单胞菌和1 株腐败希瓦氏菌。
参考文献:
[1] 李颖畅, 王亚丽, 齐凤元, 等. 紫菜多糖提取物对冷藏鲈鱼品质的影响[J]. 食品工业科技, 2014, 35(22): 336-339; 348. DOI:10.13386/ j.issn1002-0306.2014.22.065.
[2] GRAM L, DALGAARD P. Fish spoilage bacteria: problems and solutions[J]. Current Opinion in Biotechnology, 2002, 13(3): 262-266. DOI:10.1016/S0958-1669(02)00309-9.
[3] 章志超, 桂萌, 李平兰. 鱼源特定腐败菌及其应用研究进展[J]. 肉类研究, 2014, 28(3): 25-30. DOI:10.3969/j.issn.1001-8123.2014.03.006.
[4] 许振伟, 许钟, 杨宪时, 等. 鱼类腐败菌腐败能力测定方法[J]. 食品科学, 2010, 31(20): 355-359.
[5] 王慧敏, 王庆丽, 朱军莉. 鲈鱼在微冻贮藏下品质及优势腐败菌的变化[J]. 食品工业科技, 2013, 34(20): 330-335.
[6] 邓锦锋, 王安利, 周初霞, 等. 鲈鱼的营养研究进展[J]. 饲料工业, 2006, 27(10): 59-60. DOI:10.3969/j.issn.1001-991X.2006.10.017.
[7] 曾名勇, 黄海. 鲈鱼在微冻保鲜过程中的质量变化[J]. 中国水产科学, 2001, 8(4): 67-70. DOI:10.3321/j.issn:1005-8737.2001.04.015.
[8] LAN Weiqing, XIE Jing. Characterization of the dynamic changes of microorganisms in cutlassfish (Trichiurus haumela) under the cold storage with composite natural preservatives based on culturedependent and 16S rRNA-DGGE technology[J]. Advanced Materials Research, 2012, 554: 1498-1506.
[9] MACÉ S, JOFFRAUD J J, CARDINAL M, et al. Evaluation of the spoilage potential of bacteria isolated from spoiled raw salmon (Salmo salar) fi llets stored under modifi ed atmosphere packaging[J]. International Journal of Food Microbiology, 2013, 160(3): 227-238. DOI:10.1016/j.ijfoodmicro.2012.10.013.
[10] WILSON B, DANILOWICZ B S, MEIJER W G. The diversity of bacterial communities associated with Atlantic cod Gadus morhua[J]. Microbial Ecology, 2008, 55(3): 425-434. DOI:10.1007/s00248-007-9288-0.
[11] 许振伟. 冷藏鱼类腐败菌腐败能力分析[D]. 上海: 上海海洋大学, 2011. DOI:10.7666/d.y1946828.
[12] VOLPE M G, SIANO F, PAOLUCCI M, et al. Active edible coating effectiveness in shelf-life enhancement of trout (Oncorhynchusmykiss) fi llets[J]. LWT-Food Science and Technology, 2015, 60(1): 615-622. DOI:10.1016/j.lwt.2014.08.048.
[13] ÓLAFSDÓTTIR G, LAUZON H L, MARTINSDOTTIR E, et al. Influence of storage temperature on microbial spoilage characteristics of haddock fillets (Melanogrammus aeglefinus) evaluated by multivariate quality prediction[J]. International Journal of Food Microbiology, 2006, 111: 112-125. DOI:10.1016/ j.ijfoodmicro.2006.04.045.
[14] PARLAPANI F F, MALLOUCHOS A, HAROUTOUNIAN S A, et al. Microbiological spoilage and investigation of volatile profi le during storage of sea bream fi llets under various conditions[J]. International Journal of Food Microbiology, 2014, 189: 153-163. DOI:10.1016/ j.ijfoodmicro.2014.08.006.
[15] FOSS公司. ASN 3140鲜鱼和冻鱼中挥发性盐基氮(TVB-N)的测定[R]. FOSS应用子报, 2002-08-16.
[16] 苏辉, 谢晶, 黎柳, 等. 不同温度下鲳鱼品质及微观组织的变化研究[J].现代食品科技, 2014, 30(8): 106-111.
[17] 希坎南R E. 伯杰氏细菌鉴定手册[M]. 北京: 科学出版社, 1989: 323-378.
[18] 东秀珠, 蔡妙英. 常见的细菌鉴定手册[M]. 北京: 科学出版社, 2001: 274-281.
[19] 郝士海. 现代细菌学培养基和生化试验手册[M]. 北京: 中国科学技术出版社, 1992: 434-493.
[20] 袁春红, 张庆, 向文良, 等. 豆腐干优势腐败菌的分离鉴定及腐败特性分析[J]. 食品科技, 2014, 39(1): 312-316.
[21] 黄林, 陈全胜, 张燕华, 等. 冷却猪肉优势腐败菌分离鉴定及致腐能力测定[J]. 食品科学, 2013, 34(1): 205-209.
[22] 中国水产科学研究院黄海水产研究所, 中国水产科学研究院. GB/T 18108—2008 鲜海水鱼[S]. 北京: 中国标准出版社, 2008.
[23] 蓝蔚青, 谢晶, 施建兵, 等. 冷藏鲳鱼贮藏期间的细菌种群变化[J].食品与生物技术学报, 2013, 32(11): 1141-1148. DOI:10.3969/ j.issn.1673-1689.2013.11.004.
[24] 崔正翠, 许钟, 杨宪时, 等. 冷藏大菱鲆细菌组成变化和优势腐败菌[J].食品科学, 2011, 32(13): 184-187.
[25] 郭全友, 杨宪时, 许钟. 冷藏罗非鱼优势腐败菌的鉴定及其特征[J].食品与机械, 2009(3): 87-90.
Isolation and Identification of Specific Spoilage Organisms in Chilled Sea Bass
TANG Wenjing, WANG Chuwen, LIU Yunlong, NING Xibin*
(Shanghai Engineering Research Center of Aquatic-Product Processing and Preservation, College of Food Science and Technology, Shanghai Ocean University, Shanghai 20 1306, China)
Abstract:The specifi c spoilage organisms (SSOs) were isolated and identifi ed from chilled sea bass under 4 ℃ refrigerated condition. These SSOs were individually isolated using selective medium and their spoilage ability was analyzed. These isolates were identifi ed based on morphological, physiological and biochemical characteristics and 16S rDNA sequence analyses. The results showed there were 4 SSOs present in chilled sea bass, including one Pseudomonas fragi, one Shewanella putrefaciens, and two Pseudomonas sp.. In refrigerated condition at 4 ℃, the spoilage ability of Pseudomonas fragi was the highest, followed by Shewanella putrefaciens and Pseudomonas sp..
Key words:sea bass; chilled; specifi c spoilage organism; isolation; identifi cation
DOI:10.7506/spkx1002-6630-201603031
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2016)03-0170-05
引文格式:
唐文静, 王楚文, 柳云龙, 等. 冷藏海鲈鱼优势腐败菌的筛选和鉴定[J]. 食品科学, 2016, 37(3): 170-174. DOI:10.7506/ spkx1002-6630-201603031. http://www.spkx.net.cn
TANG Wenjing, WANG Chuwen, LIU Yunlong, et al. Isolation and identification of specific spoilage organisms in chilled sea bass[J]. Food Science, 2016, 37(3): 170-174. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603031. http://www.spkx.net.cn
收稿日期:2015-03-11
基金项目:上海市科委工程中心建设项目(11DZ2280300)
作者简介:唐文静(1990—),女,硕士研究生,研究方向为食品微生物。E-mail:wenjing_24@163.com
*通信作者:宁喜斌(1964—),男,教授,博士,研究方向为食品微生物、食品安全。E-mail:xbning@shou.edu.cn