范 璟 1,席雪冬 2,黄 彦 3,崔中利 3,*
(1.东南大学附属第二医院生物治疗中心,江苏 南京 210003;2.沈阳农业大学植物保护学院,辽宁 沈阳 110866;3.南京农业大学生命科学学院,农业部农业环境微生物重点开放实验室,江苏 南京 210095)
摘 要:为获得植物乳杆菌G63高效的电转化方法,本研究从细胞生长状态、细胞弱化剂质量浓度、洗涤液、质粒添加量和电击参数等方面对菌株G63的电转化效率进行优化。结果表明:取菌株G63对数生长中期的细胞制备感受态,以1 g/100 mL甘氨酸作为细胞弱化剂,分别用1 mmol/L MgCl 2和30 g/100 mL聚乙二醇1000洗涤细胞,并用30 g/100 mL聚乙二醇1000作为电击液,加入20 μg穿梭质粒,在1.5 kV和400 Ω条件下进行电击,可以获得最高的电转化效率,转化效率达到1.18×10 3CFU/μg DNA,满足后续遗传学实验要求。
关键词:植物乳杆菌;电转化;转化效率
乳酸菌(lactic acid bacteria,LAB)是指利用糖或其他碳源产生乳酸的一类不产芽孢、革兰氏阳性细菌的总称 [1]。目前,乳酸菌在细菌分类学上被划分为23 个属 [2]。其中乳杆菌属(Lactobacillus)已广泛用于发酵肉制品、饮料及饲料生产等行业中。
乳杆菌属于革兰氏阳性细菌,细胞壁较厚,采用经典的热激方法不能有效地导入外源DNA。因此,目前乳杆菌的转化方法主要分为两种:一是原生质体法,但该方法操作繁琐,稳定性差已被淘汰;二是电转化方法,此方法具有操作简便,转化率高的特点而被广泛应用 [3]。本研究采用电转化法导入外源DNA。
乳杆菌电转化受很多因素的影响,其中细胞弱化剂的选择是决定电转化成功与否的重要条件之一。据文献报道,乳杆菌的常用细胞弱化剂有甘氨酸、青霉素和溶菌酶等 [4-6]。但Piuri等 [7]发现,有的乳杆菌对于细胞壁水解酶(例如溶解酶和变溶菌素)有一定抗性。除了细胞弱化剂外,细胞的生长状态、细胞洗涤剂、电击液、电击条件及质粒浓度等对转化效率都有一定影响 [8]。此外,研究表明,乳酸菌的有些种属中存在限制性修饰系统(restriction-modi cation system),这一系统可抵御外源DNA,从而降低电转化效率 [9]。
植物乳杆菌(Lactobacillus plantarum)G63由南京农业大学微生物实验室分离所得,含有3 个内源性质粒,前期实验发现常用的乳酸菌电转化方法不能将外源质粒转入菌株G63中 [9]。因此本研究旨在建立一套Lactobacillus plantarum G63的电转化方法,并对该方法进行优化,为以后从分子水平更深入地研究该菌株提供基础条件。
1.1 菌株与质粒
植物乳杆菌G63、植物乳杆菌NC8、乳酸乳球菌(Lactococcus lactis)MG1363、大肠杆菌(E. coli)10B南京农业大学微生物实验室保存。
质粒pMD19-T(带有氨苄青霉素抗性基因) 日本TaKaRa公司;质粒pNZ8048(带有氯霉素抗性基因,质粒大小为3 047 bp,为大肠杆菌-乳杆菌的穿梭质粒 [10])由南京农业大学微生物实验室保存。
1.2 培养基
MRS培养基用于L. plantarum G63的培养。配方为:蛋白胨10 g、酵母提取物5 g、磷酸氢二钾2 g、柠檬酸二铵2 g、乙酸钠5 g、吐温-80 1 mL、1 m o l/L M g S O 4•7 H 2O 2.4 m L、0.1 2 5 g/m L MnSO 4•7H 2O 1.36 mL、牛肉膏10 g。固体培养基中再加入碳酸钙10 g和琼脂15 g。配制完成后用去离子水定容至1 L,在121 ℃条件下灭菌20 min。使用前,按0.5 g/mL加入50 g/100 mL的葡萄糖 [11]。
LB培养基用于 E. coli的培养。配方为蛋白胨10 g、酵母提取物5 g、氯化钠10 g,配制完成后调pH值至7.4并用去离子水定容至1 L,121 ℃灭菌20 min。
1.3 试剂与仪器
质粒构建所需限制性内切酶、T4连接酶、Prime STAR HS DNA聚合酶和dNTP 日本TaKaRa公司;质粒提取试剂盒和胶回收试剂盒 北京百泰克生物技术有限公司。
Bio-Rad PTC-200型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 美国Bio-Rad公司;BTX ECM630型电转仪 美国BTX公司;Microfuge 22R台式微量冷冻离心机 美国Beckman公司。
1.4 方法
1.4.1 植物乳杆菌-大肠杆菌穿梭质粒的构建
菌株G63包含3 个内源性质粒,分别为pG6301、pG6302和pG6303 [12]。提取菌株G63内源性质粒,以其为模板,OriF/O riR为引物扩增质粒pG6301复制所需区域,全长为2 048 bp。将上述PCR产物电泳后切胶回收纯化,通过TA克隆与克隆载体pMD19-T连接,测序验证序列正确后,将该质粒命名为pMD19-Ori。再以质粒pNZ8048为模板,CmF-ScaⅠ/CmR-AatⅡ为引物扩增包含有完整氯霉素基因及其启动子的片段,全长为892 bp。再将PCR产物电泳后切胶回收纯化,通过TA克隆与克隆载体pMD19-T连接,测序验证序列正确后,将该质粒命名为pMD19-Cm。用限制性内切酶ScaⅠ和AatⅡ分别酶切质粒pMD19-Ori和pMD19-Cm,电泳后切胶回收相应片段,再将回收片段进行酶联转化,通过测序验证后,将序列正确的载体命名为pMD19-6301ori。
以上引物均委托南京金斯瑞生物科技有限公司合成,引物序列如下:O r i F:5’-CACAAGAGCGTTCAGAGGG-3’,OriR:5’-AATCTTTACCGGCATATTCTCC-3’,CmF-ScaⅠ:5’-AGTACTTATAGAGCAAGTTATGCAAAGG-3’,CmR-AatⅡ:5’-GACGTCTACAGTCGGCATTATCTCAT AT-3’,酶切位点用下划线表示。
1.4.2 感受态细胞制备
将L. plantarum G63单菌落接入3 mL MRS液体培养基试管中,37 ℃静置培养12 h,再按1%的体积比接种至50 mL液体MRS培养基中,37 ℃静置培养至一定浓度,冰浴10 min,于4 ℃、4 500 r/min 离心7 min来收集细胞,去上清,分别用预冷的1 mmol/L MgCl 2和30 g/100 mL聚乙二醇(polyethylene glycol,PEG)洗涤细胞,最后将细胞重悬于30 g/100 mL PEG中,电转化备用。
1.4.3 L. plantarum G63的电转化及转化子的验证
取一定量质粒DNA与80 μL感受态细胞混匀,冰浴5 min后转入预冷的规格为0.2 cm的电转杯中,设置好电转参数后进行电击,电击完毕后立即加入800 μL液体MRS培养基,并在37 ℃静置温育2 h,然后取80 μL涂布于氯霉素抗性平板,37 ℃静置培养48 h后观察并记录转化子个数。
将上述获得的抗性单菌落接种于3 mL MRS液体培养基中,37 ℃静置培养过夜。收集菌体细胞并用TE缓冲液进行洗涤,去上清后加入80 μL溶液Ⅰ,20 μL溶菌酶和5 μL RNase,于37 ℃放置1 h,按照试剂盒使用说明提取质粒DNA。以该质粒为模板,CmF/CmR为引物通过PCR扩增氯霉素抗性基因,并用1%琼脂糖凝胶电泳检测。
引物CmF和CmR委托南京金斯瑞生物科技有限公司合成,引物序列如下:CmF:5’-TATAGAGCAAGTT ATGCAAAGG-3’,CmR:5’-TACAGTCGGCA TTATCTCATAT-3’。
1.4.4 L. plantarum G63不同生长时期对转化效率的影响测定
选择不同生长阶段的菌株G63制备感受态细胞,并选用1 mmol/L MgCl 2和30 g/100 mL PEG1500作为细胞洗涤剂,在1.5 kV和400 Ω条件下电击。
1.4.5 不同质量浓度细胞弱化剂对转化效率的影响测定
以甘氨酸作为细胞弱化剂,选择不同质量浓度甘氨酸对细胞菌株G63进行培养并制备感受态细胞,选用1 mmol/L MgCl 2和30 g/100 mL PEG1500作为细胞洗涤剂,并在1.5 kV和400 Ω条件下电击。
1.4.6 不同分子质量的PEG对转化效率的影响测定
选用最适甘氨酸浓度培养菌株G63,并在最适生长阶段制备感受态细胞,选用1 mmol/L MgCl 2和不同分子质量的30 g/100 mL PEG作为细胞洗涤剂,并选用相对应同样分子质量的30 g/100 mL PEG作为电击缓冲液,并在1.5 kV和400 Ω条件下进行电击。
1.4.7 不同质粒添加量对转化效率的影响测定
选择上述经优化的最适条件制备感受态,分别取0.5、1、3、6、10、20、30、40、50、60 μg的质粒加入到感受态细胞中,在1.5 kV和400 Ω条件下进行电击。
1.4.8 不同电转化条件对转化效率的影响测定
分别测定电阻值在200 Ω和400 Ω条件下,当电场强度为1.25、1.5、1.75 kV时菌株G63的转化效率。而感受态制备和其他条件则选择经上述优化后的最适条件。
1.4.9 选择不同菌株进行电转化验证
本研究选用L. plantarum NC8和L. lactis MG1363进行电转化验证,电转化方法为上述优化后的最适条件,质粒选用pMD19-6301ori。
1.4.10 电转化效率的计算
以上优化实验均作3 次重复。根据质粒质量浓度,计算每微克质粒所得转化子的数目,计算公式如下。
2.1 植物乳杆菌-大肠杆菌穿梭质粒pMD19-6301ori的构建
前期实验已表明L. plantarum G63含3 个内源性质粒,分别为pG6301、pG6302和pG6303,通过测序及序列比对发现其中质粒pG6301有比较明确的复制区域,且有文献报道乳酸菌中存在限制性修饰系统,该系统会显著降低电转化效率 [12-13]。本研究选择构建与菌株G63亲缘关系较近的穿梭质粒来优化其电转化效率。构建方法见1.4.1节。构建完成的穿梭质粒pMD19-6301ori大小在5 187 bp,包含了分别可在植物乳杆菌和大肠杆菌中复制的复制区域,并含有氯霉素抗性基因,可用于后续转化子的筛选,结果见图1。
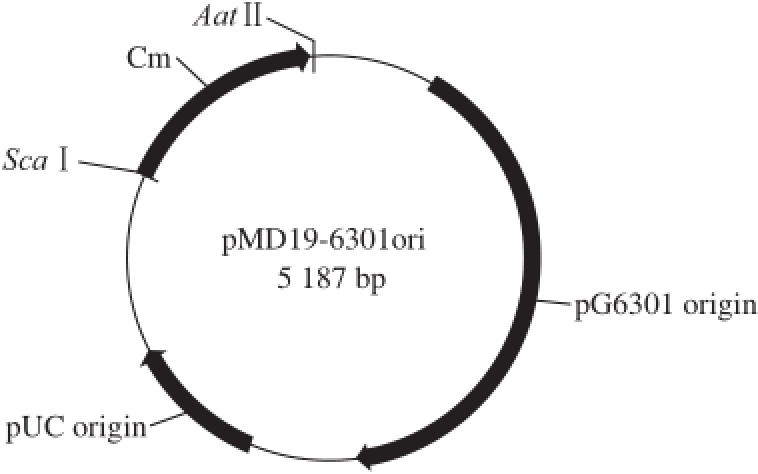
图1 穿梭质粒pMD19-6301ori图谱
Fig.1 Map of shutter vector pMD19-6301ori
2.2 L. plantarum G63生长曲线的绘制及细胞生长状态对转化效率的影响
不同生长时期的菌体细胞对电击的敏感性不同,因此选择不同生长时期的菌体细胞制备感受态细胞,测定对转化效率的影响。本研究首先测定了L. plantarum G63的生长曲线,每隔2 h取一次样,直到菌株进入衰亡期。再选择生长了2、4、6、8、10、12 h的菌株G63细胞制备感受态,并同时选择3 g/100 mL的甘氨酸作为细胞弱化剂,加入10 μg穿梭质粒pMD19-6301ori进行电击。由图2可知,不同生长时期的菌株对转化效率有很大影响;当细胞处于生长初期时,转化效率几乎为0;而当细胞进入对数生长初期时,DNA的转化效率逐步升高,在对数生长中期时达到最高,为0.27×10 3CFU/μg DNA;随着细胞生长,进入对数生长后期、稳定期和衰亡期后,DNA的转化效率呈明显下降趋势。这一结果与文献报道一致 [8]。故推测处于对数生长中期的菌株细胞代谢旺盛,且细胞壁结构相对松散,有利于在电击时形成空洞,而易于外源DNA的进入。
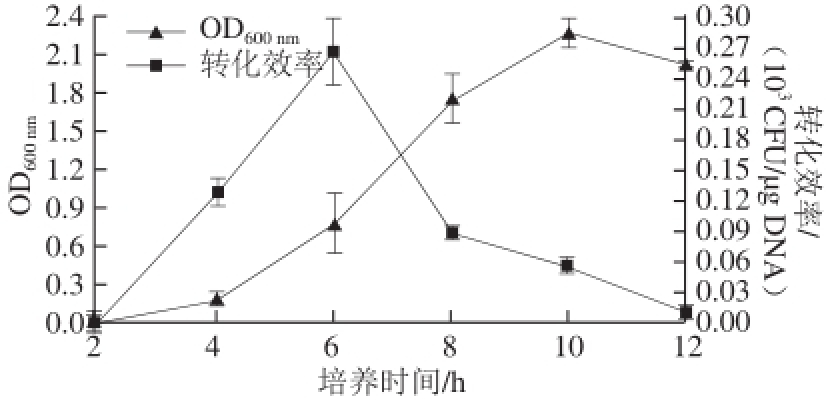
图2 不同生长时期的L. plantarum G63菌体细胞对转化效率的影响
Fig.2 Effect of cell growth phase on transformation ef ciency of L. plantarum G63
2.3 不同质量浓度细胞弱化剂对转化效率的影响
L. plantarum G63属于革兰氏阳性细菌,细胞壁肽聚糖层较厚,在培养感受态细胞时需要加入细胞弱化剂。细胞弱化剂有青霉素、溶菌酶和甘氨酸等,其中甘氨酸较为常用 [4-5]。本研究选择甘氨酸作为菌株G63的细胞弱化剂,选择含0、1、3、5、8 g/100 mL甘氨酸的MRS培养基培养菌株G63,37 ℃培养6 h后制备感受态细胞,然后进行电击。结果发现,菌株G63细胞仅在不含甘氨酸和含1 g/100 mL及3 g/100 mL甘氨酸的培养基中生长良好,当甘氨酸质量浓度高于3 g/100 mL时,细胞不生长,说明高质量浓度的甘氨酸对细胞生长具有抑制作用。转化实验结果表明:当不加甘氨酸时,未有转化子长出;当甘氨酸质量浓度为1 g/100 mL时,转化效率达到最高,达0.64×10 3CFU/μg DNA;而当甘氨酸质量浓度为3 g/100 mL时,转化率有所下降,为0.27×10 3CFU/μg DNA,与之前结果一致。以上实验结果说明,甘氨酸作为细胞弱化剂可以替代细胞壁中肽聚糖层的D-丙氨酸,从而使细胞合成过程中形成较为松散的肽聚糖层,而易于外源DNA的侵入,同时甘氨酸在一定质量浓度范围内是有利于外源DNA的导入的,而质量浓度过高时则会抑制菌株繁殖。
2.4 不同分子质量的PEG对转化效率的影响
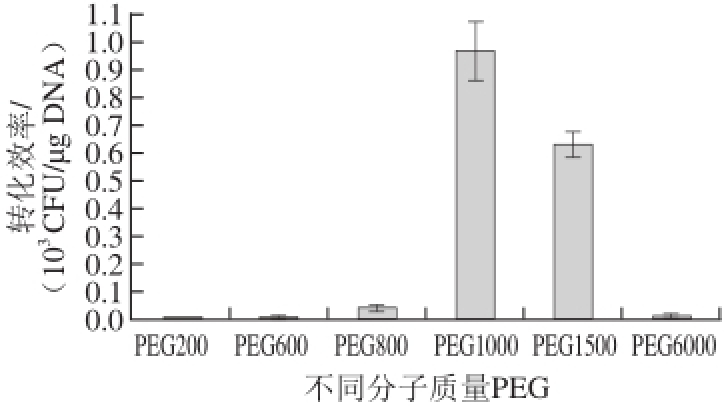
图3 不同分子质量PEG对转化效率的影响
Fig.3 Effect of different molecular weights of PEG on transformation ef
 ciency of L. plantarum G63
ciency of L. plantarum G63
在感受态细胞制备及电击过程中,洗涤液和电击液的选择对转化效率有很大的影响。常用的洗涤液有MgCl 2、蔗糖和甘油等 [13-14]。经过前期研究发现,以上3 种常用的洗涤剂对菌株G63均无效,不能将外源DNA导入菌株中。经过长期实验摸索,本实验选择用1 mmol/L MgCl 2和30 g/100 mL PEG作为菌株G63感受态制备过程中的洗涤液,并选用30 g/100 mL PEG作为电击缓冲液。为了探究不同分子质量的PEG对转化效率的影响,选择PEG200、PEG600、PEG800、PEG1000、PEG1500及PEG6000作为感受态细胞的洗涤液及电击缓冲液,进行电击转化。由图3可知,不同分子质量的PEG对转化效率有很大影响,其中使用PEG1000时转化效率达到最高,为0.97×10 3CFU/μg DNA,比使用PEG1500时的转化效率高了1.5 倍;而当使用较低分子质量和较高分子质量的PEG时,转化效率则下降明显。PEG作为感受态细胞洗涤液和电击液的原理尚未研究清楚,推测其作用原理类似于PEG作为原生质体融合剂时的作用,适宜分子质量的PEG可以帮助外源DNA附着于细胞壁周围,从而有利于电击时外源DNA的进入 [15]。
2.5 不同质粒添加量对转化效率的影响
据报道,质粒浓度也会影响转化效率 [16],因此,本研究选择不同添加量质粒进行电转化以获得最高转化效率。选择上述已优化的最适条件制备菌株G63的感受态细胞,分别取0.5、1、3、6、10、20、30、40、50、60 μg的穿梭质粒pMD19-6301ori加入到80 μL感受态细胞中,并在1.5 kV、400 Ω条件下进行电击转化。由图4可知,加入的质粒质量对转化效率有很大的影响,当质粒的质量在0.5~20 μg时,转化效率逐步提高,最高达1.18×10 3CFU/μg DNA;但当质粒质量再升高时,转化率反而下降,当加入60 μg质粒时,转化效率仅为加入20 μg质粒的转化效率的8%。

图4 不同质粒添加量对转化效率的影响
Fig.4 Effect of plasmid DNA concentration on transformation ef
 ciency of L. plantarum G63
ciency of L. plantarum G63
2.6 不同电击条件对转化效率的影响
表1 不同电转化参数对转化效率的影响
Table1 Effect of electrical parameters on transformation ef
 ciency of L. plantarum G63
ciency of L. plantarum G63

电转化参数转化效率/(10 3CFU/μg DNA)电场强度/kV电阻/Ω 1.504001.18 1.502000.02 1.254000.06 1.252000.00 1.754000.19 1.752000.13
电转化参数主要包括电场强度、电阻、电容和脉冲时间,这些因素均影响着转化效率 [8]。电容一般设为25 μF,而脉冲时间则由电场强度、电阻及感受态的离子强度共同决定。本研究主要针对电场强度和电阻做优化设计。由表1可知,在1.5 kV和400 Ω条件下菌株G63的转化效率最高,达1.18×10 3CFU/μg DNA,而当对电场强度和电阻做上下调整时,对转化效率影响较大,最低时转化效率几乎为0。由此可知,菌株G63对转化参数较为敏感,只有在适宜的电击参数下,菌株的细胞膜才会形成空洞,利于外源DNA的进入 [14]。
2.7 转化子PCR鉴定结果
为了验证电击转化后得到的L. plantarum G63转化子是否为阳性,本研究随机挑选了4 株转化子进行PCR验证。实验首先提取这4 株转化子的质粒,再以其为模板通过PCR扩增氯霉素抗性基因,具体实验操作见1.4.3节。由图5琼脂糖电泳检测结果可知:以菌株G63提取出的质粒为模板进行PCR,其结果作为阴性对照;以质粒pMD19-6301ori为模板进行PCR,其结果作为阳性对照;4 株转化子提取得到的质粒进行PCR,均能得到892 bp的氯霉素抗性基因条带。因此,通过验证说明氯霉素抗性平板上长出的菌落均为阳性,同时说明质粒pMD19-6301ori成功转入到菌株G63中,使菌株G63获得了氯霉素抗性。
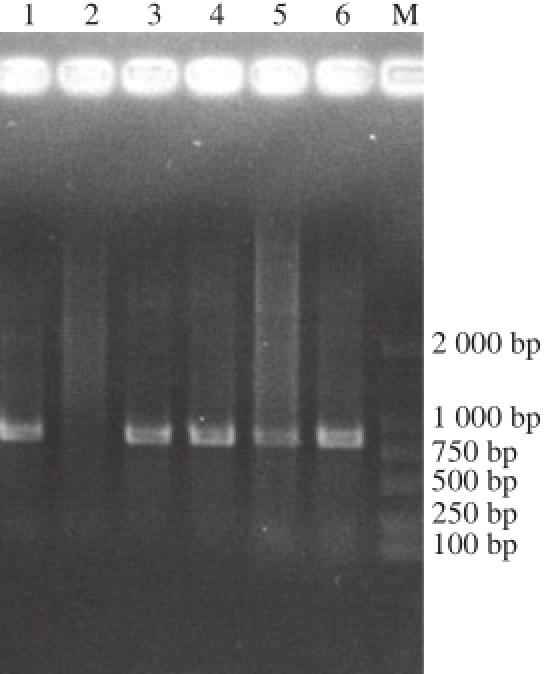
图 5 L. plantaarruumm G63转化子的PCR验证结果
Fig.5 Con
 mation of the transformants from L. plantarum G63
mation of the transformants from L. plantarum G63
泳道1. 质粒pMD19-6301ori PCR扩增产物;泳道2. 菌株G63质粒PCR扩增产物;泳道3~6. 菌株G63转化子质粒PCR扩增产物;M. DL2000 DNA Marker。
为验证菌株G63的电转化方法对其他乳酸菌的适用性,本实验选择L. plantarum NC8和L. lactis MG1363进行电转化验证。由图5可知,该方法对菌株NC8和MG1363均适用,前者转化效率达到3.89×10 3CFU/μg DNA,后者转化率为0.69×10 3CFU/μg DNA,均能满足下一步实验要求。以上实验结果表明本研究优化后的电转化方法具有一定通用性,能将外源性质粒有效导入到植物乳杆菌和乳球菌中,这也为其他野生型乳酸菌研究提供了理论基础。
在实际生活中,乳酸菌的应用很广泛。例如,在食品行业中,乳酸菌可通过发酵作用将新鲜饲料转化成青贮饲料而使得饲料易于保存 [17];在医疗行业中,乳酸菌产的细菌素可作为非抗生素类选择标记用于免疫载体的开发 [16]。研究人员对乳酸菌遗传学的研究可开发其潜在的应用价值。而对于乳酸菌的遗传学研究又主要集中在乳酸菌作为受体、乳酸菌作为表达载体及乳酸菌外源蛋白表达这三方面 [18-19]。
能否将外源DNA成功转入到乳酸菌菌体内是对其进行其他遗传学操作的基础。本实验室分离得到的L. plantarum G63含有3 个内源性质粒,其本身具有很大的科研价值,如要对其进行进一步研究,首先要获得针对菌株G63的一套电转化方法。Gerber [20]和Thompson [21]等均利用乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)作为细胞洗涤液成功将外源质粒DNA导入乳酸菌中;王艳霞等 [22]利用磷酸钠、蔗糖及甘油作为细胞洗涤液将外源质粒导入干酪乳酸菌中。而上述电转化条件均不能将外源DNA导入菌株G63中,因此本研究从细胞生长状态、细胞弱化剂、洗涤液、质粒浓度和电击参数等方面对菌株G63的电转化方法进行摸索及优化,并创新性地选择PEG1000作为菌株G63的细胞洗涤液及电击液,通过优化后,转化效率最高达到1.18×10 3CFU/μg DNA,而这一转化效率足以满足后续对该菌株作进一步遗传学研究。
参考文献:
[1] WADA T, NODA M, KASHIWABARA F, et al. Characterization of four plasmids harboured in a Lactobacillus brevis strain encoding a novel bacteriocin, brevicin 925A, and construction of a shuttle vector for lactic acid bacteria and Escherichia coli[J]. Microbiology, 2009, 155(5): 1726-1737. DOI:10.1099/mic.0.022871-0.
[2] 凌代文, 东秀珠. 乳酸菌细菌分类鉴定及试验方法[M]. 北京: 中国轻工业出版社, 1999: 4-5.
[3] 崔艳华, 张旭, 张兰威. 德氏乳杆菌保加利亚亚种电转化平台的构建和优化[J]. 生物信息学, 2010, 8(3): 267-270. DOI:10.3969/ j.issn.1672-5565.2010.03.020.
[4] KIM Y H, HAN K S, OH S, et al. Optimization of technical conditions for the transformation of Lactobacillus acidophilus strains by electroporation[J]. Journal of Applied Microbiology, 2005, 99(1): 167-174. DOI:10.1111/j.1365-2672.2005.02563.x.
[5] LÖFBLOM J, KRONQVIST N, UHLÉN M, et al. Optimization of electroporation-mediated transformation: Staphylococcus carnosus as model organism[J]. Journal of Applied Microbiology, 2007, 102(3): 736-747. DOI:10.1111/j.1365-2672.2006.03127.x.
[6] RODR¸GUEZ M C, ALEGRE M T, MESAS J M. Optimization of technical conditions for the transformation of Pediococcus acidilactici P60 by electroporation[J]. Plasmid, 2007, 58(1): 44-50. DOI:10.1016/ j.plasmid.2006.12.005.
[7] PIURI M, SANCHEZ-RIVAS C, RUZAL S M. Cell wall modifications during osmotic stress in Lactobacillus casei[J]. Journal of Applied Microbiology, 2005, 98(1): 84-95. DOI:10.1111/j.1365-2672.2004.02428.x.
[8] 张旭, 崔艳华, 张兰威, 等. 乳酸菌电转化条件研究[J]. 兰州大学学报(自然科学版), 2009, 45(F06): 26-33. DOI:10.3321/ j.issn:0455-2059.2009.z1.006.
[9] TERESA ALEGRE M, CARMEN RODRIGUEZ M, MESAS J M. Transformation of Lactobacillus plantarum by electroporation with in vitro modified plasmid DNA[J]. FEMS Microbiology Letters, 2004, 241(1): 73-77. DOI:10.1016/j.femsle.2004.10.006.
[10] O’DRISCOLL J, GLYNN F, FITZGERALD G F, et al. Sequence analysis of the lactococcal plasmid pNP40: a mobile replicon for coping with environmental hazards[J]. Journal of Bacteriology, 2006, 188(18): 6629-6639. DOI:10.1128/JB.00672-06.
[11] de MAN J C, ROGOSA M, SHARPE M E. A medium for the cultivation of lactobacilli[J]. Journal of Applied Bacteriology, 1960, 23(1): 130-135. DOI:10.1111/j.1365-2672.1960.tb00188.x.
[12] XI X, FAN J, HOU Y, et al. Characterization of three cryptic plasmids from Lactobacillus plantarum G63 that was isolated from Chinese pickle[J]. Plasmid, 2013, 70(3): 321-328. DOI:10.1016/ j.plasmid.2013.07.004.
[13] ALEGRE M T, RODR¸GUEZ M C, MESAS J M. Transformation of Lactobacillus plantarum by electroporation with in vitro modified plasmid DNA[J]. FEMS Microbiology Letters, 2004, 241(1): 73-77. DOI:10.1016/j.femsle.2004.10.006.
[14] 孙大庆, 姜毓君. 乳酸乳球菌高效电转化的方法[J]. 中国乳品工业, 2010(7): 22-24. DOI:10.3969/j.issn.1001-2230.2010.07.006.
[15] 代兴华, 蔡爱华, 张厚瑞, 等. 基因组改组技术及其在工业微生物改良中的应用[J]. 食品与发酵工业, 2011, 37(7): 142-147. DOI:10.13995/j.cnki.11-1802/ts.2011.07.020.
[16] PALOMINO M M, ALLIEVI M C, PRADO-ACOSTA M, et al. New method for electroporation of Lactobacillus species grown in high salt[J]. Journal of Microbiological Methods, 2010, 83(2): 164-167. DOI:10.1016/j.mimet.2010.08.017.
[17] SPATH K, HEINL S, EGGER E, et al. Lactobacillus plantarum and Lactobacillus buchneri as expression systems: evaluation of different origins of replication for the design of suitable shuttle vectors[J]. Molecular Biotechnology, 2012, 52(1): 40-48. DOI:10.1007/s12033-011-9471-x.
[18] 相丽, 刘伟, 范丽平, 等. 应用于乳酸茵的非抗生素抗性选择标记系统[J]. 中国生物化学与分子生物学报, 2007, 23(1): 1-7. DOI:10.13865/j.cnki.cjbmb.2007.01.001.
[19] 薛迎迎, 杨汝德. 乳酸菌基因组学与基因工程的研究新进展[J].现代食品科技, 2008, 24(6): 617-620. DOI:10.3969/ j.issn.1673-9078.2008.06.032.
[20] GERBER S D, SOLIOZ M. Efficient transformation of Lactococcus lactis IL1403 and generation of knock-out mutants by homologous recombination[J]. Journal of Basic Microbiology, 2007, 47(3): 281-286. DOI:10.1002/jobm.200610297.
[21] THOMPSON K, COLLINS M A. Improvement in electroporation efficiency for Lactobacillus plantarum by the inclusion of high concentrations of glycine in the growth medium[J]. Journal of Microbiological Methods, 1996, 26(1): 73-79. DOI:10.1016/0167-7012(96)00845-7.
[22] 王艳霞, 包秋华, 代兄, 等. 电转化方法将外源性质粒导入干酪乳杆菌的研究[J]. 中国乳品工业, 2009, 37(2): 9-13. DOI:10.3969/ j.issn.1001-2230.2009.02.002.
Optimization of Electroporation Conditions for Lactobacillus plantarum G63
FAN Jing
1, XI Xuedong
2, HUANG Yan
3, CUI Zhongli
3,*
(1. Biological Treatment Center, the Second Affiliated Hospital of Medical School of Southeast University, Nanjing 210003, China; 2. College of Plant Protection, Shenyang Agricultural University, Shenyang 110866, China; 3. Key Laboratory of Agricultural Environmental Microbiology, Ministry of Agriculture, College of Life Sciences, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:The objective of this work was to explore an efficient method for Lactobacillus plantarum G63 electrotransformation. We evaluated the effects of the growth phase, weakening cells, washing buffer, plasmid DNA concentration and electrical parameters on electroporation efficiency. The results showed that after culture in MRS medium containing 1 g/100 mL glycine to mid-logarithmic phase, the cells were harvested and washed with 1 mmol/L MgCl 2and 30 g/100 mL PEG1000. The optimal electroporation conditions could be achieved by using 30 g/100 mL PEG1000 as the electroporation buffer with 20 μg of plasmid DNA added in 80 μL of the cell suspension, and pulsing under specific conditions (field strength, 1.5 kV; resistance, 400 Ω). The transformation efficiency was 1.18 × 10 3CFU/μg DNA under the optimal conditions, which could meet the requirements for subsequent genetic experiments.
Key words:Lactobacillus plantarum; electroporation; transformation ef ciency
DOI:10.7506/spkx1002-6630-201603033
中图分类号:Q785
文献标志码:A
文章编号:1002-6630(2016)03-0180-06
引文格式:
范璟, 席雪冬, 黄彦, 等. 植物乳杆菌G63电转化方法的优化[J]. 食品科学, 2016, 37(3): 180-185. DOI:10.7506/spkx1002-6630-201603033. http://www.spkx.net.cn
FAN Jing, XI Xuedong, HUANG Yan, et al. Optimization of electroporation conditions for Lactobacillus plantarum G63[J]. Food Science, 2016, 37(3): 180-185. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603033. http://www.spkx.net.cn
收稿日期:2015-03-11
作者简介:范璟(1988—),女,硕士研究生,研究方向为食品微生物学。E-mail:fanjing310@126.com
*通信作者:崔中利(1973—),男,教授,博士,研究方向为微生物学。E-mail:czl@njau.edu.cn