三丁酸甘油酯对宫内发育迟缓哺乳仔猪肝脏抗氧化和线粒体功能的影响
何进田
1,董 丽
1,2,白凯文
1,徐 稳
1,牛 玉
1,黄 强
1,张莉莉
1,王 恬
1,*
(1.南京农业大学动物科技学院,江苏 南京 210095;2.扬州大学动物科学与技术学院,江苏 扬州 225009)
摘 要:目的:研究三丁酸甘油酯(tributyrin,TB)对宫内发育迟缓(intrauterine growth retardation,IUGR)哺乳仔猪肝脏抗氧化和线粒体功能的调节作用。方法:选取8 头正常初生体质量仔猪和16 头IUGR仔猪,将IUGR仔猪随机均分为2 组,分别饲喂基础人工乳(IUGR组)、基础人工乳+0.1% TB(IUGR+TB,IT组),正常仔猪饲喂基础人工乳(NBW组)。从仔猪7 日龄开始饲喂,21 日龄时每组选取6 头体质量接近的仔猪进行屠宰取样,并对肝脏进行组织切片观察,酶活力以及相关酶mRNA表达量的测定。结果:与NBW组相比,IUGR组仔猪的肝脏组织切片出现中央静脉充血现象,而IT组无显著变化。IUGR组仔猪肝脏谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力较NBW组显著降低(P<0.05),丙二醛(malondialdehyde,MDA)含量极显著升高(P<0.01),线粒体苹果酸脱氢酶(malate dehydrogenase,MDH)、锰-超氧化物歧化酶(Mn-superoxide dismutase,Mn-SOD)活力显著低于NBW组(P<0.05);与IUGR组相比,IT组仔猪肝脏SOD活力、还原型谷胱甘肽(glutathione,GSH)含量、GSH-Px活力及总抗氧化能力(total antioxidant capacity,T-AOC)均显著升高(P<0.05),且MDA含量极显著降低(P<0.01),线粒体MDH、Mn-SOD活力均显著升高(P<0.05);与NBW组相比,IT组仔猪肝脏GSH含量、T-AOC显著升高(P<0.05),MDA含量极显著降低(P<0.01),其他指标无显著差异。与NBW组相比,IUGR组仔猪肝脏SOD、CAT mRNA表达水平均显著升高(P<0.05),IT组仔猪肝脏SOD、PRDX3 mRNA表达水平均显著升高(P<0.05)。IT组仔猪肝脏CAT mRNA表达水平较IUGR组显著降低(P<0.05),PRDX3 mRNA表达水平较IUGR组显著升高(P<0.05)。结论:IUGR哺乳仔猪肝脏抗氧化能力降低,线粒体功能受损。TB能够提高IUGR仔猪肝脏抗氧化能力,保护线粒体免受损伤,具有作为抗氧化剂的潜力。
关键词:宫内发育迟缓;肝脏;抗氧化能力;线粒体;哺乳仔猪
宫内发育迟缓(intrauterine growth retardation,IUGR)通常发生在哺乳动物妊娠期,表现为胎儿或胎儿体内器官生长发育受阻
[1]。据统计,IUGR在人类和动物生产中的发生率高达5%~10%,具有较高的发病率和死亡率
[2]。研究表明子宫内生长环境受限会提高胎儿出生后患代谢综合征(metabolic syndrome,MS)的可能性,如2型糖尿病、高血压、代谢异常等,并且与成年期发病率有紧密的联系
[3]。IUGR还降低了具有免疫、抗氧化、蛋白质合成等功能蛋白的表达水平
[4],引起机体氧化应激。肝脏是动物体内重要的代谢器官,可以清除体内氧化代谢产生的自由基,避免机体聚积过多的自由基而造成损伤
[5]。
三丁酸甘油酯(tributyrin,TB)是由3 分子丁酸和1 分子甘油酯化后的产物,属于丁酸盐衍生物,在肠道酶的作用下分解为β-羟基丁酸和甘油进入肝脏进行代谢。TB能有效缓解IUGR引起的肠道损伤
[6],缓解肝脏炎症反应
[7],其良好的抗癌作用已在人类和动物身上得到了验证
[8]。日粮中添加2 kg/t TB时,断奶仔猪的生长性能及健康状况均得到了明显改善
[9],TB添加量为0.1%时,可缓解由脂多糖(lipopolysaccharides,LPS)引起的肉鸡肝脏损伤
[10]。这些结果都表明TB作为食品添加剂具有保护动物健康、保障食品安全的研究潜力。猪具有与人类相似的器官构造、功能等特征,IUGR猪已被广泛用于临床疾病研究,对预防和治疗人类IUGR病具有重要的参考意义。但目前有关TB在IUGR方面的应用还较少。因此,本实验选择IUGR哺乳仔猪为研究模型,观察IUGR对仔猪出生早期肝脏造成的影响(组织形态、抗氧化能力等),并探讨TB对其调节作用,为进一步评估IUGR对动物健康造成的影响奠定理论基础,同时为TB作为一种食品添加剂在生产中的应用提供基本依据。
1 材料与方法
1.1 动物与材料
选取体质量相近、预产期相近、同胎次(3~4)的妊娠母猪20 头,在其分娩当日,选择8 窝仔猪,每窝新生仔猪(杜洛克×长白×大白)中选择1 头正常体质量(normal body weight,NBW)仔猪((1.67±0.13) kg)设为NBW组和2 头IUGR仔猪((0.93±0.11) kg)分别均分到IUGR组和IT组中(以初生体质量低于群体两个标准差的仔猪为IUGR仔猪,而初生体质量在群体一个标准差范围内的仔猪为NBW仔猪
[11]),即共8 头NBW仔猪和16头IUGR仔猪。哺乳至7 日龄,进行单独人工饲喂,NBW和IUGR组饲喂基础人工乳,IT组饲喂基础人工乳+0.10% TB,至21 日龄,每组屠宰6 头仔猪,雌雄各半。宰前空腹12 h,屠宰后立即取肝脏相同部位于-20 ℃冰箱和液氮罐保存供后期指标测定。基础人工乳配方和营养成分见表1。
表1 基础人工乳配方和营养成分(消化能水平)
Table1 Compositions and nutrient contents of diets (DM basis)
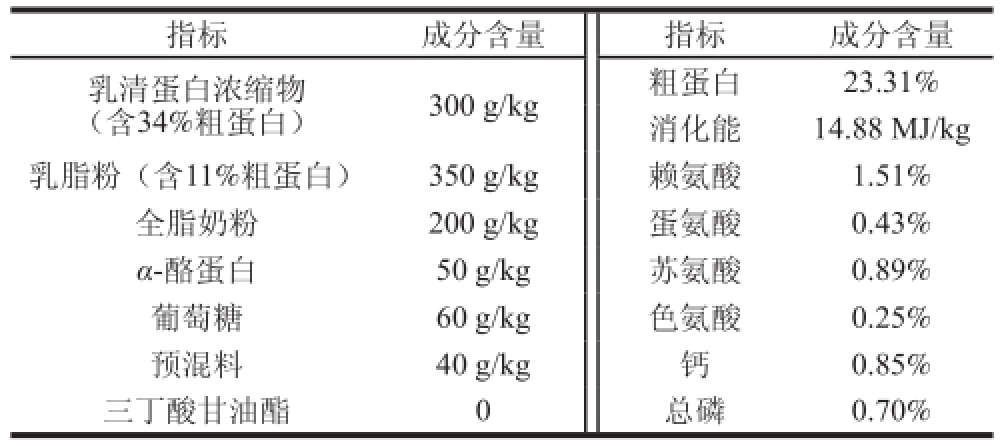
注:IT组日粮为基础人工乳+0.1% TB(酪蛋白、TB净含量各占50%);两种日粮的含氮量和能量相同。预混料中主要物质含量(以每千克预混料计):Cu(CuSO
4•5H
2O)600 mg、Fe(FeSO
4•7H
2O)8 400 mg、Mn(MnSO
4•H
2O)315 mg、Se(Na
2SeO
3)17 mg、Zn(ZnSO
4•7H
2O)12 500 mg、VA 55 000 IU、VD 5 500 IU、VE 400 IU、VK 12.5 mg、生物素2 mg、胆碱15 mg、叶酸7.5 mg、VB
2100 mg、VB
1317.5 mg、VB
6175 mg、VB
12500 mg;粗蛋白、钙、总磷含量为实测值,其他营养成分含量为计算值。
(含34%粗蛋白)300 g/kg粗蛋白23.31%消化能14.88 MJ/kg指标成分含量指标成分含量乳清蛋白浓缩物乳脂粉(含11%粗蛋白)350 g/kg赖氨酸1.51%全脂奶粉200 g/kg蛋氨酸0.43% α-酪蛋白50 g/kg苏氨酸0.89%葡萄糖60 g/kg色氨酸0.25%预混料40 g/kg钙0.85%三丁酸甘油酯0总磷0.70%
1.2 试剂
超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒、还原型谷胱甘肽(glutathione,GSH)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、琥珀酸脱氢酶(succinatedehydrogenase,SDH)试剂盒、苹果酸脱氢酶(malate dehydrogenase,MDH)试剂盒、铜锌-超氧化物歧化酶(CuZn-SOD)试剂盒 南京建成生物工程研究所;Trizol 美国Invitrogen公司;SYBR、Rox Reference Dye 日本TaKaRa生物科技股份有限公司。
1.3 方法
1.3.1 动物饲养管理
实验期内仔猪在育仔箱内饲养,自由采食人工乳,按人工乳与温水1∶4(m/V)的比例调和。实验在安徽宣城安佑实验猪场进行,按猪场饲养管理要求进行常规免疫和定期消毒。
1.3.2 肝脏组织形态学观察
取仔猪肝脏右叶相同组织部位于质量分数为4%的多聚甲醛液中固定,用乙醇及二甲苯脱水、透明,石蜡包埋、切片,苏木精-伊红(hematoxylin-eosin,HE)染色,在光学显微镜下观察肝脏组织学形态变化。
1.3.3 肝脏处理与指标测定
将仔猪肝脏组织按质量比1∶9加入预冷的生理盐水,冰水浴条件下匀浆破碎,3 000 r/min离心10 min,取上清液于-20 ℃冰箱中保存待用。肝脏线粒体的提取参考Tang等
[12]的方法。肝脏中SOD、GSH-Px活力,T-AOC及GSH、MDA含量,肝脏线粒体中SDH、MDH、SOD、CuZn-SOD活力,以上指标均严格按照试剂盒说明书方法和步骤进行测定。锰-超氧化物歧化酶(Mn-SOD)活力为SOD活力与CuZn-SOD活力的差值。
1.3.4 反转录聚合酶链式反应(reverse transcript polymerase chain reaction,RT-PCR)检测肝脏SOD、过氧化氢酶(catalase,CAT)与过氧化物还原酶3(peroxiredoxin 3,PRDX3)mRNA的表达量
1.3.4.1 RNA的提取和cDNA的合成
仔猪屠宰后取肝脏,立即放入液氮罐中冻存。采用Trizol试剂从肝脏中提取总RNA。琼脂糖凝胶电泳检查总RNA的完整性。所有用于测定的样品都需要检查RNA纯度(1.8≤OD
260
nm/OD
280
nm≤2.0),并用0.1%焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水稀释到相同质量浓度500 ng/μL。稀释后的RNA采用10 μL反转录反应体系,以TaKaRa反转录试剂盒测定加样量,按照试剂盒说明书中方法和步骤进行测定。反转录反应参数为:37 ℃ 15 min,3 个循环;85 ℃ 5 s。反转录产物(cDNA)保存于-20 ℃条件下备用。
1.3.4.2 SOD、CAT与PRDX3 mRNA表达量的测定
基因引物序列见表2,GAPDH作为内参基因校准目的基因mRNA的表达,RT-PCR采用20 μL反应体系:10 μL SYBR、上下游引物各0.4 μL、Rox Reference Dye(50×)0.4 μL、6.8 μL DEPC水和2 μL cDNA模板。
表2 RT-PCR引物序列
Table2 Primer sequences used in RT-PCR
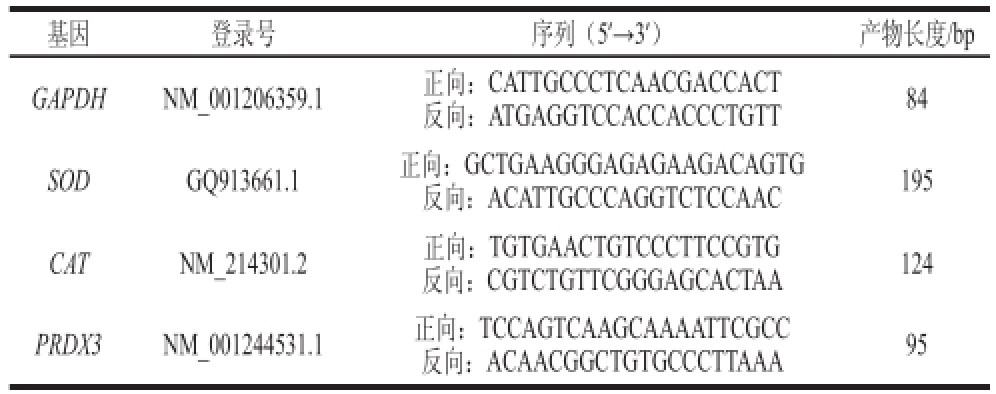
基因登录号序列(5’→3’)产物长度/bp GAPDHNM_00120635 9.1正向:CATTGCCCTCAACGACCACT反向:ATGAGGTCCACCACCCTGTT84 SODGQ913661.1正向:GCTGAAGGGAGAGAAGACAGTG反向:ACATTGCCCAGGTCTCCAAC195 CATNM_214301.2正向:TGTGAACTGTCCCTTCCGTG反向:CGTCTGTTCGGGAGCACTAA124 PRDX3NM_001244531.1正向:TCCAGTCAAGCAAAATTCGCC反向:ACAACGGCTGTGCCCTTAAA95
PCR反应步骤为:95 ℃ 30 s;95 ℃ 5 s,40 个循环;60 ℃ 34 s,每个样品均先做预试。使用ABI软件检测相关基因表达,用2
–ΔΔCT法对基因mRNA表达量进行统计。
1.4 数据统计分析
实验数据以Excel初步处理后,采用SPSS Statistics 20分析,结果以
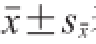 表示。所有数据采用单因素方差分析中的Duncan’s法进行多重比较,以P<0.05和P<0.01作为差异显著性的判断标准。
表示。所有数据采用单因素方差分析中的Duncan’s法进行多重比较,以P<0.05和P<0.01作为差异显著性的判断标准。
2 结果与分析
2.1 TB对IUGR哺乳仔猪肝脏组织形态的影响
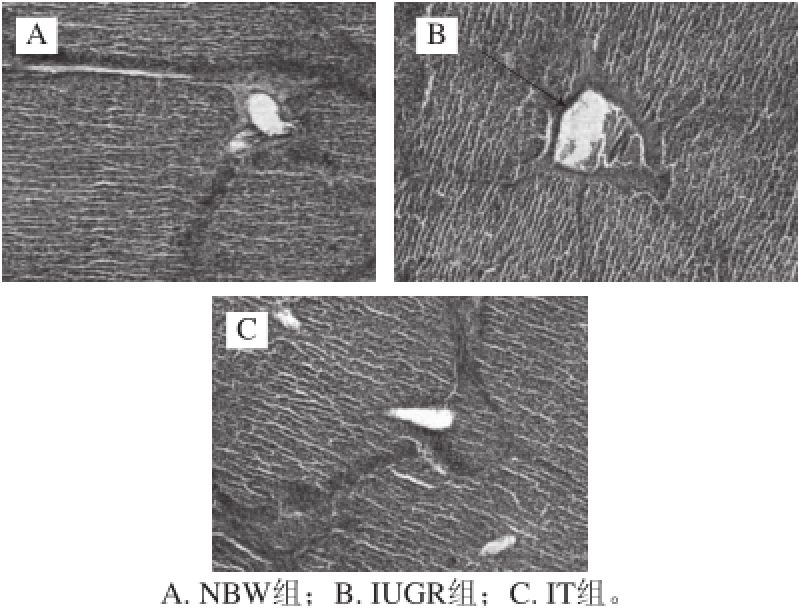
图1 仔猪肝脏组织形态切片(HE,×100)
Fig.1 Histological images of liver (HE, × 100)
由图1可知,与NBW组相比,IUGR组仔猪肝脏组织中央静脉和门管区(图1B中箭头所指部位)充血较严重,而IT组与NBW组比较则没有显著变化。
2.2 TB对IUGR哺乳仔猪肝脏抗氧化功能的影响
表3 TB对IUGR哺乳仔猪肝脏抗氧化功能的影响
Table3 Effect of tributyrin on liver antioxidant function of suckling piglets with intrauterine growth retardation

注:同行小写字母不同表示差异显著(P<0.05);同行大写字母不同表示差异极显著(P<0.01)。下同。
指标NBW组IUGR组IT组SOD活力/(U/mg pro)1 021.337±55.379
ab971.353±17.945
b1 113.257±44.758
aGSH含量/(μmol/g pro)27.110±1.291
b24.793±1.031
b35.683±1.478
aGSH-Px活力/(U/mg pro)91.501±3.087
a74.394±6.810
b92.265±6.409
aT-AOC/(U/mg pro)1.670±0.060
b1.719±0.049
b2.124±0.109
aMDA含量/(nmol/mg pro)2.153±0.202
Bb3.724±0.039
Aa1.445±0.107
Cc
由表3可知,与NBW组相比,IUGR组仔猪肝脏中GSH-Px活力显著降低(P<0.05),SOD活力和GSH含量均有降低趋势(P>0.05),T-AOC无显著变化(P>0.05),MDA含量极显著升高(P<0.01)。与IUGR组相比,IT组仔猪肝脏中GSH-Px、SOD活力和GSH含量均显著升高(P<0.05),MDA含量极显著降低(P<0.01)。IT组仔猪肝脏中GSH含量和T-AOC显著高于NBW组(P<0.05),MDA含量则极显著低于NBW组(P<0.01),SOD及GSH-Px活力与NBW组相比没有显著差异(P>0.05)。
2.3 TB对IUGR哺乳仔猪肝脏线粒体功能的影响
表4 TB对IUGR哺乳仔猪肝脏线粒体功能的影响
Table4 Effect of tributyrin on liver mitochondrial function of suckling piglets with intrauterine growth retardation

指标NBW组IUGR组IT组SDH活力/(U/mg pro)3.488±0.332
a1.625±0.185
b3.018±0.342
aMDH活力/(U/mg pro)0.103±0.0140.104±0.0120.127±0.009 Mn-SOD活力/(U/mg pro)217.998±17.722
a122.437±11.999
b184.492±9.300
a
由表4可知,与NBW组相比,IUGR组仔猪肝脏线粒体中SDH、Mn-SOD活力均显著降低(P<0.05)。IT组仔猪肝脏线粒体中SDH、Mn-SOD活力均较IUGR组显著升高(P<0.05),且与NBW组之间无显著差异(P>0.05)。
2.4 B对IUGR哺乳仔猪肝脏SOD、CAT、PRDX3 mRNA表达量的影响
表5 TB对IUGR哺乳仔猪肝脏SOD CAT PRDX3 mRNA相对表达量的影响
Table5 Effect of tributyrin on mRNA expression of SOD, CAT and PRDX3 in liver of suckling piglets with intrauterine growth retardation

mRNA种类NBW组IUGR组IT组SOD1.067±0.180
b1.890±0.443
a1.451±0.267
aCAT1.072±0.183
b1.502±0.391
a1.173±0.140
bPRDX31.039±0.140
b1.223±0.302
b1.420±0.171
a
由表5可知,IUGR组仔猪肝脏SOD、CAT mRNA表达水平较NBW组均显著升高(P<0.05)。IT组仔猪肝脏CAT mRNA表达水平较IUGR组显著降低(P<0.05),PRDX3 mRNA表达水平较IUGR组显著升高(P<0.05)。与NBW组相比,IT组肝脏SOD、PRDX3 mRNA表达水平均显著升高(P<0.05),CAT mRNA表达水平无显著差异(P>0.05)。
3 讨 论
IUGR对动物器官的不良影响已有较多报道,IUGR新生胎儿肝脏的营养代谢会发生异常。近年来,许多研究者也在试图通过开发有效的添加剂来改善IUGR对机体产生的不良影响。肝脏在机体内发挥着不可替代的作用,健康状态下能够维持体内氧化还原的动态平衡。TB分解产生的丁酸能通过抑制核转录因子κB(nuclear factor-κB,NF-κB)的激活、降低肝脏肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)mRNA的表达,实现抑制肝脏损伤和降低血清TNF-α水平的功能
[13]。有研究发现,TB能减少氢过氧化物的产生、提高抗氧化酶的活性、增强抗氧化能力
[14],但目前有关TB作为食品添加剂对IUGR引起的肝脏损伤和抗氧化功能影响的研究报道仍较少。
黄雪新
[15]研究发现7 日龄IUGR仔猪肝脏内细胞总数、肝细胞、枯否细胞、淋巴样细胞数量均显著减少,表明IUGR可能会对仔猪肝脏造成损伤,影响营养物质的转运。刘闯等
[16]利用双荧光标记miRNA芯片技术对IUGR胎猪肝脏分析发现,肝脏细胞的增殖受到了抑制。本研究发现21 日龄IUGR仔猪肝脏组织充血,但在日粮中添加TB后这一现象得到明显的改善,并且与正常仔猪无显著差异。Dong等
[6]的研究也发现IUGR会造成仔猪肠道绒毛发育受损,脾脏质量显著下降,在日粮中添加TB后对IUGR造成的机体器官损伤均有一定的缓解作用,这也与本实验结果一致。TB在肠道分解生成的β-羟基丁酸能被肠道表面细胞快速吸收,进入肝脏为细胞的生长发育提供能量,加快细胞增殖,TB对器官损伤的缓解作用可能与此有关。李娇龙等
[10]研究发现饲料中添加0.1%的TB缓解了LPS引起的肉鸡肝脏损伤,这些都表明TB作为食品添加剂可能对动物机体遭受的损伤具有一定的缓解作用,这可能是通过加速细胞增殖实现的,但具体机制还有待研究。
动物机体在健康状态下保持着氧化和抗氧化之间的动态平衡,当机体遭到攻击时(如疾病、应激、营养失衡等),体内会发生一系列的氧化应激反应,产生大量自由基,抗氧化酶活性降低
[17]。体内的氧化还原平衡状态一旦被打破,氧化应激会引发多种疾病,严重影响人类和动物的健康。SOD、GSH是体内重要的抗氧化剂和自由基清除剂
[18],GSH-Px是机体一种重要的过氧化物分解酶,MDA是体内脂质过氧化产物之一,上述几种物质活力或含量的高低可在一定程度上反应机体的氧化应激状态
[19]。本实验结果显示,受IUGR影响,21 日龄仔猪肝脏GSH含量及SOD、GSH-Px活力均降低,其中GSH-Px活力显著降低,MDA含量显著升高,这提示IUGR可能促进了肝脏脂质过氧化反应,降低了抗氧化酶的活力。李博等
[20]研究也发现23 日龄IUGR仔猪肝脏清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的能力有下降的趋势,并且SOD活性显著下降,与本实验结果相似。研究发现,发育未成熟的早产儿机体氧自由基活性较高,能够损害体内的大分子物质,如DNA、蛋白质、多不饱和脂肪酸及碳水化合物等,这种氧化损伤会导致蛋白质的二级、三级结构发生改变
[21]。Kamath等
[21]证实了IUGR新生儿氧化应激损伤严重。由此可见,IUGR会引起肝脏氧化应激,降低机体抗氧化能力。本实验发现在日粮中添加TB后,IUGR仔猪肝脏中MDA含量显著下降,抗氧化酶活力升高。王远孝等
[22]通过在断奶仔猪日粮中添加60 mg/kg的γ-氨基丁酸显著提高了仔猪机体的抗氧化能力,提示丁酸盐能使机体产生更多抗氧化酶,增强机体清除脂质过氧化产物的能力。Leonel等
[14]发现通过给患结肠炎的小鼠饲喂TB,小鼠体内SOD活性得到了显著提高,MDA含量显著降低,抗氧化性能得到了增强,这与本实验结果相似。体外实验也表明了丁酸盐具有显著的抗氧化活性
[23]。
线粒体是机体进行氧化代谢的部位,也是氧自由基产生的主要场所,线粒体在肝脏组织中的含量极高。SDH是三羧酸循环中唯一嵌入线粒体内膜的酶
[24],为线粒体的一种标志酶。MDH是一种重要的氧化还原酶,Mn-SOD主要存在于线粒体基质中,作为抗氧化剂在机体防御疾病的过程中起着重要的作用
[25]。本实验发现IUGR仔猪肝脏线粒体SDH、Mn-SOD活力均显著降低,在食用添加TB的日粮后其SDH、Mn-SOD活力均能够得到提高。机体氧化和抗氧化动态平衡被打破后,产生大量的活性氧(reactive oxygen species,ROS)自由基,改变膜蛋白的结构和酶的活性,进而引起线粒体膜发生改变,对细胞造成氧化损伤
[26]。有报道以低蛋白日粮模拟IUGR环境,发现仔猪肝脏线粒体DNA拷贝数较正常组降低,母体摄入低蛋白日粮可能会影响胎儿线粒体DNA的复制和转录,IUGR抑制线粒体的功能
[27],这也与本实验结果一致。本实验通过进一步研究发现,IUGR仔猪肝脏SOD、CAT mRNA表达水平显著上升,PRDX3 mRNA表达水平也有上升趋势。PRDX3主要分布于线粒体内,在调控线粒体内ROS暴发引起的细胞凋亡中发挥着十分重要的作用。IT组仔猪肝脏SOD、CAT mRNA表达水平下降,仍高于NBW组。这些结果表明IUGR仔猪机体发生了氧化应激,线粒体功能受损,激活自我损伤修复。在食用添加TB的日粮后对IUGR引起的线粒体功能损伤有一定的缓解作用,并且显著提高了PRDX3 mRNA表达水平。有报道证明丁酸盐能够提高AMP激酶活性,增强小鼠骨骼肌中线粒体功能
[28]。本实验中TB对IUGR仔猪肝脏线粒体功能的增强作用可能与丁酸盐作用的发挥密切相关,具体作用机制还有待进一步研究。
本实验结果表明,IUGR哺乳仔猪肝脏会发生损伤和氧化应激,线粒体功能受损。日粮中添加0.1% TB可能具有缓解IUGR引起的肝脏线粒体损伤和增强肝脏抗氧化功能的潜力。结果提示TB作为食品添加剂可能具有修复机体早期遭受内外环境变化引起的损伤、保护动物健康的重要作用。
参考文献:
[1] WU G, BAZER F W, WALLACE J M, et al. Board-invited review: intrauterine growth retardation: implications for the animal sciences[J]. Journal of Animal Science, 2006, 84(9): 2316-2337. DOI:10.2527/ jas.2006-156.
[2] WU G, BAZER F W, DATTA S, et al. Proline metabolism in the conceptus: implications for fetal growth and development[J]. Amino Acids, 2008, 35(4): 691-702. DOI:10.1007/s00726-008-0052-7.
[3] LONGO S, BORGHESI A, TZIALLA C, et al. IUGR and infections[J]. Early Human Development, 2014, 90(Suppl 1): 42-44. DOI:10.1016/ S0378-3782(14)70014-3.
[4] WANG J J, CHEN L X, LI D F. et al. Intrauterine growth restriction affects the proteomes of the small intestine, liver, and skeletal muscle in newborn pigs1,2[J]. Journal of Nutrition, 2008, 138(1): 60-66.
[5] 杜伟, 王恬. 乳源性生物活性肽对新生IUGR仔猪肝脏抗氧化功能的影响[J]. 畜牧与兽医, 2007, 39(11): 12-14. DOI:10.3969/ j.issn.0529-5130.2007.11.004.
[6] DONG L, ZHONG X, HE J T, et al. Supplementation of tributyrin improves the growth and intestinal digestive and barrier functions in intrauterine growth-restricted piglets[J]. Clinical Nutrition, 2015. DOI:10.1016/j.clnu.2015.03.002.
[7] KUROIWA-TRZMIELINA J, de CONTI A, SCOLASTICI C, et al. Chemoprevention of rat hepatocarcinogenesis with histone deacetylase inhibitors: effi cacy of tributyrin, a butyric acid prodrug[J]. International Journal of Cancer, 2009, 124(11): 2520-2527. DOI:10.1002/ijc.24212.
[8] HEIDOR R, ORTEGA J F, CONTI A D, et al. Anticarcinogenic actions of tributyrin, a butyric acid prodrug[J]. Current Drug Targets, 2012, 13(14): 1720-1729. DOI:10.2174/138945012804545443.
[9] 刘小萍, 刘昌林, 毛子平, 等. 丁酸甘油酯在仔猪生产应用中的初步研究[J]. 江西畜牧兽医杂志, 2012(2): 15-16. DOI:10.3969/ j.issn.1004-2342.2012.02.008.
[10] 李娇龙, 张俊, 邱洪仪, 等. 三丁酸甘油酯与三乳酸甘油酯对脂多糖刺激肉鸡生长性能, 血液生化指标及肝脏能量状态的影响[J]. 饲料工业, 2014, 35(18): 38-43. DOI:10.13302/j.cnki.fi .2014.18.009.
[11] SALEEM T, SAJJAD N, FATIMA S, et al. Intrauterine growth retardation: small events, big consequences[J]. Italian Journal of Pediatrics, 2011, 37: 41. DOI:10.1186/1824-7288-37-41.
[12] TANG Z, IQBAL M, CAWTHON D, et al. Heart and breast muscle mitochondrial dysfunction in pulmonary hypertension syndrome in broilers (Gallus domesticus)[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2002, 132(3): 527-540. DOI:10.1016/S1095-6433(02)00005-3.
[13] MIYOSHI M, SAKAKI H, USAMI M, et al. Oral administration of tributyrin increases concentration of butyrate in the portal vein and prevents lipopolysaccharide-induced liver injury in rats[J]. Clinical Nutrition, 2011, 30(2): 252-258. DOI:10.1016/j.clnu.2010.09.012.
[14] LEONEL A J, TEIXEIRA L G, OLIVEIRA R P, et al. Antioxidative and immunomodulatory effects of tributyrin supplementation on experimental colitis[J]. British Journal of Nutrition, 2013, 109(8): 1396-1407. DOI:10.1017/S000711451200342X.
[15] 黄雪新. IUGR对新生仔猪肝脾免疫功能的影响[D]. 南京: 南京农业大学, 2011: 43-44.
[16] 刘闯, 曹中明, 林刚, 等. 宫内生长受限对胎猪肝脏microRNA表达谱的影响[J]. 中国畜牧杂志, 2012, 48(19): 42-46. DOI:10.3969/ j.issn.0258-7033.2012.19.011.
[17] 刘显军, 杨营, 边连全, 等. 日粮ω6/ω3多不饱和脂肪酸构成比对育肥猪背最长肌脂肪酸组成和血清抗氧化指标的影响[J]. 食品科学, 2013, 34(1): 272-276.
[18] MEDEIROS M H, WEFERS H, SIES H. Generation of excited species catalyzed by horseradish peroxidase or hemin in the presence of reduced glutathione and H
2O
2[J]. Free Radical Biology and Medicine, 1987, 3(2): 107-110. DOI:10.1016/S0891-5849(87)80004-7.
[19] 屈长波, 王恬. 脱氢醋酸钠对断奶仔猪抗氧化能力的影响[J]. 食品科学, 2014, 35(11): 54-57. DOI:10.7506/spkx1002-6630-201411011.
[20] 李博, 李伟, 张昊, 等. 宫内发育迟缓对哺乳仔猪生长性能和肝脏氧化及抗氧化指标的影响[J]. 动物营养学报, 2014, 26(9): 2822-2827. DOI:10.3969/j.issn.1006-267x.2014.09.046.
[21] KAMATH U, RAO G, KAMATH SU, et al. Maternal and fetal indicators of oxidative stress during intrauterine growth retardation (IUGR)[J]. Indian Journal of Clinical Biochemistry, 2006, 21(1): 111-115. DOI:10.1007/BF02913077.
[22] 王远孝, 张莉莉, 周根来, 等. 大豆卵磷脂对子宫内发育迟缓仔猪肠道抗氧化和热休克蛋白70表达的影响[J]. 中国农业科学, 2012, 45(13): 2711-2717. DOI:10.3864/j.issn.0578-1752.2012.13.015.
[23] 沈雁. 吲哚丁酸的体外抗氧化活性研究[J]. 热带作物学报, 2014, 35(6): 1153-1156. DOI:10.3969/j.issn.1000-2561.2014.06.019.
[24] 陈娜, 尹清风, 罗迪贤, 等. 罗格列酮对2型糖尿病大鼠肝脏线粒体功能障碍的影响[J]. 中南药学, 2007, 5(5): 402-410. DOI:10.3969/ j.issn.1672-2981.2007.05.004.
[25] KRAMER R. The pharmaceutical potential of manganesebased superoxide dismutase mimics[J]. Angewandte Chemie International Edition, 2000, 39(24): 4469-4470. DOI:10.1002/1521-3773(20001215)39.
[26] HAMID N A A, HASRUL M A, RUZANNA R J, et al. Effect of vitamin E (Tri E(R)) on antioxidant enzymes and DNA damage in rats following eight weeks exercise[J]. Nutrition Journal, 2011, 10: 37. DOI:10.1186/1475-2891-10-37.
[27] 贾逸敏. 母猪低蛋白日粮对新生仔猪肝脏糖异生和肝脏线粒体功能的影响及其表遗传机制[D]. 南京: 南京农业大学, 2012: 66-71.
[28] GAO Z, YIN J, ZHANG J, et al. Butyrate improves insulin sensitivity and increases energy expenditure in mice[J]. Diabetes, 2009, 58(7): 1509-1517. DOI:10.2337/db08-1637.
Effect of Tributyrin on Liver Antioxidant Capacity and Mitochondrial Function of Piglets with Intrauterine Growth Retardation during Sucking Period
HE Jintian
1, DONG Li
1,2, BAI Kaiwen
1, XU Wen
1, NIU Yu
1, HUANG Qiang
1, ZHANG Lili
1, WANG Tian
1,*
(1. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China)
Abstract:Objective: The effect of tributyrin on liver antioxidant capacity and mitochondrial function of sucking piglets with intrauterine growth retardation (IUGR) was observed in the present study. Methods: Totally 8 piglets with normal birth weight and 16 IUGR piglets were selected. The IUGR piglets were randomly divided into 2 groups (IUGR group fed basic artifi cial milk; IT group (IUGR + 0.1% tributyrin) fed basic artifi cial milk supplemented with 0.1% tributyrin). The piglets with normal birth weight were provided with basic artifi cial milk (NBW group). The experiment started at the age from 7 to 21 days. Totally 6 piglets (similar body weight) were selected from each group and slaughtered, and liver histological sections, antioxidant enzyme activities and mRNA expression were measured. Results: 1) Compared with NBW group, liver histological sections from IUGR group revealed central venous congestion, but IT group had no signifi cant change. 2) Compared with NBW group, IUGR group had lower glutathione peroxidase (GSH-Px) activity (P < 0.05) and increased malondialdehyde (MDA) content (P < 0.01) in liver, and lower malate dehydrogenase (MDH) and Mn-superoxide (Mn-SOD)activities in mitochondria (P < 0.05). IT group had higher SOD and GSH-Px activities, glutathione (GSH) content and total antioxidant capacity (T-AOC) (P < 0.05), and lower MDA content (P < 0.01) in liver, as well as higher activities of MDH and Mn-SOD in mitochondria when compared to IUGR group. Compared with NBW group, the activities of GSH and T-AOC were significantly increased (P < 0.05), and the MDA content was significantly decreased (P < 0.01) in IT group. 3) Compare with NBW group, the mRNA expression levels of the SOD and CAT genes in liver of IUGR group were significantly increased (P < 0.05), and the mRNA expression levels of SOD and PRDX3 in liver of IT group were also signifi cantly increased (P < 0.05). Compared to IUGR group, the mRNA expression of CAT was signifi cantly decreased (P < 0.05) and the mRNA expression of PRDX3 was signifi cantly increased (P < 0.05) in liver of IT group. Conclusion: Piglets with IUGR exhibited decreased antioxidant capacity in liver and impaired mitochondrial function. Diets supplemented with tributyrin could improve antioxidant capacity and protect mitochondria from damage in liver of IUGR piglets. Tributyrin may be an effi cient antioxidant.
Key words:intrauterine growth retardation (IUGR); liver; antioxidant capacity; mitochondria; piglets
DOI:10.7506/spkx1002-6630-201603035
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2016)03-0191-06
引文格式:
何进田, 董丽, 白凯文, 等. 三丁酸甘油酯对宫内发育迟缓哺乳仔猪肝脏抗氧化和线粒体功能的影响[J]. 食品科学, 2016, 37(3): 191-196. DOI:10.7506/spkx1002-6630-201603035. http://www.spkx.net.cn
HE Jintian, DONG Li, BAI Kaiwen, et al. Effect of tributyrin on liver antioxidant capacity and mitochondrial function of piglets with intrauterine growth retardation during sucking period[J]. Food Science, 2016, 37(3): 191-196. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603035. http://www.spkx.net.cn
收稿日期:2015-05-01
基金项目:国家自然科学基金青年科学基金项目(31201808);教育部高等学校博士点基金项目(20110097120033)
作者简介:何进田(1990—),男,硕士研究生,研究方向为动物营养与饲料科学。E-mail:2013105040@njau.edu.cn
*通信作者:王恬(1958—),男,教授,博士,研究方向为动物营养与饲料科学。E-mail:twang18@163.com


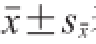 表示。所有数据采用单因素方差分析中的Duncan’s法进行多重比较,以P<0.05和P<0.01作为差异显著性的判断标准。
表示。所有数据采用单因素方差分析中的Duncan’s法进行多重比较,以P<0.05和P<0.01作为差异显著性的判断标准。



