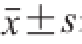 表示,采用SPSS 19.0软件进行组间显著性分析。
表示,采用SPSS 19.0软件进行组间显著性分析。
刘 红 1,曾志杰 2,李传勇 2,张水华 3,孙乐常 1,陈 琼 2,曹敏杰 1,刘光明 1,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.厦门市农产品质量安全检验测试中心,福建 厦门 361009;3.福建医科大学 福建省新药安全性评价中心,福建 福州 350108)
摘 要:目的:探讨毒豆芽中常用植物生长调节剂4-氯苯氧乙酸钠(sodium 4-chlorophenoxyacetate,4-CPANa)对小鼠的急性、蓄积性毒性及其在小鼠机体的残留规律。方法:采用改良寇氏法测定4-CPANa对小鼠的急性毒性;蓄积性毒性实验以107.4 mg/kg为起始剂量,采用剂量递增蓄积系数法染毒,观察记录实验期间小鼠的一般生理指标,结束后测定小鼠血液生化指标、脏器指数、组织病理变化状况,超高效液相色谱法测定4-CPANa在小鼠机体内的残留量。结果:4-CPANa对小鼠经口半数致死剂量(LD 50)为1 074.1 mg/kg,蓄积系数K>8;4-CPANa对小鼠的生理及血液生化指标有不同程度影响,肝脏、肾脏均发生组织病理学变化;小鼠机体中4-CPANa残留量由高到低的顺序为:尿液>肾脏>肝脏>血液>心脏>脑组织>肌肉。结论:4-CPANa为低毒、低等蓄积性药物,其毒性效应主要表现为对小鼠肝脏和肾脏的毒性作用。
关键词:4-氯苯氧乙酸钠;急性毒性;蓄积性毒性;超高效液相色谱;毒豆芽
近年来,沈阳、长春、兰州、北京、郑州等地的一些黑作坊在豆芽生产过程中,滥用添加剂或非法使用国家明令禁止的非食用物质,造成“毒豆芽”事件。2009年11月“毒豆芽”首次在长春曝光,2014年7月南昌捣毁4 家毒豆芽窝点,缴获毒豆芽3余吨 [1];同年11月北京查获一家日产20 t毒豆芽的窝点 [2];同年12月江门捣毁5 个毒豆芽窝点,缴获毒豆芽及半成品7 t [3]。可见豆芽的安全问题历经多年曝光、整顿,却始终“久治不绝”。目前毒豆芽常检有毒有害成分主要为:2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)、4-氯苯氧乙酸钠(sodium 4-chlorophenoxyacetate,4-CPANa)、6-苄基腺嘌呤(6-benzylaminopurine,6-BA)、恩诺沙星、亚硝酸盐与硝酸盐等 [4],这些非法添加的物质严重威胁着消费者的健康安全。谢寒冰 [5]在豆芽添加剂残留检测分析中发现4-CPANa与6-BA为毒豆芽生产的主要添加剂,其中4-CPANa的合格率最低,仅为76.7%;石金娥等 [6]对吉林市市售豆芽7 种植物生长调节剂的含量监测结果显示4-CPANa检出率高达71.4%;杨婕等 [7]对市售32 份绿豆芽样品进行检测,有9.4%的样品4-CPANa的含量在1.39~3.39 mg/kg之间,严重超标;北京执法人员将泡制绿豆的水、生长期的绿豆和黄豆以及成品豆芽分别取样检测,均检测出4-CPANa,其含量超标20~200 倍不等 [2]。由此可见,4-CPANa引起的豆芽安全问题相当严峻。4-CPANa是中枢神经兴奋药甲氯芬酯的中间体,俗称促生灵、蕃茄灵、防落素,广泛用于农业、果树和园艺作物从发芽到收获的各个阶段,但在豆芽的生产中最为普遍,为最常添加的植物生长调节剂。4-CPANa为2,4-D的同系物以及替代药物,可以使豆芽更加肥嫩、粗壮,提高豆芽的产量。豆芽在我国深受广大消费者的喜爱,日常消费量非常大,所以人体内4-CPANa的残留及其对机体的毒害作用不容忽视。
目前,关于4-CPANa的急性、蓄积性毒性效应报道不够全面,尤其是4-CPANa在脏器、血液、尿液中的残留分析测定未见报道。关于豆芽中4-CPANa的分析方法方面,主要有薄层色谱法 [8]、离子色谱法 [9]、高效液相色谱法 [10-11]、气相色谱-液相色谱法 [12]、液相色谱串联质谱法 [13];关于物质在机体的残留规律方面,辜雪冬 [14]和Massadeh [15]等分别利用高效液相色谱法测定四环素残留量,原子吸收光谱法测定镉和铅两种重金属残留,而利用QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)快速样品前处理技术 [16]结合超高效液相色谱(ultrahigh-performance liquid chromatography, UPLC)检测4-CPANa残留量的方法未见报道,本实验以昆明小鼠为动物模型,开展4-CPANa的急性、蓄积性毒性研究,并利用QuEChERS-UPLC方法对小鼠机体的4-CPANa残留量进行分析测定,进一步研究4-CPANa对小鼠的毒害作用,为4-CPANa毒害研究提供理论依据,以期指导4-CPANa的安全生产和使用,为豆芽的安全生产提供保障。
1.1 动物、材料与试剂
SPF级健康昆明种小鼠,体质量18~22 g,雌雄各半,购自上海斯莱克实验动物有限公司,动物合格证号:SCXK(沪)2012-0005。
4-CPANa药品(纯度≥98.5%) 上海士锋公司。
Coulter LX 20全自动生化分析仪配套试剂(总蛋白(total protein,TP,E411212)、白蛋白(albumin,ALB,E411213)、球蛋白(globulin,GLB)、天冬氨酸转氨酶(aspartate aminotransferase,AST,501258)、丙氨酸转氨酶(alanine aminotransferase,ALT,501254)、乳酸脱氢酶(lactate dehydrogenase,LDH,407242)、碱性磷酸酶(alkaline phosphatase,ALP,501236)、血尿素氮(blood urea nitrogen,BUN,E503220)) 美国贝克曼公司;肌酐(creatinine,CREA,818RJL) 日本积水公司;苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒 碧云天生物技术研究所;4-CPANa标准品(纯度≥98.50%) 上海安谱公司;OriQuE萃取盐包、DisQuE净化管 美国Agilent公司。
1.2 仪器与设备
TP-202型电子天平、Sartorius BT 125D型电子天平北京赛多利斯科学仪器公司;Coulter LX20全自动生化分析仪 美国Beckman公司;RM2235石蜡切片机 德国Leica公司;55I-1000光学显微镜 日本Nikon公司;UPLC仪 美国Waters公司;IKA T18 Basic高速组织分散机 德国IKA公司。
1.3 方法
1.3.1 急性毒性实验
根据预实验结果得知,小鼠经口灌胃4-CPANa后0%及100%死亡剂量估计值分别为800、1 600 mg/kg。正式实验将60 只小鼠按体质量随机分为6 组,每组10 只,雌雄各半,灌胃前禁食12 h,不禁水。4-CPANa剂量组设为Ⅰ~Ⅴ共5 组,组间剂量比为1.41,一次性灌胃剂量从低到高依次为800、952、1 131、1 348、1 600 mg/kg,对照组灌胃蒸馏水。灌胃染毒后连续观察7 d,记录小鼠精神状态、体质量、摄食饮水、死亡等情况,7 d后所有存活小鼠停食6 h后处死。4-CPANa的LD 50及LD 5095%可信限按改良寇氏法计算 [14]。
1.3.2 蓄积性毒性实验
将30 只小鼠按体质量随机分为2 组,蓄积组20 只,对照组10 只,雌雄各半。蓄积组以107.4 mg/kg(1/10 LD 50)为起始剂量,每天灌胃染毒1 次,4 d为一阶段,灌胃量每阶段递增1.5 倍,直至小鼠死亡数达到总数一半,或继续给药直至累计剂量达到5.0 倍LD 50以上为止(本研究共给药6 个阶段,即24 d);对照组灌胃蒸馏水。计算蓄积系数K=LD 50(n)/LD 50(1),并对结果进行评价,其中LD 50(n)为引起受试动物半数死亡的累计剂量,LD 50(1)为1 次染毒引起动物半数死亡的剂量。实验期间观察并记录小鼠精神状态、体质量、摄食饮水、死亡等情况,实验结束后停食6 h,眼眶取血,使用血液生化仪测定9 种生化指标。处死小鼠,进行大体解剖观察,称量肾脏、脾脏、肝脏、肾脏、肺和脑的质量并计算各脏器指数(脏器质量(mg)/活体体质量(g)),取心脏、肝脏、脾脏、肺、肾脏和脑置于体积分数为10%的中性甲醛溶液中固定,常规包埋、切片、HE染色、光学显微镜观察并拍照。
1.3.3 4-CPANa残留量检测
收集蓄积性毒性实验中小鼠的心脏、肝脏、肾脏、脑、肌肉和血液、尿液,采用QuEChERS结合UPLC法检测4-CPANa的残留量。样品经0.01 mol/L NaOH碱液提取后,用冰乙酸溶液调至酸性(pH 2.5),再用乙腈提取,QuEChERS净化。以甲醇和0.01 mol/L磷酸盐缓冲液(体积比为35∶65)为流动相,采用ACQUITY UPLC HSS C 18柱(2.1 mm×100 mm,1.8 μm)分离,PDA检测器在228 nm波长处检测,外标法定量。
1.4 统计学分析
实验数据以
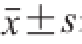 表示,采用SPSS 19.0软件进行组间显著性分析。
表示,采用SPSS 19.0软件进行组间显著性分析。
2.1 急性毒性实验结果
2.1.1 4-CPANa的LD 50及LD 5095%可信限
由表1可知,4-CPANa在1 d内使实验组18 只小鼠死亡,且在1~2 d内4-CPANa各剂量组小鼠死亡只数均高于同剂量组的其他时段,2 d后,小鼠死亡只数明显减少,说明4-CPANa毒效在1 d内最高,小鼠中毒程度剧烈。另外,随着4-CPANa剂量的增大,各组小鼠死亡只数增加。
采用改良寇氏法计算4-CPANa对小鼠的LD 50为1 074.1 mg/kg,LD 5095%可信限为975.7~1 182.4 mg/kg。按照化合物经口急性毒性分级标准 [17-18],4-CPANa属于低毒化学物质。
表1 4-CPANa对小鼠经口急性毒性实验结果(n=1100)
Table1 Oral acute toxicity of 4-CPANa in mice (n = 10)

死亡只数死亡率1 d2 d3 d4 d5 d6 d7 d1~7 d对照组0000000000Ⅰ组800000000000Ⅱ组952110000020.2Ⅲ组1 131311010060.6Ⅳ组1 348621000090.9Ⅴ组1 6008200000101总计18620100270.45组别4-CPANa剂量/(mg/kg)
2.1.2 小鼠一般生理情况
对照组小鼠在实验期间食欲、饮水、行为正常,精神良好,活泼好动,未出现死亡小鼠;而4-CPANa各剂量组小鼠在实验期间出现了精神萎靡、反应迟钝、步态蹒跚、趴卧不动、呼吸困难、抽搐明显等症状,且随着4-CPANa剂量的增加,中毒表现愈加强烈,Ⅴ组有几只小鼠在跳跃之后迅速死亡。
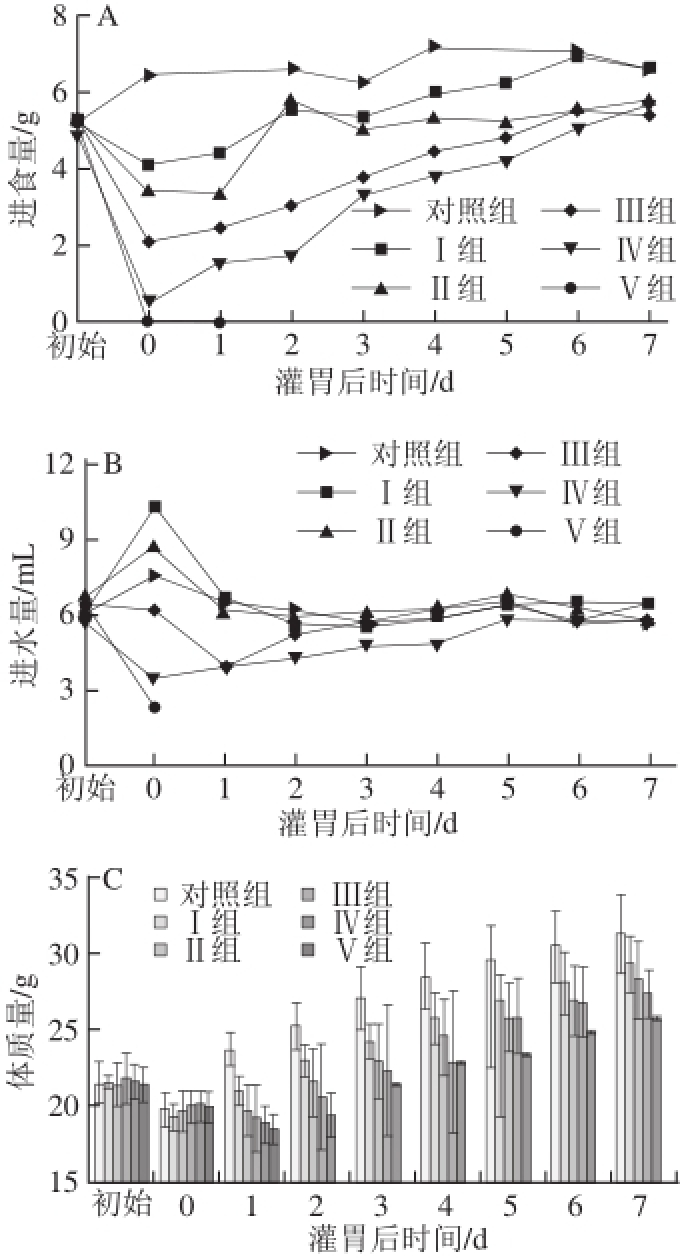
图1 不同剂量4-CPANa对小鼠进食量(A)、进水量(B)及体质量(C)的影响
Fig.1 Effects of different 4-CPANa dosages on body weight (C), daily food consumption (A) and daily water consumption (B) of mice
由图1A、1C可知,与对照组相比,在灌胃后1 d内4-CPANa各剂量组小鼠进食量明显减少,体质量也明显降低,这说明在此段时间里4-CPANa对小鼠毒性作用明显,导致小鼠少食或不食,进而使小鼠体质量下降。由图1B可知,与对照组相比,在灌胃后1 d内Ⅰ、Ⅱ组小鼠进水量增加但Ⅲ、Ⅳ、Ⅴ组小鼠进水量下降,可能是Ⅰ、Ⅱ组小鼠为了缓解药物刺激、冲淡胃内的药物浓度而增加了进水量,而Ⅲ、Ⅳ、Ⅴ组小鼠中毒剧烈,无暇顾及4-CPANa的刺激增加饮水。另外,随着时间的延长,2 d后各组小鼠进食量增加,进水量趋于稳定,体质量也开始增加,且Ⅰ组与对照组相比体质量无明显差别,Ⅱ组小鼠体质量仍然明显低于对照组,这说明药物作用己在减退,小鼠自身状况开始好转。
2.2 蓄积性毒性实验结果
2.2.1 K值的确定
蓄积性毒性实验的剂量设计及小鼠死亡结果见表2,蓄积组小鼠直至第5、6阶段才开始出现死亡,说明连续给药累积量已达到致死小鼠的程度。实验期间小鼠累计死亡2 只,死亡率10%(蓄积组小鼠共20 只),计算得K>8.4。按照蓄积性毒性分级标准 [18],4-CPANa为低等蓄积性药物。
表2 4-CPANa对小鼠蓄积性毒性的结果
Table2 Oral accumulative toxicity of 4-CPANa in mice
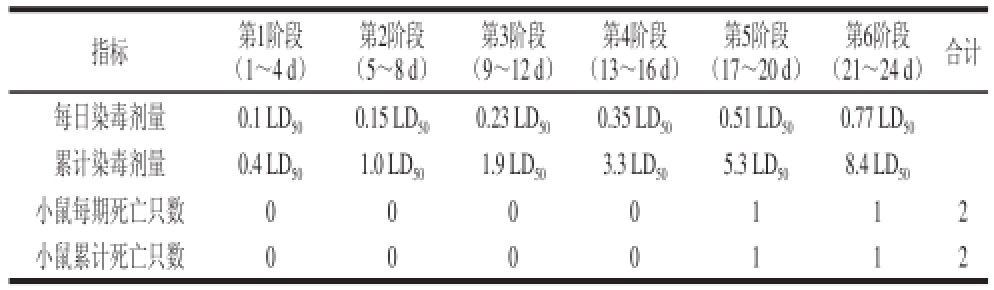
指标第1阶段(1~4 d)第2阶段(5~8 d)第3阶段(9~12 d)第4阶段(13~16 d)第5阶段(17~20 d)第6阶段(21~24 d)合计每日染毒剂量0.1 LD 500.15 LD 500.23 LD 500.35 LD 500.51 LD 500.77 LD 50累计染毒剂量0.4 LD 501.0 LD 501.9 LD 503.3 LD 505.3 LD 508.4 LD 50小鼠每期死亡只数0000112小鼠累计死亡只数0000112
2.2.2 小鼠一般生理情况
在给药期间的前3 个阶段小鼠均表现正常,活动自如、精神状态正常;到第4阶段时,个别小鼠精神不佳,对外界的刺激反应不灵敏、精神萎靡;到第5、6阶段时,个别小鼠趴卧少动、体温降低。
表3显示了4-CPANa蓄积性毒性对小鼠进食量、进水量、体质量的影响,随着4-CPANa剂量的阶段递增,与对照组相比,蓄积组小鼠的进食量、进水量、体质量逐渐呈现出显著或极显著变化(P<0.05或P<0.01),且在整个实验期间蓄积组小鼠的平均体质量均低于对照组,对照组小鼠的体质量增长率为99.5%,而蓄积组仅为78.4%,说明随着4-CPANa剂量的阶段递增,其累积作用对小鼠的毒性增大,明显降低了小鼠的食欲,导致小鼠少食,体质量增长下降。
表3 4-CPANa蓄积性毒性对小鼠体质量、进食量、进水量的影响
Table3 Effects of accumulative toxicity of 4-CPANa on body weight, daily food consumption and daily water consumption of mice
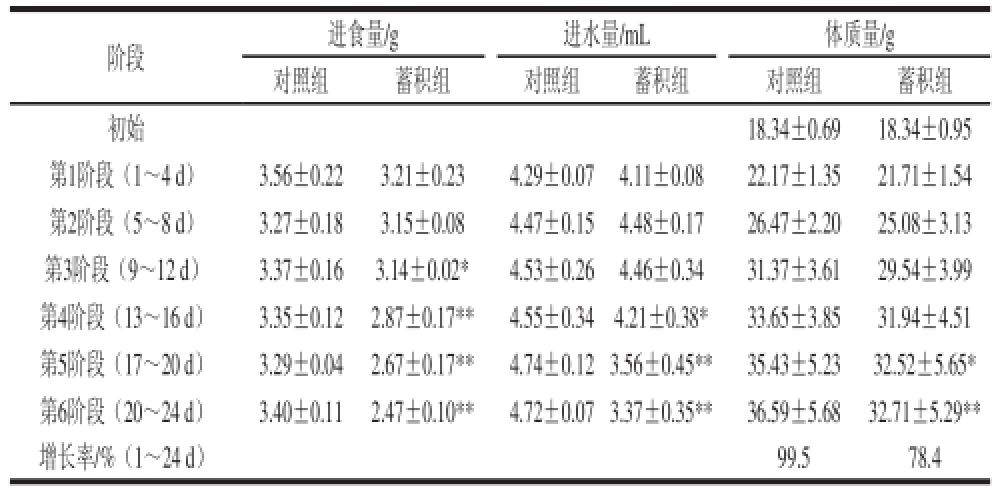
注:**.与对照组相比,差异极显著(P<0.01);*.与对照组相比,差异显著(P<0.05)。下同。
阶段进食量/g进水量/mL体质量/g对照组蓄积组对照组蓄积组对照组蓄积组初始18.34±0.6918.34±0.95第1阶段(1~4 d)3.56±0.223.21±0.234.29±0.074.11±0.0822.17±1.3521.71±1.54第2阶段(5~8 d)3.27±0.183.15±0.084.47±0.154.48±0.1726.47±2.2025.08±3.13第3阶段(9~12 d)3.37±0.163.14±0.02*4.53±0.264.46±0.3431.37±3.6129.54±3.99第4阶段(13~16 d)3.35±0.122.87±0.17**4.55±0.344.21±0.38*33.65±3.8531.94±4.51第5阶段(17~20 d)3.29±0.042.67±0.17**4.74±0.12 3.56±0.45**35.43±5.2332.52±5.65*第6阶段(20~24 d)3.40±0.112.47±0.10**4.72±0.07 3.37±0.35**36.59±5.6832.71±5.29**增长率/%(1~24 d)99.578.4
2.2.3 小鼠脏器解剖观察结果及脏器指数
对照组小鼠肝脏、肾脏、心脏、脾脏、肺脏、脑组织的颜色及形状正常。蓄积组小鼠肝脏肿大,有树枝状或细小长条形出血斑,部分有局灶性肝细胞坏死;肾脏肿大,被膜紧张,呈现深褐色;心脏肿大、出血;脾脏呈暗红色;肺脏淤血、水肿、颜色潮红;脑组织有不同程度萎缩。
表4显示了4-CPANa蓄积性毒性对小鼠各脏器指数的影响,结果显示蓄积组小鼠的肝脏指数、心脏指数极显著高于对照组(P<0.01),肾脏指数显著高于对照组(P<0.05),脑组织指数显著低于对照组(P<0.05)。
表4 4-CPANa蓄积性毒性对小鼠各脏器指数的影响
Table4 Effect of accumulative toxicity of 4-CPANa on viscera indices of mice
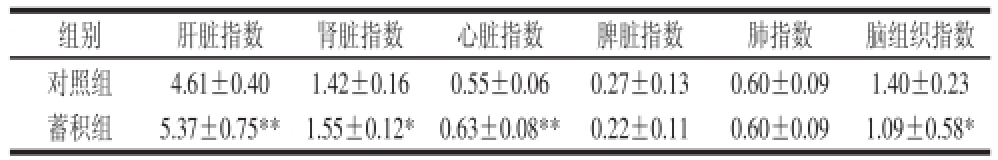
组别肝脏指数肾脏指数心脏指数脾脏指数肺指数脑组织指数对照组4.61±0.401.42±0.160.55±0.060.27±0.130.60±0.091.40±0.23蓄积组5.37±0.75**1.55±0.12*0.63±0.08**0.22±0.110.60±0.091.09±0.58*
2.2.4 小鼠组织病理学变化
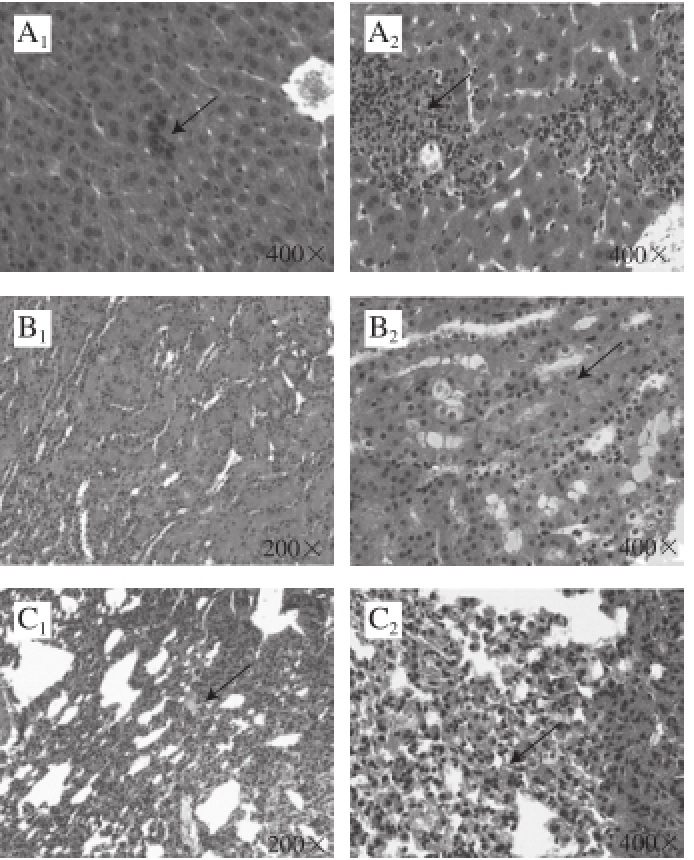

图2 4-CPANa蓄积毒性实验小鼠病理组织变化(HE)
Fig.2 Histopathologic lesions of mice suffering from accumulative toxicity of 4-CPANa (HE)
图2 是对照组、蓄积组小鼠各脏器的病理组织石蜡切片图,对照组与蓄积组小鼠肺部均可见轻微肺间质血管扩张充血,个别肺泡腔有少许水肿液;两组小鼠心脏、脾脏均未见明显异常。另外,对照组小鼠肝脏除了出现白细胞聚集灶(自发病变,图2A 1箭头所示)外,其余部分结构正常,对照组肾脏、脑组织未见明显异常;蓄积组小鼠肝脏可见肝细胞变性坏死、炎细胞浸润,蓄积组小鼠肾脏肾小管见上皮细胞变性,且有1 只雌性小鼠大脑海马组织附近轻微出血。
2.2.5 血液生化指标
表5显示了4-CPANa蓄积性毒性对小鼠血液生化指标的影响,结果显示蓄积组小鼠血清TP含量极显著低于对照组(P<0.01),ALB含量显著低于对照组(P<0.05);ALT和AST活力、BUN含量极显著高于对照组(P<0.01),CREA含量显著高于对照组(P<0.05)。
表5 4-CPANa蓄积性毒性对小鼠血液生化指标的影响
Table5 Effects of accumulative toxicity of 4-CPANa on blood biochemical indices
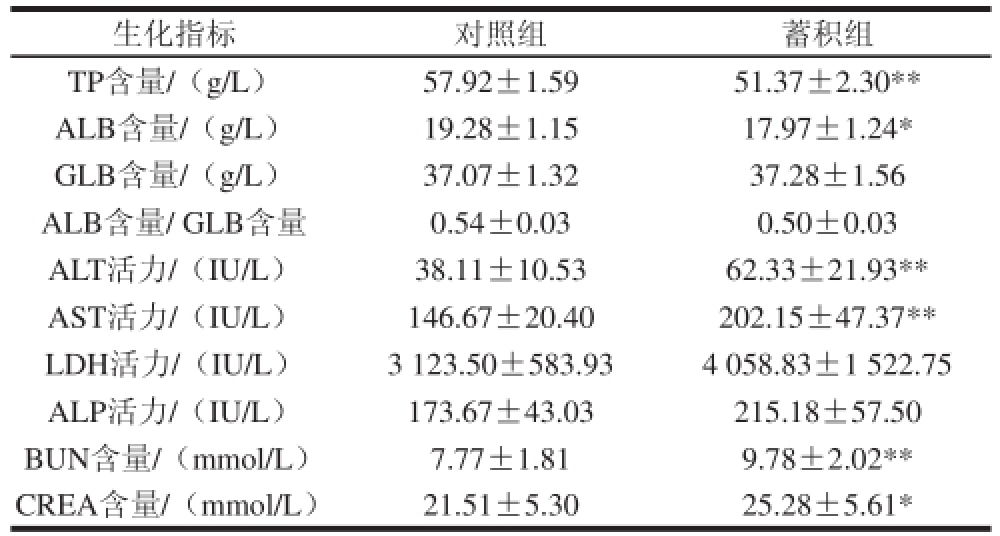
生化指标对照组蓄积组TP含量/(g/L)57.92±1.5951.37±2.30** ALB含量/(g/L)19.28±1.1517.97±1.24* GLB含量/(g/L)37.07±1.3237.28±1.56 ALB含量/ GLB含量0.54±0.030.50±0.03 ALT活力/(IU/L)38.11±10.5362.33±21.93** AST活力/(IU/L)146.67±20.40202.15±47.37** LDH活力/(IU/L)3 123.50±583.934 058.83±1 522.75 ALP活力/(IU/L)173.67±43.03215.18±57.50 BUN含量/(mmol/L)7.77±1.819.78±2.02** CREA含量/(mmol/L)21.51±5.3025.28±5.61*
2.2.6 小鼠机体4-CPANa残留分析
2.2.6.1 4-CPANa的UPLC测定方法验证
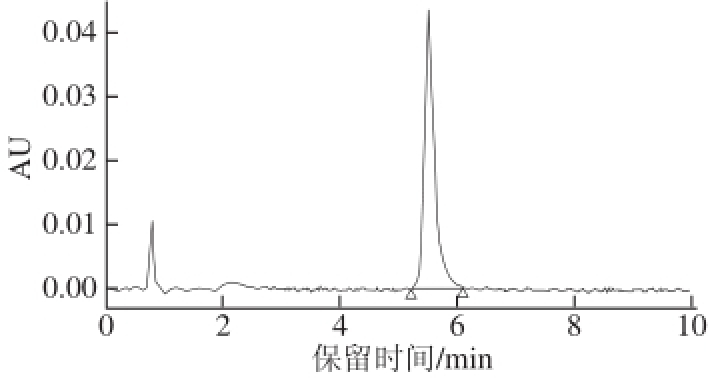
图3 4-CPANa标准溶液的UPLLCC图
Fig.3 UPLC chromatogram of 4-CPANa
图3 是4-CPANa标准溶液(2 mg/L)的UPLC图,可以看出4-CPANa基本无基质干扰,其UPLC保留时间为5.509 min。
用峰面积对4-CPANa标准溶液质量浓度作图并计算,按信噪比(S/N)的3 倍确定方法的检出限(limit of detection,LOD),按S/N的10 倍确定方法的定量限(limit of quantitation,LOQ)。结果显示,本研究建立的4-CPANa测定方法在质量浓度为0.200~4.000 mg/kg范围内线性关系良好:y=32 200x+401(R 2=0.999 9),LOD为0.015 mg/kg,LOQ为0.050 mg/kg。
2.2.6.2 小鼠机体4-CPANa的残留量
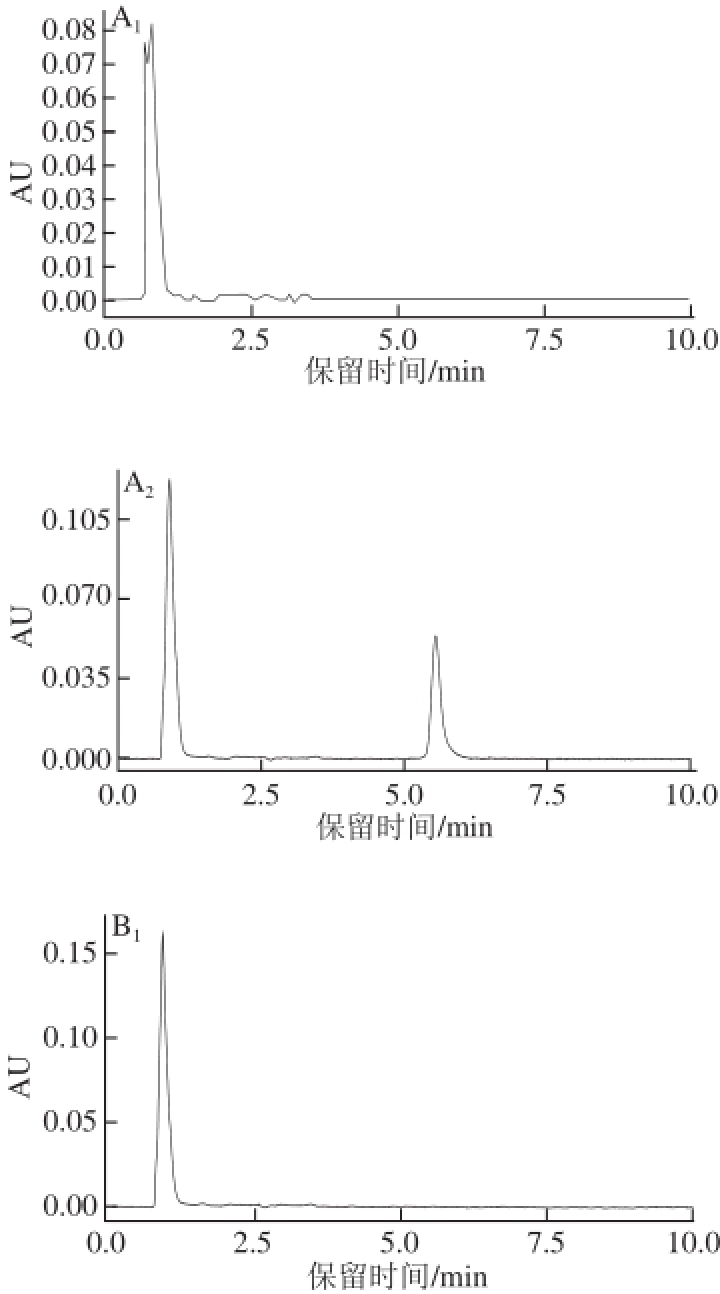
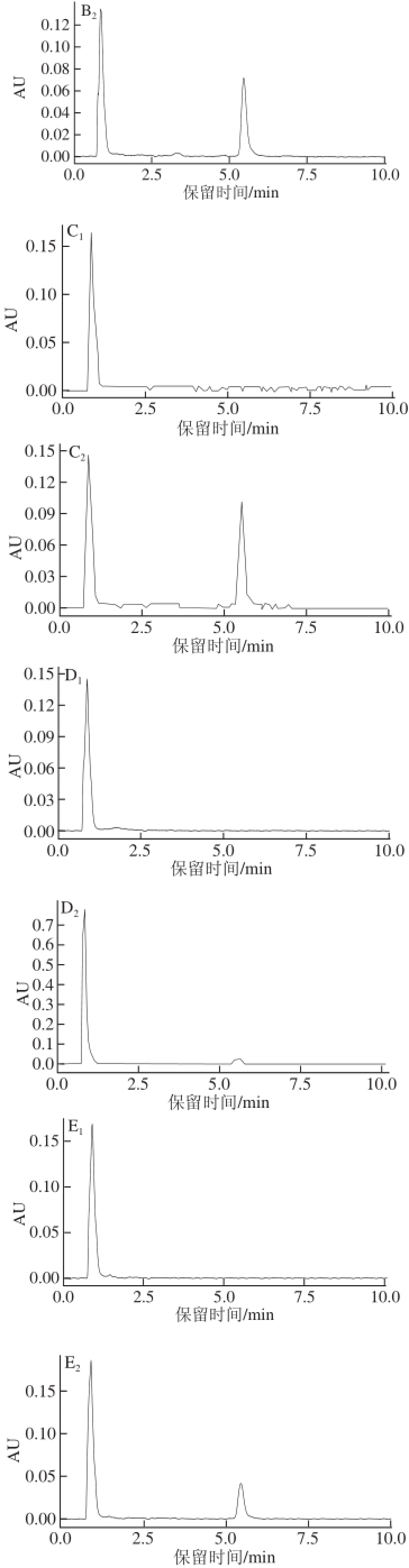
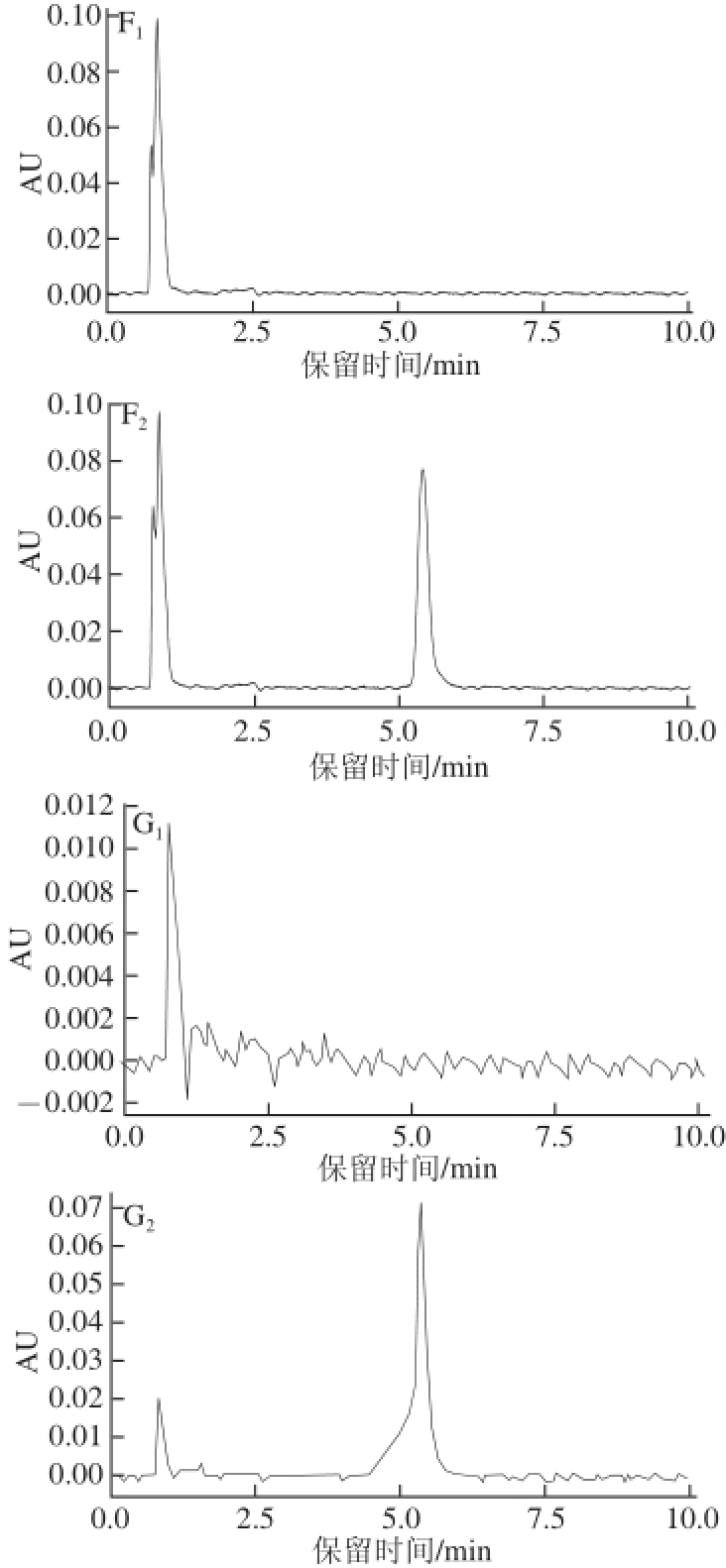
图4 小鼠血液、尿液以及各种脏器和组织的UPLLCC图
Fig.4 UPLC chromatograms of 4-CPANa in blood, urine, visceral organs and tissue of mice
A.心脏;B.肝脏;C.肾脏;D.脑组织;E.肌肉;F.血液;G.尿液。下标1、2分别表示对照组、蓄积组。
图4为小鼠血液、尿液以及各种脏器和组织中4-CPANa的UPLC图,可以看出对照组小鼠的心脏、肝脏、肾脏、脑组织、肌肉、血液、尿液中均无4-CPANa检出,也无杂质干扰,蓄积组小鼠的相应脏器、组织及血液、尿液样品均在保留时间为5.509 min时有4-CPANa峰的出现。
小鼠机体的4-CPANa残留量见表6,结果显示蓄积组小鼠机体内4-CPANa残留量由高到低的顺序为:尿液>肾脏>肝脏>血液>心脏>脑组织>肌肉。
表6 蓄积实验小鼠机体的4-CPANa残留量
Table6 Residual amounts of 4-CPANa in mice in accumulative toxicity test mg/kg
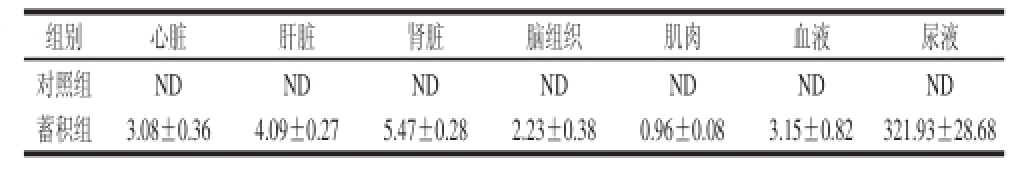
注:ND.未检出;蓄积组累积剂量9 022 mg/kg。
?
4-CPANa是常被滥用在豆芽生产中的植物生长调节剂,它可以促进豆芽下胚轴粗大、减少根部萌发、加速细胞分裂。全国已有多个城市相继曝出毒豆芽窝点,毒豆芽中4-CPANa的检出与超标情况最为严重 [2-7]。4-CPANa对大鼠急性经口LD 50为2 000 mg/kg(以体质量计),对小鼠成熟精细胞有一定损伤作用 [19-20]。本实验考察了4-CPANa对小鼠的急性、蓄积性毒性,通过测定小鼠的一般生理指标、脏器指标、血液生化指标、病理切片并结合QuEChERS-UPLC检测手段分析其在小鼠血液、尿液、各种脏器和组织的残留情况。
急性毒性实验结果表明:4-CPANa属于低毒化合物,其对小鼠的经口LD 50为1 074.1 mg/kg,本研究与冯静仪等 [19]报道的4-CPANa的LD 50(794 mg/kg)及黄星培等 [20]报道的4-CPANa的LD 50(雄性915.4 mg/kg;雌性667.5 mg/kg)的结果不一致,但与徐雪玉 [21]所报道的4-CPANa的LD 50(1 180 mg/kg)的结果很相近。前两个不一致的LD 50结果是分别是在1985年及1987年报道的,距目前已有近30 a,这期间动物质量发生了很大的变化,且不同品种、级别、来源的小鼠个体差异较大,对药物的耐受力不同 [22-25],同时LD 50不是一个常数,可受多种内外部因素的影响,结果可能存在较大差别,可达2~8 倍 [26]。
蓄积性毒性实验结果表明:4-CPANa为低等蓄积性药物。这与黄星培等 [19]报道的相符。随着4-CPANa用药剂量的递增,其累积作用对小鼠的毒性增大,明显降低了小鼠的食欲,导致小鼠少食、体质量增长下降,并且造成小鼠血清TP、ALB含量明显低于对照组;ALT、AST活力以及BUN、CREA含量明显高于对照组。血清中TP和ALB含量减少,说明可能是4-CPANa摄入过量后对小鼠肝脏造成了损伤,导致肝脏合成白蛋白、清蛋白的能力明显下降;同时ALT、AST活力升高,进一步说明肝脏损伤,使ALT、AST从受损的肝细胞中大量逸出而造成其活性明显升高 [27],与肝脏解剖观察结果(肝脏明显肿大)及病理切片观察结果(肝细胞变性坏死、炎细胞浸润)相一致。另外,蓄积组小鼠血清BUN和CREA含量的升高说明蓄积组小鼠肾脏遭到损害,造成肾小球对BUN、CREA滤出减少而导致其在血清中的含量升高 [27],与肾脏解剖观察结果(肾脏肿大)及病理切片结果(肾小管均见上皮细胞变性)一致。且这与4-CPANa摄入后在体内代谢及残留的规律相符:小鼠在反复接触4-CPANa后,药物首先通过肝脏解毒、肾脏过滤,主要以尿液的形式排出体外;但肝脏解毒、肾脏过滤能力有限,当小鼠摄入4-CPANa超过机体的代谢能力时,4-CPANa就会随着血液进入到脑组织、肌肉中,以未解毒的形式存留在机体内,故尿液中的4-CPANa残留量最大,肾脏、肝脏次之,高于血液中的残留量,血液中4-CPANa的残留量又比脑组织、肌肉中的残留量高。过量的4-CPANa残留会导致机体中毒,使组织、器官、细胞受损,如石蜡组织切片观察到蓄积组小鼠肝脏、肾脏病变。
本研究进行了24 d蓄积毒性实验,由于在第20天才开始出现1 只小鼠死亡的情况,于是将实验时间又延长了1 个阶段,以考察累积的剂量是否会达到致死小鼠的阈值。对于蓄积组小鼠的肺部与对照组都出现相同的轻微肺间质血管扩张充血、个别肺泡腔有少许水肿液现象,推测这与4-CPANa无关,可能与饲料或实验操作有关。蓄积组1 只雌性小鼠的大脑海马组织附近轻微出血,可能是小鼠个体原因,也有可能是4-CPANa对小鼠中枢神经有毒害作用所致。有研究表明,4-CPANa是中枢神经兴奋药甲氯芬酯的中间体,又是具有较强的神经毒性2,4-D的同系物 [28],且蓄积组小鼠脑组织有明显的萎缩现象,故4-CPANa的神经毒性有待于进一步的深入研究。
在以后的研究中,可以基于4-CPANa的毒性及其机体残留规律,进一步探讨添加4-CPANa生产出的毒豆芽的毒性,进而扩大对豆芽的4-CPANa残留监测,结合膳食暴露情况,对毒豆芽中的添加物质进行系统的风险评估,从而有效指导豆芽的安全生产与食用。
参考文献:
[1] 吴腮忠. 江西省食品药品监管部门与公安机关深夜行动联手查处“毒豆芽” 连捣四家“黑窝点”[N]. 中国医药报, 2014-07-21(1).
[2] 毛伟豪. 豆芽被“泡药”, 毒性超三聚氰胺[N]. 新华每日电讯, 2014-11-26(5).
[3] 曾育军. 江门捣毁5个毒豆芽窝点 缴获毒豆芽及半成品1.4万斤江门[DB/OL]. (2014-08-30) [2015-06-12]. http://paper.oeeee.com/ nis/201412/08/303156.html.
[4] 何勇. 毒豆芽在监管盲区中疯长[N]. 人民日报, 2011-04-25(9).
[5] 谢寒冰. 豆芽质量安全的关键影响因素分析及对策[D]. 青岛: 中国海洋大学, 2008: 26-30.
[6] 石金娥, 侯宇, 王莹, 等. 吉林省市售豆芽中7种植物生长调节剂的含量监测分析[J]. 吉林蔬菜, 2014(12): 54-55. DOI:10.3969/ j.issn.1672-0180.2014.12.047.
[7] 杨婕, 黄少文, 孙远明, 等. 4-氯苯氧乙酸钠对绿豆芽生长的影响及其残留分析[J]. 食品工业科技, 2015, 36(15): 104-108. DOI:10.13386/j.issn1002-0306.2015.15.014.
[8] 丁友昌, 姜爱香, 钟鸣文. 薄层层析法测定无根豆芽中4-氯苯氧乙酸钠残留量的研究[J]. 中国公共卫生, 1997, 13(2): 77.
[9] 颜金良, 颜勇卿, 王立, 等. 离子色谱法快速测定豆芽中4-氯苯氧乙酸残留量[J]. 中国卫生检验杂志, 2006, 16(10): 1207-1208. DOI:10.3969/j.issn.1004-8685.2006.10.027.
[10] 黄卫平. 高效液相色谱法测定豆芽中4-氯苯氧乙酸钠残留量[J]. 中华预防医学杂志, 2002, 36(1): 44-45. DOI:10.3760/ j:issn:0253-9624.2002.01.013.
[11] 李小平, 蒋经伟, 范建中, 等. 固相萃取HPLC法测定豆芽中4-氯苯氧乙酸钠[J]. 中国卫生检验杂志, 2006, 16(3): 267-269. DOI:10.3969/ j.issn.1004-8685.2006.03.005.
[12] WONG Y S. Gas-liquid chromatographic determination of 4-chlorophnoxyacetic acid residues in mung bean-sprouts[J]. Journal of the Association of Official Analytical Chemists, 1982, 65(5): 1118-1121.
[13] 张婧雯, 郭春海, 葛世辉, 等. 固相萃取-超高效液相色谱串联质谱法同时测定豆芽中6-苄基腺嘌呤, 赤霉素和4-氯苯氧乙酸的残留量[J]. 中国食品卫生杂志, 2014, 26(5): 441-445. DOI:10.13590/ j.cjfh.2014.05.008.
[14] 辜雪冬. 家禽四环素蓄积性毒性试验及残留HPLC检测研究[D]. 雅安: 四川农业大学, 2007: 13-14.
[15] MASSADEH A M, AL-SAFI S A, MOMANI I F, et al. Garlic (Allium sativum L.) as a potential antidote for cadmium and lead intoxication: cadmium and lead distribution and analysis in different mice organs[J]. Biological Trace Element Research, 2007, 120(1/3): 227-234. DOI:10. 1007/s12011-007-8017-3.
[16] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/ partitioning and dispersive solid-phase extraction for the determination of pesticide residues in produce[J]. Journal of AOCO International, 2003, 86(2): 412-431.
[17] 中华人民共和国国家卫生和计划生育委员会. GB 15193.3—2014食品安全国家标准 急性经口毒性试验[S]. 北京: 中国标准出版社, 2015.
[18] 李建科. 食品毒理学[M]. 北京: 中国计量出版社, 2008: 122-149.
[19] 冯静仪, 张玉华, 凌宝银. 对氯苯氧乙酸盐对小鼠的睾丸效应[J]. 环境与职业医学, 1985, 2(2): 33-35. DOI:10.13213/j.cnki.jeom.1985.02.014.
[20] 黄星培, 吴先福, 王挂华, 等. 植物生长调节剂对氯苯氧乙酸的毒性试验[J]. 中国职业医学, 1987, 14(6): 53.
[21] 徐雪玉. 对氯苯氧乙酸钠的合成[J]. 广西师范大学学报(自然科学版), 1999(2): 554-555. DOI:10.16088/j.issn.1001-6600.1999.s1.055.
[22] AUNE T, AASEN J A, MILES C O, et al. Effect of mouse strain and gender on LD 50of yessotoxin[J]. Toxicon, 2008, 52(4): 535-540.
[23] KALLMAN R F, KOHN H I, KALLMAN R F, et al. The influence of strain on acute X-ray lethality in the mouse. I. LD 50and death rate studies[J]. Radiation Research, 1956, 5(4): 309-317.
[24] 施美莲, 朱冬琴, 顾坚忠, 等. 中国六个群体KM小鼠脏器重量测定[J]. 上海实验动物科学, 2001, 21(3): 143-146. DOI:10.3969/ j.issn.1674-5817.2001.03.005.
[25] HEIKKILA R E. Differential neurotoxicity of 1-methyl-4-phenyl-1,2, 3,6-tetrahydropyridine (MPTP) in Swiss-Webster mice from different sources[J]. European Journal of Pharmacology, 1985, 117(1): 131-133. DOI:10.1016/0014-2999(85)90482-0.
[26] 袁伯俊. 药物毒理学实验方法与技术[M]. 北京: 化学工业出版社, 2007: 209.
[27] JODYNIS-LIEBERT J, NOWICKI M, MURIAS M, et al. Cytotoxicity, acute and subchronic toxicity of ionic liquid, didecyldimethylammonium saccharinate, in rats[J]. Regulatory Toxicology & Pharmacology, 2010, 57(2/3): 266-273. DOI:10.1016/ j.yrtph.2010.03.006.
[28] BONGIOVANNI B, de LORENZI P, FERRI A, et al. Melatonin decreases the oxidative stress produced by 2,4-dichlorophenoxyacetic acid in rat cerebellar granule cells[J]. Neurotoxicity Research, 2007, 11(2): 93-99.
Acute and Accumulative Toxicity and Detection of Residual Sodium 4-Chlorophenoxyacetate in Mice
LIU Hong
1, ZENG Zhijie
2, LI Chuanyong
2, ZHANG Shuihua
3, SUN Lechang
1, CHEN Qiong
2, CAO Minjie
1, LIU Guangming
1,*
(1. College of Food and Biological Engineering, Jimei University, Xiamen 361021, China; 2. Xiamen Agriculture Product Quality and Safety Testing Center, Xiamen 361009, China; 3. Fujian Center for Safety Evaluation of New Drug, Fujian Medical University, Fuzhou 350108, China)
Abstract:Objective: To investigate acute and accumulative toxicity and residual patterns of sodium 4-chlorophenoxyacetate (4-CPANa), a plant growth regulator usually abused in poisonous bean sprouts, in mice. Methods: The oral acute toxicity of 4-CPANa in mice was determined by a modified Korbor method, and oral accumulative toxicity was assayed by an incremental exposure accumulative coefficient method with an initial dose of 107.4 mg/kg. Physiological indices of mice were recorded during the experimental period. Serum biochemical and organ indices and morphological examination of mice were carried out, and the 4-CPANa residues in mouse body were analyzed by ultrahigh-performance liquid chromatography at the end of the experiment. Results: The half-lethal dose (LD 50) of 4-CPANa to mice was 1 074.1 mg/kg and the accumulative coefficient K was larger than 8. Compared with the control group, 4-CPANa showed different influence on physiological and serum biochemical indices in mice. Furthermore, 4-CPANa also resulted in visible lesions and significant histopathological changes in the liver and kidney of mice. The 4-CPANa residue in mice was observed in the following decreasing order: urine > kidney > liver > blood > heart > brain > muscle. Conclusion: 4-CPANa was classified as the 4 thlevel of toxicity and belonged to the low-accumulation family. The toxic effect of 4-CPANa toward mice was mainly exhibited as lesions in liver and kidney.
Key words:sodium 4-chlorophenoxyacetate; acute toxicity; accumulative toxicity; ultra-high-performance liquid chromatography (UPLC); poisonous bean sprout
DOI:10.7506/spkx1002-6630-201603036
中图分类号:S481.1;TS201.6
文献标志码:A
文章编号:1002-6630(2016)03-0197-08
引文格式:
刘红, 曾志杰, 李传勇, 等. 4-氯苯氧乙酸钠对小鼠的毒性及其残留分析[J]. 食品科学, 2016, 37(3): 197-204. DOI:10.7506/spkx1002-6630-201603036. http://www.spkx.net.cn
LIU Hong, ZENG Zhijie, LI Chuanyong, et al. Acute and accumulative toxicity and detection of residual sodium 4-chlorophenoxyacetate in mice[J]. Food Science, 2016, 37(3): 197-204. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201603036. http://www.spkx.net.cn
收稿日期:2015-04-24
基金项目:国家自然科学基金重点项目(U1405214);国家自然科学基金面上项目(31171660);厦门市科技局基金项目(3502z20132010)
作者简介:刘红(1989—),女,硕士研究生,研究方向为食品质量安全检测。E-mail:liuhonghappily@qq.com
*通信作者:刘光明(1972—),男,教授,博士,研究方向为食品加工与安全。E-mail:gmliu@jmu.edu.cn