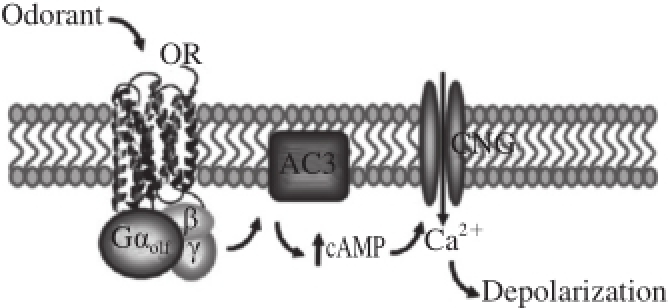
图1 嗅、味觉成分与受体结合引起钙通道的开放、钙内流和极化作用
[77]
Fig.1 GPCR-mediated olfactory signaling cascade is highly specialized in the olfactory epithelium
[7]
庞广昌,陈庆森,胡志和,解军波
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘 要:哺乳动物味觉系统传统分类为五味:鲜、甜、咸、酸、苦。这些味觉让我们能够大概了解食物的组成成分。味觉的传感受体经鉴定属于最大的基因家族——G蛋白偶联受体的主要成员T1R和T2R。有研究表明,还有一种和脂肪传感有关的受体,可以介导游离脂肪酸(free fatty acid,FFA)的味道,也属于G蛋白偶联受体(G protein-coupled receptors,GPCR)家族成员。越来越多的研究显示,味觉受体不仅在味觉器官中表达,也广泛表达于其他组织和器官中。但是大多数研究结果都是通过反转录聚合酶链式反应(reverse transcriptionpolymerase chain reaction,RT-PCR)和微阵列方法得到,尚未对其蛋白表达和生理功能进行系统研究。近年来,一些文章报道了关于胃肠道味觉受体的生理功能。这些研究结果进一步证明嗅觉和味觉受体绝不仅仅局限于味觉和嗅觉传感,可能还有其他潜在的重要功能。本文首先整理和总结了嗅觉和味觉受体在嗅觉和味觉器官以外的组织中的表达情况,而后深入探讨其潜在的多种生理功能,从营养传感、吸收控制及对代谢平衡、能量吸收与控制的影响,到代谢紊乱所引起的疾病。最后,预期这些受体及其检测技术的发展方向和应用前景,特别是在食品性味评价和主要功能性成分,如:白藜芦醇、多酚类、黄酮类和其他植物化合物的功能性评价中的应用。
关键词:G蛋白偶联受体;嗅、味觉受体;配体(基);G蛋白级联放大;生物传感器
G蛋白偶联受体(G protein-coupled receptors,GPCRs)是一种七跨膜蛋白受体,几乎存在于所有细胞中,通过激活胞内G蛋白级联放大系统传递营养信号。该受体基因是细胞中最大的受体基因超家族 [1]。GPCRs作为多种配体或配基的传感系统,可以和光量子、离子、生物胺、脂肪、碳水化合物、肽类和多种化合物相互作用,作用结果通过胞内结构域激活G蛋白级联放大系统,从而介导多种细胞生理活性,包括视觉、听觉、嗅觉和味觉传感作用,是细胞和机体与环境进行物质和信息交流的主要受体。显然,该受体不仅在调节细胞和生物营养物质的传感与吸收控制起作用,而且在神经、免疫、内分泌、代谢控制以及繁殖等几乎所有生理活动中发挥至关重要的作用。由此可见,GPCRs的传感与控制构成了生命活动的关键性调控机制。尽管其结构与功能研究因其与细胞膜的复杂相互作用而存在很多难题,其传递信号的复杂性又使得测定方法上面临很多难以克服的问题,但仍无法掩盖GPCRs作为药物筛选靶点的巨大潜力。事实上,至少40%的药物是通过GPCRs作为靶点筛选出来的。GPCRs最早是在嗅觉上皮作为嗅觉受体得以鉴定 [2]。已知在人类中有900 个嗅、味觉GPCRs成员(包括假基因),在鼠科动物中则高达1 500 个成员,在脊椎动物中该基因家族占总编码基因的3%~5%。人类有390 个编码嗅、味觉受体的基因 [3],这些受体主要属于GPCRs的视紫红质A家族(the rhodopsin family A)。国际上,味觉感受一般分为5 种:甜、鲜、苦、咸和酸,和中国传统的五味:酸、甜、苦、辣、咸略有区别。在中国传统五味中,按照味觉物质属性,甜和咸显然分别代表营养物质(或能量物质,如糖、蛋白和脂肪)和食盐,而酸、苦、辣则代表抗营养物质。国际上主要是描述以GPCRs为受体的营养感受:甜、鲜和咸代表营养,苦和酸代表抗营养。显然,味觉传感代表了生物对环境中营养的探查、追求以及对抗营养的回避。值得注意的是,中国传统饮食文化中讲究的是“五味调和”,这正是在自身嗅、味觉传感的基础上追求营养的平衡与协调 [4]。在过去的几十年里,甜、鲜和苦味的传感机制已经清楚,它是由GPCRs介导的,主要由味觉受体1型(taste receptor type 1,T1R)和味觉受体2型(taste receptor type 2,T2R)组成。T1R家族即谷氨酸盐家族C(glutamate/ family C GPCR group),共有3 个家族,它们形成甜和鲜味受体。而T2R家族则有多达25 个高度分化的GPCRs,主要负责苦味传感。已经有证据表明,在味觉系统也存在专门传感游离脂肪酸的受体,即游离脂肪酸GPCR家族(the free fatty acid GPCR family),该受体主要传递香味感受。近年来不断发现这些嗅、味觉传感受体不仅分布在嗅觉和味觉系统也广泛分布在其他组织、器官和系统例如脑、骨骼肌、胃肠道和呼吸道等。然而这些研究结果主要通过反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)和微阵列技术(microarray technology)得到很少对受体蛋白的表达和功能进行系统研究。作为化学传感受体的GPCRs嗅、味觉受体,可能在多种组织中发挥更多重要的生理功能,这引起了科学家们的密切关注 [5]。对这些受体的研究不仅在食品、营养和调味品方面的应用,也在其他领域如药物筛选靶点和食品的功能性评价等 [6]。
嗅、味觉传感受体家族的信号级联放大和传递途径已经有较为详尽的研究,如图1所示 [7]。嗅、味觉受体信号途径所涉及的G蛋白级联放大系统被命名为Gα olf(GNAL),该信号系统主要通过激活嗅、味觉同型腺苷环化酶(olfactory isoform of adenylyl cyclase,AC),即AC3(即ADCY3)由ATP环化生成第二信使cAMP [8]。细胞cAMP的升高激活阳离子选择性环核苷酸门控通道(cation selective cyclic nucleotide-gated channels,CNG)导致钙离子渗透性增强 [9],使细胞膜去极化,并积累后产生嗅、味觉神经元动作电位。基因敲除小鼠实验证实,缺少Gα olf [10]、AC3 [11]和CNG [12]的小鼠表现出嗅、味觉缺失。有证据表明,一种钾离子依赖性Na +/Ca 2+交换因子(a potassium-dependent Na +/Ca 2+exchanger,NCKX4)可能用来决定嗅、味觉的响应模式 [13],但是激活Ca 2+或Cl −通道的详细机制尚存在争议 [14]。

图1 嗅、味觉成分与受体结合引起钙通道的开放、钙内流和极化作用
[77]
Fig.1 GPCR-mediated olfactory signaling cascade is highly specialized in the olfactory epithelium
[7]
嗅、味觉传感是在决定是否进食和消化吸收之前,为我们提供了评价食品来源和营养成分的有力工具。苦味和酸味往往意味着抗营养或食物腐烂变质,甚至存在有毒成分;咸味主要传感食盐的存在;而甜味和鲜味意味着富含能量物质,激活机体的欲望,驱使进食 [15]。脂肪和游离脂肪酸的传感则主要表现为诱人的香味,而由于对脂肪和游离脂肪酸的感受在香味和油腻之间交叉转变而一直充满争议,直到近年来才得到了较为详细的研究 [16]。有趣的是,中国的传统饮食和烹饪中的五味调和理论不仅没将鲜味列在其内,也把香味排斥在五味之外。虽然味觉系统 非常复杂,但是人类似乎很难在味觉系统的区分和描述上取得完全统一的认识、描述和量化指标。虽然如此,人们似乎凭借这5 种基本味道就能够实现对食品营养成分的控制与取舍 [17]。
经典的T1R和T2R信号传导级联放大系统可以放大分子信号,当分子和受体结合时,激活受体的胞内结构域,βγ亚基激活PLCβ2,从而促使Ca 2+从瞬时受体电位离子通道蛋白5(transient receptor potential cation channel,subfamily M,member 5,TRPM5)离子通道流入。推测味导素(gustducin,Gαt3)就是配合T2Rs这一作用,部分证据已表明T1Rs的作用与此相似。也有证据表明α-亚基在甜味、鲜味(包括:Gαs、Gαi2、Gαt和Gα14)的味觉传感中发挥重要作用。这些推测也得到了敲除PLCβ2或TRPM5实验的证明:敲除这2 个基因的小鼠传感甜、苦和鲜味受阻,而传感咸和酸味作用不受影响,如图2所示 [17]。

图2 不同味觉物质通过激活不同的G蛋白信号放大系统传递细胞信号,产生不同的味道神经传感
[17][17]
Fig.2 Canonical T1R and T2R signal transduction cascades share common signaling molecules
[17]
嗅觉和味觉受体的概念会将这些受体局限在机体的味觉和嗅觉系统。也正是这些受体在系统中传感嗅、味觉信号,并将信号转为神经兴奋,传入大脑,才使机体产生味觉感受。事实上,我们也的确不能通过其他器官来感受相应的嗅觉或味觉。但是,近年来发现这些味觉或嗅觉受体在其他器官中也有表达。最初这些表达被冠以“异位表达”(ectopic expression),或嗅、味觉样受体(olfactory-like receptors)的名称。但后来发现,这些所谓的异位表达是一种普遍现象,且已超过“异常表达”的本意,故需要重新解释 [18]。嗅、味觉GPCRs在多种细胞和组织上表达,表明其功能不止是传感嗅、味觉,而是还有其他功能 [19],但是这些部位上,信号并非通过激活神经元传递到大脑,所以还未可知它们的作用。
利用转录分析技术在鼠科动物和人类组织,包括精子 [20]、心脏 [21]、脾脏 [22]、红细胞 [23]和胎盘 [24]中都检测出嗅、味觉受体基因的转录。而且在心脏和胰腺中 [25-26]也发现存在Gα olf。已有证据表明Gα olf在多巴胺D1受体和腺苷A2a受体信号传递中发挥关键作用 [27]。AC3也并非仅在味觉神经信号传递中发挥作用,它也在中枢神经系统、心血管系统、呼吸系统和视神经系统中表达 [28-30]。同样,T1R和T2R GPCRs也已经在很多组织中被发现 [31-32]。由于上述研究结果主要是基于转录检测的方法,对这些受体的实际合成与分拣作用尚需研究和证实。然而这些受体在气管和胃肠道黏膜系统的表达与功能特性已得到了证实。已有至少32 个嗅、味觉基因在嗅、味觉上皮以外的组织上表达。例如,在肺和心脏中各有10 个基因表达 [19]。可见这些基因除传递嗅、味觉信号外,还应具有其他功能 [33]。Feldmesser等 [18]为此提出假说:该现象可能是嗅、味觉神经传导系统的痕迹性转录和表达,因此不可能在组织或器官发挥功能。但是,这个假说遭到了来自进化生物学研究证据的挑战,特异性的嗅、味觉基因的表达并没有所谓“痕迹”的转录和表达 [34]。同时,传导素也被证明在其他器官,如胃中表达 [35-36]。报告基因技术为嗅、味觉受体在其他组织或器官中的表达调查提供了有效手段。实验结果有力证明了嗅觉和味觉受体的确存在于人类几乎所有的组织或细胞中。因此,这些受体可能正是内分泌系统调节与控制的介导者 [37]。嗅觉信号可以调节激素分泌,而激素,如肾上腺素 [38]则可以通过循环系统调节机体的能量内平衡(energy homeostasis),包括食欲肽(orexigenic peptides)、神经肽( neuropeptide)Y等 [39-40]。这意味着嗅、味觉上皮在传递信号到神经系统的同时,也传递代谢内分泌信号 [41]。越来越多的证据表明嗅、味觉传感作用可能还具有调节多种激素,包括大麻素类(cannabinoids) [42]、腺苷类 [43-44]和血管紧张素转换酶Ⅱ类 [45]的功能。
大量研究表明,嗅、味觉受体GPCRs出问题会导致疾病。例如,一系列的味觉受体在肌发生和再生中发挥重要作用 [46],而嗅觉受体可能在精子发生中发挥作用 [47]。大鼠在饥饿状态 [48]、缺少必要的肠道微生物菌群 [49]或脑缺血 [50]等状态下,T1R3转录和蛋白水平就会升高。还有研究证明,T2R的激活作用可以促进肠促胰酶肽(cholecystokinin,CCK)和胰高血糖素样肽(glucagon-like peptide-1,GLP-1)的分泌。Tas2基因表达则受饮食中的甾醇类化合物的控制 [51],而且饥饿状态可以上调鼠科动物心脏的Tas2基因的表达,证明营养成分传感可以作用于心脏的基因表达 [52]。
3.1 胃肠系统
一些嗅、味觉化合物对调节机体内平衡发挥了重要作用,它们能被各种器官或组织感受或“检测”到,以便对机体的代谢、内分泌和免疫系统进行相应的调节与控制,特别是肾脏、胰脏、消化道和脑部。我们可以直观地推测:在肠道中味觉传感系统应该可以通过味觉GPCRs对肠腔中的营养进行定量探测,并在此基础上通过释放激素、细胞因子和趋化因子控制机体代谢和免疫功能 [53-55]。大量研究证明,甜味、鲜味和苦味GPCRs遍及整个消化道,Meyerhof等 [56]专门对此进行了综述。T1Rs可以调控GLP-1肠内分泌细胞(enteroendocrine cells)的分泌、降糖素(incretin)的分泌、以及葡萄糖钠依赖性吸收与转运所形成的体内平衡 [57-58]。据报道,作为鲜味物质的L-谷氨酸可以通过鲜味受体发挥黏膜防御功能 [59],这个防御过程是通过L-谷氨酸和葡萄糖激活T1Rs,然后激活肠黏膜系统的葡萄糖载体(glucose transporter,GLUT2)和寡肽载体(oligopeptide transporter,PepT1)。这些发现证明味觉受体之间可能调节运载体运输网络从而控制体内能量和代谢平衡 [60]。甜味和鲜味受体也存在于下丘脑的事实说明,食欲控制的器官也是通过受体发挥作用 [61]。已经有人提出,T1Rs可能作为Ⅱ型糖尿病和某些代谢性疾病的治疗药物靶点 [62]。但是由于它的广泛表达增加了体内信号传递和信号与胃肠道的复杂关系,因此在作为靶点时必须重点考虑。T2Rs具有调节胃肠道激素分泌的功能,这使得目前大多数利用体外细胞进行的研究结果说服力大打折扣。多数情况下,缺少T2R依赖性生物学作用的直接证据,例如,在人类和小鼠中,苦味会增加肠内分泌细胞Ca 2+的内流,这将导致肠道激素的分泌,包括:CCK和GLP-1 [51,63-64]。而且,推测T2R配体(基)还可以引发前列腺素调节性阴离子在大肠中的分泌,调节胃的排空 [65-66]。存在于肠腔中的食品衍生味觉成分与嗅、味觉受体作用,也会刺激人类肠嗜铬细胞释放5-羟色胺 [67]。上述这些研究表明,嗅、味觉受体作为靶标,可能在胃肠道中和在肥胖、糖尿病和吸收不良综合症治疗及药物筛选中起到重要作用。
3.2 呼吸系统
T2Rs已经被揭示出在呼吸系统中的一系列不同细胞类型中发挥不同的作用。作为鼻腔上皮嗅觉系统的化学传感细胞受体,T2Rs被各种刺激物激活,如苦味物质和外源异物可以激活三叉神经纤维,并产生气管保护性反应 [68-69];气管中的TAS2受体表达细胞也可以对苦味物质,如环己酰亚胺(cycloheximide)做出响应,导致呼吸频率的减少 [70]。
人类呼吸道上皮细胞也能对苦味物质做出响应,例如增加纤毛的运动频率,有助于清除有害物质的吸入和病原体的入侵 [71]。对Tas2R38基因的研究结果表明,该基因可以增强呼吸道对细菌感染的敏感性。在此过程中,受体T2R38首先被细菌分泌的敏感成分激活,然后产生氧化一氮从而介导内源性防御应答 [72]。此外,T2Rs在人类和老鼠呼吸道平滑肌中被检测到,预示着该受体可以作为哮喘病治疗的靶点 [73]。
苦味物质可以促进钙的细胞内流,却使鼠科动物平滑肌松弛,减弱哮喘模型鼠的症状,这表明T2R在非味觉组织也能发挥生理功能 [73]。高浓度的苦味配基往往可以引起支气管扩张,也说明了味觉受体药物应用前景。并且推测呼吸道的肌肉松弛的原因,可能是通过细胞内钙流激活通道 (Ca 2+-activated K +BKCa)引起的。但近期此观点受到了质疑,认为该过程可能是苦味依赖性G βγ电压依赖性Ca 2+通道的作用 [74]引起的。T2Rs可能成为哮喘和慢性阻塞性肺病治疗性药物筛选的重要靶点,但其作用机制仍有待于深入研究。
3.3 骨骼肌和心肌
微阵列方法揭示出肌发生、再生、损伤修复过程,与特异性味觉受体的存在和传感密切相关 [46]。在该研究中,研究人员用一种合成的水溶性配基——新铃兰醛(lyral)发现特异性味觉受体可以作为精子Olfr16受体选择性趋化作用的激动剂。对该受体是否可以作为药物靶点的研究结果表明,的确具有很大的潜力。最近又有研究证明在鼠科和人类心脏中也存在味觉受体 [52]。他们通过微阵列方法鉴定了血管紧张素转化酶Ⅱ诱导的心肌肥大模型动物的味觉受体表达情况,证明了味觉受体亚类的确在鼠科动物心脏中表达,并受营养状态的调控 [52]。
3.4 肾脏
嗅、味觉受体也在肾脏中分布,并可能对肾脏功能发挥调节作用 [75]。至少有6 个嗅、味觉受体,如Gα olf和AC3,在整个肾脏中都有分布。通过免疫细胞化学定位法已经测定到Gα olf和AC3分布于远侧肾单位——致密斑细胞(macula densa),而且AC3 −/−缺陷型小鼠表现出肾素分泌和肾小球过滤缺陷。敲除Olfr78和Gpr41基因,小鼠表现出对肠道微生物产生的短链脂肪酸的应答失调,以致肾素和血压的失调 [76]。
3.5 生殖系统
不少研究证明,人类和小鼠嗅、味觉受体在生殖系统,如睾丸和精子中表达 [77]。这些受体与不同的信号传递途径相配合,产生特异性的鞭毛运动模式和精子的趋化特性。家蚕的性诱素(蚕蛾醇)正是通过雌性个体分泌蚕蛾醇并散发到空气中,当雄蚕蛾触角上的性信息素受体接受到蚕蛾醇时,就可以做出响应,沿着蚕蛾醇的浓度梯度找到雌蚕蛾。这些性诱素的受体也正是和嗅、味觉受体的作用相似,但更加特异而灵敏,最大接收信息距离可以达到10 km [78]。人类精子表现出对叔丁基苯丙醛配基较高的激活作用,这与趋药实验结果一致 [79]。另外一项研究结果表明,对前列腺癌细胞增殖的抑制作用与特异性的味觉受体——OR51E2明显相关 [80]。这些表达在精子上的嗅、味觉受体可能通过调节Ca 2+和cAMP的水平在精子发生和趋化中发挥作用 [81]。
3.6 嗅、味觉GPCRs的功能扩展
游离脂肪酸受体FFA4(GPR120)是另一种具有重要生理功能的GPCR,它的主要功能是传感脂肪酸或脂肪的味道。在对ω-3脂肪酸刺激作出响应时,FFA4还可以减少巨噬细胞介导的炎症,介导体内抗糖尿病作用 [82]。FFA4在肥胖个体脂肪组织中表达量明显增高,在脂肪膳食传感和控制鼠和人类能量平衡中发挥重要作用 [83]。T1R1、T1R3可以直接传感氨基酸,同时也在调节哺乳动物雷帕霉素靶蛋白1(mammalian target of rapamycin complex 1,mTORC1)自吞噬途径中发挥重要作用 [48]。OR2A4和TRs(T1R2和T2R13)对细胞分裂周期的控制最近也有报道 [84],这是对其命名为嗅、味觉受体的又一个挑战。与苦味传感相关,并广泛表达的T2Rs可能还具有介导苦味药物的脱靶效应 [85]。越来越多的证据迫使我们改变原来的看法,所谓嗅、味觉受体GPCRs还具有其他广泛的生理和病理作用,它们不能传递感知信号的原因,主要是它们释放的是激素和免疫内分泌信号,而不是通过神经元传导神经兴奋。
4.1 配体(基)的鉴定及其与GPCRs分离与纯化的不对称性
一系列受体和配体(基)被用来阐明嗅、味觉受体除嗅、味觉以外的功能。大量不同的嗅、味觉GPCRs家族在分离、纯化、检测和鉴定方法上遇到不少实际困难和难以克服问题。在药物筛选方面,第一个难题就是潜在的配体(基)的靶标受体Ors或T2Rs的分离与鉴定 [86]。在这两个受体家族中,每一个受体成员都可以结合多种配体(基),而且一种配体(基)又可以结合多种受体,甚至作用于不同的细胞内G蛋白信号级联放大系统。在配体(基)的选择性方面,Ors和T2Rs往往表现出在某一情况下被单一化合物激活,而在其他场合却表现为与相当广泛的配体(基)相互作用。这些嗅、味觉受体往往只被作为味觉化合物的受体 [87],因此很少对这些受体的其他功能进行研究。这些味觉化合物往往还有其他作用靶点,如离子通道、运载体等,这将会影响或混淆对实验材料的选择和对结果的判断,从而进一步增加了研究的复杂性。例如,在人类精神物理学检测(psychophysical tests)中,氯奎宁(chloroquine)和环己酰亚胺都是苦味化合物。氯奎宁是已知溶酶体抑制剂,被用来抗疟疾,并具有抗炎症,抑制免疫等作用,而环己亚胺则通常被用作蛋白质合成抑制剂。与此相似,已知最苦的物质——苯酸苄铵酰胺(denatonium benzoate),具有激活ATP-敏感性钾通道(ATP-sensitive potassium channel) [88]活性的作用。另一个的问题是当考量苦味物质与推定T2R依赖性功能作用时,往往使用高浓度的配体(基),这样的浓度常常和脂肪受体产生与T1Rs的交叉作用。这是因为一般T2Rs都具有较低的EC 50值 [87],有些甚至有细胞毒性,因此浓度太高的T2Rs有可能增加非特异性作用。故在推测T2R与配体(基)互作产生生理作用时,这些配体(基)在浓度和交叉作用方面的问题也需要给予重视。到目前为止,我们还对嗅、味觉GPCRs在嗅觉和味觉器官以外的组织中的配体(基)的物质结构和来源缺少了解。从直觉判断,肠道表达的嗅、味觉GPCRs可能受饮食中化合物的作用 [65]。同样道理推测T2Rs在呼吸道中的作用主要是用来排除呼吸空气中的刺激性,甚至毒性物质 [72]。
另一个值得注意的问题是,在分离和鉴定嗅、味觉受体及其配体(基)之间存在着明显的不对称性。经验得出几乎所有自然界的有机化合物或金属离子都有嗅、味觉作用,说明不仅嗅、味觉受体具有很大的多样性 [89],其配体(基)则具有更加巨大的多样性,所以很多文献称GPCRs为化学传感受体。GPCRs作为七跨膜受体蛋白超家族具有上千个成员,和细胞内的G蛋白级联放大系统相偶联,放大其与配体(基)的识别作用。虽然GPCRs的研究一直受到科学家的广泛关注,但是对其结构和功能的研究却遇到很多难以克服的问题,例如分离和纯化就需要解决它与膜之间相互作用、结构和功能之间的复杂关系。另外,由于它是通过细胞内G蛋白不同途径放大和传递信号,进一步增加了问题的复杂性。根据目前的研究可知,在体内细胞间正是通过GPCRs和配体(基)之间的信号传递形成细胞通讯网络、神经网络、代谢和内分泌网络。虽然通过分子生物学方法,以及GPCRs序列可以检测到该超家族的多样性和进化特性,但是其分离、纯化、结构与功能的关系研究却受到了很多限制,例如纯化的GPCR是否还具有和锚定在细胞膜上相同的功能?胞外结构域和胞内结构域的关系是否随分离纯化而改变?GPCRs之间及其与辅助刺激分子之间是否有互作?GPCRs在和G蛋白级联放大系统偶联时的选择性问题、和其他信号途径之间的“串音”(cross talking)等众多问题都有待克服。而在配体,特别是配基的分离、纯化、化学合成以及结构分析等方面,却由于物理化学,有机化学合成与分析技术的发展取得了巨大成就。因此在研究配体,特别是配基与受体的作用规律时,应着重对已知配基对载有GPCRs的细胞或组织上的研究。
4.2 内源性嗅觉和味觉受体激动剂
已知的嗅、味觉受体的配体(基)基本上都是合成或异源化合物。所研究的受体广泛表达在几乎整个机体中,所以有假说认为可能还存在着这些GPCRs内源性激活性配体(基),像这样推定的内源性激动剂可能为我们提供嗅觉或味觉受体全身性分布的功能的合理解释。根据这一思路,Kimoto [90]和Haga [91]等相继证明了外分泌腺通过释放生物活性肽作用于信息素受体,产生性特异性生殖诱导作用。研究证明,从组织中筛选到的味觉配体,一种脂肪酸代谢中间体可以作为味觉受体的生理性配体 [92]。实验证明,这些嗅、味觉受体的确可以被内源性中间代谢物激活 [93]。从这一观点出发,中间代谢产物配基可能和多种受体系统相互作用,调节机体的代谢、免疫和内分泌平衡,因而具有治疗各种代谢性疾病的潜力 [94]。
值得注意的是,T1Rs属于谷氨酸盐/家族C,是被研究较多的GPCRs家族成员,这一组GPCRs包括非常广泛的由营养——氨基酸、蛋白降解肽、离子、糖类和游离脂肪酸 [53]受体。该受体异源表达后经体内实验研究证明,T1R2、T1R3作为甜味物质的传感受体,传感相应的甜味物质包括糖、人工甜味剂、D-氨基酸、甘氨酸和甜蛋白 [56]。重要的是,研究所得出的结果在不同哺乳动物之间差别很大,特别是人工甜味剂和甜蛋白并不能引起啮齿类动物甜味受体的响应。与这些结果相似,已知T1R1、T1R3是鲜味受体,可以优先结合谷氨酸盐,而啮齿类动物该受体则可以对多数L-氨基酸做出响应 [32]。它们的这种广泛的配体(基)响应和多种组织的表达反映了作为药物靶点的GPCRs,在治疗糖尿病、代谢紊乱等方面应该有所作为 [48]。
4.3 嗅、味觉受体拮抗剂
已经有多种嗅、味觉GPCR-修饰化合物(配基)可以对嗅、味觉以外的器官表现出功能作用。特别是关于T1Rs的拮抗剂,一系列的变构调节小分子化合物,如怡甜降甜剂(lactisole) [95]已经广泛应用于对甜味机制的研究。在美国,怡甜降甜剂已经可以作为食品添加剂以及代谢性疾病治疗的候选药物进行研究。在食品和饮料行业开发新的别构调节剂也已经开始发展 [96],结合嗅、味觉受体的深入研究一定能够揭示出更多有关这些嗅、味觉GPCRs全身性分布的秘密。另外,苦味受体及其作用机制的研究结果也表明,它们的功能可能远远超出其本来含义 [97]。同样,作为嗅觉受体,包含了GPCRs家族A——最大的视紫红质子集,虽然在作为治疗性药物靶标方面进展不佳,但是由于这些嗅觉受体往往和信息素密切相关,在虫害和鼠害防治,激素控制和信号传递等方面已经展示出广阔的发展空间 [98]。
苦、辣、酸、甜、咸“五味”是中国人对味觉的总结和认识。虽然中国人早就清楚“味觉”远非只有这“五味”,而是“百味”或更多。但是从“属性”和功能相生相克的关系来说,则主要归纳为五味。例如,中国的五味里不包括鲜味,并不是因为不知道有鲜味物质存在,而是中国人至少在三千年以前已经意识到味觉和健康、疾病之间的“表里”联系和相生相克关系,所以从其属性和表里关系上归纳为“五味”。以“性味”为主要内容的中医药、食品性味理论,是中医药和食品属性理论的核心,也是中医临床用药及饮食的依据。匡海学等 [99-100]通过一系列研究表明,中药同时具有性与味两种作用,且中药性味组分、性味拆分组分或化合物亦有其性味属性,即两种属性都具有可拆分性和可组合性。五味主要与功效相关,属性则主要影响机体能量和物质代谢。在食品、饮食和烹饪方面,中国人主张食材也具有四气、五味、归经、升降、浮沉等食性 [101]。人类通过平衡膳食就可以“不治已病治未病”,其可操作性理论基础就是五味调和。由于人的生活和饮食习惯以及所处的环境各不相同,所以主张针对每一个人的不同情况,依据各种食材的性味制定不同的饮食方案 [102]。显然,中国人早就注意到嗅、味觉,特别是五味与机体五脏六腑、神经、免疫和内分泌、代谢内平衡互成“表里”的关系,并通过“五味”的传感与机体内部五脏六腑的功能相联系,从而根据“五味”之“表”判断脏腑及功能之“里”。中医药正是通过治“标(表)”达到治“本”的目的。为了能够更清晰地说明嗅、味觉传感与机体生理需要和功能的关系,根据目前的研究结果并结合本实验室的研究结果,我们提出嗅、味觉受体及其全身分布的“窗口”假说,如图3、4所示。

图3 “五味”和“脏腑”之间的“表里”关系
Fig.3 Internal and external relationships among five flavors (sweet, sour, bitter, pungent, and salty) and internal organs (Zang-Fu viscera)
中国人一直认为“五味”调和才是健康之本,原因是“五味”和五脏六腑互成“表里”关系,甜和咸分别作为糖、脂和氨基酸以及钠离子等营养成分,苦、辣和酸则作为“抗营养”成分,在体内形成脏腑之间的相生相克关系。五脏六腑的健康和问题通过味觉表现出来。“味觉”既可以作为机体内部营养需求及平衡的“窗口”,又可以通过味觉变化控制食欲。医生也可以通过味觉变化来判断机体营养需求和平衡情况,维护机体健康,减少由于饮食不平衡所导致的疾病。

图4 “嗅、味觉”物质及其受体之间所形成的通讯网络
Fig.4 Communication network formed by odorant/taste receptors and their ligands
如图4所示的假说认为:在嗅、味觉物质及其受体之间形成化学通讯系统,通常所说的嗅、味觉实际上是嗅、味觉受体在接受相应配体(基)刺激以后释放神经递质,通过神经纤维与中枢神经(脑)系统之间形成有线通讯网络,发挥摄食、食欲和性引诱等快速反应机制;而分布在消化道、呼吸道中的嗅、味觉受体则是用来接受相应配体(基)刺激,通过分泌激素、细胞因子和趋化因子等信号分子,经循环系统在机体内细胞间形成无线通讯网络。细胞间无线通讯网络控制机体的免疫、代谢平衡和内分泌 [103]。正是由于动物的生理和营养需求,才需要进化出营养和生理传感系统,用以取食、进食和食欲控制。同样,也正是由于机体内复杂的生理、免疫、代谢和能量需求,才在消化道系统表达这些营养传感受体,从而实现营养的吸收与控制。嗅、味觉受体传感系统的实质是控制机体营养摄取、生理需求,是一个“窗口”机构,就像公司的人事部,它控制整个公司的人力需求,而不是“人事部”本身。已经有研究证明,至少在GPCRs及其配体(基)之间具有一种配体和多种受体作用,而多种受体又可以和同一种配体作用,如趋化因子及其受体 [104],这恰恰符合网络通讯的基本要素。相信随着细胞及其分子生物学研究的不断深入,嗅、味觉受体的作用规律和分子机制将得到深入研究。
由于这些嗅、味觉受体的高质量的抗体非常有限,再加上遗传的多样性,有关其分布的研究大多数都依赖于RT-PCR技术,而且大多集中在比较容易取样的部位,如气管、消化道等。
6.1 微阵列技术
微阵列技术可以高通量检测GPCRs的转录情况 [18,34,105]。但是,高通量测定的结果只能反映出某种GPCRs基因的转录情况,由于翻译、运输、分拣和定位要经历一个非常复杂的过程,所以对这些数据应该持审慎态度。而且,微阵列技术很难实现真正意义上的定量化测定 [19]。但测定结果的确可以证明嗅觉受体基因主要在嗅觉上皮组织中转录,这和实际情况吻合。微阵列方法检测结果表明,人类有32 个嗅觉基因的转录并不局限在嗅觉组织,在其他组织器官如肺和心脏也有分布 [71]。因为目前对GPCRs的分类主要是根据基因序列,所以有些嗅觉受体并不在嗅觉组织中表达 [33]。味觉GPCRs基因的丰度常常很低,处于微阵列测定的下限,容易漏检,因此需要更多的探针 [106]。因为微阵列方法所检测的是转录情况,要确认味觉受体是否发挥味觉以外的功能则需要其他方法的印证。
6.2 检测嗅、味觉受体的新方法
关于嗅、味觉GPCRs新功能的多数证据来自体内、外方法的结合测定。除上述微阵列方法外,转基因或基因缺陷型小鼠模型也是常用的方法。前沿技术的应用,如在RT-qPCR阵列基础上的高通量定量表达和新一代测序技术等,将有助于探察嗅、味觉受体在非嗅、味觉组织中的表达情况 [107]。例如最近公布的对人类心、肾、肝、肺和白细胞等16 种组织器官进行的嗅、味觉受体基因转录和表达组学研究结果证明:嗅、味觉受体几乎存在于所有人类器官或组织。显然,新技术的发展和应用将会进一步揭开这些嗅、味觉受体的分布之谜。
尽管对嗅、味觉受体的研究已有很多,但是有关辣味、麻味的研究仍然很少,其主要原因是有些科学家认为麻、辣味不属于味觉,而是痛觉。直到其受体TRPV1 [108]被发现之后,才逐渐引起科学家的关注。本实验室通过固定化小鼠味蕾组织研制出姜辣素和辣椒碱的生物传感器,不仅实现了对这两种物质的定量、高灵敏的测定,且获得了这两种物质与相应受体的结合解离常数 [109]。实验室通过相似方法也实现了对甜味、苦味物质与相应受体间的结合解离常数的测定(尚未发表的材料)。为了能够直接测定GPCR和配基之间的相互作用,本课题组还引入纳米金、辣根过氧化物酶放大系统 [110],利用体外表达的代谢性鲜味受体GPR70(T1R1)的固定化所制成生物传感器,检测了谷氨酸钠盐与受体的互作动力学及其结合解离常数(尚未发表的材料),成功实现了GPCR与配体(基)间弱相互作用的动力学分析 [111]。利用该技术不仅可以实现对多种味觉物质的定量化测定,还可以实现受体和配体(基)之间相互作用和胞内结构域激活信号的传递,改变细胞周围的电化学性质和对动力学参数的测定。与此同时,本验室还通过对几种常见动物味蕾细胞、肠道细胞的固定化,成功实现了对食品功能成分——白藜芦醇的定量化测定,实现了受体和配体(基)互作所产生的胞内信号放大和动力学特性的研究(尚未发表的结果)。实验证明这些方法对破解嗅、味觉受体全身性分布之谜开辟了新的途径。
如上所述,嗅、味觉受体构成了整个机体的生理生化、免疫内分泌、对基本营养的需求、食品安全等长时间形成的评价体系。因此,受体与配体(基)之间的识别和互作研究可能为食品在体内、外功能地方评价提供重要方法和平台。由于以往对味觉或嗅觉的测定基本是基于对物质本身浓度测定,与受、配体识别、细胞信号传递或动物神经信号传导无关,因此无法用于药品和食品的功能评价但是,当味觉受体与配体(基)相互作用,从而激活细胞内信号放大系统,造成细胞的极化、Ca 2+通道的开启或神经递质的释放,我们就可以用传感电极取代神经元将这些电信号的变化传递到信号放大器和电脑,通过这一检测系统,我们可以实现受体和配体(基)互作所产生的细胞信号功能的定量化测定,原理如图5所示。预期这种测定方法能够成为对功能成分评价的有力工具。不仅如此,相信这些方法在药物筛选、药效评价等方面也可以发挥重要作用。

图5 固定化味蕾组织生物传感器设计原理
[109]
Fig.5 Principle and scheme of the immobilized taste-bud tissue biosensor
[109]
本实验室的研究结果显示,动物对味觉的感受明显不同于人类,因此将某一动物的实验结果外推到其他动物是不合适的,更不能用人类的味觉经验外推到其他动物。用固定化不同味蕾组织对雌二醇的测定结果表明,猪、牛和鲶鱼等动物均对雌二醇具有极宽的线性范围(1×10 -2~1×10 -14mg/mL),然而对味觉物质仅表现为1~2 个数量级的线性范围。该结果可以解释雄家蚕在10 km的范围内可以感受到雌家蚕所释放的蚕蛾醇的原因。味觉物质大多是与营养相关的物质,其非线性正好适应了对食欲的控制,就像人类对脂肪的传感,少量表现为香味,而超过了限量就会变为油腻一样。本实验团队还通过固定化大鼠小肠不同部位的组织所制备的生物传感器,检测了白藜芦醇与受体的作用规律,结果表明(尚未发表的材料),白藜芦醇在小肠不同的部位作用受体所产生的信号放大动力学特性是不一样的,这说明细胞表面受体的分布也是不一样的。可见白藜芦醇的功能主要是在小肠内与受体相互作用激活不同的信号通路,向机体内部传递不同的信号,从而发挥不同的生物功能。
综上所述,嗅、味觉受体在机体内部的组织、器官和细胞都有分布,且和机体的五脏六腑互成“表-里”关系,所以它不仅是构成五味调和的基础,同时也能反映机体的健康状况,是评定食品或药物功能性成分的基础。
多数嗅、味觉受体是属于GPCRs超家族成员。GPCRs是细胞营养物质传感、细胞趋化、代谢、免疫和内分泌系统的主要受体家族,动物机体对视觉、听觉、嗅觉、味觉的感知都依赖于GPCRs的信号传递作用。越来越多的研究结果表明,嗅、味觉受体不仅分布于嗅、味觉组织和器官,而是遍布于整个机体。对原因的研究已经受到越来越多的科学家的关注。弄清楚嗅、味觉GPCRs全身分布的原因不仅要深入研究这些受体的功能和机制,更可以探究这些受体成为更多化学药物筛选的重要靶标。在目前的临床药物中,40%以上都是通过GPCRs作为靶标筛选出来的,所以有人推断嗅、味觉GPCRs作为药物筛选靶标的潜力极其巨大,特别是针对高血压、高血脂、糖尿病、肥胖等现代代谢综合征的药物筛选。本文根据中国传统食品和中医药理论和经验,结合目前对嗅、味觉受体分布、功能的研究结果、技术发展和面临的问题,提出了嗅、味觉全身分布的“窗口”假说,认为嗅、味觉受体系统正是构成整个机体对营养需求、代谢内平衡、免疫防御、神经内分泌等生理状态的显示窗口(中医作为诊病的依据之一),同时也构成了机体觅食、取食、安全检测、营养吸收、免疫防御、代谢内分泌系统的检测窗口和平台。因此,应加强对嗅、味觉受体与配体(基)之间识别和互作规律的研究,攻克研究方法上的难题和瓶颈,深入探讨不同GPCRs的信号传递和放大机制,系统研究由这些GPCRs及其配体(基)所形成的互作网络,其中包括携带这些受体的细胞通过释放神经递质和中枢神经系统之间所形成的有线通讯网络,和这些细胞通过释放激素、细胞因子和趋化因子在细胞、组织和器官间所形成的无线通讯网络(包括代谢和内分泌网络)。这些研究不仅可以为我们揭开嗅、味觉GPCRs全身分布的秘密,而且在中医药“性味”归经和中医药现代化,食品或药物的功能评价、食品营养与安全、食品添加剂等方面均具有重大的理论意义和应用前景。
参考文献:
[1] LAGERSTRÖM M C, SCHIOTH H B. Structural diversity of G protein-coupled receptors and significance for drug discovery[J]. Nature Reviews Drug Discovery, 2008, 7(4): 339-357. DOI:10.1038/ nrd2518.
[2] BUCK L, AXEL R. A novel multigene family may encode odorant receptors: a molecular basis for odor recognition[J]. Cell, 1991, 65(1): 175-187. DOI:10.1016/0092-8674(91)90418-X.
[3] OLENDER T, LANCET D, NEBERT D W. Update on the olfactory receptor (OR) gene superfamily[J]. Hum Genomics, 2008, 3(1): 87-97.
[4] 庞广昌, 陈庆森, 胡志和, 等. 五味调与营养平衡及其信号传导[J].食品科学, 2012, 33(13): 1-20.
[5] SIMON R F, EUGENI R, WALTER G T. Extrasensory perception: odorant and taste receptors beyond the nose and mouth[J]. Pharmacology & Therapeutics, 2014, 142(1):41-61. DOI:10.1016/ j.pharmthera.2013.11.004.
[6] HUANG E S. Predicting ligands for orphan GPCRs[J]. Drug Discovery Today, 2005, 10(1): 69-73. DOI:10.1016/S1359-6446(04)03349-5.
[7] JONES D T, REED R R. Golf: an olfactory neuron specifi c-G protein involved in odorant signal transduction[J]. Science, 1989, 244: 790-795.
[8] SKLAR P B, ANHOLT R R H, SNYDER S H. The odorant-sensitive adenylate cyclase of olfactory receptor cells. Differential stimulation by distinct classes of odorants[J]. Journal of Biological Chemistry, 1987, 510: 15538-15543. DOI:10.1111/j.1749-6632.1987.tb43646.x.
[9] DHALLAN R S, YAU K W, SCHRADER K A, et al. Primary structure and functional expression of a cyclic nucleotide-activated channel from olfactory neurons[J]. Nature, 1990, 347: 184-187.
[10] BELLUSCIO L, GOLD G H, NEMES A, et al. Mice deficient in G(olf) are anosmic[J]. Neuron, 1998, 20(1): 69-81.
[11] WONG S T, TRINH K, HACKER B, et al. Disruption of the type III adenylyl cyclase gene leads to peripheral and behavioral anosmia in transgenic mice[J]. Neuron, 2000, 27(3): 487-497. DOI:10.1016/ S0896-6273(00)00060-X.
[12] BRUNET L J, GOLD G H, NGAI J. General anosmia caused by a targeted disruption of the mouse olfactory cyclic nucleotide-gated cation channel[J]. Neuron, 1996, 17(4): 681-693. DOI:10.1016/S0896-6273(00)80200-7.
[13] STEPHAN A B, TOBOCHNIK S, DIBATTISTA M, et al. The Na +/Ca 2+exchanger NCKX4 governs termination and adaptation of the mammalian olfactory response[J]. Nature Neuroscience, 2011, 15(1): 131-137. DOI:10.1038/nn.2943.
[14] BILLIG G M, PAL B, FIDZINSKI P, et al. Ca 2+-activated Cl −currents are dispensable for olfaction[J]. Nature Neuroscience, 2011, 14(6): 763-769. DOI:10.1038/nn.2821.
[15] BACHMANOV A A, BEAUCHAMP G K. Taste receptor genes[J]. Annual Review of Nutrition, 2007, 27: 389-414. DOI:10.1146/ annurev.nutr.26.061505.111329.
[16] MATTES R D. Ac cumulating evidence supports a taste component for free fatty acids in humans[J]. Physiology & Behavior, 2011, 104(4): 624-631. DOI:10.1016/j.physbeh.2011.05.002.
[17] CHANDRASHEKAR J, HOON M A, RYBA N J, et al. Th e receptors and cells for mammalian taste[J]. Nature, 2006, 444: 288-294. DOI:10.1038/nature05401.
[18] FELDMESSER E, OLENDER T, KHEN M, et al. W idespread ectopic expression of olfactory receptor genes[J]. BMC Genomics, 2006, 7(121): 1-8. DOI:10.1186/1471-2164-7-121.
[19] ZHANG X H, de la CRUZ O, PINTO J M, et al. Ch aracterizing the expression of the human olfactory receptor gene family using a novel DNA microarray[J]. Genome Biology, 2007, 8(5): R86. DOI:10.1186/ gb-2007-8-5-r86.
[20] PARMENTIER M, LIBERT F, SCHURMANS S, et al. Ex pression of members of the putative olfactory receptor gene family in mammalian germ cells[J]. Nature, 1992, 355: 453-455. DOI:10.1038/355453a0.
[21] DRUTEL G, ARRANG J M, DIAZ J, et al. Cloning of OL1, a putative olfactory receptor and its expression in the developing rat heart[J]. Receptors Channels, 1995, 3(1): 33-40.
[22] BLACHE P, GROS L, SALAZAR G, et al. Cl oning and tissue distribution of a new rat olfactory receptor-like (OL2)[J]. Biochemical and Biophysical Research Communications, 1998, 242(3): 669-672. DOI:10.1006/bbrc.1997.8041.
[23] FEINGOLD E A, PENNY L A, NIENHUIS A W, et al. An olfactory receptor gene is located in the extended human beta-globin gene cluster and is expressed in erythroid cells[J]. Genomics, 1999, 61(1): 15-23. DOI:10.1006/geno.1999.5935.
[24] ITAKURA S, OHNO K, UEKI T, et al. Ex pression of Golf in the rat placenta: possible implication in olfactory receptor transduction[J]. Placenta, 2006, 27(1): 103-108. DOI:10.1016/j.placenta.2004.12.006.
[25] FERRAND N, PESSAH M, FRAYON S, et al. Olfactory receptors, Golf alpha and adenylyl cyclase mRNA expressions in the rat heart during ontogenic development[J]. Journal of Molecular and Cellular Cardiology, 1999, 31(5): 1137-1142. DOI:10.1006/jmcc.1999.0945.
[26] FRAYON S, PESSAH M, GIROIX M H, et al. G alpha olf identification by RT-PCR in purified normal pancreatic B cells and in islets from rat models of non-insulin-dependent diabetes[J]. Biochemical and Biophysical Research Communications, 1999, 254(1): 269-272.
[27] CORVOL J C, STUDLER J M, SCHONN J S, et al. G alpha(olf) is necessary for coupling D1 and A2a receptors to adenylyl cyclase in the striatum[J]. Journal of Neurochemistry, 2001, 76(5): 1585-1588. DOI:10.1046/j.1471-4159.2001.00201.x.
[28] BAKALYAR H A, REED R R. Id entification of a specialized adenylyl cyclase that may mediate odorant detection[J]. Science, 1990, 250: 1403-1406. DOI:10.1126/science.2255909.
[29] XIA Z, CHOI E J, WANG F, et al. Th e type III calcium/ calmodulinsensitive adenylyl cyclase is not specific to olfactory sensory neurons[J]. Neuroscience Letters, 1992, 144(1/2): 169-173. DOI:10.1016/0304-3940(92)90742-P.
[30] JOURDAN K B, MASON N A, LONG L, et al. Characterization of adenylyl cyclase isoforms in rat peripheral pulmonary arteries[J]. American Journal of Physiology Lung Cell Molecular Physiology 2001, 280: L1359-L1369.
[31] NELSON G, CHANDRASHEKAR J, HOON M A, et al. An aminoacid taste receptor[J]. Nature, 2002, 416: 199-202.
[32] NELSON G, HOON M A, CHANDRASHEKAR J, et al. M ammalian sweet taste receptors[J]. Cell, 2001, 106(3): 381-390. DOI:10.1016/ S0092-8674(01)00451-2.
[33] ZHANG X, FIRESTEIN S. Ge nomics of olfactory receptors[J]. Results and Problems in Cell Differentiation, 2009, 47: 25-36. DOI:10.1007/400_2008_28.
[34] de la CRUZ O, BLEKHMAN R, ZHANG X, et al. A signature of evolutionary constraint on a subset of ectopically expressed olfactory receptor genes[J]. Molecular Biology and Evolution, 2009, 26(3): 491-494. DOI:10.1093/molbev/msn294. Epub 2008 Dec 22.
[35] HÖFER D, PÜSCHEL B, DRENCKHAHN D. Tast e receptor-like cells in the rat gut identified by expression of alpha-gustducin[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(13): 6631-6634. DOI:10.1073/pnas.93.13.6631.
[36] FLEGEL C, MANTENIOTIS S, OSTHOLD S, et al. Expr ession profile of ectopic olfactory receptors determined by deep sequencing[J]. PLoS ONE, 2013, 8(2): e55368. DOI:10.1371/journal. pone.0055368.
[37] MARTIN B, MAUDSLEY S, WHITE C M, et al. Horm ones in the naso-oropharynx: endocrine modulation of taste and smell[J]. Trends in Endocrinol & Metabolism, 2009, 20(4): 163-170. DOI:10.1016/ j.tem.2009.01.006.
[38] KAWAI F, KURAHASHI T, KANEKO A. Adre naline enhances odorant contrast by modulating signal encoding in olfactory receptor cells[J]. Nature Neuroscience, 1999, 2(2): 133-138. DOI:10.1038/5686.
[39] TONG J, MANNEA E, AIMÉ P, et al. Ghrelin enhances olfactory sensitivity and exploratory sniffing in rodents and humans[J]. The Journal of Neuroscience, 2011, 31(15): 5841-5846. DOI:10.1523/ JNEUROSCI.5680-10.2011.
[40] TRELLAKIS S, TAGAY S, FISCHER C, et al. Ghreli n, leptin and adiponectin as possible predictors of the hedonic value of odors[J]. Regulatory Peptides, 2011, 167(1): 112-117. DOI:10.1016/ j.regpep.2010.12.005.
[41] FIRESTEIN S, MENINI A. The sm ell of adrenaline[J]. Nature Neuroscience. 1999, 2(2): 106-108. DOI:10.1038/5661.
[42] YOSHIDA R, OHKURI T, JYOTAKI M, et al. Endoca nnabinoids selectively enhance sweet taste[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(2): 935-939. DOI:10.1073/pnas.0912048107.
[43] DANDO R, DVORYANCHIKOV G, PEREIRA E, et al. Adenosine enhances sweet taste through A2B receptors in the taste bud[J]. Journal of Neuroscience, 2012, 32(1): 322-330. DOI:10.1523/ JNEUROSCI.4070-11.2012.
[44] KATAOKA S, BAQUERO A, YANG D, et al. A2BR adenosine receptor modulates sweet taste in circumvallate taste buds[J]. PLoS ONE, 2012, 7(1):e30032. DOI:10.1371/journal.pone.0030032.
[45] SHIGEMURA N, IWATA S, YASUMATSU K, et al. Angiotensin II modulates salty and sweet taste sensitivities[J]. Journal of Neuroscience, 2013, 33(15): 6267-6277. DOI:10.1523/ JNEUROSCI.5599-12.2013.
[46] GRIFFIN C A, KAFADAR K A, PAVLATH G K. MOR23 promotesmuscle regeneration and regulates cell adhesion and migration[J]. Developmental Cell, 2009, 17(5): 649-661. DOI:10.1016/ j.devcel.2009.09.004.
[47] FUKUDA N, TOUHARA K. Develo pmental expression patterns of testicular olfactory receptor genes during mouse spermatogenesis[J]. Genes Cells, 2006, 11(1): 71-81. DOI:10.1111/j.1365-2443.2005.00915.x.
[48] WAUSON E M, ZAGANJOR E, LEE A Y, et al. The G proteincoupled taste receptor T1R1/T1R3 regulates mTORC1 and autophagy[J]. Molecular Cell, 2012, 47(6): 851-862. DOI:10.1016/ j.molcel.2012.08.001.
[49] SWARTZ T D, DUCA F A, de WOUTERS T, et al. Up-reg ulation of intestinal type 1 taste receptor 3 and sodium glucose luminal transporter-1 expression and increased sucrose intake in mice lacking gut microbiota[J]. British Journal of Nutrition, 2012, 107(5): 621-630. DOI:10.1017/S0007114511003412.
[50] SHIN Y J, PARK J H, CHOI J S, et al. Enhanc ed expression of the sweet taste receptors and alpha-gustducin in reactive astrocytes of the rat hippocampus following ischemic injury[J]. Neurochemical Research, 2010, 35(10):1628-1634. DOI:10.1007/s11064-010-0223-2.
[51] JEON T I, ZHU B, LARSON J L, et al. SREBP- 2 regulates gut peptide secretion through intestinal bitter taste receptor signaling in mice[J]. Journal of Clinical Investigate, 2008, 118(11): 3693-3700. DOI:10.1172/JCI36461.
[52] FOSTER S R, PORRELLO E R, PURDUE B, et al. Expres sion, regulation and putative nutrient-sensing function of taste GPCRs in the heart[J]. PLoS ONE, 2013, 8(5): e64579. DOI:10.1371/journal.pone.0064579.
[53] WELLENDORPH P, JOHANSEN L D, BRÄUNER-OSBORNE H. Molecular pharmacology of promiscuous seven transmembrane receptors sensing organic nutrients[J]. Molecular Pharmacology, 2009, 76(3): 453-465. DOI:10.1124/mol.109.055244.
[54] PANG G C, XIE J B, CHEN Q S, et al. How functional foods play critical roles in human health[J]. Food Science and Human Wellness, 2012, 1(1): 26-60. DOI:10.1016/j.fshw.2012.10.001.
[55] KAREN K R, RANDY J S. Food as a hormone[J]. Science, 2013, 339: 918-919. DOI:10.1126/science.1234062.
[56] MEYERHOF W, BATRAM C, KUHN C, et al. The molecular receptive ranges of human TAS2R bitter taste receptors[J]. Chemical Senses, 2010, 35(2): 157-170. DOI:10.1093/chemse/bjp092.
[57] JANG H J, KOKRASHVILI Z, THEODORAKIS M J, et al. Gutexpressed gustducin and taste receptors regulate secretion of glucagonlike peptide-1[J]. Proceeding of the National Academy of Sciences of the United States of America, 2007, 104: 15069-15074. DOI:10.1073/ pnas.0706890104.
[58] MARGOLSKEE R F, DYER J, KOKRASHVILI Z, et al. T1R3 and gustducin in gut sense sugars to regulate expression of Na +-glucose cotransporter[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(38): 15075-15080. DOI:10.1073/pnas.0706890104.
[59] AKIBA Y, WATANABE C, MIZUMORI M, et al. Luminal L-glutamate enhances duodenal mucosal defense mechanisms via multiple glutamate receptors in rats[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2009, 297(4): G781-G791. DOI:10.1152/ajpgi.90605.2008.
[60] MACE O J, LISTER N, MORGAN E, et al. An energy supply network of nutrient absorption coordinated by calcium and T1R taste receptors in rat small intestine[J]. Journal of Physiology, 2009, 587(Pt 1): 195-210. DOI:10.1113/jphysiol.2008.159616.
[61] REN X, ZHOU L, TERWILLIGER R, et al. Sweet taste signaling functions as a hypothalamic glucose sensor[J]. Frontiers in Integrative Neuroscience, 2009, 3: 12. DOI:10.3389/neuro.07.012.2009. eCollection 2009.
[62] DOTSON C D, VIGUES S, STEINLE N I, et al. T1R and T2R receptors: the modulation of incretin hormones and potential targets for the treatment of type 2 diabetes mellitus[J]. Current Opinion in Investigational Drugs, 2010, 11(4): 447-454.
[63] CHEN M C, WU S V, REEVE J R, et al. Bitter stimuli induce Ca 2+signaling and CCK release in enteroendocrine STC-1 cells: role of L-type voltagesensitive Ca 2+channels[J]. American Journal of Physiology, 2006, 291(4): C726-C739. DOI:10.1152/ ajpcell.00003.2006.
[64] DOTSON C D, ZHANG L, XU H, et al. Bitter taste receptors infl uence glucose homeostasis[J]. PLoS ONE, 2008, 3(12): e3974. DOI:10.1371/ journal.pone.0003974.
[65] KAJI I, KARAKI S, FUKAMI Y, et al. Secretory effects of a luminal bitter tastant and expressions of bitter taste receptors, T2Rs, in the human and rat large intestine[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2009, 296(5): G971-G981. DOI:10.1152/ajpgi.90514.2008.
[66] JANSSEN S, LAERMANS J, VERHULST P J, et al. Bitter taste receptors and {alpha}-gustducin regulate the secretion of ghrelin with functional effects on food intake and gastric emptying[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(5): 2094-2099. DOI:10.1073/pnas.1011508108.
[67] BRAUN T, VOLAND P, KUNZ L, et al. Enterochromaffi n cells of the human gut: sensors for spices and odorants[J]. Gastroenterology, 2007, 132(5): 1890-1901. DOI:10.1053/j.gastro.2007.02.036.
[68] FINGER T E, BÖTTGER B, HANSEN A, et al. Solitary chemoreceptor cells in the nasal cavity serve as sentinels of respiration[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(15): 8981-8986.
[69] TIZZANO M, GULBRANSEN BD, VANDENBEUCH A, et al. Nasal chemosensory cells use bitter taste signaling to detect irritants and bacterial signals[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(7): 3210-3215. DOI:10.1073/pnas.0911934107.
[70] KRASTEVA G, CANNING B J, HARTMANN P, et al. Cholinergic chemosensory cells in the trachea regulate breathing[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(23): 9478-9483. DOI:10.1073/pnas.1019418108.
[71] SHAH A S, BEN-SHAHAR Y, MONINGER T O, et al. Motile cilia of human airway epithelia are chemosensory[J]. Science, 2009, 325: 1131-1134. DOI:10.1126/science.1173869.
[72] LEE R J, XIONG G, KOFONOW J M, et al. T2R38 taste receptor polymorphisms underlie susceptibility to upper respiratory infection[J]. Journal of Clinical Investigation, 2012, 122(11): 4145-4159. DOI:10.1172/JCI64240.
[73] DESHPANDE D A, WANG W C H, MCILMOYLE E L, et al., Bitter taste receptors on airway smooth muscle bronchodilate by localized calcium signaling and reverse obstruction[J]. Nature Medicine, 2010, 16(11): 1299-1304.
[74] ZHANG C H, LIFSHITZ L M, UY K F, et al. The cellular and molecular basis of bitter tastant-induced bronchodilation[J]. PLoS Biology, 2013, 11(13): e1001501.
[75] PLUZNICK J L, ZOU D J, ZHANG X H, et al. Functional expression of the olfactory signaling system in the kidney[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(6): 2059-2064.
[76] PLUZNICK J L, PROTZKO R J, GEVORGYAN H, et al. Olfactory receptor responding to gutmicrobiota-derived signals plays a role in renin secretion and blood pressure regulation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(11): 4410-4415. DOI:10.1073/pnas.1215927110.
[77] FUKUDA N, YOMOGIDA K, OKABE M, et al. Functional characterization of a mouse testicular olfactory receptor and its role in chemosensing and in regulation of sperm motility[J]. Journal of Cell Science, 2004, 117(Pt 24): 5835-5845.
[78] LEAL W S. Pheromone reception[J]. Topics in Current Chemistry, 2005, 240: 1-36. DOI:10.1007/b98314.
[79] SPEHR M, SCHWANE K, HEILMANN S, et al. Dual capacity of a human olfactory receptor[J]. Current Biology, 2004, 14(19): R832-R833. DOI:10.1016/j.cub.2004.09.034.
[80] NEUHAUS E M, ZHANG W Y, GELIS L, et al. Activation of an olfactory receptor inhibits proliferation of prostate cancer cells[J]. Journal of Biological Chemistry, 2009, 284(24): 16218-16225. DOI:10.1074/jbc.M109.012096.
[81] MEYER D, VOIGT A, WIDMAYER P, et al. Expression of Tas1 taste receptors in mammalian spermatozoa: functional role of Tas1r1 in regulating basal Ca 2+and cAMP concentrations in spermatozoa[J]. PLoS ONE, 2012, 7(2): e32354. DOI:10.1371/journal.pone.0032354.
[82] OH D Y, TALUKDAR S, BAE E J, et al. GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulinsensitizing effects[J]. Cell, 2010, 142(2): 687-698. DOI:10.1016/ j.cell.2010.07.041.
[83] ICHIMURA A, HIRASAWA A, POULAIN-GODEFROY O, et al. Dysfunction of lipid sensor GPR120 leads to obesity in both mouse and human[J]. Nature, 2012, 483: 350-354. DOI:10.1038/nature10798. [84] ZHANG X, BEDIGIAN A V, WANG W, et al. U. S. G protein-coupled receptors participate in cytokinesis[J]. Cytoskeleton (Hoboken), 2012, 69(10): 810-818. DOI:10.1002/cm.21055.
[85] CLARK A A, LIGGETT S B, MUNGER S D, et al. Extraoral bitter taste receptors as mediators of off-target drug effects[J]. Faseb Journal Offi cial Publication of the Federation of American Societies for Experimental Biology, 2012, 26(12): 4827-4831. DOI:10.1096/fj.12-215087.
[86] BEHRENS M, MEYERHOF W. Bitter taste receptor research comes of age: from characterization to modulation of TAS2Rs[J]. Seminars in Cell & Developmental Biology, 2013, 24(3): 215-221. DOI:10.1016/ j.semcdb.2012.08.006.
[87] MEYERHOF W, BATRAM C, KUHN C, et al. The molecular receptive ranges of human TAS2R bitter taste receptors[J]. Chemical Senses, 2010, 35(2): 157-170. DOI:10.1093/chemse/bjp092.
[88] STRAUB S G, MULVANEY-MUSA J, YAJIMA H, et al. Stimulation of insulin secretion by denatonium, one of the most bitter-tasting substances known[J]. Diabetes, 2003, 52(2): 356-364. DOI:10.2337/ diabetes.52.2.356.
[89] SCHLIKMANN K M, ANNEMARIE H, ESIN TÜRECI, et al. Critical features for biosynthesis, stability, and functionality of a G proteincoupled receptor uncovered by all-versus-all mutations[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(25): 9810-9815. DOI:10.1073/pnas.1202107109.
[90] KIMOTO H, HAGA S, SATO K, et al. Sex-specific peptides from exocrine glands stimulate mouse vomeronasal sensory neurons[J]. Nature, 2005, 437: 898-901. DOI:10.1038/nature04033.
[91] HAGA S, HATTORI T, SATO T, et al. The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specifi c vomeronasal receptor[J]. Nature, 2010, 466: 118-122. DOI:10.1038/ nature09142.
[92] YOSHIKAWA K, NAKAGAWA H, MORI N, et al. An unsaturated aliphatic alcohol as a natural ligand for a mouse odorant receptor[J]. Nature Chemical Biology, 2013, 9(3): 160-162. DOI:10.1038/ nchembio.1164.
[93] BLAD C C, TANG C, OFFERMANNS S. G protein-coupled receptors for energy metabolites as new therapeutic targets[J]. Nature Reviews Drug Discovery, 2012, 11(8): 603-619. DOI:10.1038/nrd3777.
[94] WOOTTEN D, SAVAGE E E, VALANT C, et al. Allosteric modulation of endogenous metabolites as an avenue for drug discovery[J]. Molecular Pharmacology, 2012, 82(2): 281-290. DOI:10.1124/ mol.112.079319.
[95] SIGOILLOT M, BROCKHOFF A, MEYERHOF W, et al. Sweettaste-suppressing compounds: current knowledge and perspectives of application[J]. Applied Microbiology and Biotechnology, 2012, 96(3): 619-630. DOI:10.1007/s00253-012-4387-3.
[96] SERVANT G, TACHDJIAN C, TANG X Q, et al. Positive allosteric modulators of the human sweet taste receptor enhance sweet taste[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(10): 4746-4751. DOI:10.1073/ pnas.0911670107.
[97] BROCKHOFF A, BEHRENS M, ROUDNITZKY N, et al. Receptor agonism and antagonism of dietary bitter compounds[J]. Journal of Neuroscience, 2011, 31(41): 14775-14782. DOI:10.1523/ JNEUROSCI.2923-11.2011.
[98] PARTAN S R. Ten unanswered questions in multimodal communication[J]. Behavioral Ecology and Sociobiology, 2013, 67: 1523-1539. DOI:10.1007/s00265-013-1565-y.
[99] 匡海学, 王艳宏, 王秋红, 等. 基于中药性味可拆分性和可组合性的中药性味理论研究新模式[J]. 世界科学技术(中医药现代化), 2011, 13(1): 25-29. DOI:10.3969/j.issn.1674-3849.2011.01.004.
[100] 匡学海, 程伟. 中药呈味的可拆分性和可组合性研究[J]. 世界科学技术(中医药现代化), 2009, 11(6): 768-771.
[101] 柴可夫, 谷英敏, 马纲. 中医食性视野下食养发展刍议[J]. 中华中医药学刊, 2011, 29(1): 5-6.
[102] 柴可夫, 代民涛, 马纲, 等. 论构建中国食材性味归经功效理论体系的必要性与意义[J]. 中华中医药学刊, 2013, 31(3): 455-456.
[103] 庞广昌, 陈庆森, 胡志和, 等. 网络方法在食品体内功能定量化评价中的应用[J]. 食品科学, 2014, 35(13): 293-302. DOI:10.7506/ spkx1002-6630-201413058.
[104] GRIFFITH J W, SOKOL C L, LUSTER A D. Chemokines and chemokine receptors: positioning cells for host defense and immunity[J]. Annual Review of Immunology, 2014, 32: 659-702.
[105] ZHANG X M, ROGERS M, TIAN H K, et al. High-throughput microarray detection of olfactory receptor gene expression in the mouse[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(39): 14168-14173. DOI:10.1073/ pnas.0405350101.
[106] BEZENCON C, FURHOLZ A, RAYMOND F, et al. Murine intestinal cells expressing Trpm5 are mostly brush cells and express markers of neuronal and inflammatory cells[J]. Journal of Comparative Neurology, 2008, 509(5): 514-525. DOI:10.1002/cne.21768.
[107] SNEAD A N, INSEL P A. Defi ning the cellular repertoire of GPCRs identifies a profibrotic role for the most highly expressed receptor, protease-activated receptor 1, in cardiac fi broblasts[J]. FASEB Journal, 2012, 26(11): 4540-4547. DOI:10.1096/fj.12-213496.
[108] RAMSEY I S, DELLING M, de CLAPHAM C. An introduction to TRP channels[J]. Annual Review of Physiology, 2006, 68: 619-647.
[109] QIAO L X, JIAO L H, PANG G C, et al. A novel pungency biosensor prepared with fixing taste-bud tissue of rats[J]. Biosensors and Bioelectronics, 2015, 68: 454-461. DOI:10.1016/j.bios.2015.01.032.
[110] KANG X B, PANG G C, LIANG X Y, et al. Study on a hydrogen peroxide biosensor based on horseradish peroxidase/GNPs-thionine/ chitosan[J]. Electrochimica Acta, 2012, 62: 327-334. DOI:10.1016/ j.electacta.2011.12.034.
[111] WANG X Y, PANG G C. Amplifi cation systems of weak interaction biosensors: applications and prospects[J]. Sensor Review, 2015, 35(1):30-42.
Odorant and Taste Receptors and Their Potential Applications in Evaluation of Functional Foods
PANG Guangchang, CHEN Qingsen, HU Zhihe, XIE Junbo
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:The mammalian gustatory system is classified into five primary tastes: umami, sweet, salty, sour and bitter, which enable us to evaluate food constituents. The tastes have been identified as the major members of the G protein-coupled receptor (GPCR) family, the largest family of receptor proteins in mammals (referred to as taste receptor type 1 (T1R) and type 2 (T2R)). Another taste quality related to lipid sensing is mediated by free fatty acid (FFA) GPCR family. An increasing number of reports on the expression of odorant and taste receptors in tissues beyond the nose and mouth started to appear in the literature. But most literatures have been relied on reverse transcription PCR (RT-PCR) and microarray data without demonstrating either protein expression or function. Recently, some publications are appearing on the function of odorant and taste receptors in the gastrointestinal tract. These studies reinforce the broader potential and even more important roles beyond the odorant and taste receptors. In this review, the prevailing evidence for the expression of odorant and taste GPCRs in cells and tissues beyond the nose and mouth is summarized, and then the putative function for these receptors in diverse physiological functions, ranging from nutrient sensing, regulation of nutrient uptake, metabolic balance, energy control and metabolic disorder is highlighted. Finally, the future trends and potential applications of detection technologies for these GPCRs are expected for the evaluation of functional ingredients such as resveratrol, polyphenols, flavonoids and other phytochemicals.
Key words:G protein-coupled receptors; odorant/taste GPCRs; ligand; G protein cascade; biosensor
DOI:10.7506/spkx1002-6630-201603039
中图分类号:R151.41
文献标志码:A
文章编号:1002-6630(2016)03-0217-12
引文格式:
庞广昌, 陈庆森, 胡志和, 等. 味觉受体及其对食品功能评价的应用潜力[J]. 食品科学, 2016, 37(3): 217-228. DOI:10.7506/spkx1002-6630-201603039. http://www.spkx.net.cn
PANG Guangchang, CHEN Qingsen, HU Zhihe, et al. Odorant and taste receptors and their potential applications in evaluation of functional foods[J]. Food Science, 2016, 37(3): 217-228. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603039. http://www.spkx.net.cn
收稿日期:2015-07-05
基金项目:国家自然科学基金面上项目(31371773)
作者简介:庞广昌(1956—),男,教授,博士,研究方向为食品生物技术和生物传感器。E-mail:pgc@tjcu.edu.cn