脱落酸的生物合成及对水果成熟的调控研究进展
杨方威,段懿菲,冯叙桥*
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
摘 要:作为一种重要的植物激素,脱落酸(abscisic acid,ABA)除具有引起植物芽体休眠、叶子脱落、气孔关闭、抑制植株生长和增强植物抗逆性等生理作用外,在果实生长发育和成熟衰老的过程中也具有重要的调控作用。高等植物组织中ABA生物合成主要是通过C
40类胡萝卜素的间接途径来实现的。植物内源ABA的含量水平处于动态平衡状态,受其生物合成和分解代谢等因素影响,在此过程中有关基因转录表达水平和酶活性起着关键作用。内源ABA含量的升高会导致水果成熟和果肉软化,ABA可能同时调控了呼吸跃变型和呼吸非跃变型水果的成熟衰老。探究ABA的生物合成及其调控作用,对揭示水果的生长发育、品质形成、着色软化、成熟衰老等过程具有重要的现实意义。本文综述了ABA及其生成代谢相关基因调控水果成熟的研究进展,并展望了ABA在提高水果品质、延长水果货架期等方面的商业应用。
关键词:脱落酸;生物合成;水果;成熟;调控
脱落酸(abscisic acid,ABA),与生长素(indole acetic acid,IAA)、赤霉素(gibberellins,GA)、细胞分裂素(cytokinin,CTK)、乙烯(ethylene,ETH)一起,被公认为是调控植物生长发育的五大类植物激素。ABA广泛分布在高等植物各种幼嫩和衰老器官及组织中,在植物的生长发育过程中发挥着重要作用,如促进器官脱落、促进芽和种子休眠、促进气孔关闭、响应环境因素以增强抗逆性等
[1]。近年来,越来越多的研究发现,ABA是调控果实成熟的关键激素,ABA在水果生长发育、品质形成、着色软化、成熟衰老等过程中具有重要作用
[2-4]。果实在生长发育和成熟衰老进程中,内源ABA的含量一般由较低水平逐渐升高,达到峰值后又逐渐下降;果实内源ABA的积累主要取决于ABA的生物合成和代谢分解两方面。ABA含量积累到一定程度后,便会通过复杂的信号转导途径对果实的生长发育和成熟衰老等一系列生理活动进行调控
[5]。随着研究的深入,关于ABA在水果尤其是在呼吸非跃变型水果生长发育和成熟软化进程中的作用逐渐被揭示出来
[3,6-9]。
1 ABA的生物合成
1.1 ABA的生物合成途径
自然界生物体内脱落酸的生物合成有两条途径。一是C
15直接途径:3 个异戊烯单位聚合成C
15前体FPP,由FPP经环化和氧化直接形成15碳的ABA;另一个是高等植物中的C
40间接途径:先由MVA聚合成C
40前体类胡萝卜素,再由类胡萝卜素裂解成C
15的化合物,如黄质醛(xanthoxin,XAN),最后黄质醛作为C
15骨架经一系列变化形成ABA
[10-11]。高等植物组织中ABA生物合成主要是通过类胡萝卜素的间接途径来实现的(图1)。
ABA在高等植物中的间接合成途径可分为3 个阶段:首先是在质体内形成胡萝卜素;接着在质体内形成玉米黄质,玉米黄质经过环化形成环氧类胡萝卜素,即9-顺式-紫黄质和9-顺式-新黄质,然后9-顺式-紫黄质或9-顺式-新黄质经过裂解形成XAN;最后XAN在细胞溶胶内转变形成ABA
[10]。其中参与ABA合成的酶主要有八氢番茄红素脱氢酶(phytoene desaturase,PDS)、玉米黄质环氧化酶(zeaxanthin epoxidase,ZEP)、9-顺式-环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenase,NCED)、脱落酸醛脱氢酶(abscisic aldehyde oxidase,AAO)等
[12-13]。生物化学和遗传学实验结果证明,9-顺式紫黄质或9-顺式新黄质裂解形成黄质醛是高等植物ABA生物合成的限速步骤,催化该反应的NCED则是调控ABA生物合成的关键酶
[14-15]。
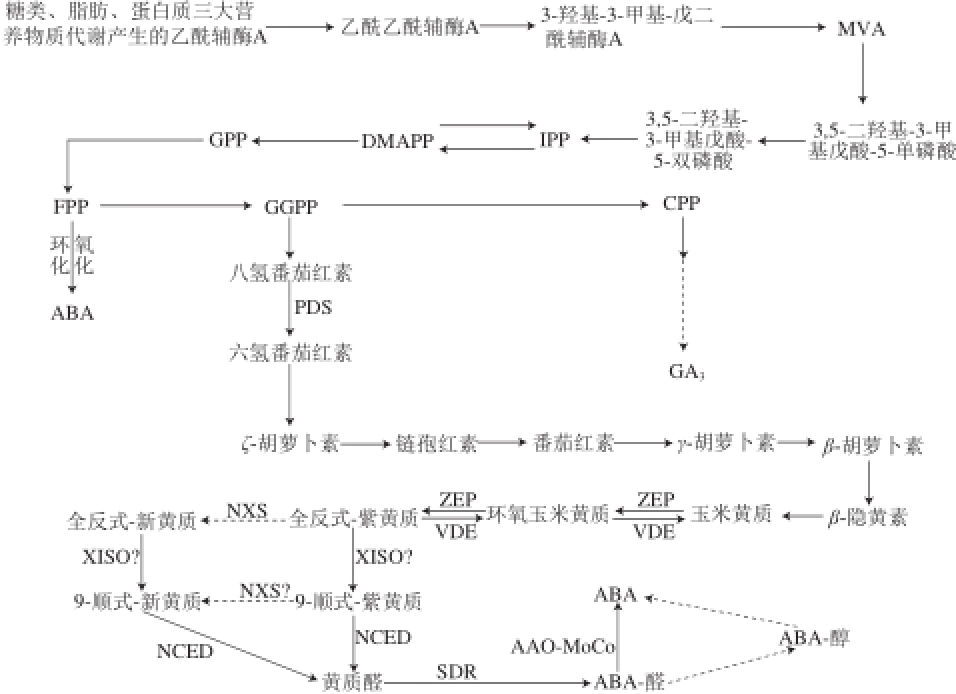
图1 高等植物中ABA的生物合成途径
[10,16-17]
Fig.1 Biosynthetic pathways of ABA in higher plants
[10,166--1177]]
CPP.古巴焦磷酸(copalyl diphosphate);DMAPP.二甲丙烯焦磷酸(dimethylallyl diphosphate);FPP.法尼基焦磷酸(farnesylpyrophosphate);GGPP.牻牛儿牻牛儿基焦磷酸(geranylgeranyl pyrophosphate);GPP.牻牛儿基焦磷酸(geranylpyrophosphate);IPP.异戊烯基焦磷酸(isopentenyl diphosphate);MoCo.钼元素辅因子(molybdenum co-factor);MVA.甲瓦龙酸(mevalonic acid);NXS.新黄质合成酶(neoxanthin synthase);SDR.短链脱氢酶(short chain dehydrogenase);VDE.紫黄质脱环氧化酶(violaxanthin deepoxidase);XISO.叶黄素异构酶(xanthophyll isomerase (predicted))。
在高等植物中,类倍半萜烯可由C
40类胡萝卜素裂解产物经间接途径生成,在ABA生物合成途径中的第一个关键步骤就是质体中玉米黄质在ZEP催化作用下生成紫黄质的两步环氧化反应
[18]。VDE与ZEP一起可使两种叶黄素通过叶黄素循环的形式相互转换,这有利于保护植物光合体系免受光氧化性损伤
[19]。在ABA生物合成的途径中,紫黄质到新黄质的转换还未能完全阐明,但是这个反应依赖于拟南芥中ABA4基因的表达产物,而该基因可编码NXS;紫黄质和新黄质在裂解之前必须先进行异构化,但是编码9-顺式-环氧类胡萝卜素异构酶(9-cis-epoxycarotenoid isomerase,NCEI)的基因尚未被鉴别到
[20]。9-顺式-新黄质和9-顺式-紫黄质的氧化裂解生成ABA的C
15前体XAN,在高等植物中该步反应被NCED所催化,该酶被认为是ABA生物合成途径中的关键酶
[6,15]。前期的研究成果表明,在高等植物中编码NCED的基因是一个小的基因家族
[8]。例如,在拟南芥中至少有7 种AtNCEDs基因(1~6和9)
[15,21];在水稻中有5 种OsNCEDs基因(1~5)
[22];在鳄梨果实中有3 种PaNCEDs基因(1~3),在鳄梨成熟过程中PaNCED1和PaNCED3基因被大量诱导表达
[23]。FaNCED1基因是导致草莓成熟过程中ABA大量积累的主导基因
[6]。在拟南芥中,生成的黄质醛被转运到细胞质基质,在细胞质基质中黄质醛被由AtABA2/AtGIN1基因编码的短链脱氢酶/还原酶家族的酶蛋白催化生成脱落酸醛
[24]。脱落酸醛随后被AAO氧化形成ABA
[25]。
1.2 ABA生物合成抑制剂
去甲二氢化愈创木酸(1,4-双(3,4-二羟基苯基)-2,3-二甲基丁烷(nordihydroguaiaretic acid,NDGA)为ABA生物合成关键酶NCED的抑制剂,能有效地抑制ABA的生物合成
[4]。另外,由于高等植物内源ABA的生物合成途径主要是类胡萝卜素裂解产物这一间接途径,因此阻断类胡萝卜素的生成就可以相应地抑制内源ABA的生物合成。Fluridone,即氟洛酮、氟啶草酮、氟啶酮,化学名称为1-甲基-3-苯基-5-(3-(三氟甲基)苯基)-4(1H)-吡啶酮,可抑制类胡萝卜素合成中催化八氢番茄红素转变为六氢番茄红素的PDS的活性,从而也能够抑制ABA的生物合成,成为ABA合成间接途径的有效阻断剂
[13,26]。根据相关研究,GA
3和ABA的合成都是从MVA开始的,它们经过了相同的化学反应,即类异戊二烯途径,牻牛儿牻牛儿基焦磷酸(geranylgeranyl pyrophosphate,GGPP)是生成ABA和GA
3的分叉口;果实用Fluridone处理,可阻滞GGPP形成ABA的通道,使GGPP转向生成GA
3的通道,由于GA
3和ABA的拮抗作用,使ABA的生成和生理作用受到抑制
[27]。
2 ABA在水果生长发育和成熟衰老过程中的调控作用
近年来,植物激素ABA被认为在水果的生长发育、成熟衰老等生命历程中起着关键性作用。按照在成熟过程中是否有呼吸强度和乙烯释放量的增加,通常将水果分为呼吸跃变型和呼吸非跃变型两种类型
[28]。长期以来,乙烯都是人们所公认的果实后熟衰老激素,尤其是乙烯在跃变型果实成熟过程中的作用已有较多研究,已经证明,在跃变型果实中,乙烯是诱导与成熟相关特定基因表达的关键信号之一,乙烯的增加导致了果实成熟进程的开始。近年来,人们开始强调另一种成熟衰老激素ABA在果实成熟过程中的调控作用更为重要,不论在跃变型果实,还是在非跃变型果实的成熟进程中,ABA均起着重要的作用。研究表明,外源ABA处理能够促进果实后熟衰老过程中乙烯的生成、呼吸升高和果实的完熟。因此,ABA可能同时调控了非跃变型和跃变型果实的成熟衰老。
未成熟水果具有低水平内源ABA、外源ABA处理可以加速水果成熟和果肉软化以及水果成熟过程中ABA生物合成相关基因的大量转录表达、内源ABA的大量积累,这些研究结果说明ABA在水果成熟衰老调控过程中起着重要的作用。这在呼吸跃变型水果桃
[3,29]、鳄梨
[30]、番茄
[4,31]、香蕉
[32]、苹果
[33]、芒果
[34-35],以及呼吸非跃变型水果葡萄
[3,36]、柑橘
[7,37]、草莓
[6,38]中都有证据支持。2.1 ABA直接诱导调控水果的生长发育和成熟衰老
比较而言,对呼吸非跃变型水果在成熟过程中的触发信号和信号调控的研究较少,具体机理也不是十分清楚。前期的研究成果显示植物激素ABA可能与呼吸非跃变型水果的成熟具有密切联系,如ABA缺陷型柑橘的消绿期要迟于野生型柑橘,这预示着ABA在柑橘成熟衰老过程中扮演着决定性角色
[2]。多数实验表明,内源ABA含量升高发生在果实成熟之前,显示ABA的增加诱发了成熟启动,而不是成熟引起ABA的增加。对于呼吸非跃变型果实,成熟信号可能并不是乙烯,如葡萄
[3]、草莓
[6,8]等水果,均证明ABA可诱导果实的生长发育和成熟衰老,ABA的积累具有上升高峰,而这些果实中乙烯的含量水平很低且变化平缓,因此ABA在呼吸非跃变型果实中被认为是重要的成熟启动因子。有证据表明,ABA在许多果实成熟衰老中的作用比乙烯更为重要
[4],在甜樱桃
[39-40]、鲜枣
[41-42]和葡萄
[3]等呼吸非跃变型果实中ABA可能启动了果实的成熟进程。
Zhang Mei等
[3]的研究结果显示,当葡萄果实开始成熟的时候,葡萄中催化ABA生物合成的酶NCED的基因(VvNCED1基因,741 bp)会大量表达,与此同时ABA含量也急剧上升。ABA含量在葡萄开始成熟时即逐步升高,在收获期的前20 d左右达到最大值,然而在这整个过程中乙烯的生成量始终很低。外源ABA处理会使葡萄果实中ABA的含量升高,使葡萄的成熟衰老、果肉软化等生理进程加快;而ABA生物合成抑制剂Fluridone、NDGA处理的葡萄果实中内源ABA较低,且成熟衰老、果肉软化等生理进程被显著推迟。VvNCED1基因的大量表达导致了葡萄成熟早期阶段ABA的生物合成和积累,当ABA含量累积到一定程度时就会开始对葡萄果实的成熟衰老进行调控。
ABA参与了葡萄成熟过程的启动以及葡萄果实生长发育过程中的诸多变化
[43]。有研究表明,应用外源ABA处理葡萄可以增加葡萄皮中的抗氧化成分和花青素、类黄酮含量,提高葡萄的色泽和质量
[44-45]。栾丽英等
[46]研究发现,外源ABA处理可显著提高赤霞珠和烟73葡萄果皮中的花色苷总量,并且不同种类花色苷单体物质含量也有不同程度的提高,这说明ABA能促进葡萄果实花色苷合成,促进葡萄果实着色,这有助于提高酿制的红葡萄酒的品质。Lacampagne等
[47]的研究结果显示,ABA可能调控相关酶参与鞣酸的生物合成,使绿色葡萄果实在成熟转色期的鞣酸含量升高。在葡萄中的蛋白质组学研究结果显示ABA通过影响参与葡萄成熟过程的大多数蛋白质来诱导其最终的成熟
[48]。
Jia Haifeng等
[6]报道了ABA能促进草莓的成熟,ABA在调控草莓成熟过程中具有重要的作用。Jia Haifeng课题组通过在草莓生长发育过程中应用病毒诱导基因沉默技术,将ABA生物合成关键酶NCED的编码基因FaNCED1进行沉默,导致草莓果实内ABA水平显著下降以及不能正常转红无色果实的形成,而FaNCED1基因受抑制的无色表现型果实在外源ABA的作用刺激下又可以转为正常红色果实;外源糖类物质,尤其是蔗糖,在刺激ABA积累的同时,也促进了草莓果实的成熟。这些实验结果证实ABA是促进草莓成熟的信号分子。
黄瓜属于呼吸非跃变型果实,为保证其鲜食品质和货架期通常在黄瓜尚未成熟的緑熟期收获。为了探究ABA在黄瓜生长发育和成熟过程中的作用,Wang Yanping等
[49]监测了黄瓜完熟期前ABA含量水平的变化以及ABA积累高峰的出现,且在转熟期应用外源ABA可以促进黄瓜的成熟;应用实时荧光定量聚合酶链式反应(real time polymerase chain reaction,real time-PCR)技术对与ABA生物合成有关的基因进行转录调控研究,发现在黄瓜生长发育和成熟过程中ABA的含量受ABA生物合成基因(CsNCEDs)、分解代谢相关基因(CsCYP707A1)和活化基因(CsBGs)调控;相应地,在黄瓜脱水和授粉过程中,CsNCED1、CsCYP707A1和CsBG1基因得到高度表达,说明ABA的生成代谢在黄瓜生长发育过程中具有重要作用。当应用外源ABA处理脱水和授粉黄瓜时,Wang Yanping等发现了上述这些基因在处于生长发育和成熟阶段的黄瓜果实的果肉、果皮、种子中的表达模式。这些研究结果为进一步揭示ABA在调控呼吸非跃变型水果生长发育和成熟过程中的分子机制奠定了基础。
Sun Yufei等
[50]发现,ABA的含量在“伊丽莎白”甜瓜幼果中含量很低,在随后水果成熟过程中逐渐升高,且乙烯生成量、1-氨基环丙烷-1-羧酸合成酶(1-aminocyclopropane-1-carboxylic acid synthase,ACS)生成量、1-氨基环丙烷-1-羧酸氧化酶(1-aminocyclopropane-1-carboxylic acid oxidase,ACO)活性在水果成熟早期阶段处于较低水平,但是在ABA积累量高峰5 d后可以观察到这些物质生成量和活性的峰值出现。甜瓜CmNCED3和CmBG1基因具有相似的表达模式,它们转录表达水平高峰的出现与ABA的积累相一致。甜瓜CmNCED2基因在其成熟早期具有较高的表达量,但是没有出现峰值;而CmCYP707A1基因主要在甜瓜成熟后期表达。外源ABA处理能够促进水果的成熟和果肉的软化,这是因为ABA可以调控乙烯生物合成基因CmACS1和CmACO1以及细胞壁代谢酶基因CmPG1的上调和表达。且这种调控效果与外源ABA的浓度成正比,但是浓度过高(>500 μmol/L)会对水果生长发育造成负面影响。受CmNCEDs、CmBG1和CmCYP707A1等基因的调控,内源ABA的含量因其生物合成和代谢分解而维持在动态平衡的水平。ABA和乙烯在调控甜瓜成熟过程中具有协同作用,ABA主要在成熟早期阶段发挥重要作用,而乙烯在成熟后期起着主要作用。可见,ABA是水果果实成熟至关重要的触发信号,调控着果实的生长发育和成熟衰老。
2.2 ABA通过诱导乙烯的生物合成调控水果的生长发育和成熟衰老
在呼吸跃变型水果成熟过程中,乙烯生理作用的分子机理、乙烯受体识别等已被人们逐渐熟悉;然而,对呼吸跃变型水果在成熟过程中的触发信号和上游调控的研究还较少,ABA是否是乙烯生成的上游调控信号及其可能的调控机理尚不是十分清楚。在桃
[3,29]、番茄
[4,31]、香蕉
[32]和苹果
[33]等呼吸跃变型水果以及具有呼吸跃变型和呼吸非跃变型两种类型的甜瓜
[50]果实中,ABA合成高峰的出现要早于乙烯,ABA对乙烯的生物合成可能具有触发和调控作用。
Zhang Mei等
[4]研究结果显示,应用100 μmmol/L ABA溶液处理番茄,可以导致编码ACO的基因Le-ACO1和编码ACS的基因Le-ACS2大量表达,同时相应地增加乙烯的生成量并加速番茄的成熟。另外,应用ABA生物合成阻断剂Fluridone或NDGA,能够抑制Le-ACO1和Le-ACS2基因的表达,并延缓番茄果实的成熟。
Sun Liang等
[51]利用RNAi技术限制番茄中SlNCED1基因的表达,研究了ABA对番茄质构特性和软化过程的影响。与对照水果相比,转基因水果的ABA积累量和SlNCED1转录产物水平分别下降了20%和50%。NCED活性的显著下降导致了大多数编码细胞壁代谢酶基因的转录水平下降,尤其是多聚半乳糖醛酸酶、果胶甲酯酶、β-半乳糖醛酸酶前体mRNA、木葡聚糖内糖基转移酶、纤维素酶、扩张蛋白等酶活性的下降。这些变化导致水果成熟过程中果胶物质的积累增加,使水果的货架期由原对照组的7 d延长到15~29 d,且果肉硬度在成熟期间提高了30%~45%,推迟了番茄的成熟衰老。
ABA缺陷突变体番茄的成熟率只有野生型番茄成熟率的25%,总果质量和均果质量均大幅下降,但ABA缺陷突变体番茄成熟果实中类胡萝卜素含量要比野生型番茄高30%
[49]。而且,抑制番茄中SlNCED1基因的表达能够降低果实中ABA的含量,延长果实的货架期
[51]。因此,对于水果的生长发育和成熟衰老,ABA的调控作用是必不可少的。
Soto等
[52]以桃作为模式水果进一步研究阐明ABA在水果成熟过程中的生理学重要作用。他们以0.02 mmol/L ABA处理处于不同生长发育阶段的桃果,发现外源ABA的应用会干扰水果成熟进程,导致桃果不能正常成熟或过熟;在接近成熟阶段应用ABA会导致桃果中乙烯生成量的增加、细胞壁软化相关酶的酶活性升高、植物激素生物合成与代谢加快,且通过实时荧光定量逆转录聚合酶链式反应(real-time reverse transcription PCR,real-time RT-PCR)技术发现与这些变化相关的基因过早地被上调表达,桃果的这些变化说明ABA加速了水果的成熟和软化。
早期的一些研究表明,芒果在即将成熟收获时其果肉和果皮中内源ABA含量会升高
[53]。还有研究显示芒果呼吸强度上升期间内源ABA的积累可能导致了其成熟过程中乙烯生物合成的启动
[34]。在芒果的成熟过程中,当ABA的积累达到3 000 ng/g鲜质量时,就会诱导乙烯的生成,并调控芒果的成熟过程。应用1 mmol/L ABA处理芒果能够增强乙烯生物合成相关酶ACS、ACO的酶活性,促进乙烯的生物合成,并且会加速芒果果肉的软化,增强多聚半乳糖醛酸内切酶的活性,降低果胶酶的活性。然而,用NDGA处理芒果,会发现乙烯生物合成和果肉软化相关酶的酶活性显著降低,甚至被抑制。与NDGA处理组芒果相比,ABA处理组芒果具有更高的总糖含量,而且有机酸降解更严重。这些结果说明ABA参与了芒果成熟过程的调控,且ABA对芒果成熟过程的调控极有可能是通过影响乙烯生成量的变化实现的
[35]。然而,ABA调控乙烯生物合成和呼吸跃变型水果成熟衰老的具体机理还有待进一步研究。
在水果成熟之前,果实中ABA的含量通过其生物合成与代谢分解而保持在动态平衡状态。外源ABA处理能够通过上调ABA、乙烯、细胞壁酶的基因转录表达来促进水果的软化、成熟和衰老;然而应用ABA生物合成抑制剂Fluridone、NDGA或者利用RNAi技术使编码NCED的相关基因沉默可以延缓或抑制水果的发育、成熟和衰老。这些研究成果为进一步揭示ABA在调控水果成熟过程中的分子机制奠定了一定的基础。随着研究的进一步深入,高等植物中ABA的生物合成与代谢分解途径、信号转导网络和受体识别机制等将会被逐步详细揭示出来,如ABA受体PYR/PYL/RCAR(pyrabactin resistance proteins/PYR-like proteins/regulatory components of ABA receptor)的发现与证实
[54-55]。同时ABA在水果生长发育、品质形成、着色软化、成熟衰老中的重要调控作用也会得到进一步的阐释
[56-57](图2)。
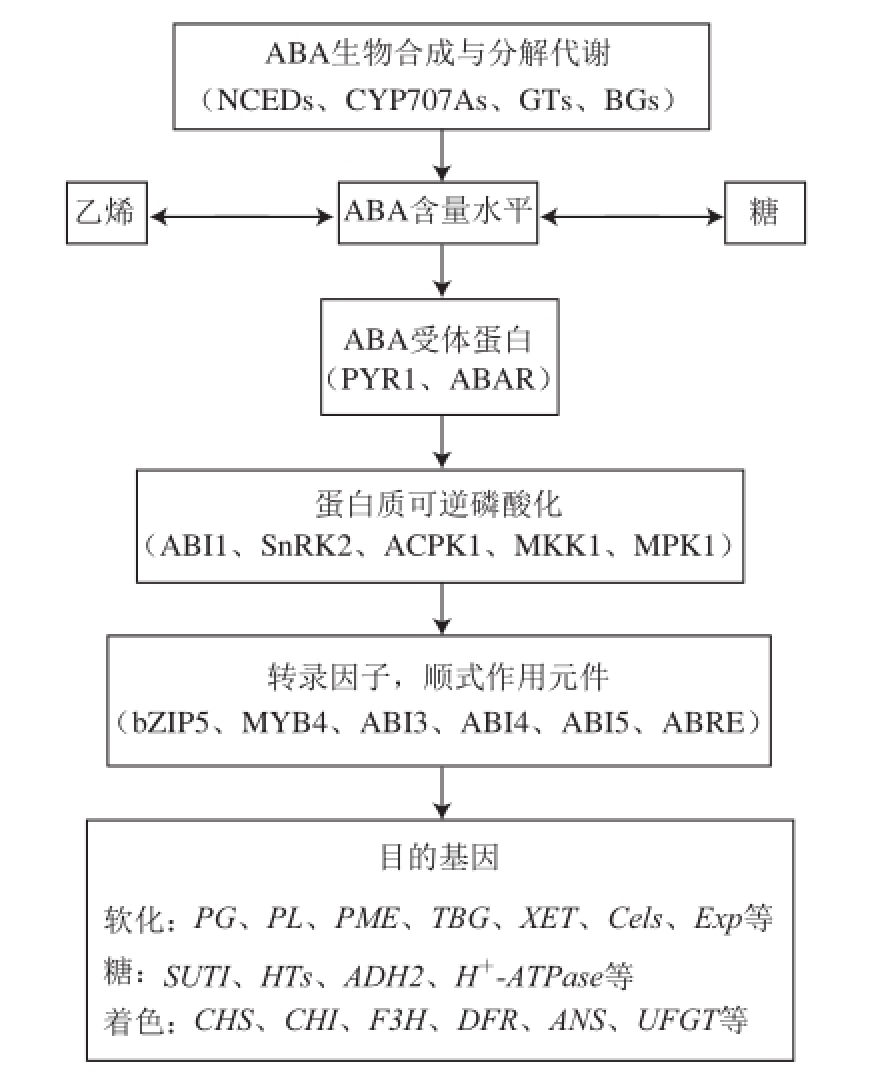
图2 ABA代谢和信号转导调控水果软化、着色、成熟模型
[56]
Fig.2 A model for ABA metabolism and signaling in fruits
[56]
ABAR. ABA受体(ABA receptor);ABI.脱落酸不敏感(abscisic acid insensitive);ABRE. ABA响应元件(ABA response element);ACPK1. ABA刺激的钙依赖蛋白激酶1(ABA-stimulated calcium-dependent protein kinase 1);ADH2.乙醇脱氢酶2(alcohol dehydrogenase 2);ANS.花青素合成酶(anthocyanidin synthase);BG. β-葡萄糖苷酶(β-glucosidase);bZIP5.碱性亮氨酸拉链5(basic leucine zipper 5);Cels.内切-1,4-β-纤维素酶(endo-1,4-β-cellulose);CHI.查尔酮异构酶(chalcone isomerase);CHS.查尔酮合成酶(chalcone synthase);CYP707A.细胞色素P450、707家族、A亚家族(cytochrome P450,family 707,subfamily A);DFR.二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase);Exp.扩张蛋白(expansin);F3H.黄烷酮3-羟化酶(fl avanone 3-hydroxylase);GTs.葡糖基转移酶(glucosyltransferases);H
+-ATPase.质子泵ATPase(proton-pump ATPase);HTs.单糖转运蛋白(monosaccharide transporter);MKK1.丝裂原活化蛋白激酶激酶1(mitogen-activated protein kinase kinase 1);MPK1.丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1);MYB4.脱水应答元件相关转录因子4(dehydration responsive element-related transcription factor 4);PG.多聚半乳糖醛酸酶(polygalacturonase);PL.果胶裂解酶(pectate lyase);PME.果胶甲酯酶(pectin methyl esterase);SnRK2.蔗糖非发酵相关蛋白激酶家族2(sucrose non-fermenting 1-related protein kinase 2);SUT1.蔗糖转运蛋白1(sucrose transporter 1);TBG. β-半乳糖苷酶(β-galactosidase);UFGT.类黄酮3-O-葡萄糖基转移酶(UDP-glucose flavonoid 3-O-glucosyltransferase);XET.木葡聚糖转葡糖苷酶(xyloglucan endotransglycosylase)。
3 结 语
ABA作为一种植物激素,在高等植物广泛的生理代谢过程中具有重要的作用,包括调控生长与发育,尤其是植物种子的萌发、果实的成熟和对环境胁迫的响应。不论是在呼吸跃变型水果,还是在呼吸非跃变型水果中,植物激素ABA在调控水果生长发育和成熟衰老方面均具有重要作用。应用外源ABA可增加水果花青素的含量和糖的积累,促进水果的成熟和果肉组织的软化。在呼吸跃变型水果中,这种变化被认为是由于ABA可作为启动乙烯合成的上游调控信号,诱导了乙烯生成量的增加,大量生成的乙烯进一步导致果实的成熟。呼吸非跃变型水果中乙烯的含量水平很低且变化平缓,ABA在呼吸非跃变果实成熟衰老中的作用比乙烯更为重要,ABA被认为是调控这类水果成熟的重要启动因子,且越来越多的研究结果表明ABA受体PYR/PYL/RCAR是水果成熟过程中的正调控因子。水果内源ABA含量的积累可触发ABA下游信号通路(包括ABA受体、第二信使、蛋白激酶、蛋白磷酸酶和转录因子等)的一系列信号转导和调控,并进一步启动成熟相关基因(如糖、色素和细胞壁组分代谢相关基因)的表达和调控,进而诱导水果的成熟和软化。
目前,ABA的生物合成途径尚未被完全了解,ABA迄今仍主要靠化学合成,价格昂贵。由于人工合成ABA的成本很高,且非常不稳定,使ABA在科研及生产应用中受到很大限制,制约了其在农业和园艺生产中的应用。随着ABA研究的深入和多方面实验内容的展开,在生物化学、分子生物学、植物生理学与基因工程技术理论与实践的基础上阐明水果中ABA的应答合成、受体识别、信号转导等机理,对揭示果实的生长发育、品质形成、着色软化、成熟衰老等研究具有重要的现实意义。
生命是一个艰苦绝伦的过程,尤其是对于采后仍然具有生命活动的鲜活水果产品,它们必须忍耐环境或人为带来的各种压力,如失水、低温和机械振动等,但水果会应激产生ABA等植物激素来适应环境压力,以增强自身的生存。了解ABA的具体作用机制,就可以更有效地在分子水平上维持水果应有的鲜活品质。在果实生长发育阶段,应用ABA可以合理调控果实的生理活动和生长发育过程,增强果实对环境的适应能力和抗逆性,减少化学农药的使用量,提高水果的食用品质和营养价值。在果蔬产品采后贮藏保鲜过程中,抑制ABA的生成与代谢可以合理抑制果实的呼吸消耗作用,有利于果实优良食用品质的形成与保持,延长果蔬的货架期和鲜食品质。这些研究结果将会对果实成熟分子机制、园艺产品采后生物学、果蔬采后生理及贮藏加工等广泛的领域带来巨大帮助。
参考文献:
[1] 贺学礼. 植物生物学[M]. 北京: 科学出版社, 2009: 257-258.
[2] RODRIGO M J, MARCOS J F, ALFEREZ F, et al. Characterization of pinalate, a novel Citrus sinensis mutant with a fruit-specific alteration that results in yellow pigmentation and decreased ABA content[J]. Journal of Experimental Botany, 2003, 54(383): 727-738. DOI:10.1093/jxb/erg083.
[3] ZHANG M, LENG P, ZHANG G L, et al. Cloning and functioning analysis of 9-cis-epoxycarotenoid dioxygenase (NCED) genes encoding a key enzyme during abscisic acid biosynthesis from peach and grape fruits[J]. Journal of Plant Physiology, 2009, 166(12): 1241-1252. DOI:10.1016/j.jplph.2009.01.013.
[4] ZHANG M, YUAN B, LENG P. The role of ABA in triggering ethylene biosynthesis and ripening of tomato fruit[J]. Journal of Experimental Botany, 2009, 60(6): 1579-1588. DOI:10.1093/jxb/erp026.
[5] YAMAGUCHI-SHINOZAKI K, SHINOZAKI K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J]. Annual Review of Plant Biology, 2006, 57: 781-803. DOI:10.1146/annurev.arplant.57.032905.105444.
[6] JIA H F, CHAI Y M, LI C L, et al. Abscisic acid plays an important role in the regulation of strawberry fruit ripening[J]. Plant Physiology, 2011, 157(1): 188-199. DOI:10.1104/pp.111.177311.
[7] RODRIGO M J, ALQUEZAR B, ZACARÍAS L. Cloning and characterization of two 9-cis-epoxycarotenoid dioxygenase genes, differentially regulated during fruit maturation and under stress conditions, from orange (Citrus sinensis L. Osbeck)[J]. Journal of Experimental Botany, 2006, 57(3): 633-643. DOI:10.1093/jxb/erj048.
[8] LI C L, JIA H F, CHAI Y M, et al. Abscisic acid perception and signaling transduction in strawberry: a model for non-climacteric fruit ripening[J]. Plant Signaling & Behavior, 2011, 6(12): 1950-1953. DOI:10.4161/psb.6.12.18024.
[9] KARPPINEN K, HIRVELÄ E, NEVALA T, et al. Changes in the abscisic acid levels and related gene expression during fruit development and ripening in bilberry (Vaccinium myrtillus L.)[J]. Phytochemistry, 2013, 95(6): 127-134. DOI:10.1016/j.phytochem.2013.06.023.
[10] MILBORROW B V. The pathway of biosynthesis of abscisic acid in vascular plants: a review of the present state of knowledge of ABA biosynthesis[J]. Journal of Experimental Botany, 2001, 52(359): 1145-1164. DOI:10.1093/jexbot/52.359.1145.
[11] BARTLEY G E, SCOLNIK P A, GIULIANO G. Mo lecular biology of carotenoid biosynthesis in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1994, 45: 287-301. DOI:10.1146/annurev.pp.45.060194.001443.
[12] TAYLOR I B, BURBIDGE A, THOMPSON A J. Control of abscisic acid synthesis[J]. Journal of Experimental Botany, 2000, 51(350): 1563-1574. DOI:10.1093/jexbot/51.350.1563.
[13] YOSHIOKA T, ENDO T, SATOH S. Restoration of seed germination at supraoptimal temperatures by fluridone, an inhibitor of abscisic acid biosynthesis[J]. Plant Cell Physiology, 1998, 39(3): 307-312. DOI:10.1093/oxfordjournals.pcp.a029371.
[14] TAN B C, SCHWARTZ S H, ZEEVAART J A D, et al. Genetic control of abscisic acid biosynthesis in maize[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(22): 12235-12240.
[15] IUCHI S, KOBAYASHI M, TAJI T, et al. Regulation of drought tolerance by gene manipulation of 9-cis-epoxycarotenoid dioxygenase, a key enzyme in abscisic acid biosynthesis in Arabidopsis[J]. The Plant Journal, 2001, 27(4): 325-333. DOI:10.1046/j.1365-313x.2001.01096.x.
[16] 惠伯棣, 文镜, 裴凌鹏. 类胡萝卜素化学及生物化学[M]. 北京: 中国轻工业出版社, 2005: 41-45.
[17] SCHWARTZ S H, QIN X Q, ZEEVAART J A D. Elucidation of the indirect pathway of abscisic acid biosynthesis by mutants, genes, and enzymes[J]. Plant Physiology, 2003, 131(4): 1591-1601. DOI:10.1104/ pp.102.017921.
[18] MARIN E, NUSSAUME L, QUESADA A, et al. Molecular identifi cation of zeaxanthin epoxidase of Nicotiana plumbaginifolia, a gene involved in abscisic acid biosynthesis and corresponding to the ABA locus of Arabidopsis thaliana[J]. The European Molecular Biology Organization Journal, 1996, 15(10): 2331-2342.
[19] AUDRAN C, BOREL C, FREY A, et al. Expression studies of the zeaxanthin epoxidase gene in Nicotiana plumbaginifolia[J]. Plant Physiology, 1998, 118(3): 1021-1028. DOI:10.1104/pp.118.3.1021.
[20] NORTH H M, de ALMEIDA A, BOUTIN J P, et al. The Arabidopsis ABA-deficient mutant aba4 demonstrates that the major route for stress-induced ABA accumulation is via neoxanthin isomers[J]. The Plant Journal, 2007, 50(5): 810-824. DOI:10.1111/j.1365-313X.2007.03094.x.
[21] TAN B C, JOSEPH L M, DENG W T, et al. Molecular characterization of the Arabidopsis 9-cis-epoxycarotenoid dioxygenase gene family[J]. The Plant Journal, 2003, 35(1): 44-56. DOI:10.1046/j.1365-313X.2003.01786.x.
[22] ZHU G H, YE N H, ZHANG J H. Glucose-induced delay of seed germination in rice is mediated by the suppression of ABA catabolism rather than an enhancement of ABA biosynthesis[J]. Plant and Cell Physiology, 2009, 50(3): 644-651. DOI:10.1093/pcp/pcp022.
[23] CHERNYS J T, ZEEVAART J A. Characterization of the 9-cisepoxycarotenoid dioxygenase gene family and the regulation of abscisic acid biosynthesis in avocado[J]. Plant Physiology, 2000, 124(1): 343-354. DOI:10.1104/pp.124.1.343.
[24] CHENG W H, ENDO A, ZHOU L, et al. A unique short-chain dehydrogenase/reductase in Arabidopsis glucose signaling and abscisic acid biosynthesis and functions[J]. The Plant Cell, 2002, 14(11): 2723-2743. DOI:10.1105/tpc.006494.
[25] SEO M, PEETERS A J M, KOIWAI H, et al. The Arabidopsis aldehyde oxidase 3(AAO3) gene product catalyzes the final step in abscisic acid biosynthesis in leaves[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(23): 12908-12913. DOI:10.1073/pnas.220426197.
[26] RASMUSSEN R D, HOLE D, HESS J R, et al. Wheat kernel dormancy and (+)-abscisic acid level following exposure to fluridone[J]. Journal of Plant Physiology, 1997, 150(4): 440-445. DOI:10.1016/S0176-1617(97)80095-8.
[27] 李玲, 潘瑞炽. 植物生长延缓剂和内源ABA的关系[J]. 植物学通报, 1988, 5(4): 199-204.
[28] GIOVANNONI J. Molecular biology of fruit maturation and ripening[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52: 725-749. DOI:10.1146/annurev.arplant.52.1.725.
[29] 刘廷旭. ABA对桃果实成熟软化及乙烯释放信号转导组分的影响[D].杨凌: 西北农林科技大学, 2012: 14-23.
[30] ADATO I, GAZIT S, BLUMENFELD A. Relationship between changes in abscisic acid and ethylene production during ripening of avocado fruits[J]. Australian Journal of Plant Physiology, 1976, 3(4): 555-558. DOI:10.1071/PP9760555.
[31] SHENG J P, RUAN Y, LIU K L, et al. Spatiotemporal relationships between abscisic acid and ethylene biosynthesis during tomato fruit ripening[J]. Acta Horticulture, 2008, 774(9): 59-65. DOI:10.17660/ ActaHortic.2008.774.6.
[32] LOHANI S, TRIVEDI P K, NATH P. Changes in activities of cell wall hydrolyses during ethylene-induced ripening in banana: effect of 1-MCP, ABA and IAA[J]. Postharvest Biology and Technology, 2004, 31(2): 119-126. DOI:10.1016/j.postharvbio.2003.08.001.
[33] BUESA C, DOMINGUEZ M, VENDRELL M. Abscisic acid effects on ethylene production and respiration rate in detached apple fruits at different stages of development[J]. Revista Espanola de Cienciay Tecnologia de Alimentos, 1994, 34(5): 495-506.
[34] ZAHARAH S S, SINGH Z, SYMONS G M, et al. Role of brassinosteroids, ethylene, abscisic acid, and indole-3-acetic acid in mango fruit ripening[J]. Journal of Plant Growth Regulation, 2012, 31(3): 363-372. DOI:10.1007/s00344-011-9245-5.
[35] ZAHARAH S S, SINGH Z, SYMONS G M, et al. Mode of action of abscisic acid in triggering ethylene biosynthesis and softening during ripening in mango fruit[J]. Postharvest Biology and Technology, 2013, 75: 37-44. DOI:10.1016/j.postharvbio.2012.07.009.
[36] 王延书. 葡萄果实着色前后ABA代谢合成关键酶的基因表达分析[D].泰安: 山东农业大学, 2011: 55-57.
[37] KOJIMA K. Distribution and change of endogenous IAA and ABA in asparagus spear and orange fruit[J]. Chemical Regulation of Plants, 1996, 31: 68-71.
[38] JIANG Y M, JOYCE D C. ABA effects on ethylene production, PAL activity, anthocyanin and phenolic contents of strawberry fruit[J]. Plant Growth Regulation, 2003, 39(2): 171-174. DOI:10.1023/ A:1022539901044.
[39] KONDO S, INOUE K. Abscisic acid (ABA) and 1-aminocyclopropane-1-carboxylic acid (ACC) content during growth of ‘Satohnishiki’cherry fruit, and the effect of ABA and ethylene application on fruit quality[J]. Journal of Horticultural Science, 1997, 72(2): 221-227.
[40] 任杰, 冷平. ABA和乙烯与甜樱桃果实成熟的关系[J]. 园艺学报, 2010, 37(2): 199-206.
[41] 李红卫, 冯双庆. A B A和乙烯对冬枣果实成熟衰老的调控[J]. 食品科学, 2003, 24(2): 147-150. DOI:10.3321/ j.issn:1002-6630.2003.02.040.
[42] 李红卫, 尹秀华, 冯双庆, 等. 外源ABA和乙烯利对冬枣果实采后呼吸强度、乙烯生成量及品质变化的影响[J]. 中国食品学报, 2004, 4(2): 74-77. DOI:10.3969/j.issn.1009-7848.2004.02.016.
[43] WHEELER S, LOVEYS B, FORD C, et al. The relationship between the expression of abscisic acid biosynthesis genes, accumulation of abscisic acid and the promotion of Vitis vinifera L. berry ripening by abscisic acid[J]. Australian Journal of Grape and Wine Research, 2009, 15(3): 195-204. DOI:10.1111/j.1755-0238.2008.00045.x.
[44] CANTÍN C M, FIDELIBUS M W, CRISOSTO C H. Application of abscisic acid (ABA) at veraison advanced red colour development and maintained postharvest quality of ‘Crimson Seedless’ grapes[J]. Postharvest Biology and Technology, 2007, 46(3): 237-241. DOI:10.1016/j.postharvbio.2007.05.017.
[45] SANDHU A K, GRAY D J, LU J, et al. Effects of exogenous abscisic acid on antioxidant capacities, anthocyanins, and fl avonol contents of muscadine grape (Vitis rotundifolia) skins[J]. Food Chemistry, 2011, 126(3): 982-988. DOI:10.1016/j.foodchem.2010.11.105.
[46] 栾丽英, 张振文, 惠竹梅, 等. 脱落酸处理对赤霞珠和烟73葡萄果皮花色苷组分的影响[J]. 食品科学, 2014, 35(18): 110-114. DOI:10.7506/spkx1002-6630-201418022.
[47] LACAMPAGNE S, GAGNÉ S, GÉNY L. Involvement of abscisic acid in controlling the proanthocyanidin biosynthesis pathway in grape skin: new elements regarding the regulation of tannin composition and leucoanthocyanidin reductase (LAR) and anthocyanidin reductase (ANR) activities and expression[J]. Journal of Plant Growth Regulation, 2010, 29(1): 81-90. DOI:10.1007/s00344-009-9115-6.
[48] GIRIBALDI M, GÉNY L, DELROT S, et al. Proteomic analysis of the effects of ABA treatments on ripening Vitis vinifera berries[J]. Journal of Experimental Botany, 2010, 61(9): 2447-2458. DOI:10.1093/jxb/erq079.
[49] WANG Y P, WANG Y, JI K, et al. The role of abscisic acid in regulating cucumber fruit development and ripening and its transcriptional regulation[J]. Plant Physiology and Biochemistry, 2013, 64(5): 70-79. DOI:10.1016/j.plaphy.2012.12.015.
[50] SUN Y F, CHEN P, DUAN C R, et al. Transcriptional regulation of genes encoding key enzymes of abscisic acid metabolism during melon (Cucumis melo L.) fruit development and ripening[J]. Journal of Plant Growth Regulation, 2013, 32(2): 233-244. DOI:10.1007/s00344-012-9293-5.
[51] SUN L, SUN Y F, ZHANG M, et al. Suppression of 9-cisepoxycarotenoid dioxygenase, which encodes a key enzyme in abscisic acid biosynthesis, alters fruit texture in transgenic tomato[J]. Plant Physiology, 2012, 158(1): 283-298. DOI:10.1104/pp.111.186866.
[52] SOTO A, RUIZ K B, RAVAGLIA D, et al. ABA may promote or delay peach fruit ripening through modulation of ripening- and hormonerelated gene expression depending on the developmental stage[J]. Plant Physiology and Biochemistry, 2013, 64(5): 11-24. DOI:10.1016/ j.plaphy.2012.12.011.
[53] KONDO S, SUNGCOME K, SETHA S, et al. ABA catabolism during development and storage in mangoes: infl uence of jasmonates[J]. Journal of Horticultural Science & Biotechnology, 2004, 79(6): 891-896.
[54] MA Y, SZOSTKIEWICZ I, KORTE A, et al. Regulators of PP2C phosphatase activity function as abscisic acid sensors[J]. Science, 2009, 324: 1064-1067. DOI:10.1126/science.1172408.
[55] PARK S Y, FUNG P, NISHIMURA N, et al. Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins[J]. Science, 2009, 324: 1068-1071. DOI:10.1126/ science.1173041.
[56] SHEN Y Y, ROSE J K C. ABA metabolism and signaling in fleshy fruits[M]//ZHANG D P. Abscisic acid: metabolism, transport and signaling. Berlin: Springer Netherlands, 2014: 271-286. DOI:10.1007/978-94-017-9424-4_14.
[57] LENG P, YUAN B, GUO Y D. The role of abscisic acid in fruit ripening and responses to abiotic stress[J]. Journal of Experimental Botany, 2014, 65(16): 4577-4588. DOI:10.1093/jxb/eru204.
Advances in Biosynthesis of Abscisic Acid and Its Roles in Regulation of Fruit Ripening
YANG Fangwei, DUAN Yifei, FENG Xuqiao*
(National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, Food Safety Key Laboratory of Liaoning Province, College of Food Science and Engineering, Bohai University, Jinzhou 121013, China)
Abstract:As an important plant hormone, abscisic acid (ABA) plays a series of significant physiological roles in higher plants including but not limited to bud dormancy, leaf fall, stoma closure, growth inhibition and plant resistance. Recently, it has been revealed that ABA also has an important regulatory role in the growth, development and ripening of fruits. In higher plants, the sesquiterpenoid ABA is produced via an indirect pathway from the cleavage products of C
40carotenoids. The accumulation of endogenous ABA levels in plants is a dynamic balance controlled by the processes of biosynthesis and catabolism, through transcriptional regulation of key ABA biosynthetic genes and enzymes activities. Levels of endogenous ABA gradually increase during the late stage of fruit development, and fruit ripening and softening are promoted by ABA accumulation. It has been hypothesized that the ABA level could be part of the signal that triggers fruit ripening, and that ABA biosynthesis and accumulation may play an important role in the regulation of ripening and senescence of both non-climacteric and climacteric fruits. These findings have demonstrated that ABA has varieties of important roles in the regulation of growth and development, quality formation, coloring and softening, ripening and senescence of fruits, which has great realistic significance in food science and postharvest biology of horticultural products. In this review, we summarize recent progress in the study of the role of ABA in fruit ripening and transcriptional regulation. In addition, we prospecte possible commercial applications of ABA signal regulation to improve fruit quality and shelf life.
Key words:abscisic acid (ABA); biosynthesis; fruit; ripening; regulation
DOI:10.7506/spkx1002-6630-201603046
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2016)03-0266-07
引文格式:
杨方威, 段懿菲, 冯叙桥. 脱落酸的生物合成及对水果成熟的调控研究进展[J]. 食品科学, 2016, 37(3): 266-272. DOI:10.7506/spkx1002-6630-201603046. http://www.spkx.net.cn
YANG Fangwei, DUAN Yifei, FENG Xuqiao. Advances in biosynthesis of abscisic acid and its roles in regulation of fruit ripening[J]. Food Science, 2016, 37(3): 266-272. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603046. http://www.spkx.net.cn
收稿日期:2015-05-03
基金项目:辽宁省农业科技攻关项目(2011205001);渤海大学人才引进基金项目(BHU20120301)
作者简介:杨方威(1989—),男,硕士研究生,研究方向为水果成熟分子机制与园艺产品采后生物学。E-mail:henan2009yfw@163.com
*通信作者:冯叙桥(1961—),男,教授,博士,研究方向为农产品贮藏加工与食品质量安全控制。E-mail:feng_xq@hotmail.com

