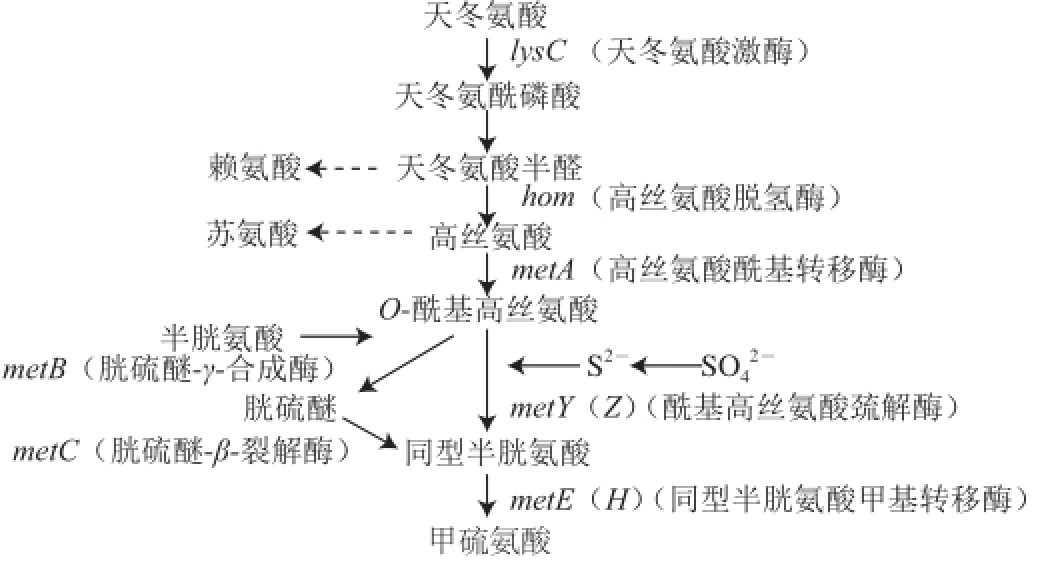
图1 细菌中甲硫氨酸合成途径
[1]
Fig.1 Biosynthetic pathway of methionine in bacteria
[1]
王隆洋,闵伟红*
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
摘 要:甲硫氨酸广泛应用于饲料、食品、医药等诸多领域,其市场需求量逐年增长。现行的化学合成甲硫氨酸产物为外消旋混合物,且对环境污染严重,与生物技术生产甲硫氨酸相比,不具备可持续性。生物技术生产甲硫氨酸可分为微生物发酵法和酶法。科研人员一直尝试阐明甲硫氨酸生物合成途径并进行高产菌株的选育,但由于其合成途径复杂,尚未获得适用于工业生产的菌株。对于现有菌株,深入研究甲硫氨酸生物合成途径、扩大甲硫氨酸向胞外的输出量、对发酵培养基组分及工艺条件进行优化都是有效提高甲硫氨酸产量的途径。酶法生产甲硫氨酸可分为异构体拆分和化合物酶解,其中利用微生物酶实现D型向L型的转化更有助于增加L-甲硫氨酸得率;最新的化合物酶解法结合了基因工程及酶的固定化技术,在实际生产中也具有巨大潜力。本文总结了国内外甲硫氨酸生产近况,重点论述了微生物发酵法、酶法及二者相结合生产甲硫氨酸的最新研究进展,并针对甲硫氨酸的发酵生产特点,提出变构抑制的解除、复合硫源的应用及关键酶的稳定性三方面的问题及建议。鼓励将酶法与发酵法相结合,并提倡通过酶解植物蛋白获得甲硫氨酸的研究,以实现低成本、低污染、高产量、高纯度的甲硫氨酸生产。
关键词:甲硫氨酸;生物技术;微生物发酵;酶法生产;异构体拆分;化合物酶解
甲硫氨酸(methionine),又名蛋氨酸,是唯一含硫的非极性α-氨基酸,1922年由Mueller首次从酪蛋白中分离出来,被认为是α-氨基-N-丁酸的γ-甲硫基衍生物,是一种重要的必需氨基酸,与苏氨酸、赖氨酸等同属于天冬氨酸家族 [1]。
甲硫氨酸在坚果、肉类及部分植物中大量存在,而在动物和人体内却不能自行合成。其对动物营养的重要作用及缺乏而产生的不良后果已经被证实,如导致家禽蛋壳硬度下降及奶牛产奶品质降低 [2];人类毒血症、肌肉麻痹、精神分裂及发育不良等 [3]。因此,其作为一种饲料、食品和保健品的重要添加成分,有着广阔的市场前景。
甲硫氨酸有D型和L型两种存在形式,均具有生物活性 [4],但部分人群对D-甲硫氨酸有过敏反应,因此L-甲硫氨酸成为较理想的含硫氨基酸资源 [5],可安全地应用于电解质平衡,肠外营养和药用辅料等治疗多种疾病。医药领域对高纯度的L-甲硫氨酸需求量亦十分可观。
在生物技术的发展中,甲硫氨酸不仅被用作蛋白质合成的底物,也是诸多活性物质S-腺苷甲硫氨酸、肉毒碱、牛磺酸、卵磷脂、磷脂酰胆碱和其他磷脂生物合成的中间体 [6]。如S-腺苷甲硫氨酸可作为甲基供体及细胞内小分子活性物质参与细胞反应 [7]。近年来,随着对S-腺苷甲硫氨酸的研究不断深入 [8-11],其前体甲硫氨酸在分子生物学中也具有重要的地位和研究价值。
甲硫氨酸生产与其他氨基酸存在本质差别。目前市场上其他氨基酸均可通过微生物发酵生产,产量可达到理论值的25%~75%,而甲硫氨酸的实际发酵产量不及其理论值的10% [12]。因此,全球甲硫氨酸生产多采用化学合成法,主要有丙二酸酯法、固-液相转移催化法、氨基内酯法和丙烯醛法等,其产物为D型和L型外消旋混合物。其中丙烯醛法因原材料较廉价、工艺路线简单、能耗低、收率高,被几大主要跨国公司采用。但该生产过程需要丙烯醛、氨水和氰化物等危险化学品,其废液严重污染环境。2015年,San ders等 [6]对甲硫氨酸石化生产路线与生物质合成路线进行比较,证明了生物合成的可持续性。多年来,科学工作者一直探索利用微生物发酵法生产甲硫氨酸,由于其合成途径调控过于复杂 [13],目前还没有适用于甲硫氨酸的工业生产菌株。
甲硫氨酸是继谷氨酸之后产量第二大的氨基酸,2011年,针对动物饲料的甲硫氨酸市场年销售额约28.5 亿美元,销量85 万t,年增长率5%。据不完全统计,2014年全球甲硫氨酸需求量约100 万t,呈逐年增长趋势。目前甲硫氨酸三大主要生产商为赢创(原德固赛)公司、安迪苏(原普朗克)公司和日本曹达(原孟山都)公司 [6]。
2006年,中国蓝星有限公司收购安迪苏子公司,并于2010年在江苏南京开始建厂,将最初年产能7 万t的计划翻倍至14 万t。该厂的建成投产将结束中国重要动物饲料添加剂完全依赖进口的局势。赢创公司2011年12月决议,在新加坡建立产能15万t的甲硫氨酸加工厂,将在2014年第三季度投入生产。韩国杰希公司和法国阿科玛公司于2012年宣布将在东南亚建立产能8 万t的甲硫氨酸加工厂,该厂将采用全新的发酵-化学法联合生产线。德国巴斯夫公司虽然于2007年申请了发酵生产甲硫氨酸的专利,但至今仍不适用于商业生产。法国迈陀保利克公司和罗盖特公司合作致力于L-甲硫氨酸发酵产品的研发 [6]。
1.1 微生物发酵路线的相关研究
1.1.1 甲硫氨酸生物合成途径的研究
为构建甲硫氨酸生产菌,首先需要了解甲硫氨酸的生物合成途径,其中最基本的氨基酸生产菌——大肠杆菌(Escherichia coli)和谷氨酸棒杆菌(Corynebacterium glutamicum)成为研究者关注的焦点。
细菌中甲硫氨酸合成途径以天冬氨酸为起点,经天冬氨酸激酶(aspartokinase,AK)和高丝氨酸脱氢酶(homoserine dehydrogenase,HSD)两个限速酶催化,生成高丝氨酸,进而分别合成苏氨酸和甲硫氨酸。甲硫氨酸合成存在两个途径:巯基转移途径以胱硫醚为中间体,以半胱氨酸为硫源,而直接巯基化途径则可利用无机硫源。大肠杆菌只通过巯基转移途径合成甲硫氨酸,谷氨酸棒杆菌可同时利用两个途径(图1)。

图1 细菌中甲硫氨酸合成途径
[1]
Fig.1 Biosynthetic pathway of methionine in bacteria
[1]
2002年Hwang等 [14]在谷氨酸棒杆菌中发现了甲硫氨酸生物合成的直接巯基化途径,并对metY或metB进行突变,比较突变株生长参数。两种酶在序列上存在相似性,但微生物优先选择巯基转移途径。因此它们在进化上可能来自同一种酶,而MetY是长期进化过程中突变和自然选择的结果,存在受甲硫氨酸反馈抑制、与底物亲和性低的缺陷。2007年,该课题组 [15]对MetB和MetY进行纯化,比较了二者的生化参数。发现MetB和MetY对O-乙酰高丝氨酸催化作用的K m值分别为3.9 mmol/L和6.4 mmol/L,与之前的推测吻合。同时,MetY对硫化物离子的K m也过高,证明其与硫化物离子的结合也很微弱,温度和pH值耐受性也较MetB差。至此,MetY存在的生理意义和利用价值尚不明晰。
2006年,Krömer等 [16]在对大肠杆菌和谷氨酸棒杆菌甲硫氨酸代谢途径进行计算机模拟分析时发现,以甲硫醇为硫源时,还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)的消耗减少,可使甲硫氨酸理论产量得到提高。以甲硫醇或其二聚体二甲基二硫为硫源的原理是将其—S—CH 3基团完整地插入甲硫氨酸的R基而直接生成甲硫氨酸。这一理论在2010年被Bolten等 [4]证实,并通过基因敲除和 14C同位素示踪实验证明,催化这一反应的酶正是MetY。至此,MetY这一独特功能为该领域的研究提供了全新的线索。
1.1.2 甲硫氨酸生产菌株选育的研究
除发酵常用的谷氨酸棒杆菌和大肠杆菌之外,枯草芽孢杆菌(Bacillus subtilis)、百合棒杆菌(Corynebacterium lilium)也常用作改造的出发菌株。2012年,Dike等 [3]从不同土样中筛选出3 株蜡样芽孢杆菌(Bacillus cereus)RS-16、DS-13和AS-9,其中最优菌株RS-16经96 h发酵产甲硫氨酸1.84 mg/mL。但野生型菌株氨基酸的生物合成受到严格的代谢调控,一般不能满足大量生产氨基酸的需要。因此,需要人为打破微生物对甲硫氨酸生物合成的代谢调节。
筛选抗结构类似物菌株和营养缺陷型菌株是最常用的育种方法。2003年,Kumar等 [17]采用紫外和亚硝基胍诱变技术处理百合属棒杆菌,筛选获得M-128菌株,其甲硫氨酸产量为2.3 g/L;2009年,闵伟红等 [18]通过抗结构类似物的筛选获得北京棒杆菌(Corynebacterium pekinense)突变株E31,其甲硫氨酸产量达1.479 g/L。2011年,该课题组程丽 [19]以E31为出发菌株,采用复合诱变和青霉素浓缩法筛选获得12 株赖氨酸和苏氨酸双重营养缺陷型突变株,其中突变株GE37的甲硫氨酸产量达3.55 g/L。这些传统的改造方法机理难以阐明,工作量大,但突变全面、有效。随着基因技术的发展,2007年,Park等 [1]解除了苏氨酸对HSD的反馈抑制,同时敲除了thrB基因,阻止苏氨酸合成。分批发酵过程中甲硫氨酸产量达2.9 g/L。2011年,Chen Zhen等 [20]利用分子动力学模拟与统计耦合分析相结合鉴别出30 个关键氨基酸残基,并证明这些残基的突变可在不同程度上解除大肠杆菌AKⅢ的反馈抑制。至此,对于两大 限速酶的研究逐渐趋于半理性,能在代谢和进化水平上做出合理的解释,改造目标更明确。
在菌种选育过程中,一些新发现也给研究人员以启示。2005年,Mampel等 [21]对谷氨酸棒杆菌进行转座子诱变,得到7 000 个具有乙硫氨酸抗性的突变株,转座子插入位点为开放阅读框(open r eading frame,ORF)NCgl2640,NCgl2640失活会导致甲硫氨酸产量增加,证明该位点与L-甲硫氨酸合成途径中某种抑制的解除密切相关。其结构和具体功能有待科研工作者深入研究。2010年,Bolten等 [4]发现了MetY的独特功能后,试图对MetY进行过表达以增加甲硫氨酸产量,结果MetY酶活力提高了近30 倍,但发酵液中并无甲硫氨酸,胞内甲硫氨酸产量也只提高了2 倍。胞内组分分析发现其底物O-乙酰高丝氨酸已完全耗尽。这说明半理性的单基因修饰难以保证整个代谢网络的平衡,以途径中各代谢物和酶的功能性质及代谢流分布信息为基础,更加理性化的多基因修饰成为下一阶段的研究目标。2000年Biran等 [22]发现大肠杆菌中MetA极易被4 种依赖ATP催化的蛋白酶水解,且该基因受热转录休克调控。2013年,Rotem等 [23]对根癌土壤杆菌中MetA进行表征时发现了相同的不稳定性和极端不耐热特性。这极有可能也是赖氨酸和苏氨酸易发酵生产,在同一途径下游的甲硫氨酸却一直难以实现发酵生产的重要原因。
1.1.3 甲硫氨酸向胞外输出的研究
发酵法生产甲硫氨酸在合成水平上不易达到增产目标,即便细胞质内甲硫氨酸产量得到提高,释放至培养液中的量却极少。总结有以下两方面原因:1)微生物自身调控严格,为趋利避害,甲硫氨酸在自然条件下不会过量积累,即使经改造的菌株,甲硫氨酸的产量与微生物细胞适应性之间的平衡也难把握。2)即使细胞质内甲硫氨酸过量积累,但其输出体系不完善,产物被微生物自身再利用或直接伤害细胞。2005年,Trötschel等 [24]在已经提高了胞内甲硫氨酸浓度的条件下,利用DNA微阵列技术识别出过量表达的膜蛋白基因brnF(编码BrnFE中较大的亚基),之前研究表明其与异亮氨酸输出体系有关。当BrnFE的合成被氯霉素关闭时,仍能观察到大量甲硫氨酸输出,只有极大提高氯霉素水平,其输出才会减弱。这说明甲 硫氨酸输出体系不止一个,还存在不易被识别、但输出能力高的其他体系。发掘并扩增输出通道既可增加发酵液中甲硫氨酸产量,又能避免代谢物积累对微生物的损伤。
1.1.4 发酵条件的研究
对于甲硫氨酸发酵,最特殊的培养基成分即硫和甲基。以谷氨酸棒杆菌为例,2006年,Krömer等 [16]用计算机模拟了不同硫源在甲硫氨酸合成途径中的应用。以硫酸盐为硫源通过直接巯基化途径生成1 mol甲硫氨酸消耗8 mol NADPH,巯基转移途径消耗9 mol NADPH,而以硫代硫酸盐为硫源,整个代谢过程只需要5.5 mol NADPH,以硫化物为硫源,NADPH消耗量仅为硫酸盐的一半。但磷酸戊糖途径(pentose phosphate pathway,PPP)和三羧酸(tricarboxylic acid,TCA)循环所能提供的NADPH是固定的,因此不同硫源的利用效率有待在实践中考证。硫与甲基来源的结合可以考虑比较硫代硫酸盐与甲酸盐、硫化物与甲酸盐及甲硫醇的利用情况。除了这两种关键组分,2014年,Anakwenze等 [25]从发酵的油豆种子中分离出甲硫氨酸产量为1.89 mg/mL的赤云金芽孢杆菌(Bacillus thuringiensis)EC1,对发酵总体积、接种量、碳源及氮源浓度、促生长物质均进行探索优化,最终赤云金芽孢杆菌EC1甲硫氨酸的产量可以达到3.18 mg/mL。
对于发酵工艺的探索一直是实际生产中的关键。Sharma等 [26]研究了百合棒杆菌产甲硫氨酸中稀释速率与溶解氧对甲硫氨酸产量的影响。最终确定当稀释速率为0.16 h -1、溶氧为42%时,甲硫氨酸生产速率最大值为160 mg/(L·h)。2012年,贾翠英等 [27]研究了不同破壁方法对细菌甲硫氨酸产量的影响。结果表明,经碱破壁、溶菌酶破壁、超声波破壁、碱与超声波复合破壁、溶菌酶与超声波复合破壁后,甲硫氨酸产量分别提高10.9%、12%、18.3%、19.6%、22.2%。这种工艺可以将胞内甲硫氨酸释放出来,增加收率,复合破壁比单一破壁效果更显著。
1.2 酶法生产路线的相关研究
1.2.1 外消旋混合物拆分生产甲硫氨酸
酶法拆分又分为两种思路,传统的拆分是消除外消旋混合物中的D-甲硫氨酸,另一种路线将D型转化为L型,纯化的同时也增加了产量无疑是更理想的选择。2007年,Findrik等 [28]利用原玻璃蝇节杆菌(Arthrobacter protophormiae)中D-氨基酸氧化酶、过氧化氢酶、红球菌(Rhodococcus)中L-苯丙氨酸脱氢酶、博伊丁假丝酵母(Candida boidinii)中甲酸脱氢酶串联实现D-甲硫氨酸向L-甲硫氨酸的完全转化(图2)。更有意义的是,D-氨基酸氧化酶和L-苯丙氨酸脱氢酶可以作用于不同的底物,因此,该体系也适用于其他D型氨基酸及某种氨基酸外消旋体向L型的转化合成。

图2 4 种酶串联进行D-甲硫氨酸向L-甲硫氨酸转化
Fig.2 Biotransformation of D-methionine into L-methionine in the cascade of four enzymes
1.2.2 化合物酶解生产甲硫氨酸
2014年,Jin Liqun等 [29]对大肠杆菌中经密码子优化的腈水解酶基因进行重新合成和表达,从而有效利用2-氨基-4-甲硫基丁腈水解生产甲硫氨酸。并在催化剂充足的情况下,以固定的底物/催化剂比值探索底物最佳浓度。该课题组也对在填充床反应器中利用固定化静息细胞生产甲硫氨酸进行了研究,结果显示固定化腈水解酶100 h后酶活力仍大于80%,甲硫氨酸总回收率达97%。该项研究表明,重组腈水解酶应用于甲硫氨酸生产具有巨大潜力,酶在微生物体内的过表达与酶的固定化技术相结合可能实现产量突破。
1.3 发酵与体外酶催化路线相结合
发酵法即以培养基组分为原料,利用微生物自身体内代谢反应,将低成本原料转化为高价值产品,是最经济环保的氨基酸生产方式。发酵法之所以至今无法应用于甲硫氨酸生产,关键在于其合成途径的每一步均受到严格地反馈抑制,经本课题组改造后的菌株GE37的甲硫氨酸发酵产量也仅为3.55 g/L [19]。因此发酵法生产甲硫氨酸仍处于科研阶段。体外酶催化反应目前并没有一套完整的独立生产体系,而是作为化学生产方法的辅助手段,2000年之前即用于DL-同型半胱氨酸向L-甲硫氨酸的合成及DL-甲硫氨酸的分离 [30]。近年的研究也多属于化学合成法的下游,目的是获得高纯度的L-甲硫氨酸。酶催化与发酵法相比,反应过程较短,反应体系及条 件易灵活操控。因此,发酵与体外酶催化路线相结合可以回避微生物的部分反馈抑制,缩短发酵过程以得到产量较大的中间体,进而以此为底物合成L-甲硫氨酸。
韩国杰希公司采用的发酵/化学法联合生产工艺即为两种路线结合的实例,并于2012年宣布在东南亚建立产量80 000 t的甲硫氨酸加工厂。该路线以葡萄糖为基质,利用微生物发酵法生产琥珀酰高丝氨酸,随后用酶将这一中间产物转化成甲硫氨酸和琥珀酸。如图3所示,经计算,这种全新的发酵/化学法联合工艺生产的L-甲硫氨酸成本略高于化学合成法 [6]。
图3 发酵/化学法联合生产工艺
Fig.3 Combined fermentative/chemical route for methionine production
2.1 发酵法生产面临的问题和建议
甲硫氨酸与其他氨基酸相比至今难以实现发酵法生产,综合上文所述,总结了以下三方面原因和建议。2.1.1 硫源的利用效率
甲硫氨酸与其他氨基酸最大的不同即对硫源的需求,而发酵法应用最普遍的硫源为硫酸盐,需消耗大量NADPH,但生物体能提供的NADPH有限;硫化物对NADPH需求量虽少,但因多有毒且稳定性差,不适用于培养基;硫代硫酸盐兼具氧化性与还原性,应该对其进行进一步选择和研究。甲硫醇作为硫和甲基的综合供体,可以缩短代谢途径并为最后一步提供更多甲基。因此,应该对硫代硫酸盐与甲硫醇或二甲基二硫的复合使用进行新的尝试。提高NADPH的供应量也是菌株改造的策略之一。
2.1.2 代谢途径调控的改造
硫和甲基的参与已经使代谢途径增长,而合成途径中涉及到诸多反馈抑制性酶,进一步削弱了代谢流。如何确定关键酶、发现酶的活性中心及抑制剂结合位点,并进一步识别关键残基成为一个艰巨的课题。通过半理性设计,本课题组已找出北京棒杆菌(Corynebacterium pekinense)天冬氨酸激酶与抑制剂结合位点有直接或间接作用的所有关键氨基酸残基,并通过突变解除反馈抑制得到高活力菌株。2013年,李慧颖等 [31]得到突变体R169H,酶活力较突变前提高2.3 倍;同年,郭永玲 [32]得到突变体T361N、A362I,酶活力分别提高47.99、34.60 倍;2014年,任军等 [33]得到突变体G277K,酶活力提高9.48 倍;同年,朱运明等 [34]得到突变体G377F,酶活力提高9.3 倍。此外,类似的单基因修饰研究缺少全面性和持续性,还应对改造前后的代谢流变化进行对比分析,尝试针对改造后的缺陷进行多基因修饰,继续对甲硫氨酸产量是否提高进行实验。
较成功的理性设计在甲硫氨酸同族氨基酸——赖氨酸生产中有成功的先例。2013年,Kind等 [35]根据TCA循环和赖氨酸合成途径相关知识,通过敲除∆sucCD在琥珀酰辅酶A合成酶水平上有目的性地阻断TCA循环,使其与赖氨酸合成途径相结合,增加目的产物合成途径代谢流,产量提高60%。由于理性设计需要大量全面准确的生物学信息,直接针对代谢流的整合在甲硫氨酸研究领域还需要尝试和突破。
2.1.3 关键酶在代谢过程中的稳定性
在大肠杆菌和根癌土壤杆菌中均证实了高丝氨酸酰基转移酶(homoserine transsuccinylase,HTS)的不稳定性,这可能也是赖氨酸和苏氨酸易发酵生产,而同一途径下游的甲硫氨酸却一直难以实现发酵生产的重要原因。其极端不耐热和易被蛋白酶分解这两大特性,是发酵法面临的难题。对Biran等 [22]发现的4 种可能分解HTS的蛋白酶进行修饰,或与嗜热菌关键基因整合都是菌株改造可以尝试的方向。
此外,甲硫氨酸向胞外输出的研究尚不成熟,可在菌株改造后,对胞内组分进行量化分析,以探索胞内甲硫氨酸产量最大时的条件,以及能分泌到胞外营养缺陷型菌种选育。
2.2 酶法生产面临的问题和建议
酶法合成一般不作为单独的生产路线,传统的酶法是与石化生产路线相结合,以石化生产废弃物为原料,进行化学合成后,对外消旋混合物进行拆分以得到高纯度的L-甲硫氨酸,其中Findrik等 [28]将D型转化为L型的实验是更具意义的研究。
韩国杰希公司首次采用发酵法与体外酶催化的联合生产工艺,先利用微生物发酵生产琥珀酰高丝氨酸,随后用酶法在微生物体外将这一中间产物转化成甲硫氨酸和琥珀酸。降低生产成本的同时减少污染。2010年,Bolten等 [4]对谷氨酸棒杆菌MetY进行过表达使酶活力大幅提高,但由于胞内底物耗尽,甲硫氨酸产量仍不理想。参考杰希公司,可尝试由发酵法获得大量O-乙酰高丝氨酸,并利用过表达的酶在体外催化甲硫醇与O-乙酰高丝氨酸生成甲硫氨酸。
目前,对酪氨酸、半胱氨酸和脯氨酸的生产,从蛋白中分离仍是最经济的方法。由于植物可以合成甲硫氨酸,因此通过酶解方法利用稻草等农作物的废弃物生产甲硫氨酸是最经济的模式。2015年,Sanders等 [6]对这种方法的成本进行了核算,证明了其具有一定可行性。但该法不适用于获得高纯度的L-甲硫氨酸,因为产物组成复杂,分离纯化难度大。
甲硫氨酸的生物技术生产与理论值之间的差距证明,此项研究具有广阔的进步空间,对微生物发酵、酶法分解等多方面的探索仍有待深入研究。随着现代生物技术的发展,利用生物技术生产甲硫氨酸仍将是科研工作者面临的重要课题。
参考文献:
[1] PARK S D, LEE J Y, SIM S Y, et al. Characteristics of methionine production by an engineered Corynebacterium glutamicum strain[J]. Metabolic Engineering, 2007, 9(4): 327-336. DOI:10.1016/ j.ymben.2007.05.001.
[2] NOFTSGER S, ST-PIERRE N R, SYLVESTER J T. Determination of rumen degradability and ruminal effects of three sources of methionine in lactating cows[J]. Journal of Dairy Science, 2005, 88(1): 223-237. DOI:10.3168/jds.S0022-0302(05)72680-1.
[3] DIKE K S, EKWEALOR I A. Production of L-methionine by Bacillus cereus isolated from different soil ecovars in Owerri, South East Nigeria[J]. European Journal of Experimental Biology, 2012, 2(2): 311-314.
[4] BOLTEN C J, DICKSCHAT J. Towards methionine overproduction in Corynebacterium glutamicum-methanethiol and dimethyldisulfide as reduced sulfur sources[J]. Journal of Microbiology and Biotechnology, 2010, 20(8): 1196-1203.
[5] SEKIZ S S, SCOTT M L, NESHEIM M C. The effect of methionine deficiency on body weight, food and energy utilization in the chick[J]. Poultry Science, 1975, 54(4): 1184-1188.
[6] SANDERS J P M, SHELDON R A. Comparison of the sustainability metrics of the petrochemical and biomass-based routes to methionine[J]. Catalysis Today, 2015, 239(1): 44-49. DOI:10.1016/ j.cattod.2014.08.003.
[7] SEKOWSKA A, KUNG H F, DANCHIN A. Sulfur metabolism in Escherichia coli and related bacteria: facts and fiction[J]. Journal of Molecular Microbiology and Biotechnology, 2000, 2(2): 145-177.
[8] DETCHANAMURTHY S, SHANMUGAM K, PARKUNAN S M A, et al. Cloning and expression of S-adenosyl methionine synthetase gene in recombinant E. coli strain for large scale production of SAMe[J]. Electronic Journal of Biotechnology, 2010, 13(4): 1-2.
[9] YU Ping, SHEN Xiaoqin. Enhancing the production of S-adenosyl-L-methionine in Pichia pastoris GS115 by metabolic engineering[J]. AMB Express, 2012, 2(1): 1-7. DOI:10.1186/2191-0855-2-57.
[10] CHU Ju, QIAN Jiangchao, ZHUANG Yingping, et al. Progress in the research of S-adenosyl-L-methionine production[J]. Applied Microbiology and Biotechnology, 2013, 97(1): 41-49. DOI:10.1007/ s00253-012-4536-8.
[11] YAO Gaofeng, QIN Xiulin, CHU Ju, et al. Expression, purification, and characterization of a recombinant methionine adenosyltransferase pDS16 in Pichia pastoris[J]. Applied Biochemistry and Biotechnology, 2014, 172(3): 1241-1253. DOI:10.1007/s12010-013-0594-3.
[12] BECKER J, WITTMANN C. Systems and synthetic metabolic engineering for amino acid production-the heartbeat of industrial strain development[J]. Current Opinion in Biotechnology, 2012, 23(5): 718-726. DOI:10.1016/j.copbio.2011.12.025.
[13] LEE H S, HWANG B J. Methionine biosynthesis and its regulation in Corynebacterium glutamicum: parallel pathways of transsulfuration and direct sulfhydrylation[J]. Applied Microbiology and Biotechnology, 2003, 62(5/6): 459-467. DOI:10.1007/s00253-003-1306-7.
[14] HWANG B J, YEOM H J, KIM Y, et al. Corynebacterium glutamicum utilizes both transsulfuration and direct sulfhydrylation pathways for methionine biosynthesis[J]. Journal of Bacteriology, 2002, 184(5): 1277-1286.
[15] HWANG B J, PARK S D, KIM Y, et al. Biochemical analysis on the parallel pathways of methionine biosynthesis in Corynebacterium glutamicum[J]. Journal of Microbiology and Biotechnology, 2007, 17(6): 1010-1017.
[16] KRÖMER J O, WITTMANN C, SCHRÖDER H, et al. Metabolic pathway analysis for rational design of L-methionine production by Escherichia coli and Corynebacterium glutamicum[J]. Metabolic Engineering, 2006, 8(4): 353-369. DOI:10.1016/j.ymben.2006.02.001.
[17] KUMAR D, GARG S, BISARIA V S, et al. Production of methionine by a multi-analogue resistant mutant of Corynebacterium lilium[J]. Process Biochemistry, 2003, 38(8): 1165-1171. DOI:10.1016/S0032-9592(02)00287-X.
[18] 闵伟红, 林小秋, 冯琦, 等. 抗蛋氨酸结构类似物突变株的筛选[J].吉林大学学报(理学版), 2009, 47(4): 840-845. DOI:10.3321/ j.issn:1671-5489.2009.04.039.
[19] 程丽. 双重营养缺陷型菌株筛选及其发酵产蛋氨酸的研究[D]. 长春: 吉林农业大学, 2011.
[20] CHEN Zhen, RAPPERT S, SUN Jibin, et al. Integrating molecular dynamics and co-evolutionary analysis for reliable target prediction and deregulation of the allosteric inhibition of aspartokinase for amino acid production[J]. Journal of Biotechnology, 2011, 154(4): 248-254. DOI:10.1016/j.jbiotec.2011.05.005.
[21] MAMPEL J, SCHRÖDER H, HAEFNER S, et al. Singlegene knockout of a novel regulatory element confers ethionine resistance and elevates methionine production in Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology, 2005, 68(2): 228-236.
[22] BIRAN D, GUR E, GOLLAN L, et al. Control of methionine biosynthesis in Escherichia coli by proteolysis[J]. Molecular Microbiology, 2000, 37(6): 1436-1443.
[23] ROTEM O, BIRAN D, RON E Z. Methionine biosynthesis in Agrobacterium tumefaciens: study of the first enzyme[J]. Research in Microbiology, 2013, 164(1): 12-16. DOI:10.1016/ j.resmic.2012.10.005.
[24] TRÖTSCHEL C, DEUTENBERG D, BATHE B, et al. Characterization of methionine export in Corynebacterium glutamicum[J]. Journal of Bacteriology, 2005, 187(11): 3786-3794.
[25] ANAKWENZE V N, EZEMBA C C, EKWEALOR I A. Optimization of fermentation conditions of Bacillus thuringiensis EC1 for enhanced methionine production[J]. Advances in Microbiology, 2014, 4(7): 344-352. DOI:10.4236/aim.2014.47041 .
[26] SHARMA S, GOMES J. Effect of dissolved oxygen on continuous production of methionine[J]. Engineering in Life Sciences, 2001, 1(2): 69-73.
[27] 贾翠英, 张玉辉, 魏娟. 不同破壁方法对细菌蛋氨酸产量的影响[J].食品工业科技, 2012, 33(9): 325-327.
[28] FINDRIK Z, VASIĆ-RAČKI Đ. Biotransformation of D-methionine into L-methionine in the cascade of four enzymes[J]. Biotechnology and Bioengineering, 2007, 98(5): 956-967.
[29] JIN Liqun, LI Zongtong, ZHENG Yuguo, et al. Efficient production of methionine from 2-amino-4-methylthiobutanenitrile by recombinant Escherichia coli harboring nitrilase[J]. Journal of Industrial Microbiology & Biotechnology, 2014, 41(10): 1479-1486. DOI:10.1007/s10295-014-1490-8.
[30] GOMES J, KUMAR D. Production of L-methionine by submerged fermentation: a review[J]. Enzyme and Microbial Technology, 2005, 37(1): 3-18. DOI:10.1016/j.enzmictec.2005.02.008.
[31] 李慧颖, 朱运明, 闵伟红, 等. 北京棒杆菌天冬氨酸激酶突变体R169H的构建及酶学性质表征[J]. 微生物学报, 2014, 54(6): 663-669. DOI:10.13343/j.cnki.wsxb.2014.06.009.
[32] 郭永玲. 北京棒杆菌天冬氨酸激酶的定点突变及突变株酶学性质表征[D]. 长春: 吉林农业大学, 2013.
[33] 任军, 闵伟红, 詹冬玲, 等. 天冬氨酸激酶突变体G277K中AK基因的克隆表达及酶学性质表征[J]. 食品科学, 2014, 35(11): 149-154. DOI:10.7506/spkx1002-6630-201411030.
[34] 朱运明, 王晓飞, 闵伟红, 等. 北京棒杆菌天冬氨酸激酶G377定点突变及酶学性质表征[J]. 食品科学, 2014, 35(9): 192-197. DOI:10.7506/spkx1002-6630-201409038.
[35] KIND S, BECKER J, WITTMANN C. Increased lysine production by flux coupling of the tricarboxylic acid cycle and the lysine biosynthetic pathway: metabolic engineering of the availability of succinyl-CoA in Corynebacterium glutamicum[J]. Metabolic Engineering, 2013, 15(1): 184-195. DOI:10.1016/j.ymben.2012.07.005.
Progress and Prospects for Methionine Bioproduction
WANG Longyang, MIN Weihong*
(National Engineering Laboratory on Wheat and Corn Further Processing, College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:Methionine is widely used in many fields such as feed, food, pharmaceutical and biotechnology, and has an increasing market demand. Compared with chemical synthesis, the biological production of methionine has many advantages especially in sustainable production and environmental protection. The biological methods used for methionine production include microbial fermentation and enzymatic treatment. Researchers have been trying to describe the biosynthetic pathway of methionine and breed high methionine-producing strains. However, no bacteria are now used in industrial production of met hionine because of the complex biosynthesis pathway of this amino acid and the affinity with other intracellular reaction systems. In-depth study of methionine biosynthesis pathway, expansion of methionine exporting system and optimization of fermentation conditions are effective to increase the yield of methionine produced by the existing strains. The stateof-the-art technology of enzymatic hydrolysis for the production of methionine, combining genetic engineering with enzyme immobilization, has great application potential. This article summarizes the latest advances in the biotechnologies for methionine production in China and abroad with emphasis on microbial fermentation, enzymatic treatment and their combination. According to the characteristics of methionine production by microbial fermentation, existing problems and corresponding suggestions with respect to the removal of allosteric inhibition, the application of composite sulfur source and the stability of key enzymes are put forward. The combination of enzymatic treatment and microbial fermentation is recommended to be used for the production of methionine from preferably hydrolyzed plant proteins, achieving the advantages of low cost, low pollution, high yield and high purity.
Key words:methionine; biotechnology; microbial fermentation; enzymatic processing; isomer resoultion; enzymatic hydrolysis
DOI:10.7506/spkx1002-6630-201603048
中图分类号:Q517
文献标志码:A
文章编号:1002-6630(2016)03-0280-06
引文格式:
王隆洋, 闵伟红. 利用生物技术生产甲硫氨酸的研究进展[J]. 食品科学, 2016, 37(3): 280-285. DOI:10.7506/spkx1002-6630-201603048. http://www.spkx.net.cn
WANG Longyang, MIN Weihong. Progress and prospects for methionine bioproduction[J]. Food Science, 2016, 37(3): 280-285. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603048. http://www.spkx.net.cn
收稿日期:2015-03-03
基金项目:吉林省自然科学基金项目(20130101139JC)
作者简介:王隆洋(1991—),女,硕士研究生,研究方向为发酵微生物的选育与代谢调控。E-mail:shuiranmo1991@163.com
*通信作者:闵伟红(1971—),女,教授,博士,研究方向为发酵工程、粮食科学与深加工技术。E-mail:minwh2000@163.com