杨丽霞,岳田利
*,袁亚宏,龙芳羽,王周利
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
摘 要:以失活酵母菌为吸附剂,对猕猴桃汁中植物生长调节剂(氯吡脲)进行吸附。在单因素试验基础上,利用Box-Behnken响应面法对影响猕猴桃汁中氯吡脲吸附的失活酵母菌添加量、氯吡脲初始质量浓度、吸附时间关键因素进行优化,分析吸附对猕猴桃汁品质的影响。结果表明,失活酵母菌吸附氯吡脲的最佳条件为:失活酵母菌添加量28 mg/mL、氯吡脲初始质量浓度0.2 μg/mL、吸附时间3 h。在此条件下,氯吡脲吸附率为97.02%,与预测结果相符。失活酵母菌吸附氯吡脲对猕猴桃汁品质没有显著影响(P>0.05)。
关键词:吸附;失活酵母;氯吡脲;响应面;猕猴桃汁
植物生长调节剂是用于调节植物生长发育的一类农药,包括人工合成的化合物和从生物中提取的天然植物激素 [1-2]。氯吡脲作为一种苯基脲类新型高效植物生长调节剂,有促进细胞分裂、扩大细胞体积等生理作用 [3]。同时是膨大剂的主要成分,广泛应用于猕猴桃、西瓜、黄瓜等多种果蔬生产中 [4-6]。目前,由于经济利益的驱使,部分生产者为了追求丰产,增加使用量,导致其残留增加,长期接触,可能会引起体内蛋白质代谢的紊乱,给人体带来潜在的健康危害。美国规定氯吡脲在猕猴桃果实中的最大残留限值为0.04 mg/kg [7],澳大利亚为0.01 mg/kg [8],我国为0.05 mg/kg。因此,对果蔬及其制品中氯吡脲进行检测和控制研究对于保障消费者饮食安全具有非常重要的作用。
对农药的去除主要包括物理吸附 [9]、化学吸附 [10]和生物降解 [11]。传统的物理、化学方法成本高、难度大,可能会带来二次污染,甚至把无毒或低毒物质变成有毒或毒性更大的物质,从而在很大程度上限制了化学方法在降解农药残留上的广泛应用。生物降解具有高效、彻底、无二次污染的优势,但其应用范围受到一定的局限性,主要应用于水污染和环境治理。近年来,生物吸附作为一种新型、有效处理难降解有机物的技术手段日益受到关注,在很多领域得到了广泛的应用 [12-18]。利用失活微生物进行有毒物质吸附成为研究的热点 [19-24]。越来越多的研究者认为失活微生物吸附剂不仅具有很好的吸附效果,而且潜在的生物危害小,使用更安全。因此,具有广泛的应用前景。尽管如此,现阶段还少有关于植物生长调节剂去除的研究;另外,失活酵母菌在农药残留分析方面的研究鲜有报道。失活酵母菌吸附氯吡脲之后,通过离心分离除去猕猴桃汁中的失活酵母菌粉。为此,本研究利用失活酵母菌吸附猕猴桃汁中氯吡脲,通过单因素和响应面试验优化氯吡脲的吸附条件,达到有效安全地去除猕猴桃汁中氯吡脲的目的。
1.1 材料与试剂
猕猴桃汁为自榨清汁,猕猴桃购自陕西杨陵夏家沟猕猴桃基地果园。
氯吡脲标品(纯度大于99%) 阿拉丁公司;HYJ-3号酵母菌 西北农林科技大学发酵动力学实验室。
酵母膏蛋白胨葡萄糖(yeast peptone dextrose,YPD)培养基组成:2%蛋白胨、1%酵母浸粉、2%葡萄糖。
1.2 仪器与设备
恒温培养箱、全自动灭菌锅、QYC-2102C全温摇床、DGX-9143BC型电热恒温鼓风干燥箱 上海福玛试验设备有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;MCFD冷冻干燥机、LC-2010AHT高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 酵母菌的培养
活化:将保存的菌种于YPD平板上进行划线,28 ℃培养24 h。
一级培养:将经过活化的酵母菌挑取两环接种到250 mL装有100 mL YPD培养基的三角瓶中进行培养,培养条件为:28 ℃、24 h、120 r/min。
二级培养:将一级培养得到的种子液以10%的接种量接种到250 mL装有150 mL YPD培养基的三角瓶中进行培养。培养条件:28 ℃、24 h、120 r/min。
1.3.2 失活酵母菌的制备
将1.3.1节中培养得到的酵母菌,4 ℃、3 600×g、 10 min离心获得菌泥,在121 ℃高压灭菌20 min,保证被处理的酵母细胞完全失活。用蒸馏水洗涤3 次,然后将失活的酵母菌进行冷冻干燥,在冷冻干燥之前,样品需在-40 ℃条件下预冻24 h,之后进行干燥,干燥条件为温度-54 ℃、真空度0.665 Pa、时间36 h。冷冻干燥完成之后,用研钵研碎,过100目筛,即得到实验所需的失活酵母菌。
1.3.3 氯吡脲的提取及纯化 [25-27]
量取2.5 mL猕猴桃汁于10 mL离心管中,加入2.5 mL含1%乙酸的乙腈,涡旋振荡2 min,再加入1 g无水硫酸镁、0.25 g 无水乙酸钠,迅速振荡2 min,防止结块。在4 ℃、4 000 r/min条件下离心5 min,取上清液。准确吸取上述上清液1 mL于10 mL离心管中,加入100 mg N-丙基乙二胺和100 mg无水硫酸镁,振荡1 min,再以同样的条件离心,取上清液,过0.22 μm有机滤膜于进样瓶中,供高效液相色谱测定。
1.3.4 高效液相色谱条件
色谱柱:Inertsil ODS-SP(4.6 mm×250 mm,5 μm);流动相:乙腈∶水=55∶45(V/V);流速:1.0 mL/min;进样量:20 øL;260 nm波长处紫外检测;柱温:30 ℃。
1.3.5 失活酵母菌吸附猕猴桃汁中氯吡脲的单因素试验
1.3.5.1 失活酵母菌添加量的确定
分别将0.4、2、4、8、12、20、32、36、40 mg/mL失活酵母菌添加到1 μg/mL氯吡脲的猕猴桃汁中。置于恒温摇床中吸附,摇床转速为120 r/min,温度为28 ℃,吸附时间为2 h。处理结束之后,对猕猴桃汁进行离心分离(3 600×g、10 min、4 ℃),收集上层猕猴桃汁进行提取纯化,用高效液相色谱进行氯吡脲剩余量的检测。考察失活酵母菌添加量对氯吡脲吸附率的影响。
氯吡脲吸附率的计算公式如下:
式中:R为t时间时失活酵母菌对氯吡脲的吸附率/%;C 0为猕猴桃汁中氯吡脲的初始质量浓度/(μg/L);C t为吸附t时间后猕猴桃汁中剩余氯吡脲的质量浓度/(μg/L)。
1.3.5.2 吸附时间的确定
称取失活酵母菌50 mg,添加到2.5 mL含有1 μg/mL氯吡脲的猕猴桃汁中。置于恒温摇床中处理,摇床转速为120 r/min,吸附温度为28 ℃。在不同的时间取样进行猕猴桃汁中氯吡脲剩余量的测定。考察吸附时间对吸附率的影响。
1.3.5.3 氯吡脲初始质量浓度的确定
配制氯吡脲初始质量浓度为0.2、0.3、0.5、1.0、2.0、3.0、10.0 μg/mL的猕猴桃汁。将50 mg失活酵母菌分别添加于不同氯吡脲初始质量浓度的猕猴桃汁中(2.5 mL),置于恒温摇床中吸附,摇床转速为120 r/min,温度为28 ℃。考察氯吡脲初始质量浓度对吸附率的影响。
1.3.5.4 吸附温度的确定
称取失活酵母菌50 mg,添加到2.5 mL含有1 μg/mL氯吡脲的猕猴桃汁中。置于恒温摇床中吸附,摇床转速为120 r/min,分别在20、28、37、45 ℃条件下吸附2 h。考察吸附温度对氯吡脲吸附率的影响。
1.3.6 响应面优化吸附条件
在单因素试验的基础上,采用Box-Behnken设计方案,以失活酵母菌添加量、氯吡脲初始质量浓度、吸附时间为试验因素,氯吡脲吸附率(Y)为响应值,试验因素水平设计见表1。
表1 响应面试验设计因素及水平
Table 1 Factors and levels used in response surface analysis

因素水平-101 X 1失活酵母菌添加量/(mg/mL)82032 X 2氯吡脲初始质量浓度/(μg/mL)0.21.63.0 X 3吸附时间/h123
1.3.7 猕猴桃汁理化指标测定
可溶性固形物含量的测定参照SB/T 10203—1994《果汁通用试验方法》;色 值和透光率测定参照GB/T 18963—2003《浓缩苹果汁》;总糖、总酸含量的测定参照SB/T 10203—1994,采 用直接滴定法。
1.4 数理统计分析方法
采用SPSS 18.0软件进行单因素试验结果统计分析,利用Design-Expert 8.0软件设计Box-Behnken试验,设计建立数学模型,并进行响应面分析。
2.1 氯吡脲标准曲线绘制
准确吸取氯吡脲标准溶液,用流动相稀释为0.02、0.05、0.1、0.5、1.0、5.0、10.0 μg/mL系列质量浓度,利用高效液相色谱进行测定,以质量浓度(x)对峰面积(y)绘制标准曲线,回归方程为y=186 609x+3 397.8,R 2=0.999 5。
2.2 单因素试验结果
2.2.1 失活酵母菌添加量对吸附率的影响
由图1可以看出,随着失活酵母菌添加量的增加,氯吡脲的吸附率呈上升趋势,当失活酵母菌达到32 mg/mL,氯吡脲的吸附率基本上变化不大。但在失活酵母菌达到20 mg/mL后,氯吡脲的吸附率增加非常缓慢。其原因可能是,当失活酵母菌添加量增加时,有效吸附位点相应增加,但猕猴桃汁中氯吡脲含量是一定的,当失活酵母上的有效吸附位点足够将猕猴桃汁中氯吡脲全部吸附后,再增加失活酵母菌添加量对氯吡脲的吸附率没有贡献,同时加大了分离难度。因此综合考虑,选择失活酵母菌的最佳添加量为20 mg/mL。
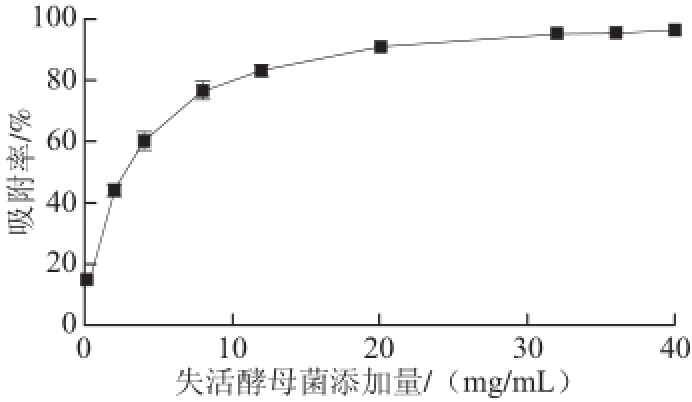
图1 失活酵母菌添加量对氯吡脲吸附率的影响
Fig.1 Effect of inactivated yeast dosage on forchlorfenuron adsorption
2.2.2 吸附时间对吸附率的影响
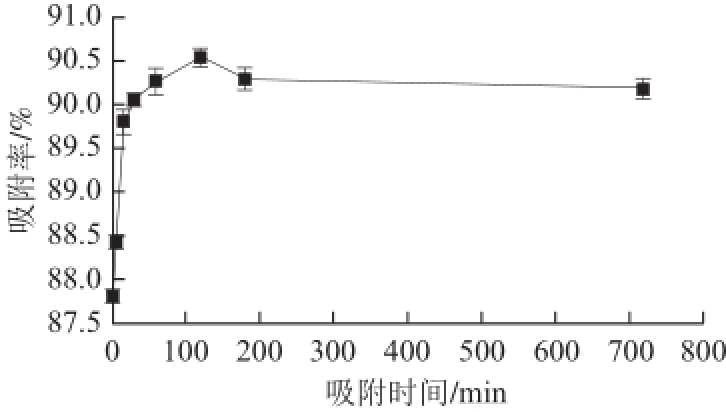
图2 吸附时间对氯吡脲吸附率的影响
Fig.2 Effect of adsorption time on forchlorfenuron adsorption
由图2可知,随着吸附时间的延长,吸附率呈先增加后降低的趋势,最终达到平衡。时间太短(小于2 h),反应不完全,因此吸附率较低;吸附时间过长(大于2 h),有可能发生解吸,吸附上的氯吡脲可能又会重新溶于猕猴桃汁中,导致吸附率降低。在吸附时间为2 h 时,吸附率最高,吸附效果最优,因此吸附时间选择2 h。
2.2.3 氯吡脲初始质量浓度对吸附率的影响
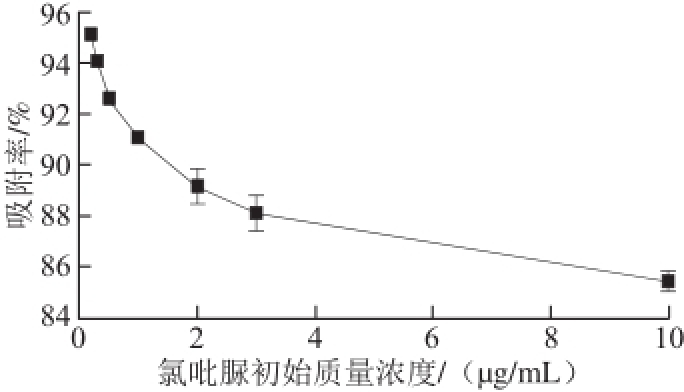
图3 氯吡脲初始质量浓度对吸附率的影响
Fig.3 Effect of initial forchlorfenuron concentration on forchlorfenuron adsorption
由图3可以看出,随着氯吡脲初始质量浓度的增加,失活酵母菌对氯吡脲的吸附率明显降低,当氯吡脲初始质量浓度超过3 μg/mL时,吸附率降低的趋势明显减缓。其原因可能是,当猕猴桃汁中失活酵母菌添加量一定时,有效吸附位点的量也是一定的;氯吡脲质量浓度越大,与失活酵母菌吸附位点作用的氯吡脲占总氯吡脲的比例越低,吸附率越低。因此综合考虑,在后面的优化中选择氯吡脲初始质量浓度范围为0.2~3 μg/mL。
2.2.4 吸附温度对吸附率的影响
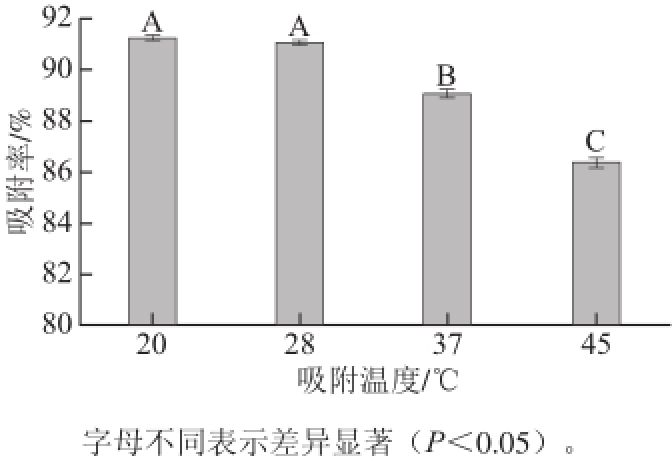
图4 吸附温度对氯吡脲吸附率的影响
Fig.4 Effect of temperature on forchlorfenuron adsorption
由图4可以看出,随着吸附温度的升高,失活酵母菌对氯吡脲的吸附率降低。说明该吸附过程是放热过程,高温不利于氯吡脲的吸附。但在20 ℃和28 ℃时对氯吡脲的吸附率没有显著差异,因此从实际操作中的方便性和经济方面综合考虑,失活酵母菌对氯吡脲的吸附适宜在常温条件下进行,因此确定温度为28 ℃。
2.3 响应面试验结果
2.3.1 Box-Behnken试验设计方案及结果
表2 响应面试验设计与结果
Table 2 Experimental results for response surface analysis

试验号X 1失活酵母菌添加量X 2氯吡脲初始质量浓度X 3吸附时间氯吡脲吸附率/%实测值预测 值残差1-1-1087.4787.310.16 21-1097.1297.100.025 3-11082.6682.69-0.025 411096.4396.60-0.17 5-10-183.8283.98-0.16 610-196.48 96.50-0.018 7-10185.5185.490.017 810196.8396.670.16 90-1-195.2295.23-7.5×10 -31001-1 92.5792.390.18 110-1195.6195.79-0.18 1201193.5293.517.5×10 -31300093.9893.720.26 1400093.5493.72-0.18 1500093.3993.72-0.33 1600094.2493.720.52 1700093.4593.72-0.27
在单因素试验中,以猕猴桃汁中氯吡脲的吸附率为试验指标,研究了影响吸附率的参数。为了进一步确定吸附的最佳条件,综合单因素试验结果,以吸附率为响应值,选择失活酵母菌添加量、氯吡脲初始质量浓度、吸附时间3 个因素设计Box-Behnken试验。试验设计与结果如表2所示,其中1~12为析因试验,13~17为中心试验,用来估计试验误差。
2.3.2 模型方程的建立及显著性分析
利用Design-Expert 8.0软件对表2数据进行多元回归拟合,得到吸附率对失活酵母菌添加量、氯吡脲初始质量浓度、吸附时间真实值的回归模型:
Y=77.78+1.34X 1-2.97X 2+0.32X 3+0.06X 1X 2-0.03XX+0.10XX-0.02X 2+0.20X 2+0.13X 2 1323123
上述回归方程的方差分析结果见表3。
表3 回归模型方差分析结果
Table 3 Analysis of variance of regression model
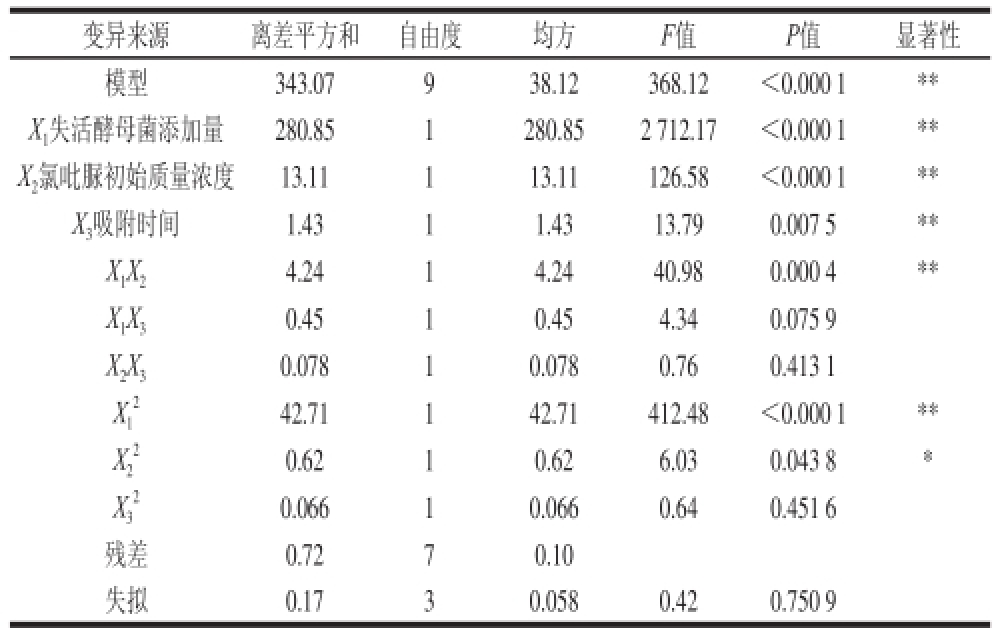
注: *.差异显著(P<0.05); * *.差异极显著(P<0.01)。
变异来源离差平方和自由度均方F值P值显著性模型343.07938.12368.12<0.000 1 * *X 1失活酵母菌添加量280.851280.852 712.17<0.000 1 * *X 2氯吡脲初始质量浓度13.11113.11126.58<0.000 1 * *X 3吸附时间1.4311.4313.790.007 5 * *X 1X 24.2414.2440.980.000 4 * *X 1X 30.4510.454.340.075 9 X 2X 30.07810.0780.760.413 1 X 142.71142.71412.48<0.000 1 * *X2 2 2 0.6210.626.030.043 8 *0.06610.0660.640.451 6残差0.7270.10失拟0.1730.0580.420.750 9 X3 2
由表3可知,失活酵母菌添加量一次项(X
1)、氯吡脲初始质量浓度一次项(X
2)、吸附时间一次项(X
3)达到极显著水平(P<0.01),表明失活酵母菌添加量、氯吡脲初始质量浓度、吸附时间对吸附率的线性效应达到极显著。失活酵母菌添加量的平方项(X
1
2)达到极显著水平,氯吡脲初始质量浓度的平方项(X
2
2)达到显著水平,表明其对氯吡脲吸附率的曲面效应显著。失活酵母菌添加量(X
1)和氯吡脲初始质量浓度(X
2)的交互项极显著(P<0.01),表明各参数对吸附率的影响不是简单的线性关系。失拟项在P<0.05水平不显著,该模型的R
2=0.997 9,整体模型达到极显著水平(P<0.000 1),说明该模型拟合程度良好,误差小,模型是合适的;模型的校正决定系数
 =0.995 2,表明该回归模型可以解释99.52%因变量的变化,具有很好的代表性,可以用来预测吸附条件的理论参数。根据回归方程分析结果,可以看出各因素影响吸附率的大小顺序为:失活酵母菌添加量>氯吡脲初始质量浓度>吸附时间。
=0.995 2,表明该回归模型可以解释99.52%因变量的变化,具有很好的代表性,可以用来预测吸附条件的理论参数。根据回归方程分析结果,可以看出各因素影响吸附率的大小顺序为:失活酵母菌添加量>氯吡脲初始质量浓度>吸附时间。
2.3.3 响应面分析
根据回归方程,作响应面图见图5。
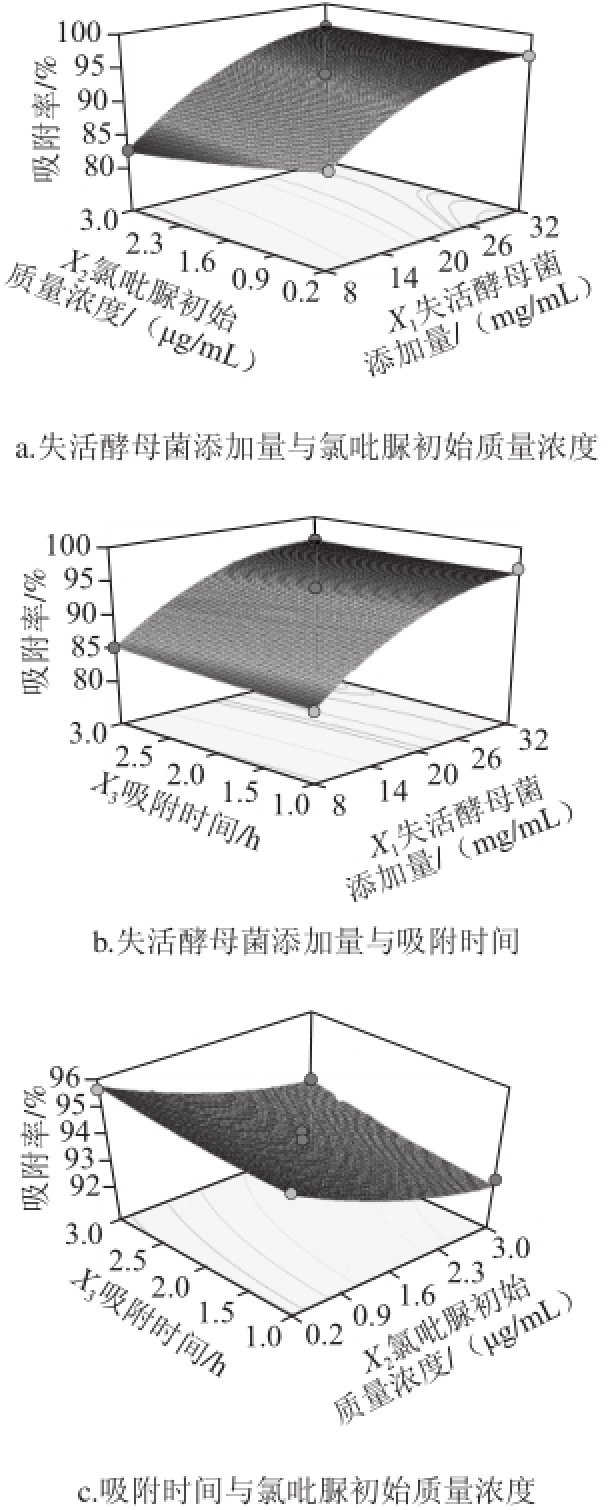
图5 各因素交互作用对氯吡脲吸附率影响的响应面图
Fig.5 Response surface graphs showing the interactive effect of three parameters on forchlorfenuron adsorption
根据图5曲线的陡峭平滑程度可以看出,失活酵母菌添加量和氯吡脲初始质量浓度的交互作用>失活酵母菌添加量和吸附时间的交互作用>吸附时间和氯吡脲初始质量浓度的交互作用。由表3可以看出,只有失活酵母菌添加量和氯吡脲初始质量浓度的交互作用极显著,其他两种交互作用不显著,所以可以不予考虑。由图5a可以看出,当失活酵母菌添加量处于较低水平时,吸附率随着氯吡脲初始质量浓度的增加而减少,当失活酵母菌添加量处于较高水平时,吸附率随着氯吡脲初始质量浓度的增加呈现出先降低后保持不变的趋势;当氯吡脲初始质量浓度处于较低水平时,吸附率随着失活酵母菌添加量的增加呈现出先增加后保持不变的趋势,当氯吡脲初始质量浓度处于较高水平时,吸附率随着失活酵母菌添加量的增加而增加。
2.3.4 吸附工艺条件的优化和可靠性验证
为进一步确定最佳吸附条件,用Design-Expert 8.0软件进行验证优化,确定失活酵母菌对猕猴桃汁中氯吡脲的最佳吸附条件为:失活酵母菌添加量28.60 mg/mL、氯吡脲初始质量浓度0.20 μg/mL、吸附时间3 h,在此条件下氯吡脲的理论吸附率为97.42%。考虑到实际条件,失活酵母菌添加量取28 mg/mL,用此最优条件进行验证得到氯吡脲的吸附率为97.02%,与理论值非常接近,表明该回归模型对优化猕猴桃汁中氯吡脲的吸附条件是可行的。
为了进一步研究失活酵母菌吸附对猕猴桃汁品质的影响,以可溶性固形物含量、pH值、总糖含量、总酸含量等为指标,对吸附前后的猕猴桃汁进行分析,结果见表4。
表3 回归模型方差分析结果
Table 3 Analysis of variance of regression model

注:同列字母不同表示差异显著(P<0.05)。
处理可溶性固形物含量/°Brix总糖含量/(g/100 mL)总酸含量/(g/100 mL)pH透光率/%吸附前11.00±0.10 a8.71±0.07 a1.61±0.05 a3.02±0.01 a96.83±0.22 a吸附后11.20±0.26 a8.80±0.06 a1.64±0.02 a3.00±0.03 a96.68±0.13 a
由表4可以看出,在P<0.05时,失活酵母菌吸附前后猕猴桃汁的可溶性固形物、总糖、总酸含量与pH值、透光率理化指标没有显著差异。说明利用失活酵母菌处理猕猴桃汁中的氯吡脲是可行的。
本研究用Box-Behnken法优化了失活酵母菌对猕猴桃汁中氯吡脲的吸附条件,得到模型的
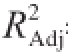 =0.995 2,说明该回归模型能解释99.52%响应值的变化,该模型拟合程度良好,失拟项不显著(P>0.05),说明本试验所得二次回归方程能很好预测氯吡脲吸附率随各参数的变化规律。3 个因素对氯吡脲吸附率的影响大小依次为失活酵母菌添加量、氯吡脲初始质量浓度、吸附时间;确立了失活酵母菌吸附氯吡脲的最佳条件为失活酵母菌添加量28 mg/mL、氯吡脲初始质量浓度0.2 μg/mL、吸附时间3 h。在此条件下吸附率为97.02%。失活酵母菌能有效去除猕猴桃汁中氯吡脲,同时对猕猴桃汁品质没有影响,极大提高了猕猴桃汁的安全性。
=0.995 2,说明该回归模型能解释99.52%响应值的变化,该模型拟合程度良好,失拟项不显著(P>0.05),说明本试验所得二次回归方程能很好预测氯吡脲吸附率随各参数的变化规律。3 个因素对氯吡脲吸附率的影响大小依次为失活酵母菌添加量、氯吡脲初始质量浓度、吸附时间;确立了失活酵母菌吸附氯吡脲的最佳条件为失活酵母菌添加量28 mg/mL、氯吡脲初始质量浓度0.2 μg/mL、吸附时间3 h。在此条件下吸附率为97.02%。失活酵母菌能有效去除猕猴桃汁中氯吡脲,同时对猕猴桃汁品质没有影响,极大提高了猕猴桃汁的安全性。
参考文献:
[1] KOBAYASHI M, TAKANO I, TAMURA Y, et al. Clean-up method of forchlorfenuron in agricultural products for HPLC analysis[J]. Food Hygiene and Safety Science (Shokuhin Eiseigaku Zasshi), 2007, 48(5): 148-152. DOI:10.3358/shokueishi.48.148.
[2] 陈卫军, 张耀海, 李云成, 等. 果蔬中常用植物生长调节剂分析方法研究进展[J]. 食品科学, 2012, 33(11): 283-289.
[3] 张卫炜. 氯吡脲的残留分析方法及残留动态研究[D]. 武汉: 华中农业大学, 2007. DOI:10.7666/d.y1198247.
[4] 侯玉茹, 杨媛, 石磊, 等. 固相萃取-高效液相色谱法检测葡萄中氯吡脲的研究[J]. 食品科技, 2011, 36(1): 255-258.
[5] 袁云香. 植物生长调节剂在猕猴桃生产中的应用[J]. 农产品加工(创新版), 2011(11): 70-72. DOI:10.3969/jissn.1671-9646(C).2011.11.008.
[6] FERRARA G, MAZZEO A, N ETTI G, et al. Girdling, gibberellic acid, and forchlorfenuron: effects on yield, quality, and metabolic profil e of table grape[J]. American Journal of Enology and Viticulture, 2014, 65(3): 381-387. DOI:10.5344/a jev.2014.13139.
[7] 朱杰丽, 杨柳, 柴振林, 等. 国内外植物生长调节剂限量标准分析研究[J]. 生物灾害科学, 2013, 36(2): 232-236. DOI:10.3969/ j.issn.2 095-3704.2013.02.025.
[8] 史晓梅, 金芬, 黄玉婷, 等. 水果中常用植物生长调节剂的研究进展[J].食品工业科技, 2012, 33(4): 417-422.
[9] SAHA A, GAJBHIYE V, GUPTA S, et a l. Removal of mixed pesticides from aqueous solutions using organoclays: evaluation of equilibrium and kinetic model[J]. Bulletin of Environmental Contamination and Toxicology, 2013, 91(1): 111-116. DOI:10.1007/ s00128-013-1012-9.
[10] CHEN J, LIN Y, KUO W. Pesticide residue removal from vegetables by ozonation[J]. Journal of Food Engineering, 2013, 114(3): 404-411. DOI:10.1016/j.jfoodeng.2012.08.033.
[11] ZOLGHARMEIN J, SHAHMORADI A, GHASEMI J. Pesticides removal using conventional and low-cost adsorbent s: a review[J]. Clean-Soil, Air, Water, 2011, 39(12): 1105-1119. DOI:10.1002/ clen.201000306.
[12] AKAR S T, SAYIN F, TURKYIlMAZ S, et al. Multivariate optimization of the decolorization process by surface modified biomaterial: Box-Behnken design and mechanism analysi s[J]. Environmental Science and Pollution Research, 2014, 21(22): 13055-13068. DOI:10.1007/s11356-014-3245-5.
[13] LUO F, LIU Y H, LI X M, et al. Biosorption of lead ion by chemically-modified biomass of marine brown algae Laminaria japonica[J]. Chemosphere, 2006, 64(7): 1122-1127. DOI:10.1016/ j.chemosphere.2005.11.076.
[14] NGUELA J M, SIECZKOWSKI N, ROI S, et al. Sor ption of grape proanthocyanidins and wine polyphenols by yeasts, inactivated yeasts, and yeast cell walls[J]. Journal of Agricultural and Food Chemistry, 2015, 63(2): 660-670. DOI:10.1021/jf504494m.
[15] TUNALI S, AKAR T, ÖZCAN A S, et al. Equilibrium and kinetics of biosorption of le ad (Ⅱ) from aqueous solutions by Cep halosporium aphidicola[J]. Separation and Purification Technology, 2006, 47(3): 105-112. DOI:10.1016/j.seppur.2005.06.009.
[16] GHOSH S, DAS S K, GUHA A K, et al. Adsorption be havior of lindane on Rhizopus oryzae biomass: physico-chemical studies[J]. Journal of Hazardous Materials, 2009, 172(1): 485-490. DOI:10.1016/ j.jhazmat.2009.06.156.
[17] MATHIALAGAN T, VIRARAGHAVAN T. Biosorption of pentachlorophenol from aqueous s olutions by a fungal biomass[J]. Bioresource Technology, 2009, 100(2): 549-558. DOI:10.1016/ j.biortech.2008.06.054.
[18] GHORBANI F, YOUNESI H, GHASEMPOURI S M, et al. Application of response surface methodology for optimization of cadmium biosorp tion in an aqueous solution by Saccharomyces cerevisiae[J]. Chemical Engineering Journal, 2008, 145(2): 267-275. DOI:10.1016/j.cej.2008.04.028.
[19] DALIE D, DESCHAMPS A, RICHARD-FORGET F. Lactic acid bacteria-potentia l for control of mould growth and mycotoxins: a review[J]. Food Control, 2010, 21(4): 370-380. DOI:10.1016/ j.foodcont.2009.07.011.
[20] GUO C X, YUE T L, YUAN Y H, et al. Biosorption of patulin from apple juice by caustic treated waste cider yeast biomass[J]. Food Control, 2013, 32(1): 99-104. DOI:10.1016/j.foodcont.2012.11.009.
[21] HATAB S, YUE T L, MOHAMAD O. Reduction of patulin in aqueous solution by lactic acid bacteria[J]. Journal of Food Science, 2012, 77(4): M2 38-M241. DOI:10.1111/j.1750-3841.2011.02615.x.
[22] SELATNIA A, BOUKAZOULA A, KECHID N, et al. Biosorption of lead (Ⅱ) from aqueous solution by a bacterial dead Streptomyces rimosus biomass[J]. Biochemical Engineering Journal, 2004, 19(2): 127-135. DOI:10.1016/j.bej.2003.12.007.
[23] YUAN Y H, WANG X Y, HATAB S, et al. Patulin reduction in apple juice by inactivated Alicyclobacillus spp.[J]. Letters in Applied Microbiology, 2014, 59(6): 604-609. DOI:10.1111/lam.12315.
[24] 代群威, 董发勤, 杨丽君, 等. 灭活面包酵母菌对溶液中铅离子的吸附研究[J]. 安全与环境学报, 2008, 8(4): 49-53. DOI:10.3969/ j.issn.1009-6094.2008.04.013.
[25] 黎路, 王楠, 黄晓晶, 等. 果蔬中植物生长调节剂氯吡脲的高效液相色谱测定方法[J]. 现代仪器, 2012, 18(5): 15-17. DOI:10.3969/ j.issn.2095-5200.2012.05.004.
[26] 王楠, 胡坪, 国欣, 等. QuEChERS-HPLC 法快速检测猕猴桃中氯吡脲残留[J]. 食品工业, 2014, 35(5): 234-237.
[27] NEGRE M, PASSARELLA I, VINDROLA D, et al. Determination of forchlorfenuron in fruits by solid phase or QuEChERS extraction and LC-UV or LC/MS/MS[J]. Journal of AOAC International, 2014, 97(3): 938-941. DOI:10.5740/jaoacint.13- 064.
Optimization of Adsorption Conditions for Forchlorfenuron in Kiwifruit Juice by Inactivated Yeast
YANG Lixia, YUE Tianli
*, YUAN Yahong, LONG Fangyu, WANG Zhouli
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Abstract:The adsorption of forchlorfenuron in kiwifruit juice was studied by inactivated yeast. Based on single-factor experiments, Box-Behnken response surface methodology (RSM) was adopted to study the effects of the key factors (inactivated yeast dosage, initial concentration of forchlorfenuron, and adsorption time) on adsorption efficiency. The influence of the adsorption on main quality indexes of kiwifruit juice was also studied. The results indicated that the optimum adsorption conditions were as follows: inactivated yeast dosage, 28 mg/mL; initial forchlorfenuron concentration, 0.2 μg/mL; and adsorption time, 3 h. Experiments conducted under the optimized conditions gave an adsorption rate of 97.02%, which was consistent with the predicted value by RSM. The quality of kiwifruit juice was not significantly affected by treatment with inactivated yeast (P > 0.05).
Key words:adsorption; inactivated yeast; forchlorfenuron; response surface methodology; kiwifruit juice
DOI:10.7506/spkx1002-6630-201604001
中图分类号:TS275.5
文献标志码:A
文章编号:1002-6630(2016)04-0001-06
引文格式:
杨丽霞, 岳田利, 袁亚宏, 等. 响应面试验优化失活酵母吸附猕猴桃汁中氯吡脲条件[J]. 食品科学, 2016, 37(4): 1-6.
DOI:10.7506/spkx1002-6630-201604001. http://www.spkx.net.cn
YANG Lixia, YUE Tianli, YUAN Yahong, et al. Optimization of adsorption conditions for forchlorfenuron in kiwifruit juice by inactivited yeast[J]. Food Science, 2016, 37(4): 1-6. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604001. http://www.spkx.net.cn
收稿日期:2015-06-10
基金项目:国家自然科学基金面上项目(31371814)
作者简介:杨丽霞(1991—),女,硕士研究生,研究方向为食品安全控制技术。E-mail:yanglx1991@126.com
*通信作者:岳田利(1965—),男,教授,博士,研究方向为食品生物技术及食品安全控制。E-mail:yuetl@nwsuaf.edu.cn