刘晓鹏
1,2,3,张俊霞
1,姜 宁
1,
*,宋宜枝
1,向极钎
1,王秋霜
2,吴 皓
3
(1.湖北民族学院生物科学与技术学院,湖北 恩施 445000;2.南京医药股份有限公司博士后工作站,江苏 南京 210012;3.南京中医药大学博士后流动站,江苏 南京 210023)
摘 要:通过中心复合试验优化超声辅助提取连钱草多糖的工艺,以1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-连氮基-双-(3-乙基苯并噻唑-6-磺酸)自由基(2,2’--azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid) radical,ABTS +•)清除能力、Fe 2+螯合力、铁离子还原抗氧化力(ferric reducing antioxidant power,FRAP)和N,N-二甲基-对苯二胺(N,N-dimethyl-p-phenylenediamine,DMPD)自由基清除能力为指标,研究连钱草多糖的体外抗氧化活性。结果表明,超声辅助提取连钱草多糖的最优工艺为pH 7.2、液固比32∶1(mL/g)、超声功率270 W、超声时间8 min,此条件下多糖提取率在4.95%~5.12%范围内。体外抗氧化活性结果显示,连钱草多糖DPPH自由基清除能力为(0.51±0.04)μmol Trolox/mg,ABTS +•清除能力为(0.69±0.04)μmol Trolox/mg,Fe 2+螯合力为(0.51±0.29)μmol EDTA/mg,FRAP值为(3.45±0.03)μmol Trolox/mg,DMPD自由基清除能力为(0.17±0.01)μmol Trolox/mg。
关键词:连钱草;多糖;超声辅助提取;响应面分析;抗氧化
连钱草为唇形科活血丹属植物活血丹(Glechoma longituba (Nakai) Kupr.)干燥地上部分,晒干或鲜用。连钱草性味凉辛,微苦,微寒,归肝、肾、膀胱经 [1]。连钱草具有利尿、预防肾结石 [2]、抑菌 [3]、抗炎镇痛 [4]、降血糖 [5]、抗肿瘤 [6]以及抑制破骨细胞生长 [7]等药理作用。
多糖是中药的主要活性成分之一,而目前对连钱草的研究主要集中在萜类 [8]、黄酮类 [9]、有机酸类 [10-11],对连钱草多糖的研究则较少,仅前期研究了水浴法提取工艺的优化 [12],而无对该多糖其他方面研究的报道。本研究通过考察提取液pH值、液固比、超声功率和超声时间等因素,采用单因素试验和中心复合试验优化超声辅助提取连钱草多糖的工艺,并考察5 个抗氧化指标以揭示其体外抗氧化活性,旨在为连钱草这一传统中药的进一步开发利用提供科学依据和理论指导。
1.1 材料与试剂
连钱草由南京同仁堂洪泽科技有限公司提供,烘干,粉碎,过60 目筛;1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-连氮基-双-(3-乙基苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid) diammonium salt,ABTS)、菲咯嗪(ferrozine试剂)、三吡啶三吖嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ)、N,N-二甲基对苯二胺二盐酸盐(N,N-dimethyl-p-phenylenediamine,DMPD)、Trolox 日本东京化成工业株式会社;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度定量试剂盒 碧云天生物技术研究所;葡萄糖、无水乙醇、蒽酮等(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Multiskan GO全波长酶标仪 美国Thermo公司;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司;RT-02A型多功能粉碎机 弘荃机械企业有限公司;COUCTER型离心机 美国Beckman公司;JY96-Ⅱ超声波细胞粉碎机 宁波新芒生物科技股份有限公司。
1.3 方法
1.3.1 超声辅助提取连钱草多糖工艺的优化
1.3.1.1 连钱草多糖的提取 [13]
称取一定量的连钱草干粉末,加入适量缓冲液,超声波处理一定时间后,离心取上清液进行真空旋转蒸发浓缩至原体积的1/10,向浓缩液中缓慢加入无水乙醇至乙醇终体积分数为80%,4 ℃静置过夜,离心,沉淀用无水乙醇洗涤3 次后用蒸馏水溶解。将上述溶液、三氯甲烷、正丁醇按体积比25∶5∶1混合并剧烈振荡20 min,离心取上清液,此过程重复5 次以除去蛋白。葡萄糖为标准品,硫酸-蒽酮法测多糖含量 [14],多糖提取率按下式计算:
式中:ρ为测定样液的质量浓度/(mg/mL);V为提取体积/mL;m为连钱草质量/mg。
测量抗氧化活性前,将上述提取多糖样品置于截留相对分子质量3 500的透析袋中,于蒸馏水中透析过夜以除去小分子物质。透析液旋转蒸发浓缩,冻干得连钱草多糖冻干粉。检测冻干粉中的多糖含量;牛血清白蛋白为标准品,BCA法检测其蛋白含量,具体操作按试剂盒说明书进行;没食子酸为标准品,Folin-Ciocalteu法测多糖冻干粉的总酚含量 [15];芦丁为标准品,分光光度法测量总黄酮含量 [16]。
1.3.1.2 单因素试验
称取一定量的连钱草粉末,按照下列条件进行单因素试验:分别配制pH 4.0、5.0、6.0、7.0、8.0、9.0的缓冲液,按液固比30∶1(mL/g)加入样品中,超声时间4 min、超声功率200 W;固定pH 7.0、超声功率200 W和超声时间4 min,改变液固比分别为10∶1、20∶1、30∶1、40∶1、50∶1(mL/g);固定pH 7.0、液固比30∶1(mL/g),分别用功率为50、100、150、200、250、300、350 W的超声波处理4 min;提取液pH 7.0、液固比30∶1(mL/g)、超声功率200 W条件下分别处理2、4、6、8、10 min。考察各单因素对连钱草多糖提取率的影响。
1.3.1.3 中心复合试验
根据单因素试验结果,采用Design-Expert 8.0软件进行中心复合试验设计,以pH值、液固比、超声功率和超声时间为自变量,多糖提取率为响应值优化连钱草多糖的提取工艺。试验因素水平设计见表1。
表1 中心复合试验因素与水平
Table 1 Coded levels for factors used in central composite design
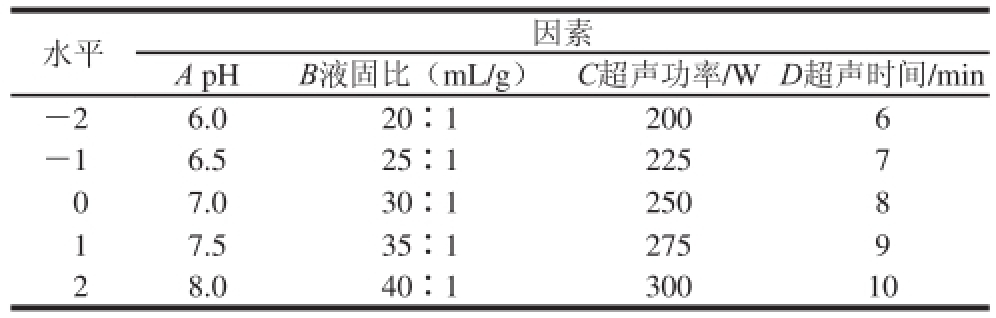
水平因素A pHB液固比(mL/g)C超声功率/W D超声时间/min-26.020∶12006-16.525∶12257 07.030∶12508 17.535∶12759 28.040∶130010
根据中心复合试验,建立pH值、液固比、超声功率和超声时间与多糖提取率的回归方程,并进行响应面分析,优化出连钱草多糖提取的最佳工艺,并对优化的工艺进行验证,证明此工艺的可行性。
1.3.2 连钱草多糖体外抗氧化活性的测定
1.3.2.1 DPPH自由基清除能力测定
连钱草多糖DPPH自由基清除能力的测定按照Gülcin等 [17]方法进行。Trolox为标准品,浓度分别为2.5、5、10、20、40、80 μmol/L,以Trolox浓度为横坐标、DPPH自由基清除能力为纵坐标,制作出Trolox对DPPH自由基清除能力的标准曲线。连钱草多糖的DPPH自由基清除能力用每毫克样品μmol Trolox当量表示(μmol Trolox/mg)。
1.3.2.2 ABTS +•清除能力测定
参照Chen等 [18]的方法测定连钱草多糖的ABTS +•清除能力。Trolox作为标准品,作出Trolox的ABTS +•清除能力(浓度分别为1.25、2.5、5、10、20、40 μmol/L)标准曲线。连钱草多糖的ABTS +•清除能力以每毫克样品μmol Trolox当量表示(μmol Trolox/mg)。
1.3.2.3 Fe 2+螯合力测定
Fe 2+螯合力依照文献[19]测定。EDTA作为测定该指标的标准品,浓度为7.8、15.6、31.3、62.5、125、250 μmol/L,计算Fe 2+螯合力与EDTA浓度的线性回归方程。样品的螯合力用每毫克样品μmol EDTA当量表示(μmol EDTA/mg)。
1.3.2.4 铁离子还原抗氧化力(ferric reducing antioxidant power,FRAP)测定
FRAP测定采用Fernandes等 [20]的方法。Trolox为标准品,测定浓度分别为5、10、20、40、80、160 μmol/L的FRAP值,计算FRAP值与Trolox浓度的线性回归方程。用每毫克样品μmol Trolox当量表示(μmol Trolox/mg)连钱草多糖的FRAP。
1.3.2.5 DMPD自由基清除能力测定
连钱草多糖DMPD自由基清除能力参考文献[19]进行测定。Trolox为标准品,测定不同浓度(分别为6.25、12.5、25、50、100、200 μmol/L)的Trolox对DMPD自由基清除能力,制作Trolox DMPD自由基清除能力的标准曲线。连钱草多糖的DMPD自由基清除能力以μmol Trolox当量表示(μmol Trolox/mg)。
1.4 数据处理
所有实验重复3次,数据均以“
 ±s”表示。单因素试验和体外抗氧化活性研究采用Origin 8.0统计软件分析,组间多重比较采用Fisher法;中心复合试验和结果分析采用Design-Expert 8.0软件。
±s”表示。单因素试验和体外抗氧化活性研究采用Origin 8.0统计软件分析,组间多重比较采用Fisher法;中心复合试验和结果分析采用Design-Expert 8.0软件。
2.1 连钱草多糖冻干粉组分分析
连钱草多糖冻干粉为白色粉末,得率为4.52%,其中多糖含量为97.28%,未检测到蛋白质、酚类以及黄酮类化合物。因此,可以推断冻干粉中连钱草多糖是体外抗氧化的物质基础。
2.2 超声辅助提取连钱草多糖工艺的优化
2.2.1 单因素试验结果
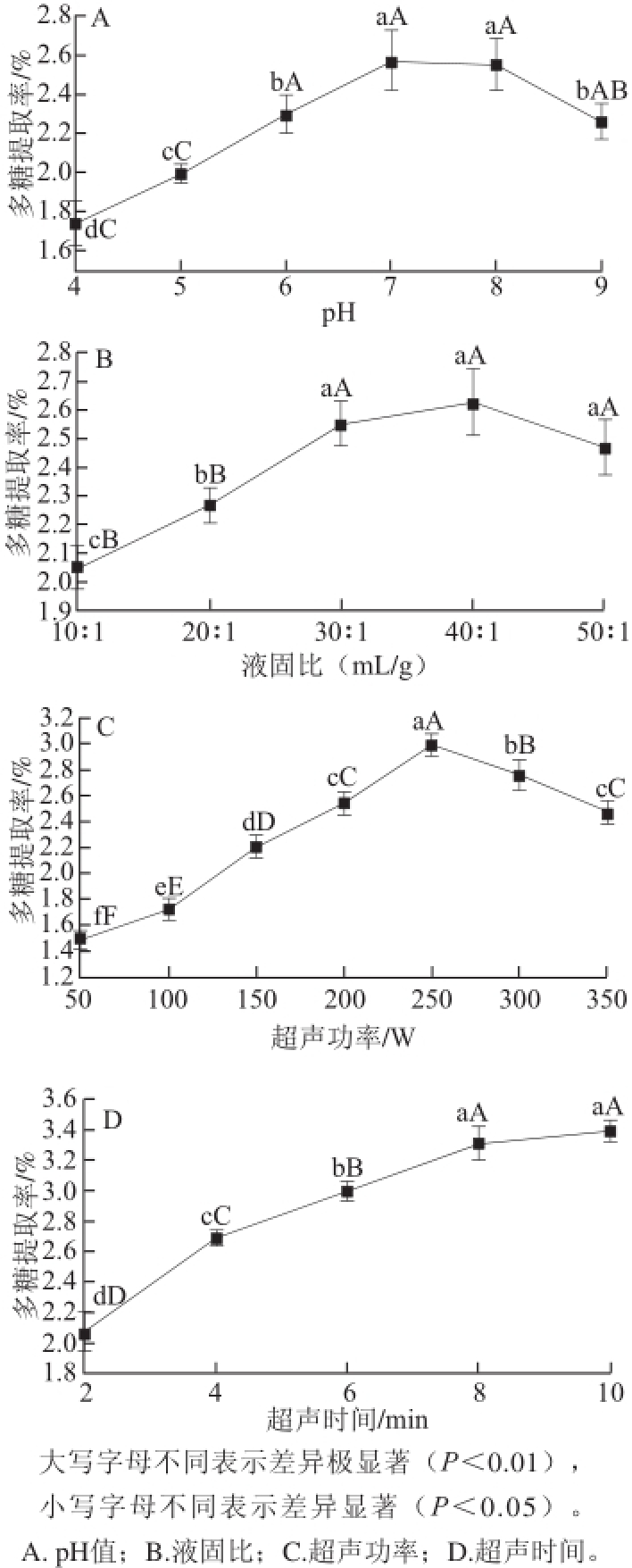
图1 单因素试验结果
Fig.1 Results of single factor experiments
当提取液pH值较低时,连钱草多糖的提取率较低,随着提取液pH值逐步增加,提取率显著上升,当pH值达到7.0时,提取率最高,随后pH值的提高不再增加连钱草多糖的提取率,反而有所下降(图1A)。液固比能显著影响连钱草多糖的提取率,当液固比较小时,增大液固比可以提取连钱草多糖的提取率,当液固比达到30∶1(mL/g)时,多糖提取率不再显著增加(图1B)。由图1C可以看出,当超声功率为250 W时,多糖提取率最高,低于或高于250 W,提取率均有所下降。随着超声时间的延长,连钱草多糖的提取率显著上升,当处理时间超过8 min后,提取率增加不再显著(图1D)。所以,在pH 6~8、液固比20∶1~40∶1(mL/g)、超声功率200~300 W、超声时间6~10 min范围内进行中心复合试验。
2.2.2 中心复合试验结果
2.2.2.1 回归模型的建立
表2 中心复合试验设计与结果
Table 2 Central composite design with experimental values of polysaccharide yield
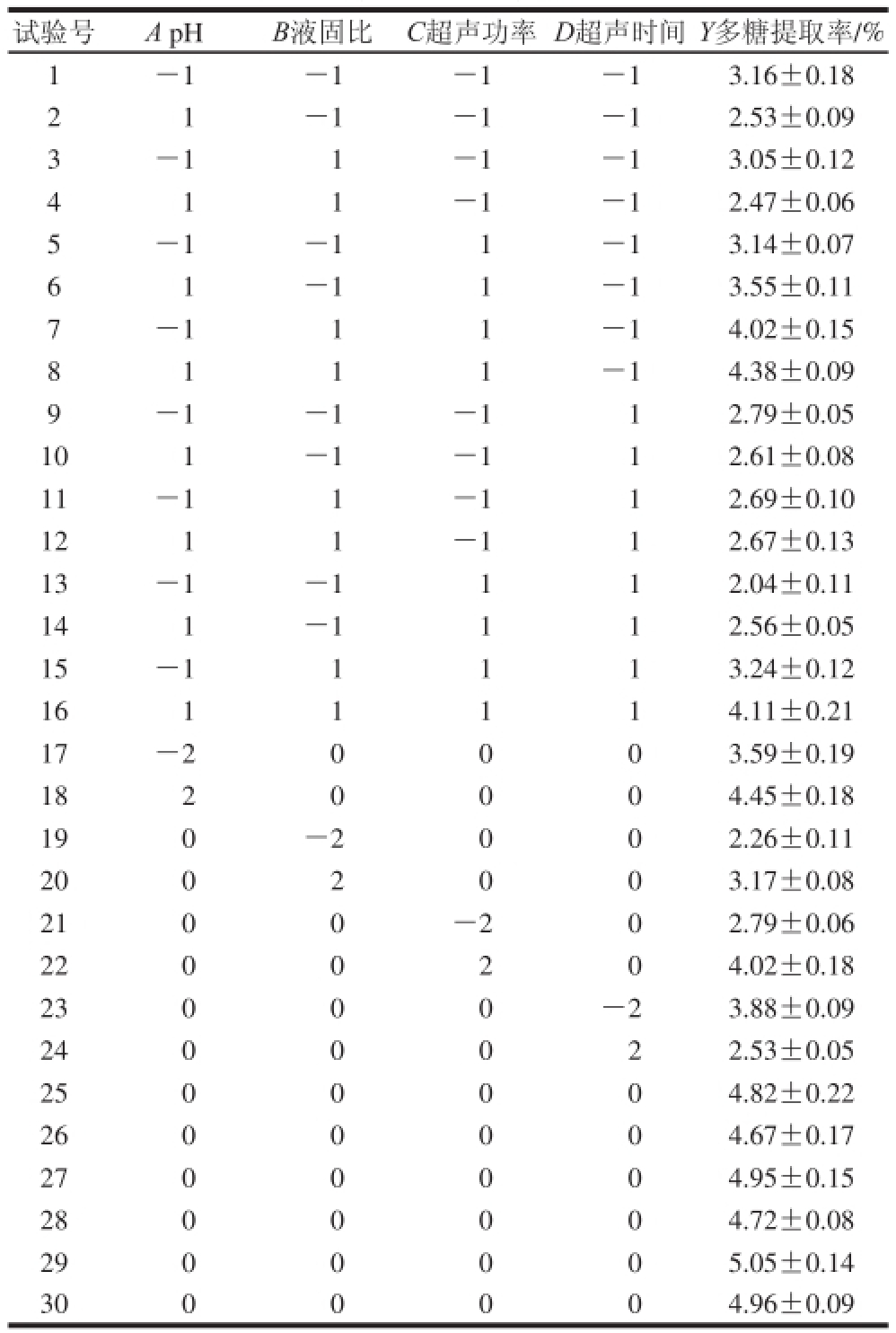
试验号A pHB液固比C超声功率D超声时间Y多糖提取率/% 1-1-1-1-13.16±0.18 21-1-1-12.53±0.09 3-11-1-13.05±0.12 411-1-12.47±0.06 5-1-11-13.14±0.07 61-11-13.55±0.11 7-111-14.02±0.15 8111-14.38±0.09 9-1-1-112.79±0.05 101-1-112.61±0.08 11-11-112.69±0.10 1211-112.67±0.13 13-1-1112.04±0.11 141-1112.56±0.05 15-11113.24±0.12 1611114.11±0.21 17-20003.59±0.19 1820004.45±0.18 190-2002.26±0.11 2002003.17±0.08 2100-202.79±0.06 2200204.02±0.18 23000-23.88±0.09 2400022.53±0.05 2500004.82±0.22 2600004.67±0.17 2700004.95±0.15 2800004.72±0.08 2900005.05±0.14 3000004.96±0.09
中心复合试验结果如表2所示。由统计软件Design-Expert 8.0分析,建立了如下四元二次回归方程:Y=4.86+0.10A+0.25B+0.31C-0.26D+0.03AB+ 0.22AC+0.10AD+0.29BC+0.07BD-0.17CD-0.26A 2-0.58B 2-0.41C 2-0.46D 2。
表3 中心复合试验结果方差分析表
Table 3 Analysis of variance (ANOVA) of the results of central composite design
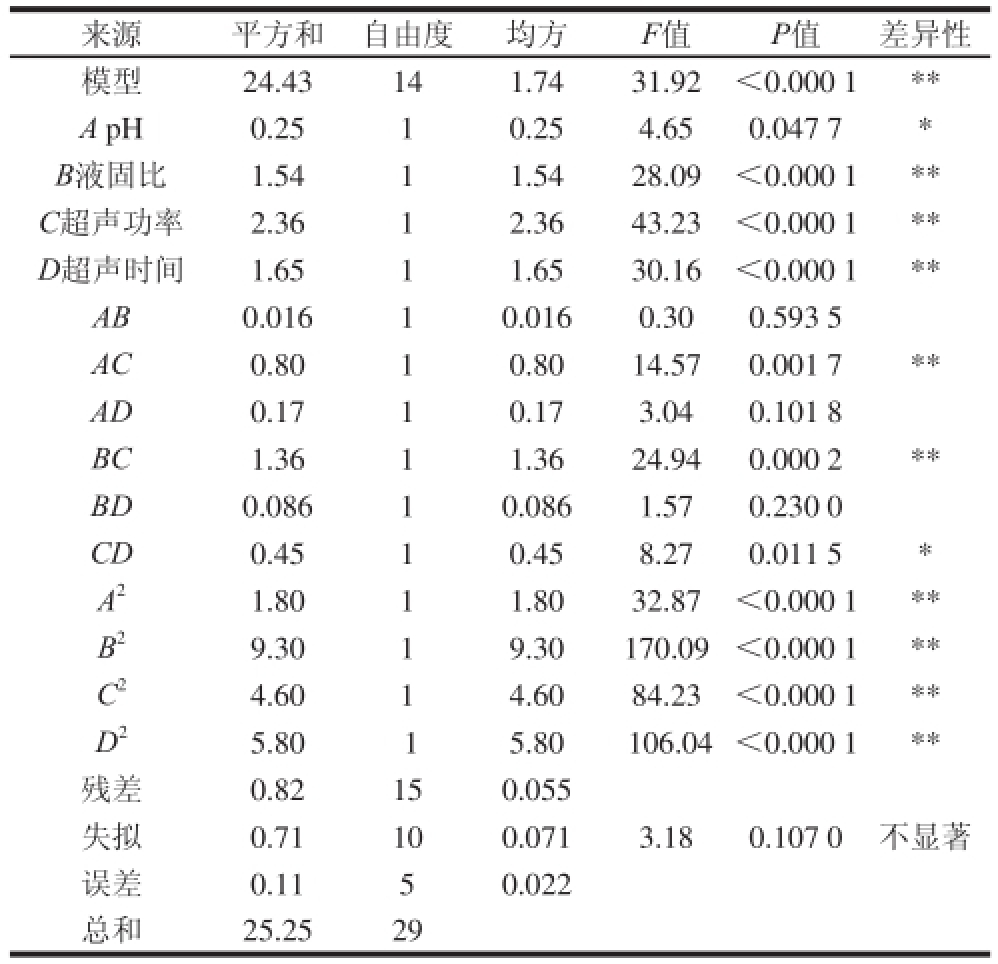
注: * *.差异极显著(P<0.01); *.差异显著(P<0.05)。
来源平方和自由度均方F值P值差异性模型24.43141.7431.92<0.000 1 * *A pH0.2510.254.650.047 7 *B液固比1.5411.5428.09<0.000 1 * *C超声功率2.3612.3643.23<0.000 1 * *D超声时间1.6511.6530.16<0.000 1 * *AB0.01610.0160.300.593 5 AC0.8010.8014.570.001 7 * *AD0.1710.173.040.101 8 BC1.3611.3624.940.000 2 * *BD0.08610.0861.570.230 0 CD0.4510.458.270.011 5 *A 21.8011.8032.87<0.000 1 * *B 29.3019.30170.09<0.000 1 * *C 24.6014.6084.23<0.000 1 * *D 25.80 15.80 106.04<0.000 1 * *残差0.82150.055失拟0.71100.0713.180.107 0不显著误差0.1150.022总和25.2529
该模型的决定系数R
2为0.967 5,校正后决定系数
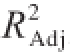 为0.937 2。对建立的模型进行方差分析,结果列于表3中,该模型极显著(P<0.000 1),失拟性不显著(P>0.1),说明此回归模型能很好地拟合实际。AB、AD和BD项不显著(P>0.05),需将此3项从回归模型中删除。因此,回归模型最终为:Y=4.86+0.10A+0.25B+0.31C-0.26D+0.22AC+0.29BC-0.17CD-0.26A
2-0.58B
2-0.41C
2-0.46D
2。
为0.937 2。对建立的模型进行方差分析,结果列于表3中,该模型极显著(P<0.000 1),失拟性不显著(P>0.1),说明此回归模型能很好地拟合实际。AB、AD和BD项不显著(P>0.05),需将此3项从回归模型中删除。因此,回归模型最终为:Y=4.86+0.10A+0.25B+0.31C-0.26D+0.22AC+0.29BC-0.17CD-0.26A
2-0.58B
2-0.41C
2-0.46D
2。
2.2.2.2 验证实验结果
由上述回归方程计算得知,当A=0.47、B=0.39、C=0.72、D=-0.33时,Y出现极大值。即当提取条件为pH 7.2、液固比32∶1(mL/g)、超声功率268 W、超声时间7.68 min时,连钱草多糖的提取率最高,达5.09%。为了操作方便,将优化的工艺定为:pH 7.2、液固比32∶1(mL/g)、超声功率270 W、超声时间8 min。并对优化的工艺进行验证,得到多糖的提取率在4.95%~5.12%之间,说明该工艺稳定可靠,对生产实践具有很好的指导作用。
本课题组曾优化水浴法提取连钱草多糖的工艺,得到的最佳工艺为pH 7.2、液固比33∶1(mL/g)、提取温度89 ℃、提取时间160 min,在此条件下,多糖得率为(3.40±0.05)% [12]。与水浴提取法相比,超声辅助法不仅缩短了提取时间,还大大提高了提取率。
2.2.2.3 响应面分析
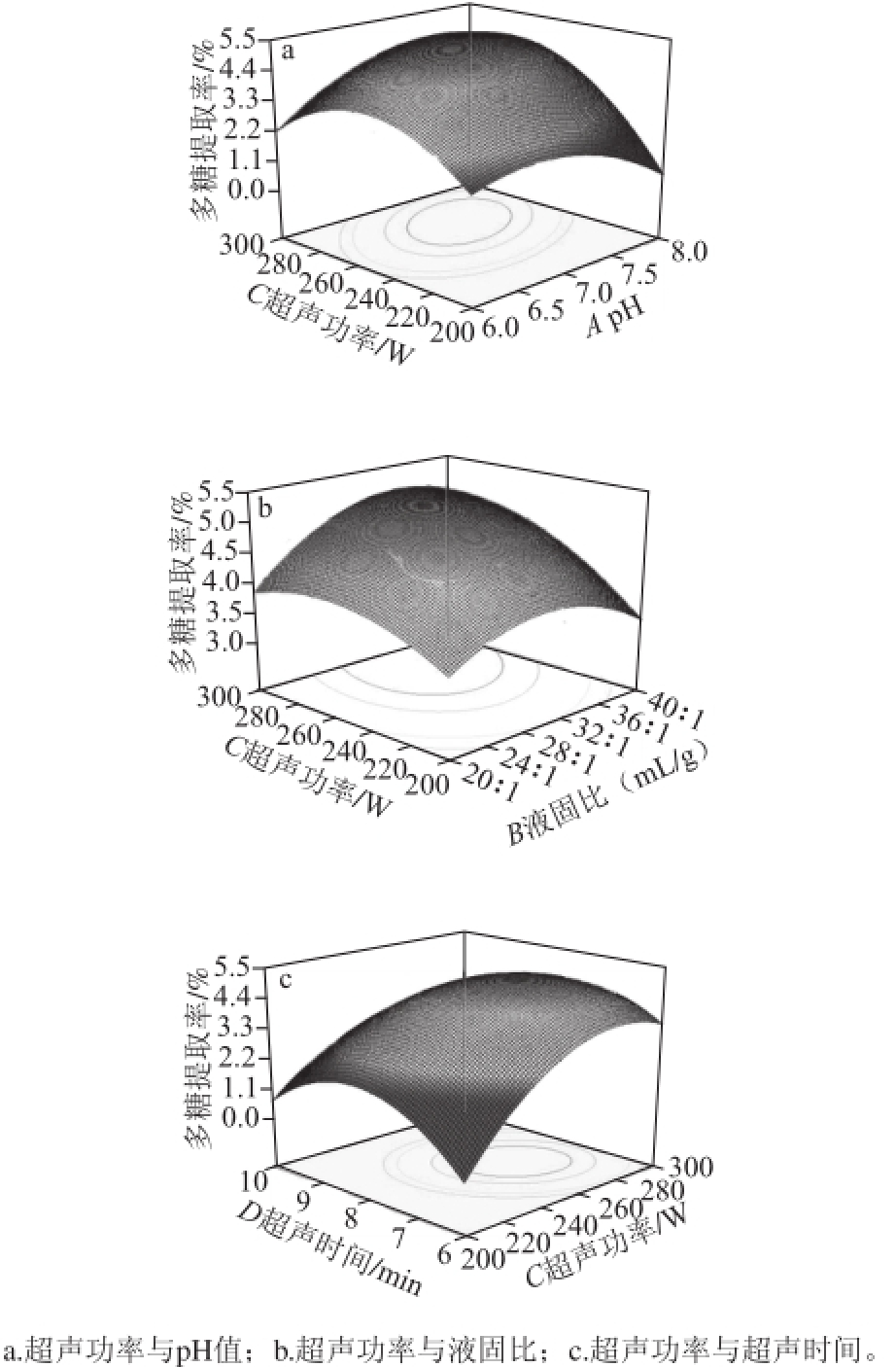
图2 各因素交互作用对连钱草多糖提取率的影响
Fig.2 Interactive effects of extraction parameters on the yield of polysaccharides
由表3可以得知,pH值与超声功率、液固比与超声功率、超声功率与超声时间的交互作用能显著影响连钱草多糖的提取率(P<0.05)。通过响应面分析可以看出,液固比32∶1(mL/g)、超声时间7.68 min时,随着pH值的上升和超声功率的加大,多糖提取率急剧增加,当pH 7.0~7.5、超声功率260~280 W时,多糖提取率最高(图2a),当pH值和超声功率继续提高后,多糖提取率急剧下降。这可能是因为pH值不适宜时,即使提高超声功率,多糖也不易溶出;如pH值适宜,超声功率过小,多糖溶出速率慢,超声功率过大又会破坏多糖的结构,均使提取率降低;只有二者协同作用,都达到最佳条件时,提取率才会最大。如图2b所示,当pH 7.2、超声时间7.68 min时,多糖提取率随着液固比和超声功率水平的上升急剧增加,液固比约32∶1(mL/g)、超声功率260~280 W时,达到最大值,随后提取率随二者的增加急剧下降。如图2c所示,pH值和液固比分别为7.2和32∶1(mL/g)时,超声功率和时间水平的上升会使多糖提取率急剧提高,随后提取率上升趋势变缓,当超声功率260~280 W、超声时间7~8 min时,多糖的提取率最高。
2.3 连钱草多糖体外抗氧化活性测定结果
Trolox由于具有较强的抗氧化能力,常被用作体外抗氧活性测定的标准品 [21-22]。本研究采用Trolox为标准品,将连钱草多糖的5 个体外抗氧化活性指标以每毫克μmol Trolox当量表示,能具体显示多糖的体外抗氧化活性。
2.3.1 DPPH自由基清除能力
Trolox在2.5~80 μmol/L浓度范围内与DPPH自由基清除率线性方程为y=0.002 9x-0.016 4,决定系数R 2为0.954 5,将测得的连钱草多糖DPPH自由基清除率代入方程中得连钱草多糖DPPH自由基清除能力为(0.51±0.04)μmol Trolox/mg。
DPPH自由基清除能力是常用的体外抗氧化活性指标,多糖能清除DPPH自由基是因为它们能提供质子。Thetsrimuang等 [23]从真菌Lentinus polychrous Lév.的菌丝体、新鲜子实体、干燥子实体中提取了多糖,并比较了3 种粗多糖的DPPH自由基清除能力,发现菌丝体多糖的清除能力最强,达0.131 μmol Trolox/mg。因此,连钱草多糖的DPPH自由基清除能力明显强于Lentinus polychrous Lév.菌丝体多糖,这可能是因为连钱草多糖能提供更多的质子清除DPPH自由基。
2.3.2 ABTS +•清除能力
当Trolox浓度在1.25~40 μmol/L范围内与ABTS +•清除率的线性方程为y=0.008 9x+0.031 2,决定系数R 2为0.972 3,将测得的连钱草多糖ABTS +•清除率代入上述回归方程中,得到连钱草多糖的ABTS +•清除能力为(0.69±0.04)μmol Trolox/mg。
Mateos-Aparicio等 [24]依次用0.05 mol/L NaOH、1 mol/L KOH和4 mol/L KOH溶液从豆渣的乙醇不溶物中提取出3 种多糖0.05MSF(0.05 mol/L NaOH溶液、0.05 mol/L NaOH可溶性多糖)、1MSF(1 mol/L KOH溶液、1 mol/L KOH可溶性多糖)、4MSF(4 mol/L KOH溶液、4 mol/L KOH可溶性多糖),对ABTS +•清除能力进行评价,3 种多糖的ABTS +•清除能力分别为(0.078±0.005)、(0.068±0.007)、(0.063±0.004)μmol Trolox/mg,由此可知连钱草多糖的ABTS +•清除能力大于豆渣中提取的多糖。由于清除ABTS +•涉及到电子的转移,所以连钱草多糖较大豆渣中提取的多糖能提供更多的电子。
2.3.3 Fe 2+螯合力
在一定浓度范围内(7.8、15.6、31.3、62.5、125、250 μmol/L),EDTA 的Fe 2+螯合力与浓度呈线性关系(y=0.003 7x+0.073 6,R 2为0.937 9),由该线性方程得到连钱草多糖的Fe 2+螯合力为(0.51±0.29)μmol EDTA/mg。
一些过渡金属如Fe 2+、Cu +、Pb 2+、Co 2+等能促使活性氧(reactive oxygen species,ROS)的产生,其中Fe 2+是最强的促氧化剂,能导致脂质过氧化体的产生 [25];菲咯嗪能与Fe 2+形成在562 nm波长处有吸收峰的Fe 2+-菲咯嗪复合物,当加入抗氧化剂后,该吸光度减弱,并在一定范围内呈线性关系,可以反映样品的Fe 2+螯合力 [26]。
Jiang Changxing等 [27]的研究表明,采用超声辅助提取的榕树(Ficus microcarpa)气生根多糖在3.6 mg/mL时,Fe 2+螯合率达81.3%。Yuan等 [28]从桑叶中提取了粗桑叶多糖(mulberry leaves polysaccharides,MLP),并将MLP进行分离纯化,得到两种纯的多糖MLP-3a和MLP-3b,对这3 种多糖的Fe 2+螯合力进行了测定,发现当质量浓度为4.0 mg/mL时,它们的 Fe 2+螯合率分别为92.96%、51.33%、87.76%。
关于多糖螯合Fe 2+的机理至今鲜见系统阐述,但有研究者证实如某物质含两个或两个以上如下基团:—OH、—SH、—COOH、—PO 3H 2,、C=O、—NR 2、—S—和—O—,并能进行有效地配置,就会具有金属螯合能力 [29];对槲皮素螯合金属的机理也证明这一点 [30]。因此,推测多糖螯合Fe 2+的机理也是因为具有某些上述功能团,但具体的作用原理还需进一步研究。
2.3.4 FRAP值
抗氧化剂将铁-三吡啶三吖嗪(Fe 3+-TPTZ)复合物还原成蓝色的亚铁离子形式(Fe 2+),此形式在593 nm波长处有吸收峰,吸光度越高,抗氧化力越强。
Trolox在一定浓度范围内(5~160 μmol/L),FRAP值与其浓度成正比,线性方程为y=0.001 4x+0.004 5,决定系数R 2为0.997 9。由此,测得连钱草多糖的FRAP为(3.45±0.03)μmol Trolox/mg。
多糖能阻止Fe 3+转化为Fe 2+,其中一个原因是能提供电子,另一个原因是具有大量重复的—OH [31]。Gómez-Ordóñez等 [32]依次采用冷水、热水、0.1 mol/L HCl溶液和2 mol/L KOH溶液提取,从食用红藻Mastocarpus stellatus中得到4 种多糖,测量4 种多糖的FRAP值,得到最高的为冷水提取组分,为0.045 μmol Trolox/mg。所以,连钱草多糖的还原Fe 3+能力要高于食用红藻Mastocarpus stellatus中的4 种多糖。这可能是因为连钱草多糖提取电子的能力强于食用红藻Mastocarpus stellatus中的4种多糖或具有更多的—OH的重复结构。
2.3.5 DMPD自由基清除能力
以Trolox浓度(6.25~100 μmol/L)为自变量,以DMPD自由基清除率为因变量,得到DMPD自由基清除率与Trolox浓度的线性方程为y=0.008 6x+0.043 8(决定系数R 2为0.936 9)。将测得的连钱草多糖的DMPD自由基清除率代入上述方程中,得到连钱草多的DMPD自由基清除能力为(0.17±0.01)μmol Trolox/mg。
DMPD在含有适宜氧化剂的酸性溶液中能形成稳定的DMPD自由基,该自由基在505 nm波长处有最大吸收峰。抗氧化剂如能提供氢原子给DMPD自由基,则会在波长505 nm处的吸光度降低,该方法与ABTS +•清除能力的测定相比,终点吸光度更稳定。这种方法对疏水性物质的测定灵敏性和重复性都要差,而多糖大多为亲水性的,所以,此法特别适合测定多糖的抗氧化性 [33]。
Rana等 [34]检测了印度黄檀(Dalbergia sissoo)叶、柚木(Tectona grandis)皮和美洲含羞草(Mimosa diplotricha)种子多糖的DMPD自由基清除能力,结果显示3 种多糖IC 50值分别为(3.360±0.080)、(2.360±0.070)、(4.980±0.100) mg/mL。本研究采用μmol Trolox/mg为单位对连钱草多糖的DMPD自由基清除能力进行量化,由于采用了不同的标准来衡量多糖的DMPD自由基清除能力,所以无法比较其能力的强弱。
本研究采用中心复合试验优化了超声辅助提取连钱草多糖的工艺,当提取条件为pH 7.2、液固比32∶1(mL/g)、超声功率268 W、超声时间7.68 min时,连钱草多糖的提取率达到5.09%,优于水浴提取法;并研究了连钱草多糖体外抗氧化活性,表明连钱草多糖具有较强的DPPH自由基、ABTS +•清除能力,较高的Fe 2+螯合力、FRAP值以及DMPD自由基清除能力。因此,连钱草多糖有望开发成具有很好抗氧化活性的药物或食品添加剂。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典: 一部[M]. 2010版. 北京: 中国医药科技出版社, 2010: 158-159.
[2] 杨念云, 刘培, 郭建明. 连钱草提取物对肾结石模型大鼠的防治作用[J]. 中国现代应用药学, 2014, 31(8): 918-920. DOI:10.13748/ j.cnki.issn1007-7693.2014.08.004.
[3] 陶勇, 石米扬. 连钱草的抑菌活性研究[J]. 中国医院药学杂志, 2011, 31(10): 824-825.
[4] 何平, 邹佳峻, 费士杰. 连钱草水提物抗炎镇痛实验研究[J]. 云南中医中药杂志, 2014, 35(2): 63-64.
[5] 袁春玲, 王佩琪, 郭伟英. 连钱草的降血糖作用及其机制研究[J]. 中药药理与临床, 2008, 24(3): 57-58. DOI:10.13412/j.cnki.zyyl.2008.03.023.
[6] QIAO Z, KOIZUMI Y, ZHANG M, et al. Anti-melanogemesis effect of Glechoma hederacea L. extract on B 16murine melanoma cells[J]. Bioscience Biotechnology and Biochemistry, 76(10): 1877-1883. DOI:10.1271/bbb.120341.
[7] HWANG J K, ERKHEMBAATAR M, GU D R, et al. Glechoma hederacea suppresses RANKL-mediated osteoclastogenesis[J]. Journal of Dental Research, 2014, 93(7): 685-690. DOI:10.1177/0022034514536579.
[8] 杨念云, 段金廒, 李萍, 等. 连钱草中的黄酮类化学成分[J].中国药科大学学报, 2005, 36(3): 210-212. DOI:10.3321/ j.issn:1000-5048.2005.03.004.
[9] 黄天赐, 聂晶, 张立群. 连钱草中黄酮、有机酸类成分的HPLC指纹图谱[J]. 中国实验方剂学杂志, 2013, 19(1): 132-135. DOI:10.13422/ j.cnki.syfjx.2013.01.041.
[10] 朱求方, 王永毅, 瞿海斌. 连钱草的化学成分研究[J]. 中草药, 2013, 44(4): 387-390. DOI:10.13422/j.cnki.syfjx.2013.01.041.
[11] 刘杰, 李国强, 吴霞, 等. 连钱草的化学成分研究[J]. 中国中药杂志, 2014, 39(4): 695-698. DOI:10.4268/cjcmm20140428.
[12] 姜宁, 刘晓鹏, 张俊霞, 等. Box-Behnken设计-效应面法优化连钱草多糖提取工艺[J]. 食品工业科技, 2015, 36(14): 317-320; 326. DOI:10.13386/j.issn1002-0306.2015.14.056.
[13] 郑义, 王卫东, 李勇, 等. 高良姜多糖提取工艺优化及其抗氧化活性[J]. 食品科学, 2014, 35(2): 126-131. DOI:10.7506/spkx1002-6630-201402023.
[14] 张惟杰. 复合多糖生化研究技术[M]. 上海: 上海科学技术出版社, 1987: 7.
[15] 杜俊娜, 陈书霞, 程智慧, 等. 响应曲面法优化大蒜中总酚提取工艺及其抗氧化活性测定[J]. 食品科学, 2012, 33(10): 72-77.
[16] 田春莲, 蒋凤开. 茜草总黄酮提取工艺研究[J]. 食品科学, 2011, 32(24): 60-63.
[17] GÜLCIN I, HUYUT Z, ELMASTAS M, et al. Radical scavenging and antioxidant activity of tannic acid[J]. Arabian Journal of Chemistry, 2010, 3(1): 43-53. DOI:10.1016/j.arabjc.2009.12.008.
[18] CHEN D, FAN J, WANG P, et al. Isolation, identification and antioxidative capacity of water-soluble phenylpropanoid compounds from Rhodiola crenulata[J]. Food Chemistry, 2012, 134(4): 2126-2133. DOI:10.1016/j.foodchem.2012.04.011.
[19] AK T, GÜLCIN I. Antioxidant and radical scavenging properties of curcumin[J]. Chemico-Biological Interactions, 2008, 174(1): 27-37. DOI:10.1016/j.cbi.2008.05.003.
[20] FERNANDES V C, DOMINGUES V F, FREITAS V, et al. Strawberries from integrated pest management and organic farming: phenolic composition and antioxidant properties[J]. Food Chemistry, 2012, 134(4): 1926-1931. DOI:10.1016/j.foodchem.2012.03.130.
[21] VERNAZA M G, DIA V P, MEJIA E G, et al. Antioxidant and antiinflammatory properties of germinated and hydrolysed Brazilian soybean flours[J]. Food Chemistry, 2012, 134(4): 2217-2225. DOI:10.1016/j.foodchem.2012.04.037.
[22] SOVRANI V, BLANDINO M, SCARPINO V, et al. Bioactive compound content, antioxidant activity, deoxynivalenol and heavy metal contamination of pearled wheat fractions[J]. Food Chemistry, 2012, 135(1): 39-46. DOI:10.1016/j.foodchem.2012.04.045.
[23] THETSRIMUANG C, KHAMMUANG S, CHIABLAEM K, et al. Antioxidant properties and cytotoxicity of crude polysaccharides from Lentinus polychrous Lév.[J]. Food Chemistry, 2011, 128(3): 634-639. DOI:10.1016/j.foodchem.2011.03.077.
[24] MATEOS-APARICIO I, MATEOS-PEINADO C, JIMÉNEN-ESCRIG A, et al. Multifunctional antioxidant activity of polysaccharide fractions from the soybean byproduct okara[J]. Carbohydrate Polymers, 2010, 82(2): 245-250. DOI:10.1016/j.carbpol.2010.04.020.
[25] XIONG Q, LI X, ZHOU R, et al. Extraction, characterization and antioxidant activities of polysaccharides from E. corneum gigeriae galli[J]. Carbohydrate Polymers, 2014, 108(12): 247-256. DOI:10.1016/j.carbpol.2014.02.068.
[26] TANG J, NIE J, LI D, et al. Characterization and antioxidant activities of degraded polysaccharides from Poria cocos sclerotium[J]. Carbohydrate Polymers, 2014, 105(5): 121-126. DOI:10.1016/ j.carbpol.2014.01.049.
[27] JIANG C X, LI X, JIAO Y P, et al. Optimization for ultrasoundassisted extraction of polysaccharides with antioxidant activity in vitro from the aerial root of Ficus microcarpa[J]. Carbohydrate Polymers, 2014, 110(38): 10-17. DOI:10.1016/j.carbpol.2014.03.027.
[28] YUAN Q X, XIE Y F, WANG W, et al. Extraction optimization, characterization and antioxidant activity in vitro of polysaccharides from mulberry (Morus alba L.) leaves[J]. Carbohydrate Polymers, 2015, 128(1): 52-62. DOI:10.1016/j.carbpol.2015.04.028.
[29] YUAN Y V, BONE D E, CARRINGTON M F. Antioxidant activity of dulse (Palmaria palmata) extract evaluated in vitro[J]. Food Chemistry, 2005, 91(3): 485-494. DOI:10.1016/j.foodchem.2004.04.039.
[30] FIORUCCI S, GOLEBIOWSKI J, CABROL-BASS D, et al. DFT study of quercetin activated forms involved in antiradical, antioxidant, and prooxidant biological processes[J]. Journal of Agricultural and Food Chemistry, 2007, 55(3): 903-911. DOI:10.1021/jf061864s.
[31] SHENG J, SUN Y. Antioxidant properties of different molecular weight polysaccharides from Athyrium multidentatum (Doll.) Ching[J]. Carbohydrate Polymers, 2014, 108(1): 41-45. DOI:10.1016/ j.carbpol.2014.03.011.
[32] GŁMEZ-ORDŁÑEZ E, JIMÉNEZ-ESCRIG A, RUPÉREZ P. Bioactivity of sulfated polysaccharides from the edible red seaweed Mastocarpus stellatus[J]. Bioactive Carbohydrates and Dietary Fibre, 2014, 3(1): 29-40. DOI:10.1016/j.bcdf.2014.01.002.
[33] GÜLCIN I, BURSAL E, SEHITOĞLU M H, et al. Polyphenol contents and antioxidant activity of lyophilized aqueous extract of propolis from Erzurum, Turkey[J]. Food and Chemical Toxicology, 48(8/9): 2227-2228. DOI:10.1016/j.fct.2010.05.053.
[34] RANA V, DAS M K, GOGOI S, et al. Multifunctional properties of polysaccharides from Dalbergia sissoo, Tectona grandis and Mimosa diplotricha[J]. Carbohydrate Polymers, 2014, 102(4): 341-350. DOI:10.1016/j.carbpol.2013.11.035.
Optimization by Response Surface Methodology of Ultrasound-Assisted Extraction and Antioxidant Activities of Polysaccharides from Glechoma longituba (Nakai) Kupr.
LIU Xiaopeng
1,2,3, ZHANG Junxia
1, JIANG Ning
1,
*, SONG Yizhi
1, XIANG Jiqian
1, WANG Qiushuang
2, WU Hao
3
(1. College of Biological Science and Technology, Hubei University for Nationalities, Enshi 445000, China; 2. Postdoctoral Research Station, Nanjing Medical Co. Ltd., Nanjing 210012, China; 3. Postdoctoral Research Station, Nanjing University of Chinese Medicine, Nanjing 210023, China)
Abstract:In this study, we optimized the ultrasound-assisted extraction of polysaccharides from the dried aboveground part of Glechoma longituba (Nakai) Kupr. by response surface methodology (RSM) based on central composite design and measured the antioxidant activities of the extracted polysaccharides using 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging, 2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid radical (ABTS +·) scavenging, Fe 2+chelating activity, ferric reducing antioxidant power (FRAP), and N,N-dimethyl-p-phenylenediamine radical scavenging methods. The optimal extraction conditions were obtained as follows: pH, 7.2; liquid-to-solid ratio, 32:1 (mL/g); ultrasonic power, 270 W; and ultrasonic time, 8 min. Under these conditions, the yield of polysaccharides was 4.95%–5.12%. The extracted polysaccharides exhibited powerful antioxidant activities. The DPPH radicals and ABTS +· scavenging activities, Fe 2+chelating activity, FRAP value and DMPD radical scavenging capacity were (0.51 ± 0.04) μmol Trolox equivalent (TE)/mg, (0.69 ± 0.04) μmol TE/mg, (0.51 ± 0.29) μmol EDTA-2Na equivalent (EE)/mg, (3.45 ± 0.03) μmol TE/mg and (0.17 ± 0.01) μmol TE/mg, respectively.
Key words:Glechoma longituba (Nakai) Kupr.; polysaccharides; ultrasound-assisted extraction; response surface methodology; antioxidant activity
DOI:10.7506/spkx1002-6630-201604003
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2016)04-0013-07
引文格式:
刘晓鹏, 张俊霞, 姜宁, 等. 响应面试验优化超声辅助提取连钱草多糖工艺及其体外抗氧化活性[J]. 食品科学, 2016, 37(4): 13-19. DOI:10.7506/spkx1002-6630-201604003. http://www.spkx.net.cn
LIU Xiaopeng, ZHANG Junxia, JIANG Ning, et al. Optimization by response surface methodology of ultrasound-assisted extraction and antioxidant activities of polysaccharides from Glechoma longituba (Nakai) Kupr.[J]. Food Science, 2016, 37(4): 13-19. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604003. http://www.spkx.net.cn
收稿日期:2015-06-29
基金项目:“十二五”国家科技支撑计划项目(2011BAI04B04-5);江苏省“企业博士后集聚计划”项目(2011033);
2013年湖北省战略性新兴(支柱)产业人才培养(生物工程)项目;
2014年度湖北省本科高校“专业综合改革”试点项目(生物工程)
作者简介:刘晓鹏(1971—),男,副教授,博士,研究方向为天然产物。E-mail:18913386031@189.cn
*通信作者:姜宁(1968—),女,副教授,硕士,研究方向为天然产物。E-mail:jiangn888@163.com