表1 响应面试验因素与水平
Table 1 Factors and levels used in response surface analysis

水平因素X 1料液比(g/mL)X 2结晶温度/℃ X 3结晶时间/h-11∶16016 0 1∶12520 1 1∶8 1024
王佳奇,宋明铭,陈 凯,王月亮,丁传波,郑毅男,申 雷,刘文丛
*
(吉林农业大学中药材学院,吉林 长春 130118)
摘 要:目的:优选落叶松中二氢槲皮素的最佳纯化工艺。方法:在单因素试验的基础上,运用Box-Behnken响应面法设计料液比、结晶温度和结晶时间三因素三水平的试验模型,以二氢槲皮素的纯度作为评价指标,对二氢槲皮素的纯化工艺进行优化。结果:最佳纯化条件为料液比1∶12(g/mL)、结晶温度5 ℃、结晶时间20 h。结论:研究结果可为二氢槲皮素纯化工艺的确定以及工业生产提供科学依据。
关键词:二氢槲皮素;重结晶;响应面
落叶松,学名为Larix gmelinii (Rupr.) Kuzen,是落叶松属的一种乔木,是我国高山针叶林的重要组成树种。落叶松的分布非常广泛,是一种最耐寒的针叶 树种。落叶松分布在大、小兴安岭、长白山、老爷岭、河北北部、陕西秦岭、甘肃、四川、云南西北部以及新疆等地区。
二氢槲皮素又名花旗松素,是一种天然的活性物质,属于二氢黄酮醇类化合物,广泛存在于落叶松、花旗松、刺玫蔷薇、水红花等植物中 [1-5],具有抗氧化 [6-7]、抗炎 [8]、抗病毒 [9]、防晒美白 [10]、抑制恶性肿瘤细胞生长 [11]、抑制高糖诱导的心肌细胞凋亡 [12-13]等生物活性,因此被广泛应用于食品、保健品、化妆品、医药、工业、农业等多个领域。目前,市场对二氢槲皮素的需求量较大,但其价格颇高,尤其是高纯度的二氢槲皮素。查阅相关文献可知,纯化二氢槲皮素的方法主要是重结晶法、大孔树脂吸附法和聚酰胺树脂吸附法,后两种方法的纯化过程比较复杂,应用于工业化生产时成本较高。本研究采用响应面分析法,根据Box-Behnken试验设计原理,对影响二氢槲皮素重结晶的主要因素行优化,以期能够为工业化生产高纯度二氢槲皮素提供科学依据。
1.1 材料与试剂
落叶松树墩由吉林省临江健维天然生物科技有限公司提供,由吉林农业大学郑毅男教授鉴定为松科(Pinaceae)落叶松属(Larix)植物长白落叶松(Larix olgensis Henry var. koreana Nakai)。
二氢槲皮素标准品(纯度≥99%) 俄罗斯Doio公司;甲醇(色谱级) 美国天地(Tedia)试剂公司;纯净水 杭州娃哈哈集团有限公司;其余试剂均为分析纯 北京化工厂。
1.2 仪器与设备
LC-2010A高效液相色谱(high performance liquid chromatography,HPLC)仪(配有LC solution工作站、SPD-20A紫外检测器) 日本岛津公司;TGL-20B高速台式离心机 上海安亭科学仪器厂;恒温水浴锅 金坛市医疗仪器厂;JHBE-50S闪式提取器 河南金鼎科技有限公司;旋转蒸发仪 上海亚荣生化仪器厂;电子天平 梅特勒-托利多仪器(上海)有限公司;DHG-9140A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司。
1.3 方法
1.3.1 标准曲线绘制
精密称取二氢槲皮素标准品5 mg,用甲醇定容于25 mL容量瓶中,分别移取2、4、6、8 mL对照品溶液于10 mL容量瓶中,用甲醇定容至刻度,得质量浓度分别为0.1、0.2、0.3、0.4 mg/mL的对照品溶液。
H P L C条件:色谱柱:H y p e r s i l O D S 2(4.5 mm×250 mm,5 μm);流动相:冰醋酸-水(1∶59,V/V);流速:1 mL/min;检测波长:288 nm;柱温:30 ℃;进样量:20 μL。
1.3.2 二氢槲皮素粗品的提取
长白落叶松树根部分,粉碎成木屑并烘干。取粉碎后的木屑200 g,加入5 倍量三重水,4 ℃静置12 h,过滤,残渣加入50%乙醇溶液(用盐酸调pH 4),根据料液比1∶5闪提120 s。提取液减压回收乙醇,在60 ℃恒温水浴中浓缩至原体积1/3,加入8 倍50%乙醇溶液,室温沉降2 h,取上清液,减压回收乙醇,浓缩液烘干,得到粗品。
1.3.3 单因素试验
将二氢槲皮素粗品按1∶2(g/mL)比例添加乙醇溶液,加热溶解后,加入一定量的水加热至沸腾,在一定温度条件下重结晶,5 000 r/min离心10 min,弃去上清液,将沉淀在60 ℃恒温水浴中烘干,采用HPLC法测定其纯度。
1.3.3.1 料液比的筛选
固定结晶温度10 ℃、结晶时间18 h,按上述方法,对料液比(二氢槲皮素粗品-水)为1∶4、1∶6、1∶8、 1∶10、1∶12、1∶14、1∶16、1∶18(g/mL)的混合物进行处理,以二氢槲皮素纯度为指标,筛选确定最佳料液比。
1.3.3.2 结晶温度的筛选
固定料液比1∶12(g/mL)、结晶时间18 h,按上述方法,分别在结晶温度为0、5、10、15、25 ℃条件下结晶,以二氢槲皮素纯度为指标,筛选确定最佳结晶温度。
1.3.3.3 结晶时间的筛选
固定料液比1∶12(g/mL)、结晶温度5 ℃,按上述方法,分别结晶12、16、20、24、32 h,以二氢槲皮素纯度为指标,筛选确定最佳结晶时间。
1.3.4 响应面试验
综合单因素试验结果,应用响应面分析法对纯化工艺进行优化。选取料液比、结晶温度和结晶时间3 个因素,通过Design-Expert 8.0.6软件,根据Box-Behnken试验设计原理,对纯化工艺进行响应面分析。试验因素和水平设计如表1所示。
表1 响应面试验因素与水平
Table 1 Factors and levels used in response surface analysis

水平因素X 1料液比(g/mL)X 2结晶温度/℃ X 3结晶时间/h-11∶16016 0 1∶12520 1 1∶8 1024
2.1 二氢槲皮素标准曲线的绘制
测定不同质量浓度的二氢槲皮素标准品溶液在288 nm波长处的峰面积,以质量浓度X(mg/mL)对峰面积Y绘制标准曲线,得到回归方程为:Y=4×10 7X+326 571,R 2=0.999 2,在质量浓度0.1~0.5 mg/mL内呈良好线性关系。
2.2 二氢槲皮素的粗品提取结果
计算得长白落叶松木屑中二氢槲皮素粗品平均含量为21.43 mg/g,其纯度为70%。
2.3 单因素试验结果
2.3.1 料液比对二氢槲 皮素纯度的影响
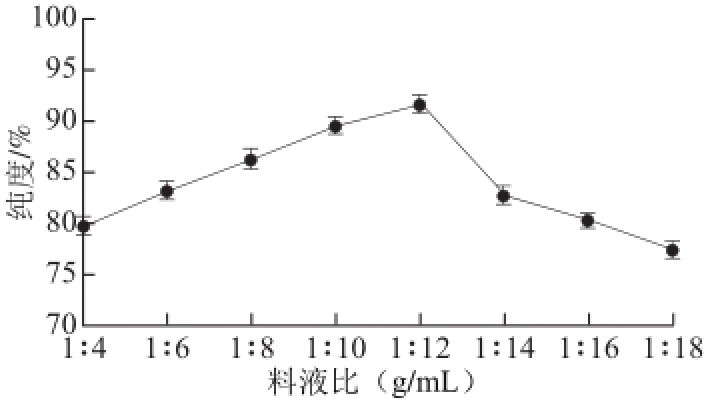
图1 料液比对二氢槲皮素纯度的影响
Fig.1 Effect of solid/liquid ratio on the purity of dihydroquercetin
由图1可知,随着溶剂用量的升高,二氢槲皮素的纯度也随之增 加,当料液比为1∶12时,二氢槲皮素的纯度达到最高,之后又随着溶剂用量的增加而降低。因此,Box-Behnken 试验选取的料液比的范围为1∶8~1∶16。
2.3.2 结晶温度对二氢槲皮素纯度的影响
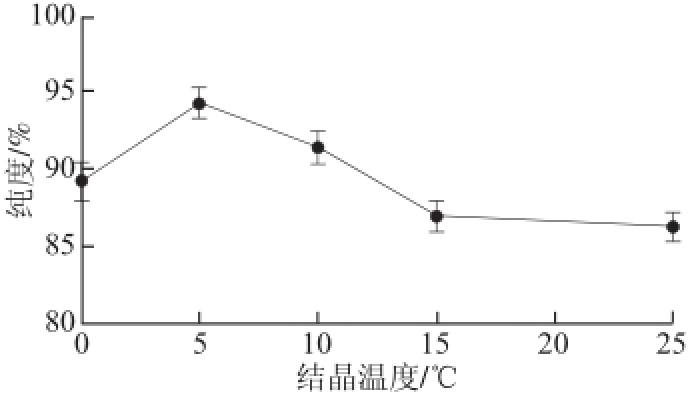
图2 结晶温度 对二氢槲皮 素纯度的影响
Fig.2 Effect of recrystallization temperature on the purity of dihydroquercetin
由图2可知,随着温度的升高,二氢槲皮素的纯度有所增加,在5 ℃时达到最大值,随后又随着温度的升高而有所降低。原因可能是因为温度过低,溶液中的杂质会因结晶速度过快而被包裹在结晶中,而温度过高,使分子的热运动加快,利于溶质由固相向液相转移,因此,Box-Behnken试验选取的结晶温度的范围为0~10 ℃。
2.3.3 结晶时间对二氢槲皮素纯度的影响
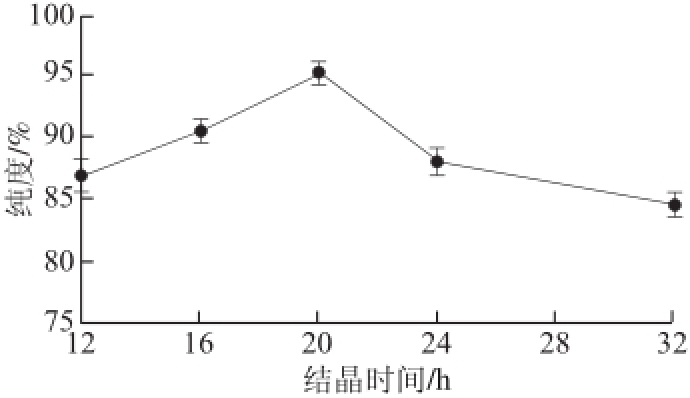
图3 结晶时间对二氢槲皮素纯度的影响
Fig.3 Effect of recryst allization time on the purity of dihy droquercetin
由图3可知,随着结晶时间的延长,二氢槲皮素的纯度有所增加,在20 h时达到最大值,随后又随着结晶时间的延长而有所降低,原因可能是结晶时间短时,二氢槲皮素未被充分结晶出来,而结晶时间较长时,液体中的大量杂质转移到结晶中。因此,Box-Behnken试验选取的结晶时间范围为16~24 h。
2.4 响应面试验结果
2.4.1 响应面试验设计与结果
由单因素试验分析,根据Box-Behnken原理 [14-15]设计了三因素三水平的响应面分析方法进行优化试验。1~12号为析因试验,13~17号为中心试验,分析方案及试验结果见表2。
表2 Box-Behnken试验设计与结果
Table 2 Box-Behnken design with experimental and predicted results
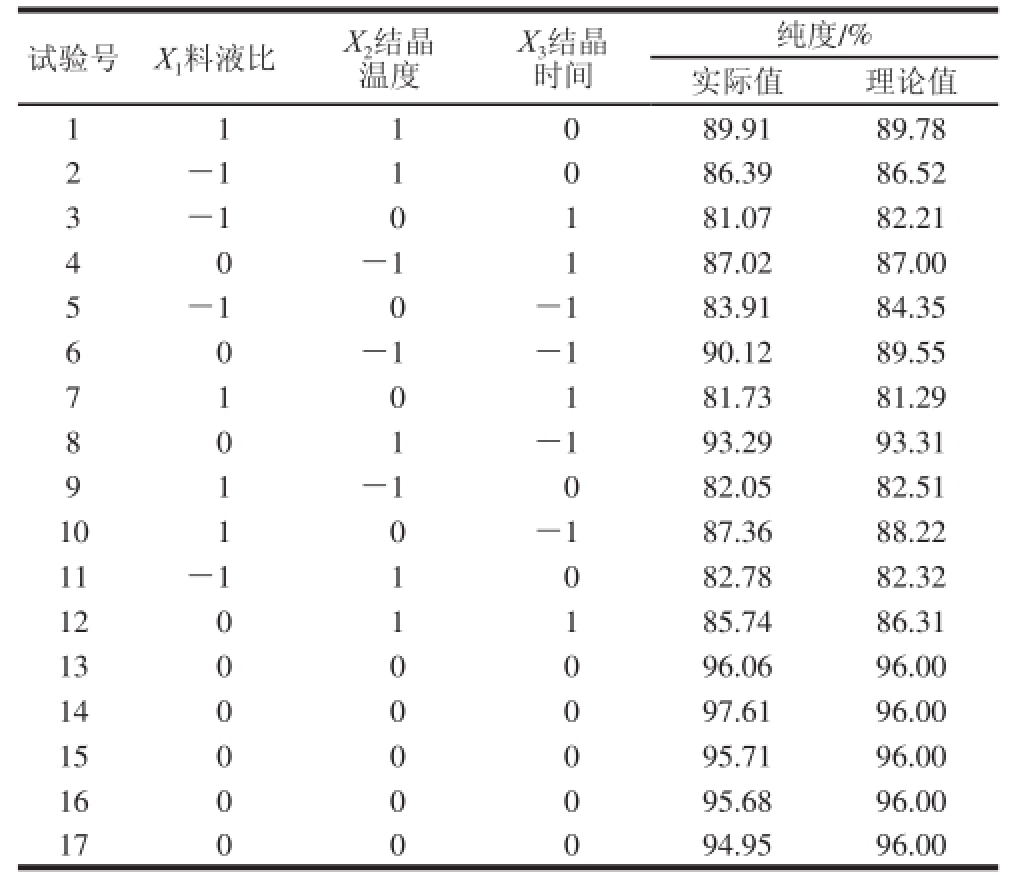
试验号X 1料液比X 2结晶温度X 3结晶时间纯度/%实际值理论值111089.9189.78 2-11086.3986.52 3-10181.0782.21 40-1187.0287.00 5-10-183.9184.35 60-1-190.1289.55 710181.7381.29 801-193.2993.31 91-1082.0582.51 1010-187.3688.22 11-11082.7882.32 1201185.7486.31 1300096.0696.00 1400097.6196.00 1500095.7196.00 1600095.6896.00 1700094.9596.00
2.4.2 模型方程建立与显著性检验
利用Design-Exper 8.0.6软件对试验数据进行多元化回归拟合分析,得到二氢槲皮素纯度与各因素变量的二次方程模型为:
Y=96+0.86X 1+0.77X 2-2.39X 3+2.87X 1X 2-0.70XX-1.11XX-8.12X 2-2.60X 2-4.36X 2 1323123
表3 回归方程方差分析
Table 3 Analysis of variance of regression model
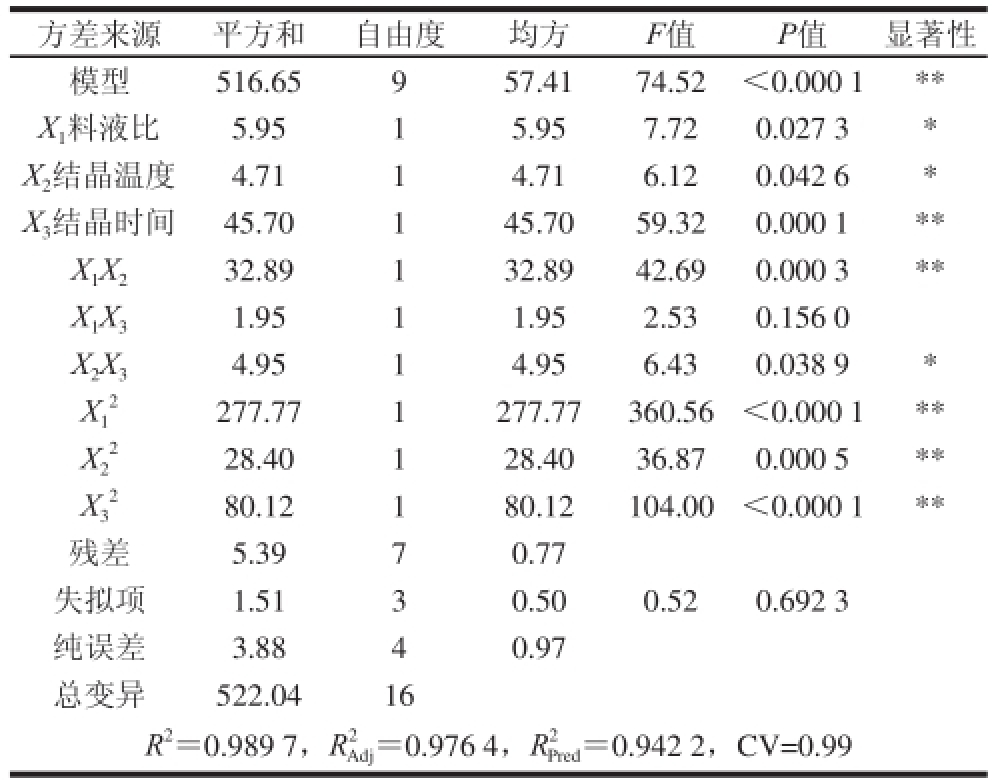
注: *.差异显著(P<0.05); * *.差异极显著(P<0.01)。
方差来源平方和自由度均方F值P值显著性模型516.65957.4174.52<0.000 1 * *X 1料液比5.9515.957.720.027 3 *X 2结晶温度4.7114.716.120.042 6 *X 3结晶时间45.70145.7059.320.000 1 * *X 1X 232.89132.8942.690.000 3 * *X 1 X 31.9511.952.530.156 0 X 2X 34.9514.956.430.038 9 *X 1277.771277.77360.56<0.000 1 * *X2 2 80.12180.12104.00<0.000 1 * *残差5.3970.77失拟项1.5130.500.520.692 3纯误差3.8840.97总变异522.0416 R 2=0.989 7,R 2 Adj=0.976 4,R 2 Pred=0.942 2,CV=0.99 28.40128.4 036.870.000 5 * *X3 22
由表3可知,经F检验显示总模型方程极显著(P<0.01)。回归系数R
2=0.989 7,表明模型相关度好。其校正决定系数
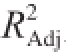 为0.976 4,表明试验误差较小。失拟项P=0.692 3>0.05,表明模型失拟度不显著,可用此模型对结果进行分析和预测。从F值得分析结果可以看出,所选的各因素水平范围内,对二氢槲皮素纯度影响大小的顺序为:结晶时间>料液比>结晶温度。
为0.976 4,表明试验误差较小。失拟项P=0.692 3>0.05,表明模型失拟度不显著,可用此模型对结果进行分析和预测。从F值得分析结果可以看出,所选的各因素水平范围内,对二氢槲皮素纯度影响大小的顺序为:结晶时间>料液比>结晶温度。
2.4.3 响应面分析
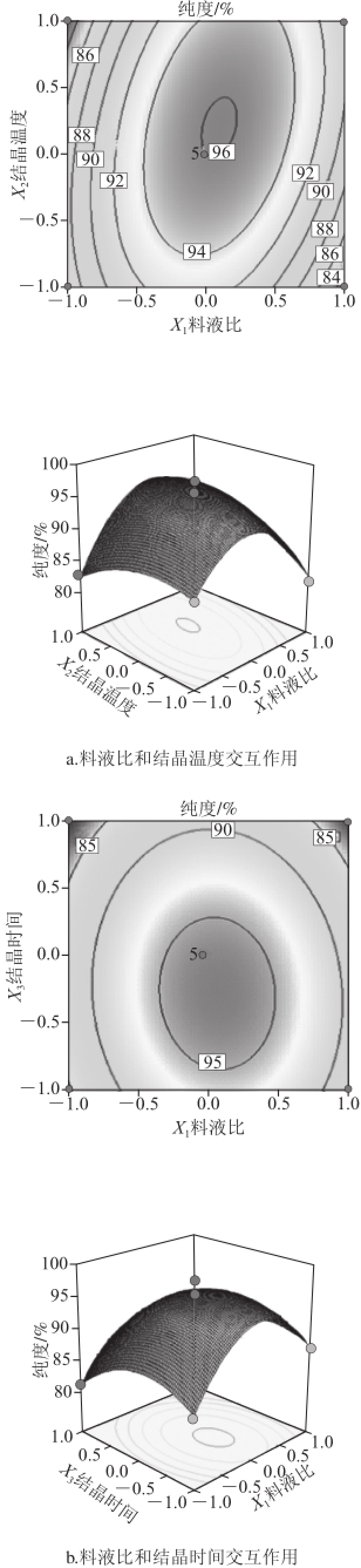

图4 各因素交互作用对二氢槲皮素纯度影响的等高线和响应面图
Fig.4 Response surface and contour plots for the effects of various factors on the purity of dihydroquercetin
由图4和表3中P值可知,模型的一次项X 1、X 2显著,X 3极显著,交互项X 1X 2极显著、X 2X 3显著、X 1X 3不显著,二次项X 1 2、X 2 2、X 3 2都极显著,表明各影响因素对二氢槲皮素纯度的影响不是简单的线性关系。由图4可知,等高线的形状可反映出交互效应的大小强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反 [16]。料液比和结晶温度交互作用最为显著,其次是结晶温度和结晶时间交互作用,比较而言,料液比与结晶时间交互作用最小。
2.5 二氢槲皮素最佳纯化条件验证实验结果
当料液比1∶12、结晶温度5 ℃、结晶时间20 h时,测定二氢槲皮素的纯度为96.20%,与预测值96.00%基本相符合,偏差较小。说明得到的回归方程与实际情况拟合较好,进一步验证了该模型的可行性。
在单因素试验的基础上,通过响应面分析对二氢槲皮素纯化条件进行优化,并得到回归方程。结果表明,各影响因素对二氢槲皮素纯度的影响程度大小依次为结晶时间>料液比>结晶温度。料液比和结晶温度对二氢槲皮素纯度的交互影响最为显著。经回归分析并结合实际条件确定二氢槲皮素最佳纯化工艺为料液比1∶12、结晶温度5 ℃、结晶时间20 h,测定实际二氢槲皮素纯度为96.20%,与预测值96.00%基本相符合,说明该回归方程可以较好预测实验结果。因此,选择响应面法来优化二氢槲皮素纯化工艺是可行的。纯化某一天然产物并非只有一种固定的办法,不同方法各有其优缺点 [17]。
席丹莹等 [18]把二氢槲皮素的粗品用水重结晶达到5 次以上,得纯度为95%的纯品。陈玥舟 [7]比较了H103树脂和聚酰胺树脂纯化二氢槲皮素后的效果,纯化后的纯度为55.0%和72.7%。然后又通过半制备液相色谱仪系统收集二氢槲皮素,冻干后测得样品纯度达到91.7%。张黎等 [19]用酸水解醇提取液,在大孔树脂富集及结晶后,得到二氢槲皮素的纯度大于99%。张泽生等 [20]以水溶剂提取落叶松中的二氢槲皮素,然后比较乙醇沉淀法、大孔树脂吸附法和聚酰胺树脂吸附法3种纯化方法对二氢槲皮素粗提物纯化的效果。其中聚酰胺树脂的纯化效果最佳。Wei Yun等 [21]采用高速逆流色谱法,溶剂系统为乙酸乙酯-甲醇-水(25∶1∶25,V/V),从400 mg草药仙鹤草粗提物中分离出11 mg花旗松素-3-糖苷,分离纯度达到96%。此外还有硅胶色谱法 [22-24]、凝胶色谱法 [25]、HPLC法 [26-30]等。而本 实验采用乙醇和水重结晶的方法纯化二氢槲皮素。此新方法弥补了硅胶色谱和凝胶色谱作用时间长、上样量低,聚酰胺色谱、HPLC和高效逆流色谱分离成本高、处理样品量少的问题,且遵循节约能源、绿色环保的原则,可用于大批量工业生产,具有较高的研究价值。
参考文献:
[1] 崔宝玉, 刘玉, 刘喆, 等. 二氢槲皮素的研究进展[J]. 黑龙江科学, 2010, 1(4): 37-40.
[2] 张宏伟, 郑伟. 二氢槲皮素的研究进展[J]. 口腔护理用品工业, 2011, 20(2): 25-28.
[3] 刘刚, 张雁南, 杜乾坤, 等. 水红花子花旗松素乙醇回流提取工艺优化[J]. 食品与机械, 2013, 29(3): 134-137; 186.
[4] 谭亚南, 佟苗苗, 张宇瑶, 等. 不同贮存期水红花子中花旗松素的含量比较[J]. 中国中药杂志, 2013, 38(17): 2779-2781.
[5] MA C H, YANG L, WANG W J, et al. Extraction of dihydroquercetin from Larix gmelinii with ultrasound-assisted and microwave-assisted alternant diges tion[J]. International Journal of Molecular Sciences, 2012, 13(7): 8789-8804. DOI:10.3390/ijms13078789.
[6] 刘妍, 王遂. 二氢槲皮素的提取及抗氧化性研究[J]. 化学研究与应用, 2011, 21(1): 107-111. DOI:10.3969/j.issn.1004-1656.2011.01.020.
[7] 陈玥舟. 落叶松中二氢槲皮素的提取及活性研究[D]. 天津: 天津科技大学, 201 1.
[8] LEE C W, P ARK N H, KIM J W, et al. Study of skin anti-ageing and anti-inflammatory effects of dihydroquercetin, natur al triterpendoids, and their synthetic derivatives[J]. Bioorg Khim, 2012, 38(3): 374-381.
[9] ZARUBAEV V, GARSHININAI A, KALININA N, et al. Anti-influenza activity of dihydroquercetin against lethal influenza virus infection[J]. Antiviral Research, 2010, 7(4): 50-86. DOI:10.1016/j.antiviral.2010.02.420.
[10] MIYAZAWA M, TAMURA N. Inhibitory compound of tyrosinase activity from the sprout of Polygonum hydropiper L. (Benitade)[J]. Biological and Pharmaceutical Bulletin, 2007, 30(3): 595-597.
[11] 翟延君, 程飞, 王添敏, 等. 花旗松素对人宫颈癌Hela细胞的体外抗肿瘤活性及其机理 研究[J]. 中成药, 2011, 33(12): 2052-2055. DOI:10.3969/j.issn.1001-15 28.2011.12.007.
[12] 师智勇, 孙宗全, 王国华. 花旗松素对大鼠心肌缺血再灌注损伤的保护作用[J]. 华中医学杂志, 2008, 32(4): 287-289.
[13] SUN X, CHEN R C, YANG Z H, et al. Taxifolin prevents diabetic cardio-myopathy in vivo and in vitro by inhibition of oxidative stress and cell apoptosis[J]. Food and Chemical Toxicology, 2014, 63: 2 21-232. DOI:10.1016/j.fct.2013.11.013.
[14] 李志西, 杜双奎. 实验优化设计与统计分析[M]. 北京: 科学出版社, 2010: 212-243.
[15] 李春英, 李晓娟, 杨磊, 等. 响应面分析法优化甘草酸和甘草黄酮联合提取工艺[J]. 黑龙江大学自然科学学报, 2009, 26(3): 390-395. DOI:10.3969/j.issn.1001-7011.2009.03.025.
[16] 刘成梅, 游海. 天然产物有效成分的分离与应用[M]. 北京: 化学工业出版社, 2003: 21.
[17] 谭斌, 周双德, 张友胜. 二氢杨梅素纯化方法的比较研究[J]. 现代食品科技, 2 008, 24(7): 631-634. DOI:10.3969/j.issn.1673-9078.2008.07.004.
[18] 席丹莹, 王正平, 宁正祥. 二氢槲皮素衍生物的制备及其抗氧化性能研究[J]. 现代食品科技, 2007, 23(10): 29-31. DOI:10.3969/ j.issn.1673-9078.2007.10.009.
[19] 张黎, 郭建华, 夏柯, 等. 一种二氢槲皮素单体的分离纯化方法: 中国, CN 101781277A[P]. 2010-07-21.
[20] 张泽生, 陈玥舟, 王利婷. 落叶松中二氢槲皮素提取工艺优化及其纯化的研究[J]. 中国食品添加剂, 2011(5): 54-58. DOI:10.3969/ j.issn.1006-2513.2011.05.002.
[21] WEI Y, XIE Q Q, ITO Y C. Preparative separation of axifolin-3-glucoside, hyperoside and amygdalin from plant extracts by high-speed countercurrent chromatography[J]. Journal of Liquid Chromatography and Related Technologies, 2009, 32(7): 1010-1022. DOI:10.1080/10826070902790983.
[22] 谢周涛, 胡进. 水红花子乙酸乙酯部位化学成分研究[J]. 中药材, 2009, 32(9): 1397-1399. DOI:10.3321/j.issn:1001-4454.2009.09.022.
[23] 王岩, 周莉玲, 李锐, 等. 显齿蛇葡萄化学成分的研究[J]. 中药材, 2002, 25(4): 254-256. DOI:10.3321/j.issn:1001-4454.2002.04.012.
[24] 郑国华, 杨娟, 冯其麟. 霉茶化学成分研究(Ⅱ)[J]. 中药材, 2009, 32(3): 370-372.
[25] 徐任生. 天然产物化学[M]. 2版. 北京: 科学出版社, 2004: 4-20.
[26] 黄阿要, 董瑞建. 功能性成分提取与分离纯化方法研究进展[J]. 扬州大学烹饪学报, 2006(1): 59-62. DOI:10.3969/ j.issn.1009-4717.2006.01.017.
[27] 王宇, 王遂. RP-HCLP法测定落叶松中二氢槲皮素的含量[J]. 化学工程师, 2009(2): 22-24.
[28] 樊铁波, 刘红煜, 汤青, 等. HPLC法测定松针中二氢槲皮素含量[J].中国药师, 2009(8): 1046-1048.
[29] 张元桐, 翟延君, 康廷国, 等. HPLC法测定不同地区水红花子中花旗松素含量[J]. 中国中药杂志, 2007, 32(20): 2190-2191.
[30] 魏艳, 陈晓青, 马志祥, 等. 红蓼不同提取部位花旗松素和总黄酮含量的测定[J]. 中成药, 2008, 30(12): 1853-1855. DOI:10.3969/ j.issn.1001-1528.2008.12.045.
Optimization of Purification Process for Dihydroquercetin in Larch Roots by Response Surface Methodology
WANG Jiaqi, SONG Mingming, CHEN Kai, WANG Yueliang, DING Chuanbo, ZHENG Yinan, SHEN Lei, LIU Wencong *(College of Traditional Chinese Medicine, Jilin Agricultural University, Changchun 130118, China)
Abstract:Objective: To optimize the purification conditions for dihydroquercetin in larch roots. Methods: Single factor method combined with Box-behnkn response surface methodology was used to optimize four factors including solid/liquid ratio, recrystallization temperature and time by establishing a model involvin g four independent variables at three levels each based on dihydroquercetin purity. Results: The optimal purification conditions were determined as recrystallized for 20 h at 5 ℃ at a liquid-to-solid ratio of 1:12 ( dihydroquercetin: water). Conclusion: The results of the study can provide scientific basis for the determination of the purification process of dihydroquercetin in industrial production.
Key words:dihydroquercetin; recrystallization; response surface methodology
DOI:10.7506/spkx1002-6630-201604004
中图分类号:R931.6
文献标志码:A
文章编号:1002-6630(2016)04-0020-05
引文格式:
王佳奇, 宋明铭, 陈凯, 等. 响应面试验优化落叶松中二氢槲皮素纯化工艺[J]. 食品科学, 2016, 37(4): 20-24.
DOI:10.7506/spkx1002-6630-201604004. http://www.spkx.net.cn
WANG Jiaqi, SONG Mingming, CHEN Kai, et al. Optimization of purification process for dihydroquercetin in larch roots by response surface methodology[J]. Food Science, 2016, 37(4): 20-24. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201604004. http://www.spkx.net.cn
收稿日期:2015-06-09
基金项目:国家科技部科技型中小企业技术创新基金项目(13C26212201221)
作者简介:王佳奇(1991—),女,硕士研究生,研究方向为中药新药研究与开发。E-mail:loveyueyang3344@sina.cn
*通信作者:刘文丛(1968—),男,教授,博士,研究方向为中药新药研究与开发。E-mail:jwlw6803@126.com