张 迪
1,刘 洋
1,李书艺
1,2,
*
(1.武汉轻工大学食品科学 与工程学院,湖北 武汉 430023;2.武汉轻工大学 湖北省农产品加工与转化重点实验室,湖北 武汉 430023)
摘 要:以高酸度苹果、富含原花青素的青蛇果为原料,采用单因素试验和Box-Behnken试验设计优化了复合酶辅助提取青蛇果多酚的工艺参数。结果表明:最适多酚提取的复合酶为纤维素酶和果胶酶(质量比2∶1)、酶解温度62 .5 ℃、提取时间82.9 min、pH 3.7,多酚得率最高可达5.07%。统计学分析显示,所选响应面模型合适,并能广泛用于青蛇果多酚的分析和预测。同时,酶法辅助提取青蛇果多酚的粗提物还具有较好的Fe 3+还原能力和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力,其对DPPH自由基的半数抑制浓度(IC 50值)为22.72 øg/mL,可以作为一种良好的食品添加剂和抗氧化剂深度开发利用。
关键词:青蛇果;多酚;复合酶法;响应面设计;抗氧化性
我国是世界上苹果产业规模最大的国家,2012年我国苹果栽培面积和总产量分别达到2.3×10 4km 2和3.8×10 7t [1]。苹果中含有丰富的植物纤维、可溶性糖、矿物质、苹果酸、维生素、蛋白质和多酚类物质。其中多酚类物质主要为酚酸(如绿原酸)、原花青素(儿茶素、表儿茶素及其聚合物)和黄酮(以槲皮素为主),因其对苹果汁颜色、风味,如苦涩味、收敛性等的影响,越来越受到人们的关注 [2-4]。研究表明,苹果多酚不仅具有抗衰老、抗肿瘤、抑菌等的生物活性,还可作为食品添加剂和抗氧化剂用于肉制品,特别是腌制品中 [5-6]。近年来,为了提高苹果及其加工副产物中多酚的有效利用,研究者们已通过多种途径,如有机溶剂提取、超声波、微波辅助提取等试图提高苹果多酚的得率和活性 [7-8],但始终无法避免大量有机试剂如甲醇和乙醇的使用,造成了不可避免的环境污染和能源浪费。基于苹果产业的发展现状和苹果多酚的多重功效,研究开发苹果酚类物质对改善我国苹果加工企业的产品结构,增加企业、果农经济效益固然意义深远,但寻找更加绿色、低碳、环保的生产工艺,才真正符合现代农业高效安全制造和可持续发展的原则。
生物酶法(主要是纤维素酶、果胶酶、蛋白酶等及其复合酶类)作为提取生物活性成分的新技术已十分成熟,并得到广泛的应用 [9-10]。相对于超声、微波法在大规模生产时的局限性,酶处理方法在成本和使用上更加简便,对设备和工艺的要求也较少 [11]。酶反应条件温和,选择性强,但目前为止仍未见用于苹果多酚的提取和制备中。青蛇果(Malus domestica Borkh.)是一种高酸度的苹果,源自美国,且富含原花青素 [12-13];肖俊松等 [4]研究表明,青蛇果原花青素以低聚体为主,可通过TSK HW-40 s树脂对原花青素B 2和C 1的纯品进行制备。因此,本课题采用生物酶法定向可控地制备了青蛇果多酚,通过响应面试验设计优化了复合酶低能耗分离提取多酚的条件工艺,并对粗提物的抗氧化活性进行研究。以期为进一步开发和利用苹果资源、提高苹果产业附加值提供理论参考。
1.1 材料与试剂
青蛇果购于本地超市,原产地秘鲁。
纤维素酶(10 000 U/g)、果胶酶(30 000 U/g)合肥Biosharp生物科技有限公司;福林-酚试剂 美国Sigma公司;无水乙醇、没食子酸、铁氰化钾等(均为分析纯) 国药集团试剂有限公司。
1.2 仪器与设备
UV-2100分光光度计 美国尤尼科公司;水浴锅郑州长城科工贸有限公司;冷冻离心机 长沙平凡仪器仪表有限公司;旋转蒸发仪 德国Buchi公司。
1.3 方法
1.3.1 青蛇果多酚的提取
取5 g去核青蛇果切块,放入0.1%的硫酸氢钠溶液中浸泡数分钟,然后取出在研钵中将其捣碎,并转移至烧杯中。向烧杯中加入50 mL蒸馏水,50 ℃水浴加热60 min,再通过200目滤布过滤,粗滤液于4 000 r/min离心10 min,上清液通过旋转蒸发仪低温浓缩(至15 mL)后为青蛇果多酚粗提液,冷冻干燥可得蛇果粗提物粉末 [4]。
1.3.2 粗提液多酚含量的测定
多酚含量的测定采用Folin-Ciocalteu法 [14],以没食子酸为标准品,在760 nm波长测定反应液吸光度,样品多酚含量以没食子酸的相对值表示,每个样品重复测定3 次。
式中:K为青蛇果多酚得率/%;ρ为所测样液的多酚含量/(mg/mL);n为稀释倍数;V为提取液体积/mL;m为青蛇果质量/g。
1.3.3 单因素试验
1.3.3.1 酶种类及其质量浓度对多酚得率的影响
在青蛇果多酚的酶法制备过程中,影响多酚得率最重要的因素是酶的种类和有效质量浓度。为研究这一因素对多酚得率的影响规律,本试验对反应条件进行了设置:控制酶解反应温度60 ℃、酶解pH 4,然后分别选择不同质量浓度的纤维素酶、果胶酶以及两种酶的复合酶,使之与青蛇果进行持续90 min的酶反应。对提取液进行同1.3.1节的过滤、离心和浓缩后,测定其多酚含量和得率,从而得到最优的复合酶配比。
1.3.3.2 酶解时间对多酚得率的影响
选取最优复合酶,控制其他反应条件(如酶解温度、pH值)同1.3.3.1节,分别测定酶解时间为30、60、90、120、150 min时青蛇果多酚的得率。
1.3.3.3 酶解温度对多酚得率的影响
选取最优复合酶,控制其他反应条件(如酶解时间、pH值)同1.3.3.1节,分别测定酶解温度为30、40、50、60、70 ℃时青蛇果多酚的得率。
1.3.3.4 pH值对多酚得率的影响
选取最优复合酶,控制其他反应条件(如酶解温度、时间)同1.3.3.1节,分别测定pH值为2、3、4、5、6时青蛇果多酚的得率。
1.3.4 响应面试验设计
在单因素试验的基础上对最优复合酶的酶解时间(A)、酶解温度(B)和pH值(C)3 个因素进行响应面设计,以期优化青蛇果多酚的复合酶提取工艺,试验设计方案见表1。对各因素水平条件下青蛇果提取液的多酚含量进行测定,并以计算所得青蛇果多酚的得率为响应值进行统计学回归分析。
表1 复合酶提取青蛇果多酚的响应面试验因素水平
Table 1 Coded levels and corresponding actual values of factors used in in Box-Behnken design

水平因素A酶解时间/minB酶解温度/℃C pH-160503.0 0 90604.0 1 120705.0
1.3.5 青蛇果多酚的抗氧化活性
1.3.5.1 Fe 3+还原能力
采用普鲁士蓝法 [15],配制4 mmol/L铁氰化钾溶液、10%三氯乙酸溶液、2 mmol/L FeCl 3溶液和pH 6.5的磷酸缓冲液。多酚可通过还原Fe 3+为Fe 2+,与铁氰化钾螯合形成一种蓝色化合物,螯合物含量越高,该溶液在700 nm波长处的吸光度就越大,即表示样品还原Fe 3+生成Fe 2+的能力越强。以蒸馏水替代样品为空白,相应质量浓度VC为阳性对照。
1.3.5.2 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力
DPPH自由基是一种以氮为中心的化学性质相对稳定的自由基,可用来评价多酚的抗氧化能力 [16]。将 青蛇果多酚粗提物配制成不同质量浓度的样品溶液(20、40、80、100、200、400 μg/mL),取样液2 mL加入等体积2 mmol/L DPPH溶液,充分混匀,于25 ℃避光反应30 min。取出后,测定其在517 nm波长处的吸光度。用蒸馏水作空白,VC为阳性对照。计算DPPH自由基的清除率,如式(2)所示。并以清除率达到50%时提取物的质量浓度表示其抗氧化能力,即IC 50值(半数抑制浓度)。
式中:A 0为空白对照组的吸光度;A 1为样品反应组的吸光度。
2.1 单因素试验结果
2.1.1 酶种类及其质量浓度对多酚得率的影响
根据福林-酚法,各因素水平条件下青蛇果多酚提取液的多酚含量可通过没食子酸标准曲线:y=0.008 5x+0.045 6(R 2=0.997 6)进行计算。结果表明(表2),不同种类和配比的酶在质量浓度不同(即酶活不同)的情况下,对青蛇果多酚的得率影响显著,且多酚得率随酶质量浓度的提升呈现先增大后略有减少的趋势。果胶酶、纤维素-果胶复合酶(质量比1∶1、1∶2、2∶1)均在质量浓度为2.05 mg/mL时,使青蛇果多酚的得率达到最大;而纤维素酶的质量浓度达到2.55 mg/mL时,多酚得率才出现峰值。其中,由质量浓度2.05 mg/mL的复合酶(质量比2∶1)辅助提取时,青蛇果多酚的得率最高达到5.35%。因此本研究拟定质量浓度为2.05 mg/mL的纤维素-果胶复合酶(质量比2∶1)为最优复合酶,并进行后续试验。
表2 酶种类和质量浓度对青蛇果多酚粗提液多酚得率的影响
Table 2 Effect of enzyme type and concentration on the yield of polyphenols from Granny Smith apple
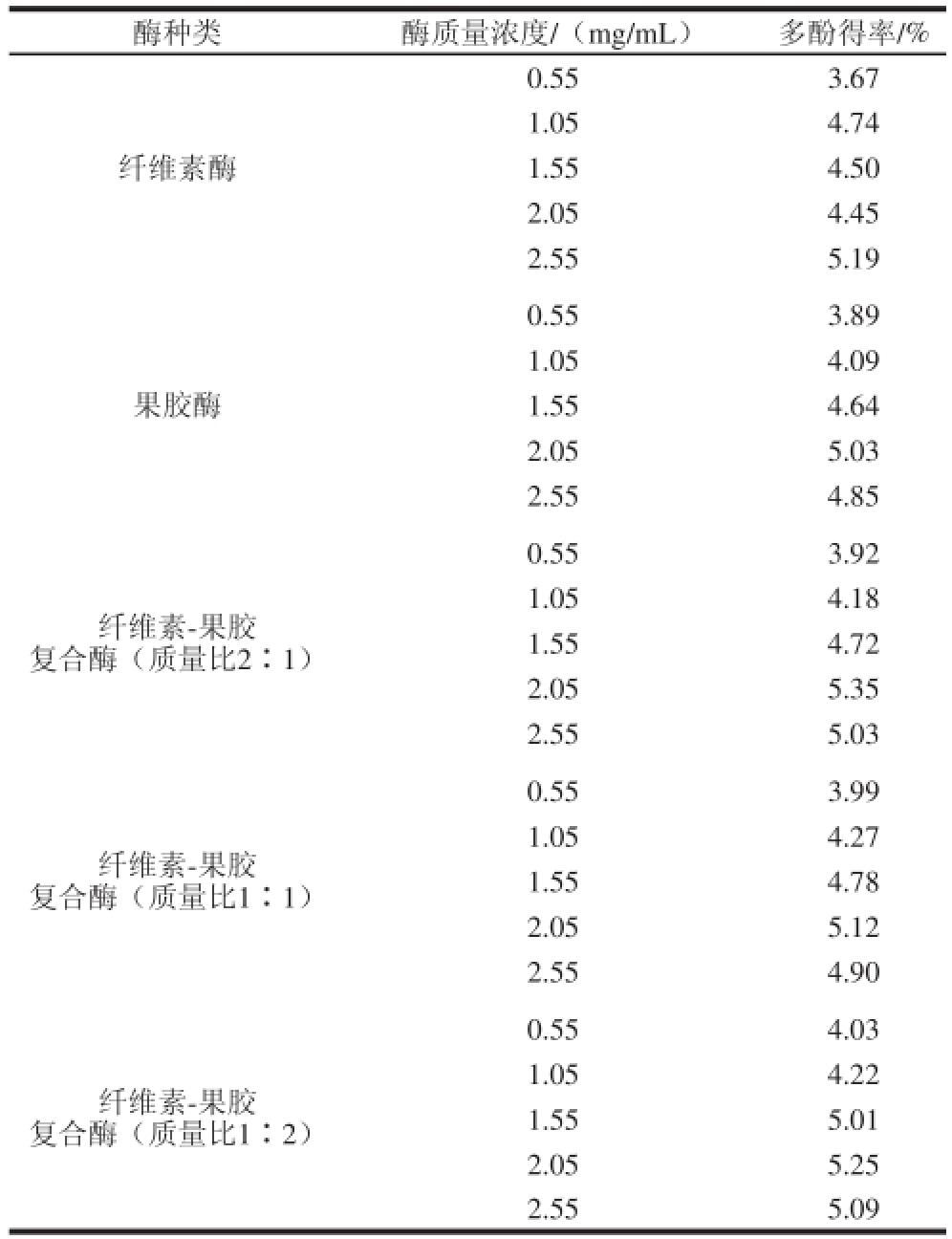
酶种类酶质量浓度/(mg/mL)多酚得率/%纤维素酶0.553.67 1.054.74 1.554.50 2.054.45 2.555.19果胶酶0.553.89 1.054.09 1.554.64 2.055.03 2.554.85纤维素-果胶复合酶(质量比2∶1)0.553.92 1.054.18 1.554.72 2.055.35 2.555.03纤维素-果胶复合酶(质量比1∶1)0.553.99 1.054.27 1.554.78 2.055.12 2.554.90纤维素-果胶复合酶(质量比1∶2)0.554.03 1.054.22 1.555.01 2.055.25 2.555.09
2.1.2 酶解时间对多酚得率的影响
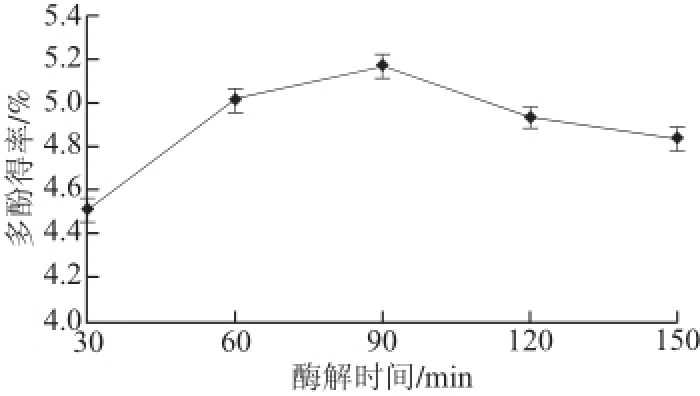
图1 酶解时间对青蛇果多酚得率的影响
Fig.1 Effect of hydrolysis time on extraction yield of polyphenols from Granny Smith apple
由图1可见,在90 min的提取时间内,随着酶解时间的延长,青蛇果多酚的得率逐渐上升;而90 min后得率逐步下降。可能与 酶发挥作用的最适反应时间和温度有关,提取时间越长未必越适合酶活力的发挥。因此,理想的青蛇果酶解时间为90 min,此时多酚得率最高。
2.1.3 酶解温度对多酚得率的影响
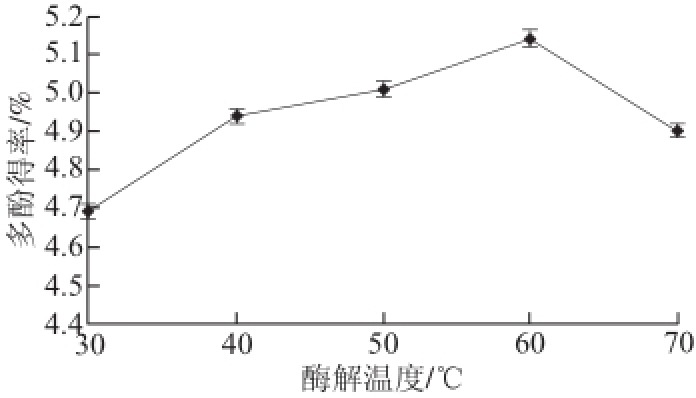
图2 酶解温度对青蛇果多酚得率的影响
Fig.2 Effect of hydrolysis temperature on extraction yield of polyphenols from Granny Smith apple
由图2可见,低于60 ℃时,随着温度的升高,酶活性也升高,多酚得率也随之提高;但温度超过60 ℃后,多酚得率开始下降,说明当温度升高到一定程度时,酶蛋白开始受热变性,使酶的活性降低,从而降低了多酚得率。因此拟确定青蛇果多酚提取的最佳酶解温度应约为60 ℃。
2.1.4 pH值对多酚得率的影响
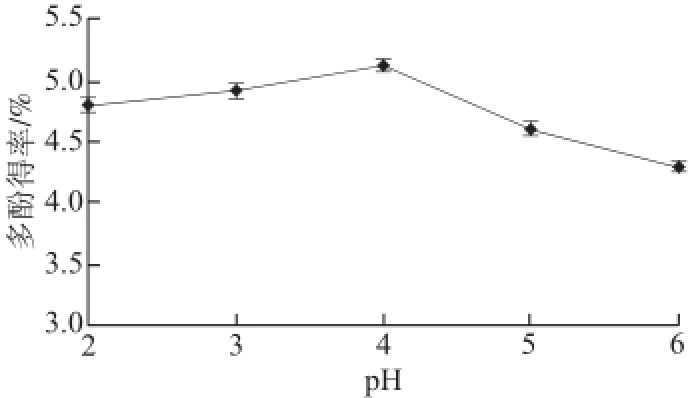
图3 pH值对青蛇果多酚得率的影响
Fig.3 Effect of pH on extraction yield of polyphenols from Granny Smith apple
由图3可见,当提取液pH 2.0~4.0时,青蛇果多酚得率随着pH值升高而提高,在pH值大于4.0后青蛇果多酚得率随着pH值的升高而下降。结果表明复合酶在pH 4.0条件下活性较好,因此将酶解最佳pH值定为4.0,此时青蛇果多酚的得率最高。
2.2 响应面试验结果
2.2.1 响应面试验设计与结果
单因素试验结果显示 ,当纤维素酶和果胶酶质量比2∶1(添加量2.05 mg/mL)、酶解时间90 min、酶解温度60 ℃、pH 4.0时,青蛇果多酚有最大得率。青蛇果多酚提取的响应面试验设计方案与结果 如表3所示。根据1.3.4节中的设计将酶解时间、酶解温度和pH值作变换,以青蛇果多酚得率为响应值(Y),共设17 个试验点,其中12 个为析因点,1 个为中心点,试验进行了5 次,以估计误差。利用Design-Expert 9.0软件对表3数据进 行多元回归拟合,得到多酚得率对以上因素的二次多项回归模型为:Y=5.14-0.031A+0.017B-0.006 25C-0.015AB+0.063AC-0.045BC-0.11A 2-0.08B 2-0.052C 2。
表3 青蛇果多酚提取响应面试验设计与结果
Table 3 Experimental design for response surface analysis and corresponding results of polyphenol extraction from Granny Smith apple
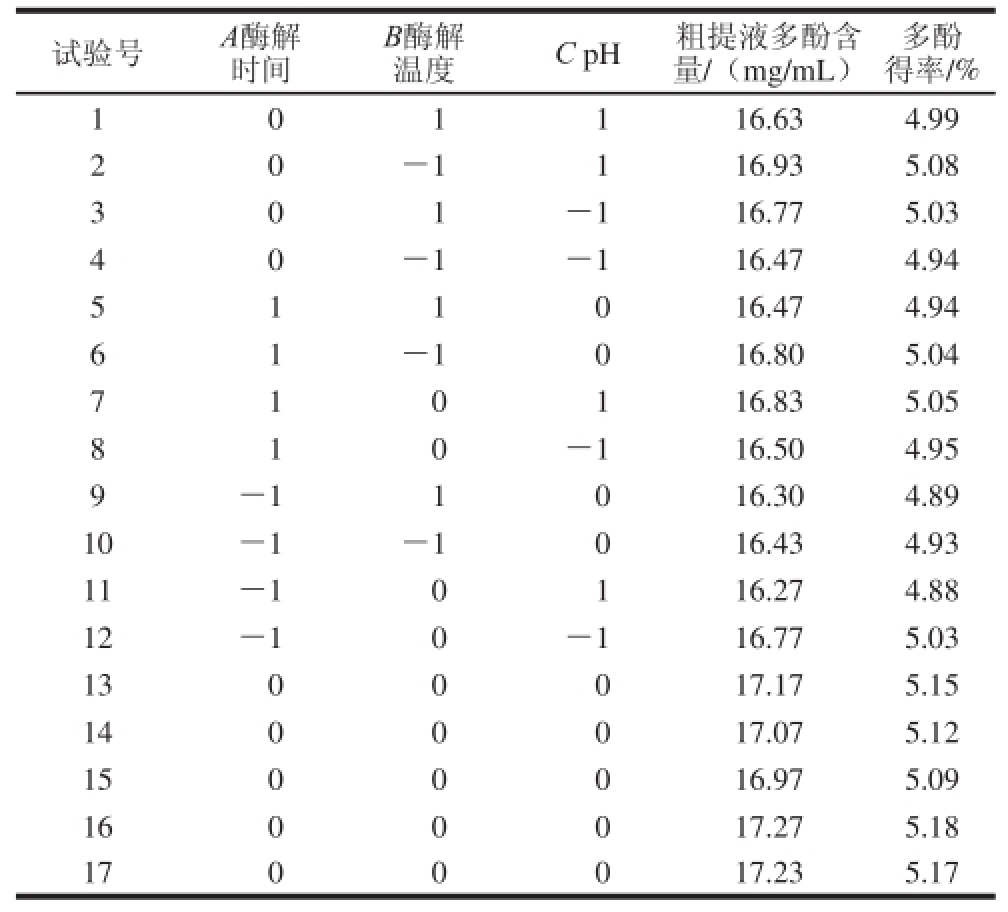
试验号A酶解时间多酚得率/% 1 0 1 116.63 4.99 2 0-1116.93 5.08 3 0 1-116.77 5.03 4 0-1-116.47 4.94 5 1 1 016.47 4.94 6 1-1016.80 5.04 7 1 0 116.83 5.05 0-116. 50 4.95 9-11016.30 4.89 10-1-1016.43 4.93 11-10116.27 4.88 12-10-116.77 5.03 1300017.17 5.15 1400017.07 5.12 1500016.97 5.09 1600017.27 5.18 1700017.23 5.17 8 1 B酶解温度C pH粗提液多酚含量/(mg/mL)
2.2.2 回归模型的方差分析
表4 多酚得率二次多项式回归模型的方差分析
Table 4 Analysis of variance of the regression model for the extraction yield of polyphenols from Granny Smith apple
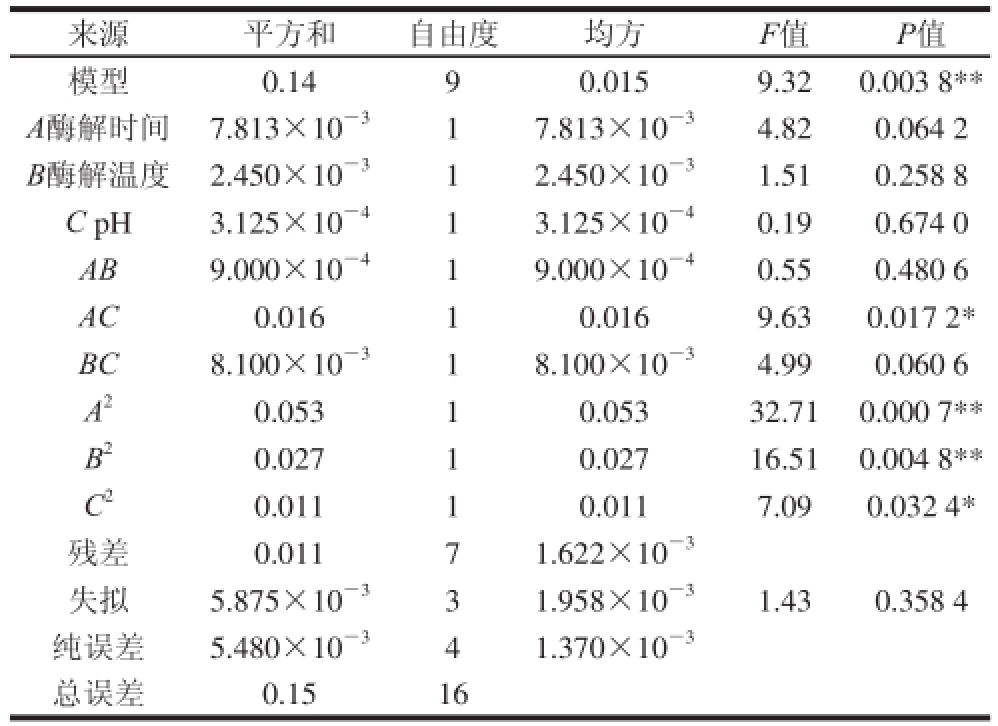
注:R 2=0.922 9, * *.差异极显著(P<0.01); *.差异显著(P<0.05)。
来源平方和自由度均方F值P值模型0.1490.0159.320.003 8 * *A酶解时间7.813×10 -317.813×10 -34.820.064 2 B酶解温度2. 450×10 -312.450×10 -31.510.258 8 C pH3.125×10 -413.125×10 -40.190.674 0 AB9.000×10 -419.000×10 -40.550.480 6 AC0.01610.0169.630.017 2 *BC8.100×10 -318.100×10 -34.990.060 6 A 20. 05310.05332.710.000 7 * *B 20.02710.02716.510.004 8 * *C 20.01110.0117.090.032 4 *残差0.01171.622×10 -3失拟 5. 875×10 -331.958×10 -31.430.358 4纯误差5.480×10 -341.370×10 -3总误差0.1516
对酶辅助提取青蛇果多酚的数学模型进行方差分析,以检验方程的有效性和各因素的偏回归系数,回归模型的方差分析如表4所示。经统计学分析可知,该试验选用的模型极显著(P<0.01),方差的失拟项不显著(P=0.358 4>0.05),即模型选择合适;同时,所选模型的校正决定系数R 2=0.922 9,表明此模型能解释92.29%的结果值变化,仅有总变异7.71%不能用该模型解释,基本可用于复合酶辅助提取青蛇果多酚得率的分析和预测。表4显示,在此试验设计中,除二次项AC、C 2显著(P<0.05),A 2、B 2极显著(P<0.01)外,其余项均不显著。
2 .2.3 响应面交互作 用分析与最佳提取条件的确定
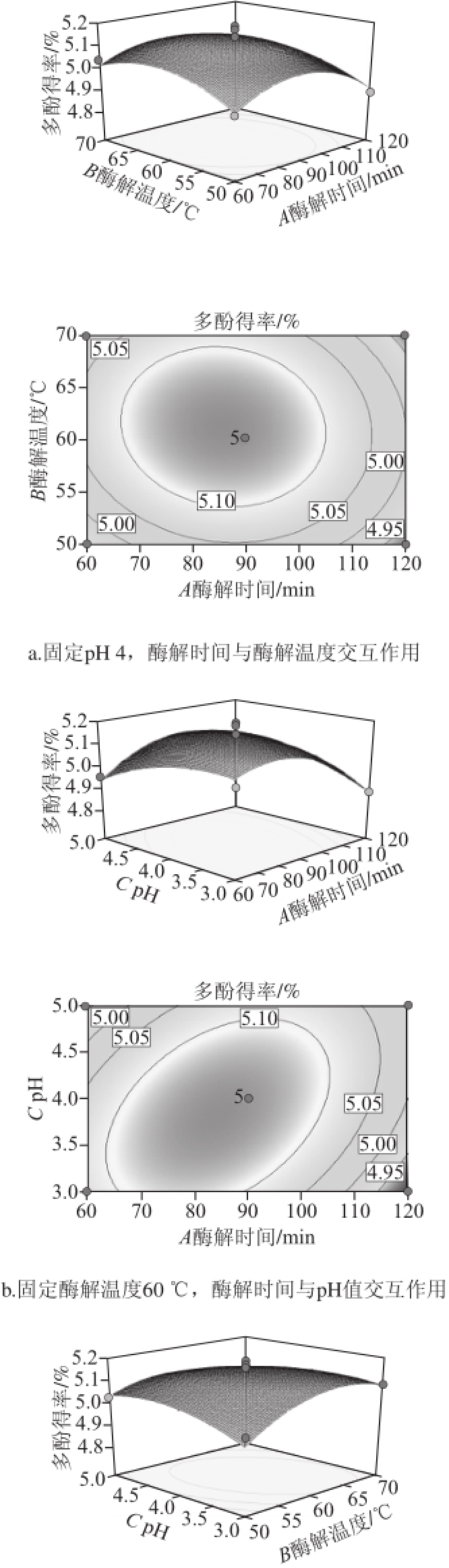

图4 各因素交互作用对多酚得率影响的响应面与等高线图
Fig.4 Response surface and contour plots of the effects of various hydrolysis conditions on the extraction yield of polyphenols from Granny Smith apple
如图4所示,通过对3 个曲面的观察可以预测和检验变量的响应值以及确定变量之间的 相互关系 [17],响应面越陡,反映出各因素之间的两两交互作用越显著。同样,等高线的形状也可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反 [18]。由响应面的陡峭程度可知,酶解时间对青蛇果多酚得率的影响最大,其次是浸提液pH值和酶解温度,这与方差分析结果一致。等高线图显示,固定酶解温度60 ℃时,酶解时间与pH值的交互作用最显著(图4b);相较而言,当浸提液pH 4时,酶解温度与酶解时间的交互作用较弱(图4a)。
根据Box-Behnken试验分析的结果和二次多项回归方程,利用Design-Expert 9.0 软件,可获得青蛇果多酚的最佳酶辅助提取条件,即酶解时间82.9 min、酶解温度62.5 ℃、pH 3.7。在此条件下,青蛇果多酚得率最高,为5.15%。为验证此模型的可靠性,在最优条件下进行3 次平行实验,结果表明,青蛇果多酚的实测平均得率为5.07%;与理论预测值相比,其相对误差约为1.55%,说明模型可以较好地反映出青蛇果多酚提取的条件,也再次证明了通过响应面法对复合酶提取青蛇果多酚的工艺参数进行优化是可行的。
2.3 青蛇果多酚的抗氧化活性
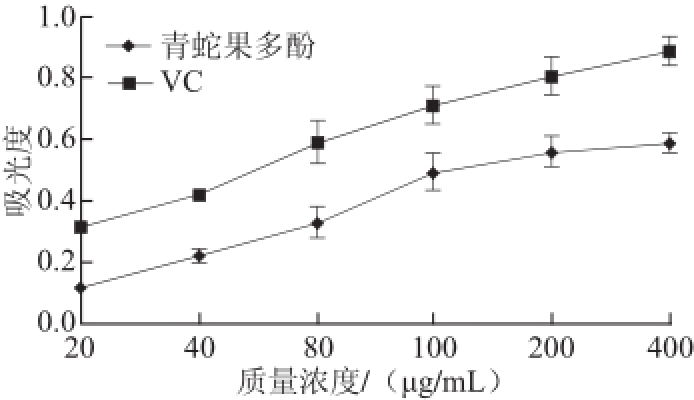
图5 不同质量浓度青蛇果多酚对FFee
33+的还原能力
Fig.5 Ferric ion reducing capacities of different concentration levels of polyphenols from Granny Smith apple
2.3.1 青蛇果多酚对Fe 3+的还原能力测定青蛇果多酚对Fe 3+的还原力,实际上是对提取物的供电子能力进行检验,还原力较强的物质理论上也能更好地提供电子;一般条件下,抗氧化活性与样品的还原能力有明显的相关性,抗氧化能力的强弱能够通过还原能力的强弱间接反映出来 [19]。如图5所示,不同质量浓度的多酚样品和VC均对Fe 3+具有一定的还原能力。虽然相同质量浓度条件下青蛇果多酚的还原能力不如VC,但不难看出,即使是未经深度纯化和富集的多酚粗提物,随着质量浓度的增大,Fe 3+还原力也呈现不断增高的趋势,表现出青蛇果多酚的抗氧化性和开发前景。
2.3.2 青蛇果多酚对DPPH自由基的清除能力
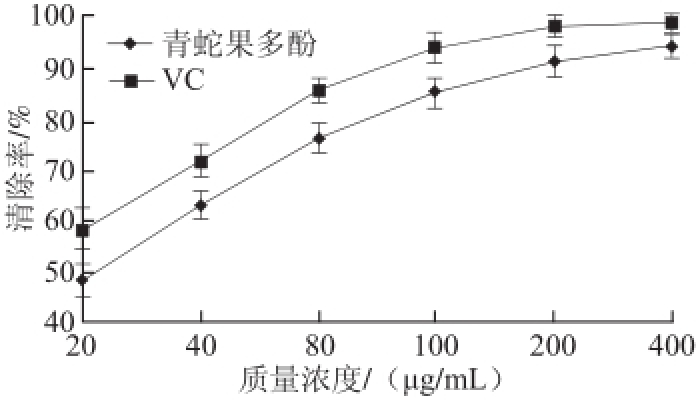
图6 不同质量浓度青蛇果多酚对DPPH自由基的清除能力
Fig.6 DPPH radical scavenging activities of different concentration levels of polyphenols from Granny Smith apple
自由基通常指化学性质较活泼的物质,但存活期限极短;而DPPH自由基不同,其为化学性质非常稳定的自由基。因此,可通过DPPH自由基分析法,对抗氧化剂清除自由基的能力进行评价 [20]。如图6所示,青蛇果多酚和VC均对DPPH自由基均有较强的清除力,随着样品质量浓度的增加,青蛇果多酚对DPPH自由基的清除率逐渐增强并与VC接近,最大时可达90%以上。同时,数据处理表明青蛇果多酚粗提物清除DPPH自由基的IC 50值约为22.72 μg/mL,属于具有较强抗氧化活性的一类物质,可深度开发。
通过生物酶法提取植物中的生物活性成分,实 际上是在传统的溶剂提取方法的基础上,根据植物细胞壁的构成,利用酶反应所具有的高度专一性特点,选择相应的酶,将细胞壁的组成成分水解或降解,使有效成分充分暴露出来并溶解、混悬于溶剂中,从而提高得率 [21-22]。苹果,特别是青蛇果中含有大量果胶质和纤维素类物质,而青蛇果多酚几乎被以纤维素和果胶为主要构成的细胞壁所包围 [23-24],因此本实验选用纤维素酶和果胶酶对苹果果肉进行酶解,并基于以上原理建立了复合酶法提取青蛇果多酚的工艺,以期得到较高的得率。采用复合酶辅助提取青蛇果肉多酚的最佳工艺条件为:纤维素酶和果胶酶复配(添加量2.05 mg/mL,质量比2∶1)、酶解温度62.5 ℃、水解时间82.9 min、pH 3.7。在此条件下,青蛇果多酚的得率可达5.07%,与传统非酶法提取的青蛇果多酚相比提高了近50%(1.3.1节所得为传统提取法蛇果多酚的粗提液,其多酚得率仅为3.47%)。更值得一提的是,酶法辅助整个提取过程无试剂污染,实现了绿色提取,符合低碳经济的原则。且其工艺较为简单,操作方便起来快捷、制备率较高,而且对环境污染较小,适用于苹果多酚的大规模工业生产。
另外,本实验还对复合酶提取青蛇果多酚的抗氧化活性进行了研究。结果显示,该多酚粗提物的Fe 3+还原能力和DPPH自由基清除能力均不如阳性对照VC,但它们始终处于同一数量级。一般来说,欲得到纯度更高的植物多酚,粗提物还需经过多级柱层析的富集和纯化,如AB-8、XAD-7HP、LX-1等 [3,5],均是适于分离纯化苹果多酚的树脂填料。上述水提青蛇果多酚的得率已可达到5%以上,倘若进一步纯化,其多酚含量或纯度至少会提升10~20 倍 [25-26]。因此,本方法所优化提取的青蛇果多酚实际上是一种良好的天然抗氧化剂的前体物质,极具深入研究和开发的价值。
参考文献:
[1] 苏梅. 我国苹果产业发展存在的问题及对策[J]. 现代农业科技, 2013(2): 306-308.
[2] 常亚飞, 何云华, 黄淑萍, 等. 不同存储温度对苹果多酚和黄酮类化合物含量的影响[J]. 应用化工, 2015, 44(2): 217-219.
[3] 贺金娜. 苹果多酚的制备、成分鉴定及其抗氧化性研究[D]. 无锡:江南大学, 2014.
[4] 肖俊松, 曹雁平, 龚玉石, 等. 青蛇果原花青素分离和低聚体纯品的制备[J]. 食品科学, 2009, 30(17): 113-119. DOI:10.3321/ j.issn:1002-6630.2009.17.026.
[5] 庞伟. 苹果多酚的分离纯化及抗氧化性研究[D]. 西安: 西北大学, 2007.
[6] 李桂星, 胡晓丹, 孙红男, 等. 模拟胃液条件下苹果多酚对亚硝酸盐的清除作用[J]. 食品科学, 2011, 32(11): 1-4.
[7] 王贤萍, 张倩茹, 尹蓉, 等. 超声波辅助提取苹果多酚优化条件的研究[J]. 农产品加工(学刊), 2014(7): 12-15.
[ 8] 艾志录, 郭娟, 王育红, 等. 微波辅助提取苹果渣中苹果多酚的工艺研究[J]. 农业工程学报, 2006, 22(6): 188-191. DOI:10.3321/ j.issn:1002-6819.2006.06.040.
[9] 王华斌, 王珊, 傅力. 酶法提取石榴皮多酚工艺研究[J]. 中国食品学报, 2012, 12(6): 56-65. DOI:10.3969/j.issn.1009-7848.2012.06.009.
[10] 李浡, 李双石, 兰蓉, 等. 酶法提取葡萄藤茎中多酚物质的含量比较研究[J]. 酿酒科技, 2 015(7): 38-40. DOI:10.13746/j.njkj.2014510.
[11] 杨云裳, 李帅斌, 李春雷, 等. 酶法浸提酿酒葡萄果渣中多酚的最优工艺[J]. 兰州理工大学报, 2013, 39(3): 61-64. DOI:10.13295/j.cnki. jlut.2013.03.020.
[12] GU L, KELM M, HAMMERSTONE J, et al. Concentrations of proanthocyanidins in common foods and estimations of normal consumption[J]. Journal of Nutrition, 2004, 134: 613-617.
[13] HAMMERSTONE J, LAZARUS S, SCHMITZ H. Procyanidin content and variation in some commonly consumed foods[J]. Journal of Nutrition, 2000, 130: 2086-2092.
[14] VRHOVSEK U, RIGO A, TONON D, et al. Quantitation of polyphenols in different apple varieties[J]. Journal of Agricultural and Food Chemistry, 2004, 52: 6532-6538. DOI:10.1021/jf049317z.
[15] 周玮婧. 荔枝皮原花青素的提取、纯化以及抗氧化活性研究[D]. 武汉: 华中农业大学, 2011.
[16] ARDESTANI A, YAZDANPARAST R. Antioxidant and free radical scavenging potential of Achillea santolina extracts[J]. Food Chemistry, 2007, 104(1): 21-29. DOI:10.1016/j.foodchem.2006.10.066.
[17] 慕运动. 响应面方法及其在食品工业中的应用[J]. 郑州工程学院学报, 2001, 22(3): 91-94.
[18] 杜玉兰, 黎庆涛, 王远辉. 响应面法优化鼠尾藻中脂质的提取工艺[J].天然产物研究与开发, 2008, 20(6): 1091-1094. DOI:10.3969/ j.issn.1001-6880.2008.06.035.
[19] 杨小兰, 袁娅, 郭晓晖, 等. 超高压处理对不同品种猕猴桃浆多酚含量及其抗氧化活性的影响[J]. 食品科学, 2013, 34(1): 73-77.
[20] 郭丽萍. 香蕉皮中多酚物质抗氧化性能的研究[D]. 南宁: 广西大学, 2006.
[21] 王敏, 陆兆新, 吕凤霞, 等. 响应面法优化酶法提取银杏叶总黄酮[J]. 食品科学, 2007, 28(3): 117-121. DOI:10.3969/j.issn.1006-2513.2010.04.018.
[22] 汪志慧, 孙智达, 谢笔钧. 响应面法优化双酶法提取莲房原花青素[J].食品科学, 2011, 32(4): 64-68.
[23] ALK F, FIALHO E. Polyphenol content and antioxidant capacity in organic and conventional plant foods[J]. Journal of Food Composition and Analysis, 2010, 23: 561-568. DOI:10.1016/j.jfca.2010.01.003.
[24] EWA C, ANNA G, WIKTOR A. Contents of polyphenols in fruit and vegetables[J]. Food Chemistry, 2006, 94: 135-142. DOI:10.1016/ j.foodchem.2004.11.015.
[25] 金莹, 孙爱东. 大孔树脂纯化苹果多酚的研究[J]. 食品科学, 2007, 28(4): 160-162. DOI:10.3321/j.issn:1002-6630.2007.04.035.
[26] 贺金娜, 曹栋, 史苏佳. 大孔树脂纯化苹果多酚的工艺优化[J]. 食品与发酵工业, 2014, 40(5): 135-141. DOI:10.13995/j.cnki.11-1802/ ts.2014.05.026.
Optimization of Multi-Enzymatic Extraction of Polyphenols from Granny Smith Apple and Their Antioxidant Activity
ZHANG Di
1, LIU Yang
1, LI Shuyi
1,2,
*
(1. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China; 2. Hubei Provincial Key Laboratory for Agricultural Products Processing and Conversion, Wuhan Polytechnic University, Wu han 430023, China)
Abstract:Granny Smith apple, an apple cultivar with high acidity, is rich in polyphenols, such as procyanidins. In this study, the extraction of polyphenols from Granny Smith apple by multi-enzymatic hydrolysis was optimized by the combined use of single factor method and Box-Behnken design. A mixture of cellulose and pectinase (2:1, m/m) was found to be the most efficient enzyme for the extraction of polyphenols. The maximum yield of polyphenols of 5.07% was obtained when the enzymatic extraction was done at 62.5 ℃ for 82.9 min with an initial pH of 3.7. According to the statistical analysis, the response surface model developed could be used to analyze and predict the extraction of polyphenols from Granny Smith apple effectively. Additionally, the polyphenols extracted from Granny Smith apple exhibited significant Fe 3+reducing capacity and DPPH free radical scavenging activity and the half-inhibition concentration (IC 50) for scavenging of DPPH free radical was 22.72 øg/mL, showing that the extract is a good source of antioxidants, and could be further utilized and explored as a useful food additive or antioxidant.
Key words:Granny Smith apple; polyphenol; multi-enzymatic extraction; response surface methodology; antioxidant activity
DOI:10.7506/spkx1002-6630-201604009
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)04-0051-07
引文格式:
张迪, 刘洋, 李书艺. 响应面试验优化复合酶法提取青蛇果多酚工艺及其抗氧化活性[J]. 食品科学, 2016, 37(4): 51-57.
DOI:10.7506/spkx1002-6630-201604009. http://www.spkx.net.cn
ZHANG Di, LIU Yang, LI Shuyi. Optimization of the multi-enzymatic extraction of polyphenols from Granny Smith apple and their antioxidant activity[J]. Food Science, 2016, 37(4): 51-57. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201604009. http://www.spkx.net.cn
收稿日期:2015-06-24
基金项目:武汉轻工大学本科生创新创业训练计划项目(CXXL20151003)
作者简介:张迪(1993—),男,学士,研究方向为天然产物化学。E-mail:zd1208@126.com
*通信作者:李书艺(1987—),女,讲师,博士,研究方向为功能食品与食品营养学。E-mail:lishuyisz@sina.com