表1 梯度洗脱程序
Table 1 Gradient elution program
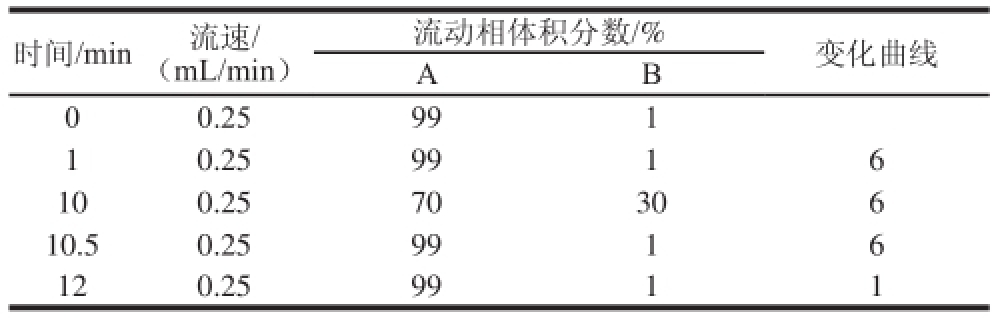
时间/min流速/(mL/min)流动相体积分数/%变化曲线A B 00.25991 10.259916 100.2570306 10.50.259916 120.259911
陈美君
1,王 旻
1,亢美娟
1,段奇慧
2,尚教文
2,单 艺
1,
*
(1.东北农业大学 黑龙江省乳品工业技术开发中心,黑龙江 哈尔滨 150028;2.黑龙江民族职业学院,黑龙江 哈尔滨 150066)
摘 要:目的:建立一种能够同时测定婴幼儿配方乳粉中11 种B族维生素的超高压液相色谱-串联质谱法。方法:样品用0.1%甲酸溶液溶解,乙酸锌沉淀蛋白,滤液经ACQUITY UPLC HSS T3色谱柱分离,流动相为0.1%甲酸溶液和乙腈,梯度洗脱,采用电喷雾离子源正离子模式,多反应监测进行检测,分析时间12 min。结果:11 种B族维生素在各自质量浓度范围内线性良好,R 2均大于0.99,加标回收率在85%~110%之间,相对标准偏差在1.03%~6.75%之间,VB 1、VB 2、烟酸、烟酰胺、泛酸(VB 5)、吡哆醛、吡哆醇、吡哆胺、叶酸、游离生物素和VB 12的定量下限分别为40.0、40.0、30.0、30.0、50.0、0.9、1.2、1.2、2.0、2.0、0.2 øg/100 g,与国家标准比较,部分维生素定量限提高了7.7%~60%。结论:该法具有灵敏度高、前处理操作简单快速、分析时间短的特点,而且具有良好的精密度和准确性,可以应用于婴幼儿配方乳粉中11 种B族维生素的同时测定。
关键词:B族维生素;婴幼儿配方乳粉;超高压液相色谱-串联质谱法
维生素是维持人体正常机能不可缺少的营养物质,人体必需维生素可分为两类:水溶性维生素和脂溶性维生素,其中水溶性维生素中又以B族维生素最为重要 [1-2],B族维生素主要包括VB 1(盐酸硫胺素)、VB 2(核黄素)、VB 3(烟酰胺、烟酸)、VB 5(泛酸)、VB 6(吡哆醇、吡哆醛和吡哆胺)、VB 7(游离生物素)、VB 9(叶酸)、VB 12(氰钴维生素)等,它们虽然在体内的含量很少,却是调节人体各种新陈代谢必不可少的物质,在人体生长、发育及维持身体健康的过程中却发挥着重要的作用,当人体缺乏时会引起多种疾病,而维生素无法人体合成必须由食物供给,因而成为婴儿配方乳粉的重要组成部分 [3-4]。目前B族维生素的检测方法有很多 [5-11],其中乳制品中叶酸、VB 12和生物素的测定我国国家标准采用微生物分析方法 [12-14],VB 1、VB 2、VB 3、VB 5、VB 6的测定采用高效液相色谱法 [15-19],微生物法灵敏度高但步骤繁锁、实验周期长、环境要求高、影响因素多,且重复性稍差 [20-21],而高效液相色谱法具有样品前处理简单的优势,然而因其化学性质和结构差别大,分离测定困难,许多需要使用离子对试剂,易造成性质相近的维生素保留时间和洗脱顺序发生变化,影响测定结果的准确性和重复性,普通检测器很难同满足对各种待测物质的检测要求,因此目前高效液相色谱法可同时测定的水溶性维生素种类偏少 [22-26]。随着分析仪器开发技术的发展,高效液相色谱-串联质谱法为食品、医药等领域的分析工作开拓了更为广阔的前景。研究表明,在测定维生素方面,质谱检测器有更明显的优势,可提供可靠、精确的相对分子质量及结构信息,具有灵敏度高、分辨率高、特异性好、重复性好、选择性好、定量更加准确等特点 [27-35],而超高压液相色谱除具有高效液相色谱优点外,还独具耐高压特性,可使用小粒径填料色谱柱,在液相色谱分析中,小粒径填料色谱柱可获得更高的柱效和更快的分离速度,峰容量更大,能够更好地满足复杂样品的分析 [36-37]。
本研究采用超高压液相色谱-串联质谱法同时测定婴幼儿配方乳粉中的11 种B族维生素,探求样品前处理简单快速、分析时间短、重复性好、精密度高的测定方法,为婴幼儿配方乳粉中B族维生素的快速定量检测提供技术支持。
1.1 材料与试剂
10 种婴幼儿配方乳粉(样品1~10) 市购;国际质控样(标准参照物):1849a(美国);标准品(纯度)分别为VB 1(≥99%)、VB 2(≥98%)、烟酸(≥99.5%)、烟酰胺(≥98%)、泛酸(≥98%)、吡哆醛(≥99%)、吡哆醇(≥98%)、吡哆胺(≥98%)、叶酸(≥97%)、生物素(≥99%)、VB 12(≥98%)及甲酸(色谱纯) 美国Sigma公司;乙腈、甲醇(色谱纯) 美国Fisher公司;浓盐酸(优级纯,37%)、乙酸铵(优级纯)、磷酸二氢钠(分析纯)、氢氧化钠(分析纯) 天津科密欧化学试剂有限公司;甲酸铵(优级纯) 德国Flcka公司;木瓜蛋白酶(酶活≥600 U/g) 上海沃凯生物技术有限公司;水为超纯水(经Millipore超纯水装置处理)。
1.2 仪器与设备
UPLC XEVO TQ-MS/MS超高压液相色谱-串联质谱联用仪(配有电喷雾离子源)、ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)色谱柱、ACQUITY UPLC BEH C 18(2.1 mm×100 mm,1.7 μm)色谱柱 美国Waters公司;BS224S电子天平 德国赛多利斯公司;涡流振荡器 德国IKA公司;超纯水仪 美国Millipore公司;s430/r离心机 德国Eppendorf公司;PH 700 pH计美国Eutech公司;GMSX-280手提式高压灭菌锅 北京永光明医疗仪器有限公司;S10P超生波清洗器 美国致微仪器有限公司。
1.3 方法
1.3.1 标准溶液配制
分别称取VB 1标准储备液:称取0.011 1 g标准品,用0.01 mol/L盐酸溶解并定容于10 mL容量瓶,质量浓度为0.987 9 mg/mL;VB 2标准储备液:精确称取0.002 5 g标准品,加入0.1 mol/L盐酸5 mL,避光超声溶解后,立即用水转移并定容至50 mL棕色容量瓶中,质量浓度为50 μg/mL;分别称取标准品烟酸0.050 7 g、烟酰胺0.056 6 g、泛酸0.050 0 g、吡哆醛0.030 5 g、吡哆醇0.039 9 g、吡哆胺0.030 4 g,用水溶解并定容至50 mL容量瓶中,质量浓度为分别为1.014 0、1.132 0、0.920 0、0.500 8、0.656 0、0.423 8 mg/mL;叶酸标准贮备液(1 mg/mL):称取0.05 g叶酸标准品,用30 mL蒸馏水溶解转入50 mL容量瓶中,加1 mL氨水,用水定容。生物素标准贮备液(100 μg/mL):称取生物素标准品用乙醇溶液定容至生物素质量浓度为100 μg/mL;VB 12贮备液(10 μg/mL):精确称取VB 12标准品,用乙醇溶液定容至VB 12质量浓度为10 μg/mL。以上标准储备液配制完成后放入棕色试剂瓶中2~4 ℃冰箱冷藏,保存期为3 个月,配制校准曲线时用超纯水逐级稀释,现用现配。
1.3.2 超高压液相色谱参考条件
色谱柱:A C Q U I T Y U P L C H S S T 3(2.1 mm×100 mm,1.8 μm),柱温:35 ℃,进样体积10 μL,流动相A:0.1%甲酸溶液,流动相B:乙腈,采用梯度洗脱,如表1所示。
表1 梯度洗脱程序
Table 1 Gradient elution program

时间/min流速/(mL/min)流动相体积分数/%变化曲线A B 00.25991 10.259916 100.2570306 10.50.259916 120.259911
1.3.3 质谱参数条件
电喷雾离子源正离子模式,多反应监测(multiple reaction monitoring,MRM)扫描;毛细管电压:3.0 kV;脱溶剂气温度:400 ℃;脱溶剂气流量:800 L/min;离子源温度:150 ℃;其他质谱参数见表2。
表2 质谱MRM参数
Table 2 Mass spectrometry parameters

碰撞能量/eV VB 1265.1122.0、144.02614、14 VB 2377.2172.1、243.03540、22烟酸124.053.1、80.43220、18烟酰胺123.053.0、96.03422、16泛酸钙220.198.0、90.02220、14吡哆醛168.0122.0、94.01520、22吡哆醇170.1124.0、134.01618、20吡哆胺169.1106.0、134.01422、20叶酸442.2295.1、176.03014、40游离生物素245.1123.0、97.02828、30 VB 12678.6147.1、359.23036、24化合物母离子(m/z)子离子(m/z)锥孔电压/V
1.3.4 样品的前处理
称取5.00 g样品(精确至0.01 g)于100 mL三角瓶,用25.0 mL 0.1%甲酸溶液溶解,超声提取20 min后加入2 mL 20%乙酸锌溶液混匀,冷却至室温后转移至50 mL容量瓶中用水定容,混匀,滤纸过滤,取滤液过0.22 μm水膜,待上机。
2.1 色谱条件的优化
2.1.1 色谱柱的选择
ACQUITY UPLC BEH C 18色谱柱属于通用型色谱柱,pH值耐受范围为1~12,稳定性好,适用于广泛化合物的分析测定。ACQUITY UPLC HSS T3色谱柱用于水溶性的、极性大的小分子化合物,HSS T3柱固定相是与100%水溶液流动相兼容的C 18固定相,用于保留和分离极性有机物。本实验分别考察了UPLC BEH C 18和UPLC HSS T3两种色谱柱对11 种待测化合物的分离情况。实验用同一混合标准物质溶液对备选的两种型号色谱柱分别进样,经比较,ACQUITY UPLC HSS T3色谱柱同时分离11 种被测组分时,各个组分得到很好地分离,峰形尖锐对称,ACQUITY UPLC BEH C 18色谱柱分离各组分效果不佳,其中叶酸出现裂峰,VB 2在8.11 min出峰,峰响应值底于杂质峰,VB 1、吡哆醛出现双峰,吡哆醇峰形呈宽峰、双峰的异常峰,吡哆胺、烟酸峰形出现拖尾现象,烟酰胺峰形宽,因此表明UPLC HSS T3色谱柱分离效果优于UPLC BEH C 18色谱柱,如图1所示。本实验最终确定选用ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)作为分析色谱柱。



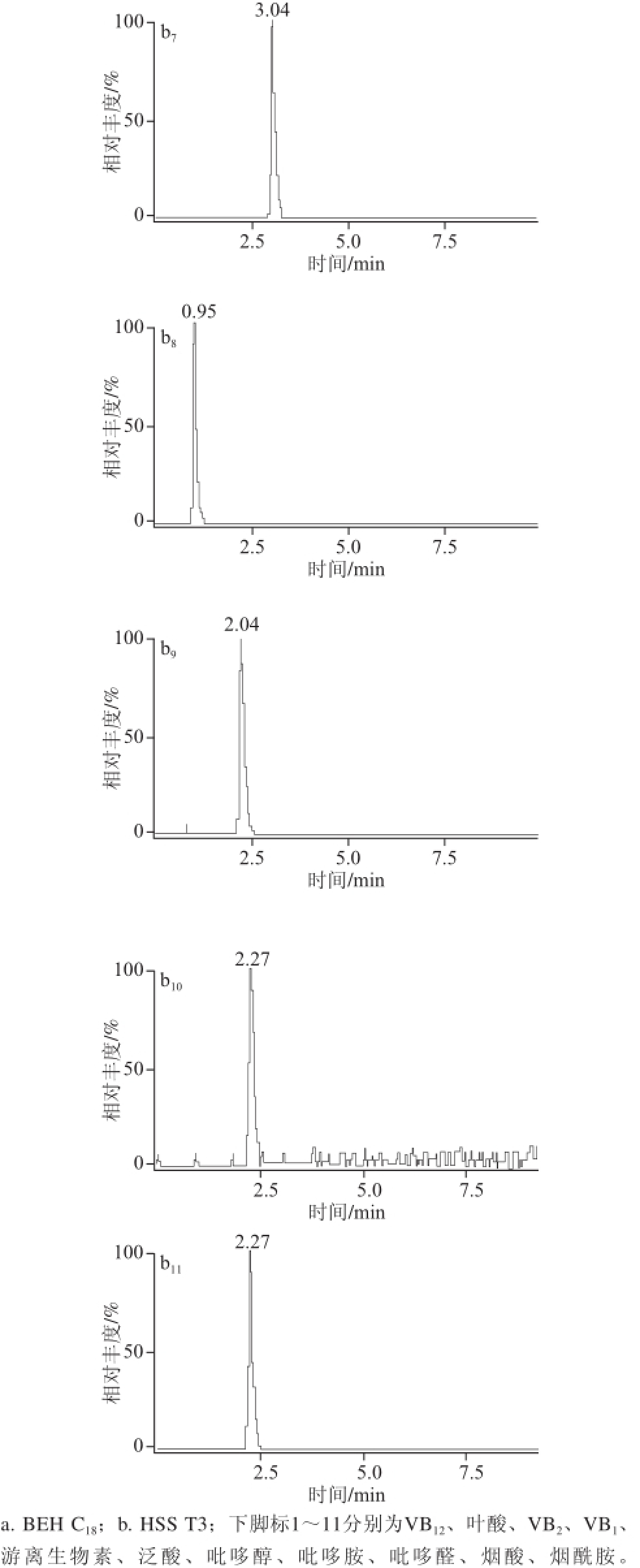
图1 比较BEH C
18和HSS T3的色谱图
Fig.1 Comparison of chromatographic separation on BEH C
18and HSS T3
2.1.2 流动相的选择
质谱应用技术中,流动相的选择除考虑色谱的分离效果外还要考虑化合物的离子化,由于本实验选用电喷雾离子化,正离子模式模式,所以在流动相中添加乙酸铵、甲酸铵或甲酸有利于被测物的离子化和改善色谱峰,因此分别比较了乙腈、甲醇作为有机相,10 mmol/L乙酸铵、10 mmol/L甲酸铵、0.1%甲酸溶液作为水相交叉组合实验,进样同一混合标样,同时通过调节流动相比例及流速获得最佳条件,结果表明0.1%甲酸溶液对被测的11 种化合物的电离均有促进作用且响应值最高,经比较在流速为0.25 mL/min时,选用0.1%甲酸溶液和乙腈作为流动相各组分分离效果良好,峰形对称丰度响应值最高,无杂质峰干扰。因此本实验流动相选用0.1%甲酸溶液和乙腈,分析时间12 min,经优化确定最终梯度洗脱条件如表1所示。在该条件下一次进样分离11 种被测组分,11 种物质分别在11 个通道中的MRM扫描总离子图如图2所示。
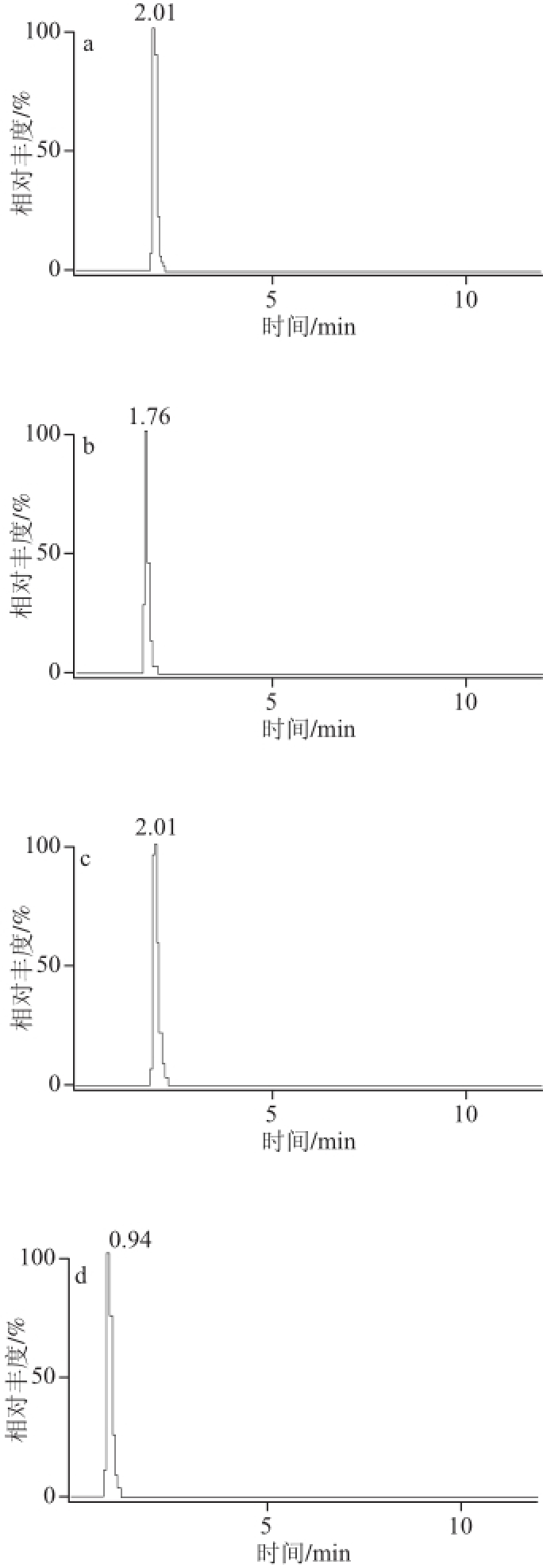

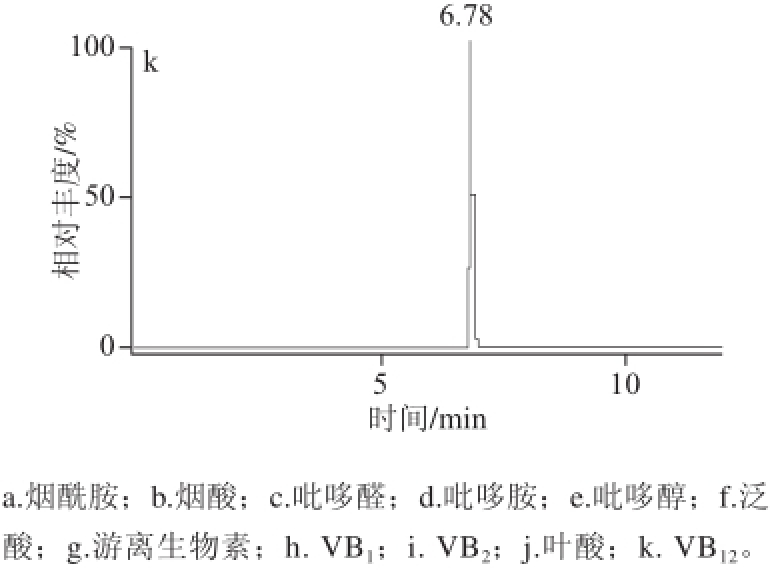
图2 MRM扫描总离子图
Fig.2 MRM total ion current chromatograms
2.1.3 样品前处理方法的选择
本实验分别选择水、0.1%甲酸溶液、乙腈和0.1 mol/L盐酸溶液作为提取液,称取5 g样品,分别加入20 mL水、0.1%甲酸溶液、乙腈和0.1 mol/L盐酸溶液,其中0.1 mol/L盐酸样品采用高压水解法,利用手提式高压灭菌锅,121 ℃高压水解20 min的方式破化乳中的蛋白质和脂肪,释放可能存在的结合态被测组分,其余3 种通过超生30 min充分提取被测组分,提取后用水定容至50 mL,滤纸过滤后取滤液过0.22 μm水系过滤头至进样瓶中进行测定,通过比较回收率选择提取率高的试剂作为提取液。结果表明,高压水解法处理样品,吡哆醇、吡哆醛损失明显,烟酸、烟酰胺回收率低,因此不适用于样品前处理,而用水和乙腈作为提取液的回收率普各组分回收率遍低于0.1%甲酸溶液的回收率,所以最终选用0.1%甲酸溶液作为提取液,但总体回收率偏低,如图3所示。由于11 种B族维生素均为水溶性维生素,但其化学性质区别大,且在婴幼儿配方乳粉中含有大量的蛋白质、脂肪和多种维生素矿物质等,干扰因素繁多,背景高,基质效应突出,回收率低,会直接影响准确的定量,同时还会严重缩短色谱柱使用寿命等,因此在保证提取率的同时,要尽可能的净化样品 [38-40]。本实验分别利用等电点法(1 mol/L盐酸溶液调pH 1.5~2.2后再用10%氢氧化钠溶液调pH 4~5),离心法(5 000 r/min离心10 min)和添加20%乙酸锌沉淀剂净化样品,当采用等电点法和添加沉淀剂法时,均可得到澄清溶液,净化效果较好,而离心法则不能得到澄清溶液,净化效果不理想,不满足实验要求,其中等电点法虽然样品净化效果较好,但由于样品要经过pH 1.5~2.2的低pH值阶段,使得被测组分中对酸不稳定的化合物如叶酸、VB 12出现损失,造成回收率低定量不准的问题 [41],不能满足实验要求。最终实验发现,用0.1%甲酸溶液溶解样品,超声提取后加沉淀剂乙酸锌,过滤过膜后上机,经测定11种维生素平均回收率在85%~110%之间,满足实验要求,确定了前处理方法。

图3 回收率实验结果
Fig.3 Effect of extractant type on the recovery of B vitamins
2.2 质谱条件的选择
选用电喷雾离子源正离子模式下,11 种维生素均能获得较高丰度的母离子,其中除VB 12外均可得到[M+H] +峰,而VB 12得到的母离子m/z为678.6,由于VB 12分子式为C 36H 88CoN 14O 14P,相对分子质量1 355.38,其母离子(m/z)678.6为相对分子质量加2H的一半,即VB 12在电喷雾离子源正离子下,生成[M+2H] +峰。因此采用电喷雾离子源正离子模式,VB 12采用双电荷形式的质荷比作为母离子,其余10 种选用单电荷形式的质荷比作为母离子。确定母离子后,采用子离子扫描,选择高丰度特征碎片离子作为子离子,优化锥孔电压和碰撞能量,选用产生最高丰度碎片离子的锥孔电压和碰撞能量为最优锥孔电压和碰撞能量。最终优化结果见表2。
2.3 方法学评价
2.3.1 方法的线性范围和检出限
表3 方法的线性范围、相关系数、检出限及定量限
Table 3 Linear ranges, correlation coefficients and limits of detection of the method
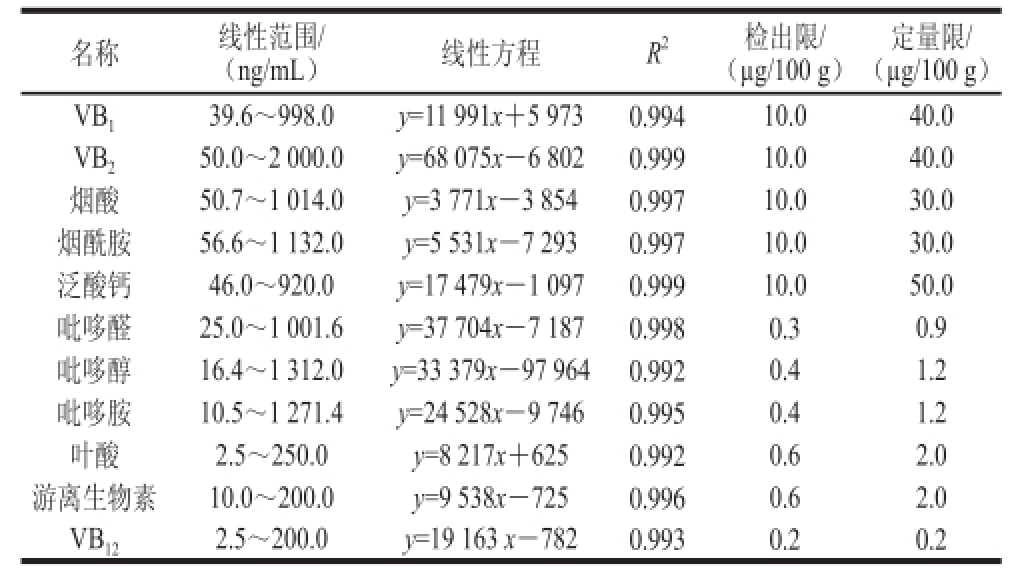
定量限/(μg/100 g)VB 139.6~998.0y=11 991x+5 9730.99410.040.0 VB 250.0~2 000.0y=68 075x-6 8020.99910.040.0烟酸50.7~1 014.0y=3 771x-3 8540.99710.030.0烟酰胺56.6~1 132.0y=5 531x-7 2930.99710.030.0泛酸钙46.0~920.0y=17 479x-1 0970.99910.050.0吡哆醛25.0~1 001.6y=37 704x-7 1870.9980.30.9吡哆醇16.4~1 312.0y=33 379x-97 9640.9920.4 1.2吡哆胺10.5~1 271.4y=24 528x-9 7460.9950.41.2叶酸2.5~250.0y=8 217x+6250.9920.62.0游离生物素10.0~200.0y=9 538x-7250.9960.62.0 VB 122.5~200.0y=19 163 x-7820.9930.20.2名称线性范围/(ng/mL)线性方程R 2检出限/(μg/100 g)
用0.1%甲酸溶液,配制标准溶液,绘制标准曲线,11 种维生素均具有良好的线性关系,以信噪比为3时的进样质量浓度为最低检出质量浓度,以信噪比为10时的进样质量浓度为最低定量质量浓度,根据样品前处理最终计算得出该方法的检出限和定量限,VB 1、VB 2、烟酸、烟酰胺、泛酸、吡哆醛、吡哆醇、吡哆胺、叶酸、游离生物素和VB 12的定量限分别为40.0、40.0、30.0、30.0、50.0、0.9、1.2、1.2、2.0、2.0、0.2 øg/100 g,与国家标准比较,部分维生素定量限提高了7.7%~60%,结果如表3、4所示。
表4 优化方法和国标方法测定定量限的比较
Table 4 Comparison of the limits of quantitation for B vitamins using tthhee ddeevveellooppeedd mmeetthhoodd aanndd tthhee nnaattiioonnaall ssttaannddaarrddss ooff CChhiinnaa
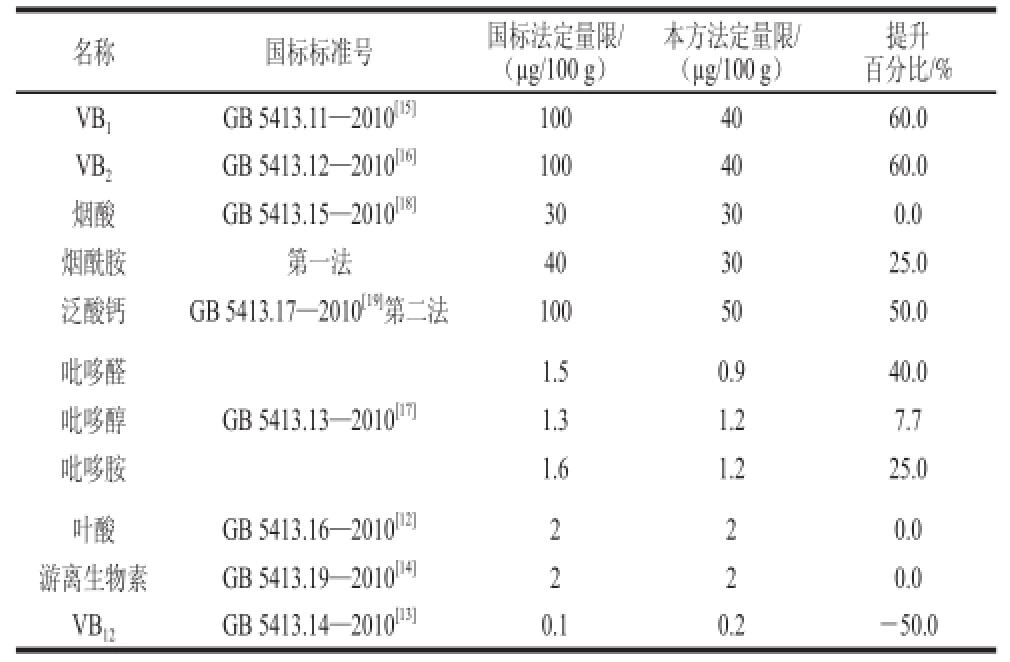
本方法定量限/(μg/100 g)名称国标标准号国标法定量限/(μg/100 g)提升百分比/% VB 1GB 5413.11—2010 [15]1004060.0 VB 2GB 5413.12—2010 [16]1004060.0烟酸GB 5413.15—2010 [18]30300.0烟酰胺第一法403025.0泛酸钙GB 5413.17—2010 [19]第二法1005050.0吡哆醛1.50.940.0吡哆醇GB 5413.13—2010 [17]1.31.27.7吡哆胺1.61.225.0叶酸GB 5413.16—2010 [12]220.0游离生物素GB 5413.19—2010 [14]220.0 VB 12GB 5413.14—2010 [13]0.10.2-50.0
2.3.2 精密度实验结果
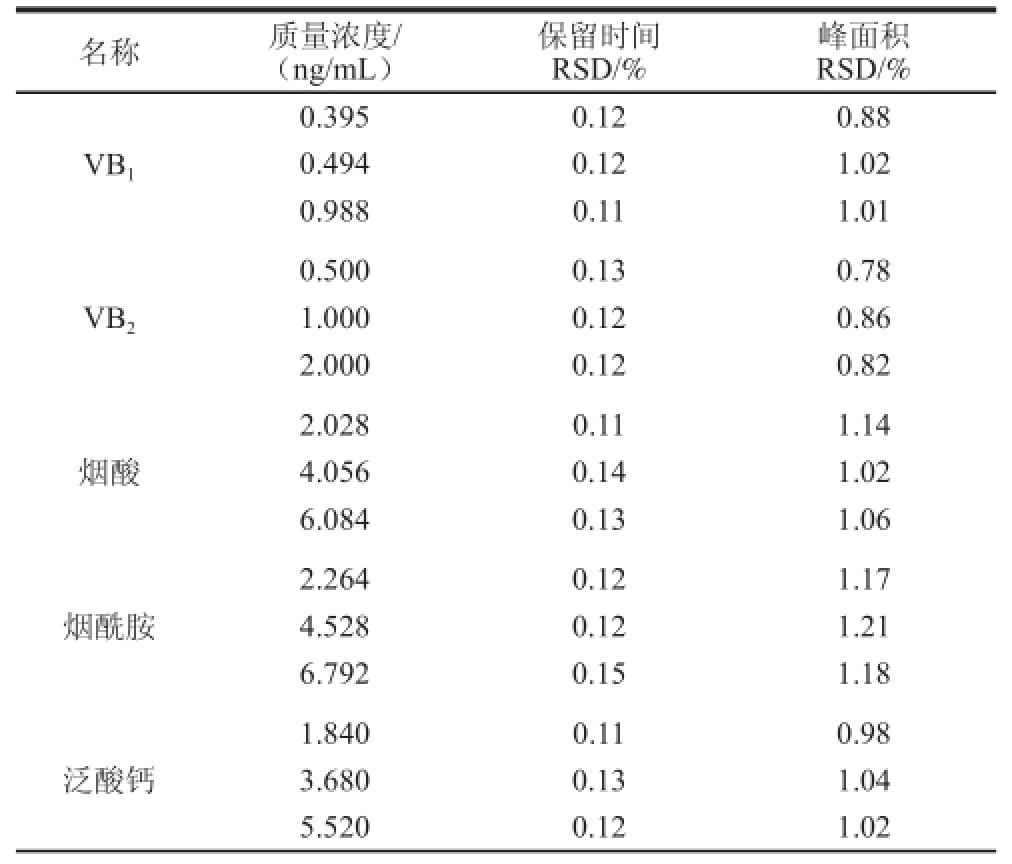
取11 种混合标准溶液3 个质量浓度,每个质量浓度连续进样6 次,得到各组分保留时间相对标准偏差(relative standard deviation,RSD)为0.11%~0.22%,色谱峰面积RSD为0.78%~1.31%,表明仪器精密度良好,具体结果见表5。
表5 不同质量浓度精密度实验结果(n=6)
TTaabbllee 55 RReessuullttss ooff pprreecciissiioonn tteessttss aatt vvaarriioouuss ccoonncceennttrraattiioonnss ((n == 66))
?
续表5
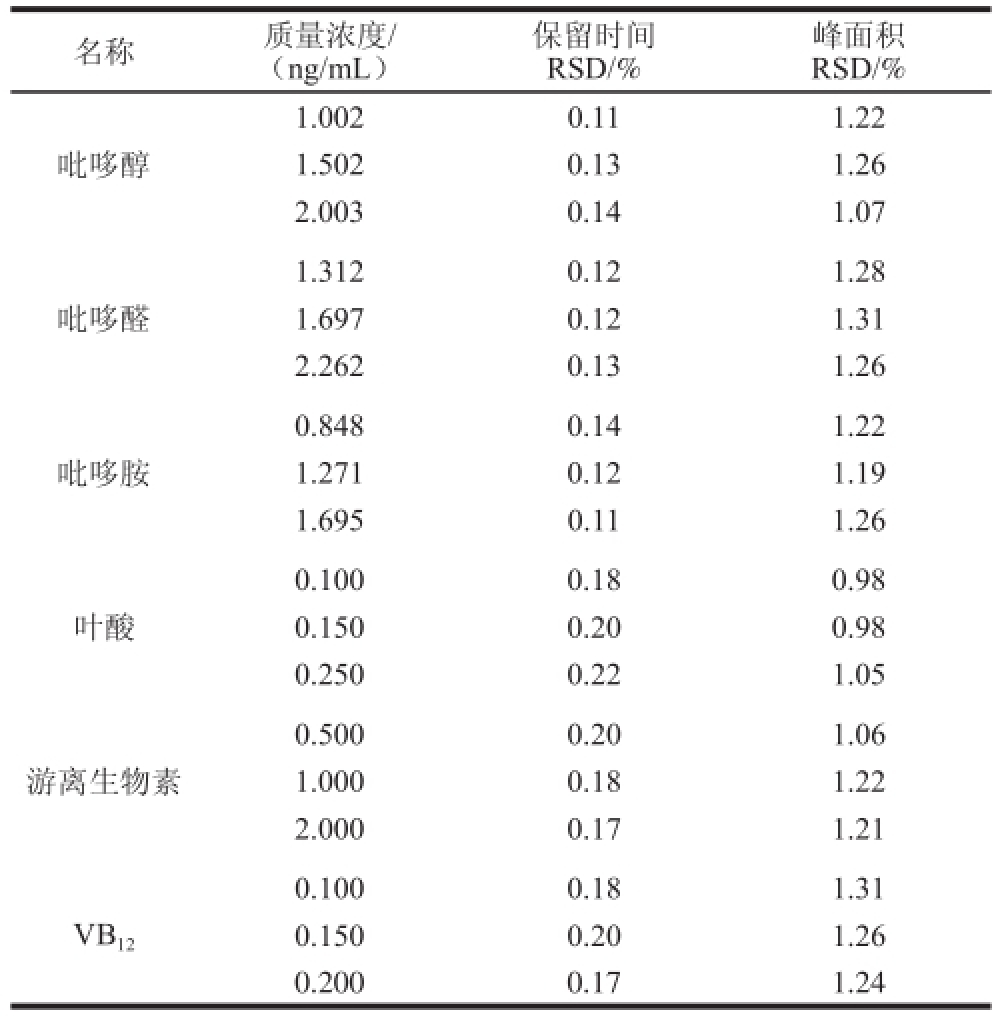
名称质量浓度/(ng/mL)保留时间RSD/%峰面积RSD/%吡哆醇1.0020.111.22 1.5020.131.26 2.0030.141.07吡哆醛1.3120.121.28 1.6970.121.31 2.2620.131.26吡哆胺0.8480.141.22 1.2710.121.19 1.6950.111.26叶酸0.1000.180.98 0.1500.200.98 0.2500.221.05游离生物素0.5000.201.06 1.0000.181.22 2.0000.171.21 VB 120.1000.181.31 0.1500.201.26 0.2000.171.24
续表6

化合物样品含量/(μg/100 g)添加量/(ng/mL)平均回收率/%RSD/%游离生物素27.5 0.10089.386.08 0.20094.645.42 0.40085.316.75 VB 122.96 0.10085.185.89 0.20089.394.37 0.50086.424.80
2.3.3 回收率和重复性实验结果
表6 加标回收实验和RSD结果(n=6)
T
Taabbllee 66 RReessuullttss ooff ssppiikkeedd rreeccoovveerryy aanndd rreellaattiivvee ssttaannddaarrdd ddeevviiaattiioonn (RSDDss)) ((n == 66))

化合物样品含量/(μg/100 g)添加量/(ng/mL)平均回收率/%RSD/% VB 1927 0.10094.562.12 0.200102.333.85 0.30092.874.61 VB 21 604 0.10091.643.02 0.20089.331.78 0.30092.075.02烟酸0 0.20396.713.04 0.40694.394.07 0.60591.262.36烟酰胺4 648 0.22695.381.78 0.45397.064.27 0.679109.342.09泛酸钙4 156 0.18490.254.68 0.36888.631.86 0.55292.153.47吡哆醛91 0.50096.372.02 1.00094.182.89 1.50091.371.03吡哆醇303 0.13192.664.28 0.262104.753.54 0.39490.321.89吡哆胺32 0.42490.572.05 0.84892.693.87 1.69591.212.68叶酸112 0.01088.243.75 0.01589.474.82 0.02595.065.06
10号样品中分别添加3 个不同质量浓度的标准溶液进行测定,如表6所示,每个水平设定6 组平行实验,结果显示待测11 种维生素平均回收率在85%~110%之间,RSD在1.03%~6.75%之间。结果表明该方法在不同添加水平均有很好的回收率和重复性,方法的准确度与精密度满足实验需求。
2.4 实际样品检测结果
分别用所建立的超高压液相色谱-质谱法和国标法:GB 5413.11—2010《婴幼儿食品和乳品中维生素B 1的测定》 [15]、GB 5413.12—2010《婴幼儿食品和乳品中维生素B 2的测定》 [16]、GB 5413.15—2010《婴幼儿食品和乳品中烟酸和烟酰胺的测定》 [18];GB 5413.17—2010《婴幼儿食品和乳品中泛酸的测定》 [19];GB 5413.13—2010《婴幼儿食品和乳品中维生素B 6的测定》 [17];GB 5413.16—2010《婴幼儿食品和乳品中叶酸的测定》 [12];GB 5413.19—2010《婴幼儿食品和乳品中游离生物素的测定》 [14];GB 5413.14—2010《婴幼儿食品和乳品中维生素B 12的测定》 [13],测定10 种不同婴幼儿乳粉和国际质控样中的11 种B族维生素,将国际质控样说明中给出的中位值视为11 种待测组分含量的真实值,给出的允许范围作为实验数据允许的检测结果浮动范围,通过国标法同时测定,得到的实际测定质控样数据与质控样给出的中位值比较,均在允许范围内,说明国标法测得的10 种不同婴幼儿乳粉的数据准确可靠,然后应用本实验建立的超高压液相色谱-串联质谱法同时测定国际质控样和10 种不同婴幼儿配方乳粉,数据表明国际质控样的测定值均在允许范围内且和国标法测定结果吻合,相对误差在2.1%~10.0%之间,因此该方法适用于婴幼儿配方乳粉中11 种B族维生素的同时测定,结果准确可靠,如表7所示。
表7 样品含量的测定
Table 7 Contents of 11 B vitamins in real samples determined by UPLC-MS/MS øg/100 g

6#幼儿羊乳粉GB 5413.11—2010VB 1方法维生素1#婴儿乳粉2#较大婴儿乳粉3#幼儿乳粉4#婴儿羊乳粉5#较大婴儿羊乳粉1 3381 53615499671 026953本方法1 3871 57215279611 034966 GB 5413.15—2010第一法烟酸03585660247684本方法03625510259658 GB 5413.15—2010第一法烟酰胺4 9694 7593 7773 7232 8932 129本方法5 0424 8113 7173 8052 9172 078 GB 5413.17—2010第二法泛酸钙4 4794 42039743 2592 0082 144本方法4 5024 5604 0273 1422 0992 204 GB 5413.13—2010吡哆醛10010991865259本方法107117104975157 GB 5413.13—2010吡哆醇582579531301222204本方法591562548289210217 GB 5413.13—2010吡哆胺344628151413本方法304521191918 GB 5413.16—2010叶酸1029810110110399本方法921041059710997 GB 5413.19—2010游离生物素930946852589456419本方法918954861567452428 GB 5413.12—2010VB 247.944.243.238.539.0 43.7本方法42.449.642.840.542.349.2 GB 5413.14—2010VB 121.52.0 2.81.41.52.2本方法1.71.831.51.52.1国际质控样允许范围GB 5413.11—20104104004009271 3022.11 257±98本方法4014144189131 275 GB 5413.12—20101 2401 2041 2001 6041 9982.52 034±52本方法1 2091 2271 1941 5912 048 GB 5413.15—2010第一法4510504000—本方法424048700 GB 5413.15—2010第一法3 6894 0003 4964 64810 0453.710 900±1 000本方法3 7063 9273 5284 69910 445 GB 5413.17—2010第二法4 1403 2003 6004 1566 8902.76 820±190本方法4 0673 1083 5174 2196 706 GB 5413.13—20107773729130方法7#婴儿牦牛乳粉8#较大婴儿牦牛乳粉9#幼儿牦牛乳粉10#幼儿配方乳粉国际质控样国际质控样相对误差/%国际质控样中位值本方法82808010234 GB 5413.13—201030530130330312733.0本方法3242872842921304 GB 5413.13—20102826253262本方法3230293868 GB 5413.16—20101041181051122252.6229.3±6.2本方法95125112107231 GB 5413.19—201044.441.247.427.519010.0199±13本方法40.238.850.631.8210 GB 5413.14—20102.22.92.33.0 4.92.14.82±0.85本方法2.73.12.83.14.8 1 346(VB 6总含量)±93
本实验建立了同时进行测定婴幼儿配方乳粉中的VB 1、VB 2、烟酸、烟酰胺、泛酸、吡哆醛、吡哆醇、吡哆胺、叶酸、游离生物素和VB 12的超高压液相色谱-串联质谱法,样品经0.1%甲酸溶液提取,乙酸锌沉淀蛋白,应用超高压液相色谱-串联质谱进行检测,通过MRM扫描方式12 min完成11 种B族维生素的测定,该方法操作简单、分析时间短、重复性好,经方法学验证,所建立方法具有良好的准确度、精密度与重复性,结果准确灵敏度高,通过测定10 种未知样品和国际质控样,测定结果与国标法测定数据比较,结果吻合且国际质控样的测定结果均在允许范围内,因此本法可用于婴幼儿配方乳粉中11 种B族维生素的同时测定。
参考文献:
[1] 郑集, 陈均辉. 普通生物化学[M]. 北京: 高等教育出版社, 2007: 211-243.
[2] 李克, 王华娟, 潘朝晖, 等. 离子对反相高效液相色谱法同时测定复合维生素片中4 种水溶性维生素[J]. 色谱, 2003, 21(1): 66-68.
[3] 刘娜, 陈大舟, 汤桦, 等. 婴儿配方奶粉中8 种水溶性维生素的高效液相色谱同时测定[J]. 分析测试学报, 2008, 27(4): 408-411.
[4] DANIEL A H, EMILY R Y, LINDSAY H. Allen a ultra-performance liquid chromatography tandem mass-spectrometry (UPLC-MS-MS) for the rapid, simultaneous analysis of thiamin, riboflavin, flavin adenine dinucleotide, nicotinamide and pyridoxal in human milk[J]. Journal of Chromatography B, 2012, 903: 7-13. DOI:10.1016/ j.jchromb.2012.06.024.
[5] 崔明, 杨大进, 鲁杰, 等. VB 12检测技术研究进展[J]. 食品与发酵工业, 2011, 37(4): 166-171.
[6] 王荣艳, 贾丽, 钱春燕. PLC-PDA 法同时测定功能性饮料中9 种水溶性维生素[J]. 现代科学仪器, 2010, 4(8): 98-101.
[7] 王浩, 刘艳琴, 杨红梅, 等. HPLC法同时测定婴幼儿配方奶粉中5 种水溶性维生素[J]. 中国乳品工业, 2009, 37(10): 56-58.
[8] 姜文清, 金鹏飞, 朱峰, 等. HPLC同时测定多维元素片中维生素B 1、维生素C、维生素B 6和烟酰胺的含量[J]. 中国药学杂志, 2011, 46(4): 1122-1125.
[9] 夏静, 俞婧, 孙磊, 等. 功能性饮料中9 种水溶性维生素的HPLCMS-MS同步检测技术[J]. 食品科学, 2014, 35(12): 196-199. DOI:10.7506/spkx1002-6630-201412040.
[10] 任一平, 陈恒武. 柱后光化学衍生荧光检测高效液相色谱法测定食品中的维生素B 1[J]. 分析化学, 2000, 28(5): 554-558.
[11] 雷涛, 张辉, 韩惠雯, 等. 婴幼儿配方奶粉中水溶性维生素的检测方法研究[J]. 乳业科学与技术, 2007(3): 81-83.
[12] 卫生部. GB 5413.16—2010 婴幼儿食品和乳品中叶酸的测定[S]. 北京: 中国标准出版社, 2010.
[13] 卫生部. GB 5413.14—2010 婴幼儿食品和乳品中维生素B 12的测定[S].北京: 中国标准出版社, 2010.
[14] 卫生部. GB 5413.19—2010 婴幼儿食品和乳品中游离生物素的测定[S]. 北京: 中国标准出版社, 2010.
[15] 卫生部. GB 5413.11—2010 婴幼儿食品和乳品中维生素B 1的测定[S].北京: 中国标准出版社, 2010.
[16] 卫生部. GB 5413.12—2010 婴幼儿食品和乳品中维生素B 2的测定[S].北京: 中国标准出版社, 2010.
[17] 卫生部. GB 5413.13—2010 婴幼儿食品和乳品中维生素B 6的测定[S].北京: 中国标准出版社, 2010.
[18] 卫生部. GB 5413.15—2010 婴幼儿食品和乳品中烟酸和烟酰胺的测定[S]. 北京: 中国标准出版社, 2010.
[19] 卫生部. GB 5413.17—2010 婴幼儿食品和乳品中泛酸的测定[S]. 北京: 中国标准出版社, 2010.
[20] 王凤玲, 刘爱国, 孙佳佳, 等. 高效液相色谱-质谱法同时测定婴幼儿配方奶粉中叶酸、VB 12和生物素[J]. 食品科学, 2013, 34(22): 269-272. DOI:10.7506/spkx1002-6630-201322054.
[21] 徐双阳, 许荣年, 汪庆旗, 等. 超高效液相色谱-质谱联用测定婴幼儿配方奶粉中的维生素B 12[J]. 食品工业, 2011, 32(8): 103-105.
[22] 王一红, 冯家力, 潘振球, 等. 液相色谱-串联质谱法分析10 种水溶性维生素[J]. 中国卫生检验杂志, 2001, 17(7): 1160-1162.
[23] 成志强, 孙成均, 黎源倩. 反相高效液相色谱法同时测定食品和多维片中8 种水溶性维生素[J]. 分析化学研究简报, 2001, 29(9): 1068-1071.
[24] 蒋晔, 刘红菊, 郝晓化. 反相高效液相色谱法同时测定9 种水溶性维生素[J]. 药物分析杂志, 2005, 25(3): 339-341.
[25] 赵明明, 彭茂民, 周有祥, 等. 水溶性维生素检测分析的研究进展[J].湖北农业科学, 2013, 52(23): 5676-5717.
[26] MARCIN L M, ANNA L, WOJCIECH C, et al. Highperformance liquid chromatography method for the simultaneous determination of thiamine hydrochloride, pyridoxine hydrochloride and cyanocobalamin in pharmaceutical formulations using coulometric electrochemical[J]. Journal of Chromatography A, 2005, 1094(1): 91-98. DOI:10.1016/j.chroma.2005.07.091.
[27] 甘宾宾, 汤艳荣, 蒋世琼. 高效液相色谱-质谱联用技术在食品安全中的应用及进展[J]. 化工技术与开发, 2009, 38(12): 33-37.
[28] 刘飞. 色谱-质谱联用技术在食品分析中的应用[J]. 质量技术监督研究, 2009(6): 28-31.
[29] 尹显贵. 液相色谱-质谱/串联质谱联用技术及其在药物分析中的应用[J]. 天津药学, 2005, 17(3): 51-53.
[30] CHURCH M I, TWADDLE N C, MEEKER L R, et al. Improving LCMS sensitivity through increases in chromatographic performance: comparisons of UPLC-ES/MS/MS to HPLC-ESI/MS/MS[J]. Journal of Chromatography B, 2005, 825(2): 134-143. DOI:10.1016/ j.jchromb.2005.05.037.
[31] BROUWERA V D, STOROZHENKOB S, STOVEA C P, et al. Ultraperformance liquid chromatography-tandem mass spectrome-try (UPLC-MS/MS) for the sensitive determinate on of folates in rice[J]. Journal of Chromatography B, 2010, 878(3/4): 509-513. DOI:10.1016/ j.jchromb.2009.12.032.
[32] CHANDRA M V, BUCKNALL M P, ARCOT J. Folate analysis in foods by UPLC-MS/MS: development and validation of a novel, high throughput quantitative assay, folate levels determined in Australian fortified breads[J]. Analytical and Bioanalytical Chemistry, 2011, 401(3): 1035-1042. DOI:10.1007/s00216-011-5156-3.
[33] OKAMOTO H, NAKAJIMA T, ITO Y. Simultaneous determination of water-soluble vitamins in a vitamin-enriched drink by an incapillary enzyme reaction method[J]. Journal of Chromatography A, 2003, 986(1): 153-161. DOI:10.1016/S0021-9673(02)01916-7.
[34] MARCIN L M, ANNA L, WOJCIECH C, et al. High-performance liquid chromatography method fo r the simultaneous determination of thiamine hydrochloride, pyridoxine hydrochloride and cyanocobalamin in pharmaceutical formulations using coulometric electrochemical and ultraviolet detection[J]. Journal of Chromatography A, 2005, 1094(1/2): 91-98. DOI:10.1016/j.chrom a.2005.07.091.
[35] WANG X, WANG S J, CAI Z W. The latest developments and applications of mass spectrometry in food-safety and quality analysis[J]. TrAC Trends in Analytical Chemistry, 2013, 52: 170-185. DOI:10.1016/j.trac.2013.08.005.
[36] 李笃信, 唐涛, 王风云, 等. 超高压液相色 谱仪的研究进展及超高压引起的相关问题[J]. 色谱, 2008, 26(1): 105-109.
[37] LUICE N, LUDMILA M. Advantages of application of UPLC in pharmaceutical analysis[J]. Talanta, 2006, 68(3): 908-918. DOI:10.1016/j.talanta.2005.06.035.
[38] SOLEDAD A H, TERESA V N, MARI L P, et al. Determination of water-soluble vitamins in infant milk by high-performance liquid chromatography[J]. Journal of Chromatography A, 1997, 778(1/2): 247-253. DOI:10.1016/S0021-96 73(97)00387-7.
[39] ANDREA L, DANTE C. Application of a liquid chromatography tandem mass spectrometry method to the analysis of water-so luble vitamins in italian pasta[J]. Analyica Chimica Acta, 2005, 531(1): 87-95. DOI:10.1016/j.aca.2004.10.006.
[40] 郎昭滨, 程纲领, 马世波. 婴幼儿配方食品和乳粉中串联四级杆质谱的检测方法[J]. 中国乳品工业, 2009, 37(9): 39-42.
[41] 王敬, 马育松, 刘彩虹, 等. 液相色谱-串联质谱法测定强化食品中叶酸的含量[J]. 分析测试学报, 2014, 33(11): 1224-1230.
Simultaneous Determination of 11 B Vitamins in Infant Formula by UPLC-MS/MS
CHEN Meijun
1, WANG Min
1, KANG Meijuan
1, DUAN Qihui
2, SHANG Jiaowen
2, SHAN Yi
1,
*
(1. Heilongjiang Dairy Industry Technical Development Center, Northeast Agricultural University, Harbin 150028, China; 2. Heilongjiang National Vocational College, Harbin 150066, China)
Abstract:Objective: To establish a method for the simultaneous determination of 11 B vitamins in infant formula by ultrapressure liquidchromatography-tandem mass spectrometry (UPLC-MS/MS). Methods: The samples were dissolved in 0.1% formic acid and then added with xinc acetate to precipitate the proteins. Then the filtrate was separated by an ACQUITY UPLC HSS T3 column through gradient elution using 0.1% formic acid and acetonitrile as the mobile phase. Mass spectral acquisition was done in the positive ion mode by applying multiple reaction monitoring and the analysis was completed in 12 min. Results: High correlation coefficients (R 2> 0.99) for 11 B vitamins in their linear ranges were obtained. The spiked recovery rates and accuracy (expressed as relative standard deviation, RSD) were determined to be in the ranges of 85%–110% and 1.03%–6.75%, respectively. The limits of quantitation (LOQs) for vitamin B 1, vitamin B 2, nicotinic acid, niacinamide, pantothenic acid, pyridoxal, pyridoxine, pyridoxamine, folic acid, vitamin H and vitamin B 12were 40.0, 40.0, 30.0, 30.0, 50.0, 0.9, 1.2, 1.2, 2.0, 2.0, and 0.2 øg/100 g, respectively, an increase by 7.7% to 60% over those from the national standards of China. Conclusions: The method is characterized by high sensitivity, simple operation, fast analysis and short time. This method also has good precision and accuracy and can be applied to detect 11 B vitamins in infant formula.
Key words:B vitamins; infant formula milk powder; ultra pressure liquid chromatography-tandem mass spectrometry (UPLC-MS/MS)
DOI:10.7506/spkx1002-6630-201604026
中图分类号:TS252.7
文献标志码:A
文章编号:1002-6630(2016)04-0144-10
引文格式:
陈美君, 王旻, 亢美娟, 等. 超高压液相色谱-串联质谱法同时测定婴幼儿配方乳粉中11 种B族维生素[J]. 食品科学, 2016, 37(4): 144-153. DOI:10.7506/spkx1002-6630-201604026. http://www.spkx.net.cn
CHEN Meijun, WANG Min, KANG Meijuan, et al. Simultaneous determination of 11 B vitamins in infant formula by UPLC-MS/MS[J]. Food Science, 2016, 37(4): 144-153. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604026. http://www.spkx.net.cn
收稿日期:2015-03-26
作者简介:陈美君(1990—),女,硕士研究生,研究方向为乳品科学。E-mail:chenmeijun0872@163.com
*通信作者:单艺(1981—),女,高级工程师,博士,研究方向为乳品科学。E-mail:Shanyi_1@sian.com