表1 响应面试验因素与水平
Table 1 Factors and levers used in response surface design
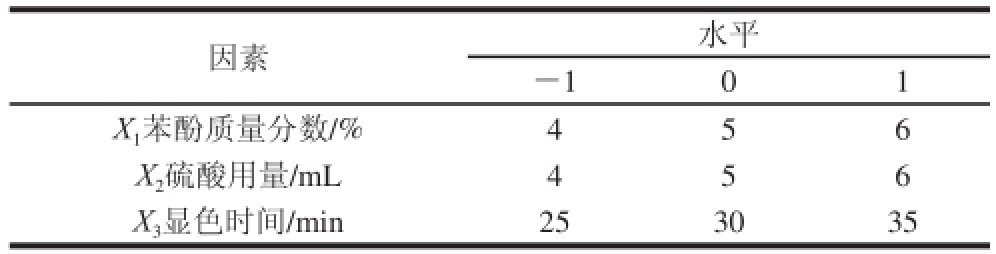
因素水平-101 X 1苯酚质量分数/%456 X 2硫酸用量/mL456 X 3显色时间/min253035
张媛媛,张 彬
(石家庄学院,河北 石家庄 050035)
摘 要:对苯酚-硫酸法和蒽酮-硫酸法在茶多糖测定中的差异进行比较,并对苯酚-硫酸法的检测条件进行优化,在单因素试验的基础上,选定苯酚质量分数、硫酸用量、显色时间3 个因素,利用响应面试验考察各因素变化对吸光度的影响。通过优化得到最佳测定条件为4.8%苯酚溶液1 mL、浓硫酸5 mL、显色时间29 mi n、检测波长488 nm。在此条件下的标准曲线在0~0.2 mg/mL范围内呈良好线性关系。该方法对3 种样品的加标回收率均不小于97.55%,重复性实验相对标准偏差为1.82%,说明此方法准确可靠、稳定性高,适合于茶多糖的测定。
关键词:茶多糖;苯酚-硫酸法;蒽酮-硫酸法;响应面分析法
茶叶起源于中国,是中国文献记载最早的医用草药之一。在东亚地区,特别是在中国和日本,有用绿茶治疗糖尿病的传统。据报道,茶叶尤其是绿茶,具有广泛的医用和营养价值,如降血糖、降血脂、降血压、抗血凝、抗肿瘤、增强机体非特异性免疫等 [1]。有研究表明,茶多糖是从茶叶中提取出来的具有多种生物活性且结构复杂的多糖复合物,是茶叶生物活性的重要活性成分 [2-3]。目前,测定多糖含量的方法主要有蒽酮-硫酸法 [4-6]、苯酚-硫酸法 [7-10]、高效液相色谱法 [11-13]、酶法等 [14-15]。高效液相色谱法与酶法由于样品前处理工序比较繁琐,测定时间较长,且检测费用较高等原因,不能广泛使用。而蒽酮-硫酸法与苯酚-硫酸法由于操作简单、实用性强,在多糖研究中广泛使用 [16-21],但采用2 种方法测定茶多糖准确性的比较研究鲜见有文献报道,本实验比较苯酚-硫酸法和蒽酮-硫酸法在茶多糖测定中的应用,确定了较优的检测方法。采用响应面分析法 [22-25]对苯酚-硫酸法检测条件进行了优化,得到了最佳的检测条件,使得优化后的苯酚-硫酸法测定茶多糖含量的数据更准确、稳定。
1.1 材料与试剂
日照绿茶(原产地山东)、婺源绿茶(原产地江西)、信阳毛尖(原产地河南) 市售;无水乙醇、蒽酮、苯酚、浓硫酸、葡萄糖(均为分析纯) 国药集团上海试剂公司。
1.2 仪器与设备
UV-2000双光束紫外-可见分光光度计 上海尤尼柯仪器有限公司;FA1104电子天平 上海精天电子仪器厂;HH-4数显恒温水浴锅 国华电器有限公司;旋转蒸发器 上海荣生有限公司;SHZ-Ⅲ型循环水真空泵上海亚荣生化仪器厂。
1.3 方法
1.3.1 实验溶液的配制
1.3.1.1 粗茶多糖溶液的制备
称取一定量已干燥的茶叶粉末,添加到80%乙醇溶液中浸泡4 h,抽滤,滤渣干燥后加入20 倍体积的蒸馏水,90 ℃水浴回流提取1 h,间歇搅拌,离心分离,取上清液,备用。
1.3.1.2 精制茶多糖的制备
将粗多糖溶液真空浓缩至原体积的1/4,采用Sevag法除蛋白,蒸馏水透析24 h,加入无水乙醇使乙醇体积分数达到80%进行醇沉,于4 ℃冰箱中静止12 h,离心分离,所得沉淀依次用丙酮、乙醚各洗涤,然后干燥,即得精制茶多糖,备用。
1.3.1.3 葡萄糖标准溶液的配制
准确称取葡萄糖标准品0.200 0 g,置于200 mL容量瓶中,加蒸馏水溶解并稀释至刻度,配成1.0 mg/mL的标准溶液,然后分别移取2.5、5、10、15、20 mL标准溶液,置于100 mL容量瓶中稀释至刻度,摇匀,配成系列葡萄糖标准溶液。
1.3.1.4 蒽酮-硫酸溶液的配制
称取0.33 g蒽酮,加100 mL浓硫酸,置于棕色瓶中,混合摇匀置于冰箱中(现配现用) 。
1.3.1.5 苯酚溶液的配制
称取苯酚100 g,加铝片0.1 g和碳酸氢钠0.05 g,常压蒸馏,收集(180±2)℃馏分。精密称取该馏分5 g于100 mL容量瓶中,再加入95 g蒸馏水,摇匀后转置于棕色试剂瓶中,即得质量分数为5%的苯酚溶液,将其置于冰箱中备用。
1.3.2 苯酚-硫酸法和蒽酮-硫酸法精确度实验
1.3.2.1 蒽酮-硫酸法反应产物的吸收光谱
分别移取茶多糖溶液和葡萄糖标准品溶液1 mL于具塞试管中,以1 mL蒸馏水作空白,室温条件下加入5 mL蒽酮-硫酸溶液,快速置冰水浴中摇匀,然后置于沸水浴中加热,观察其颜色变化,10 min后用自来水冷却至室温,在400~900 nm区域扫描吸收曲线。
1.3.2.2 苯酚-硫酸法反应产物的吸收光谱
分别移取上述茶多糖溶液和葡萄糖标准品溶液1 mL于具塞试管中,以1 mL蒸馏水作空白,置冰水浴中加入3%苯酚溶液1 mL,摇匀,分别加入浓硫酸5 mL,摇匀,静置30 min,自来水冷却至室温,在400~900 nm区域扫描吸收曲线。
1.3.2.3 苯酚-硫酸法和蒽酮-硫酸法稳定性实验
分别取茶多糖样品溶液1 mL于具塞试管中,以1 mL蒸馏水作空白,分别采用蒽酮-硫酸法和苯酚-硫酸法进行显色反应,并对其进行时间-吸光度曲线扫描。
1.3.2.4 苯酚-硫酸法和蒽酮-硫酸法2 种检测方法精密度实验
分别取茶多糖样品溶液1 mL于具塞试管中,以1 mL蒸馏水作空白,分别采用蒽酮-硫酸法和苯酚-硫酸法进行显色反应,在120 min内,间隔20 min检测一次,考察其精密度。
1.3.2.5 苯酚-硫酸法和蒽酮-硫酸法的回收率实验
精密量取已知含量的茶多糖样品溶液6 份,分成2 组置于具塞试管中,分别加入已知含量的葡萄糖标准溶液,采用苯酚-硫酸和蒽酮-硫酸法测定其吸光度,分别计算加标回收率。
1.3.3 单因素试验设计
以葡萄糖标准溶液为研究对象,以吸光度为响应值,以蒸馏水为空白,在488 nm波长条件下,分别考察苯酚质量分数、苯酚用量、浓硫酸用量、显色时间对实验结果的影响。
1.3.4 响应面试验设计
根据单因素试验结果,结合用Box-Behnken响应面分析软件提供的模型,选取苯酚质量分数(X 1)、硫酸用量(X 2)、显色时间(X 3)3 个因素为自变量,以吸光度为响应值,设计三因素三水平的试验进行优化,试验设计见表1。
表1 响应面试验因素与水平
Table 1 Factors and levers used in response surface design

因素水平-101 X 1苯酚质量分数/%456 X 2硫酸用量/mL456 X 3显色时间/min253035
1.3.5 葡萄糖标准曲线的绘制
分别准确移取1 mL系列标准溶液于具塞试管中,以1 mL蒸馏水作空白,置冰水浴中加入3%苯酚溶液1 mL,摇匀,分别加入浓硫酸5 mL,摇匀,静置30 min,自来水冷却至室温,于488 nm波长处测定吸光度,制备标准曲线,并计算回归方程。
1.3.6 样品中茶多糖含量的测定
取1 mL茶多糖样液,加5%苯酚溶液1 mL,混匀后加浓硫酸5 mL,摇匀,室温放置30 min,静置30 min,自来水冷却至室温后,于488 nm波长处测定吸光度,根据式(1)计算茶多糖含量:
式中:C为样品中葡萄糖质量浓度/(mg/mL);D为茶多糖溶液的稀释因子;f为校正因子;m为样品茶叶的质量/mg。
1.3.7 校正因子的测定 [22]
准确称取精制茶多糖10 mg,定容于50 mL容量瓶中,采用苯酚-硫酸比色法测定其吸光度,由标准曲线求出此精制茶多糖贮备液中葡萄糖质量浓度,按式(2)计算校正因子(f):
式中:m为称取茶多糖的质量/mg;C为精制茶多糖贮备液中葡萄糖质量浓度/(mg/mL);D为茶多糖溶液稀释因子。
1.3.8 加标回收率实验
精密量取已知含量的3 种茶多糖样品溶液各3 份,置于具塞试管中,分别加入已知含量的葡萄糖标准溶液,在最佳检测条件下测定吸光度,计算加标回收率。
1.3.9 重复性实验
采用优化后的苯酚-硫酸法间隔2 h对茶多糖进行一次检测,重复7 次,考察其重复性。
2.1 苯酚-硫酸法和蒽酮-硫酸法吸收波长的比较
采用苯酚-硫酸法和蒽酮-硫酸法对葡萄糖和茶多糖进行测定,于UV-2000双光束紫外-可见分光光度计上,扫描其在400~900 nm区域的最大吸收波长,其波长曲线变化见图1。

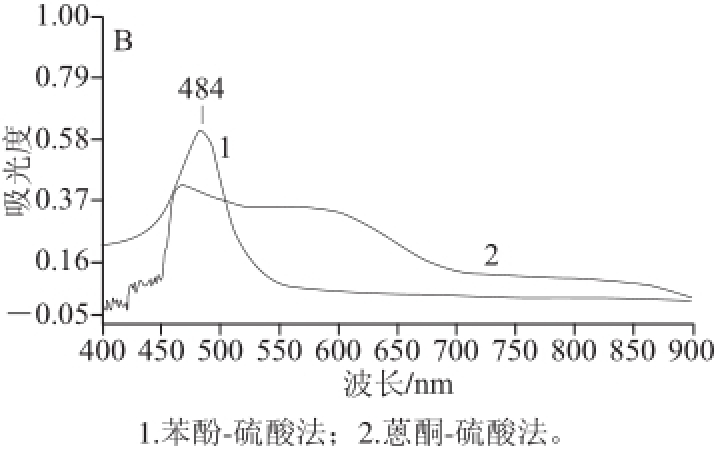
图1 2 种方法测定葡萄糖(A)和茶多糖(B)吸收波长的比较
Fig.1 Comparison of absorption wavelengths for the detection of glucose (A) and tea polysaccharides (B) by phenol-sulfuric acid method and anthrone-sulfuric method
从图1可见,在苯酚-硫酸法测定葡萄糖和茶多糖的实验中,葡萄糖在488 nm波长处有明显的最大吸收峰,茶多糖时在484 nm波长处有最大吸收峰,其余波段无干扰峰的存在,说明茶多糖在苯酚-硫酸作用下生成络合衍生物组分较单一,显色效果更好。采用蒽酮-硫酸法测定葡萄糖和茶多糖时,发现在400~900 nm波长范围内的吸收波长变化较多,葡萄糖在460 nm和600 nm波长附近出现较高的吸收峰;而茶多糖在460 nm波长处出现最大吸收峰,但与苯酚-硫酸法相比,最大吸收峰不明显,而且干扰峰较多,测定方法准确性不佳。
2.2 苯酚-硫酸法和蒽酮-硫酸法稳定性实验结果
2.2.1 苯酚-硫酸法和蒽酮-硫酸法反应产物的时间扫描光谱
对茶多糖溶液分别采用苯酚-硫酸法和蒽酮-硫酸法进行测定,用UV-2000双光束紫外-可见分光光度计进行时间扫描,扫描时间为120 min,其结果见图2。
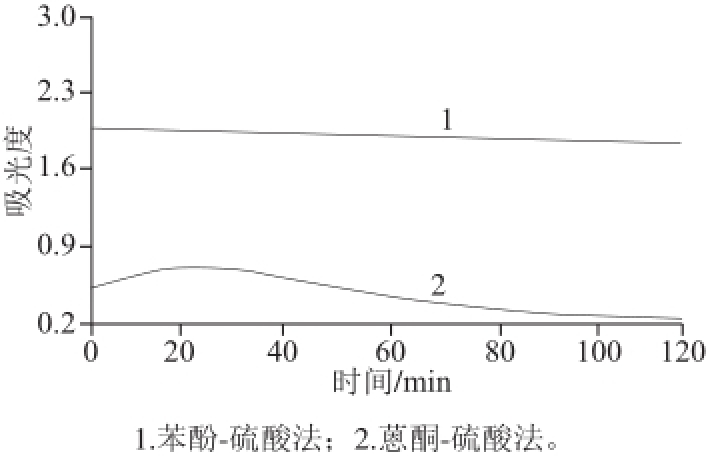
图2 2 种方法测定茶多糖稳定性比较
Fig.2 Comparison of the stability of the two methods for determination of tea polysaccharides
由图2可知,茶多糖与蒽酮-硫酸试剂显色后,随着时间的变化,吸收曲线也有变化,在25 min左右出现较大波动,随后迅速降低,其原因可能是茶多糖在蒽酮-硫酸试剂作用下生成的衍生物不稳定,受环境温度和时间的影响较大,影响结果的准确性。而采用苯酚-硫酸法显色的茶多糖吸收曲线受环境温度和时间的影响变化不大,在120 min内很稳定。
2.2.2 苯酚-硫酸法和蒽酮-硫酸法精确度实验结果
分别采用苯酚-硫酸法和蒽酮-硫酸法与茶多糖样品溶液进行检测,得到其反应产物。在120 min内间隔20 min测定一次吸光度,结果见表2。
表2 苯酚-硫酸法和蒽酮-硫酸法测定茶多糖精确度比较(吸光度)
Table 2 Comparison of the accuracy of the two methods for determination of tea polysaccharides
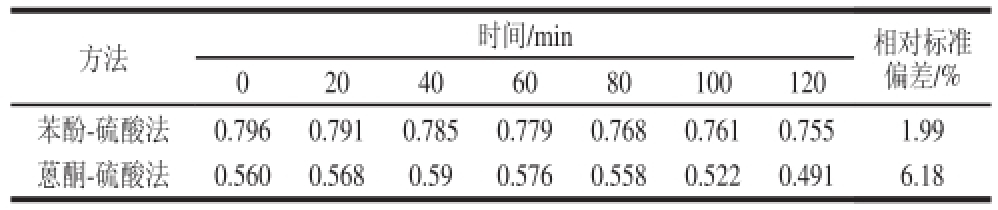
方法时间/min相对标准偏差/% 020406080100120苯酚-硫酸法0.7960.7910.7850.7790.7680.7610.7551.99蒽酮-硫酸法0.5600.5680.590.5760.5580.5220.4916.18
由表2可见,120 min内2 种检测方法的吸光度的变化进行考察,发现蒽酮-硫酸法吸光度精确度较低,相对标准偏差为6.18%,而苯酚-硫酸法表现较为稳定,精确度较高,相对标准偏差为1.99%。
2.2.3 苯酚-硫酸法和蒽酮-硫酸法的回收率实验结果
表3 2 种方法的回收率实验结果
Table 3 Results of recovery experiments using the two methods

方法序号样品含量/mg加标量/mg检测总量/mg回收率/%平均回收率/%相对标准偏差/%苯酚-硫酸法195.290183.699.14 295.290182.798.65 99.60 1.26 395.290187.1101.03蒽酮-硫酸法195.290189.6102.38 295.290174.2103.50 100.18 4.82 395.290175.394.65
如表3所示,蒽酮-硫酸法的回收率实验结果波动较大,其相对标准偏差为4.82%,而苯酚-硫酸法的回收率实验结果更为可靠,其相对标准偏差为1.26%,更为适合茶多糖的检测。
通过上述实验结果比较发现,苯酚-硫酸法在反应产物的稳定性、测定精确度以及样品回收率方面均优于蒽酮-硫酸法,本实验选择苯酚-硫酸法进行下一步的优化实验。
2.3 最大吸收波长的确定
采用苯酚-硫酸法显色后,葡萄糖在488 nm波长处有最大吸收峰,而茶多糖在484 nm波长处有最大吸收峰,两者最大吸收峰的波长非常接近。考虑到由于产地不同,茶叶中所含茶多糖的单糖组成存在一定差异,其在浓硫酸作用下与苯酚的显色情况也存在差异,而本方法是以葡萄糖为标准单糖的,所以选择测定最大吸收波长为488 nm。
2.4 单因素试验结果
2.4.1 苯酚质量分数的影响
由图3可知,吸光度随着苯酚质量分数的增加而增加,但到达5%以后增势趋于平缓,所以苯酚试剂的质量分数选择5%左右。
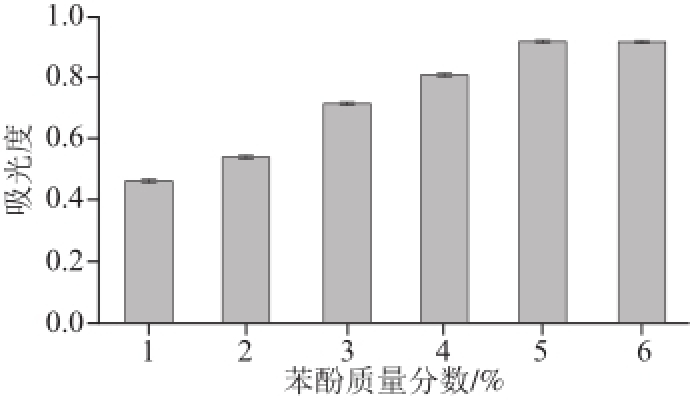
图3 苯酚质量分数对吸光度的影响
Fig.3 Effect of phenol concentration on the absorbance
2.4.2 苯酚用量的确定
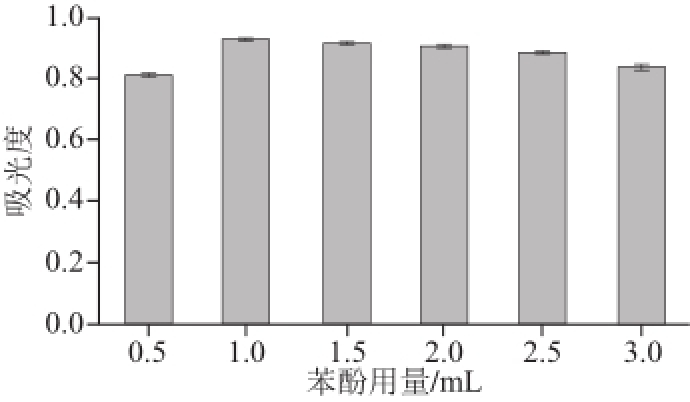
图4 苯酚用量对吸光度的影响
Fig.4 Effect of phenol dosage on the absorbance
由图4可知,在低用量时,吸光度随着苯酚用量的增加而增加,在用量为1 mL时吸光度达到最大值。但当苯酚试剂的用量超过1 mL时吸光度反而苯酚试剂用量的增加而降低,所以苯酚试剂的适宜用量应选择1 mL。
2.4.3 硫酸用量的确定
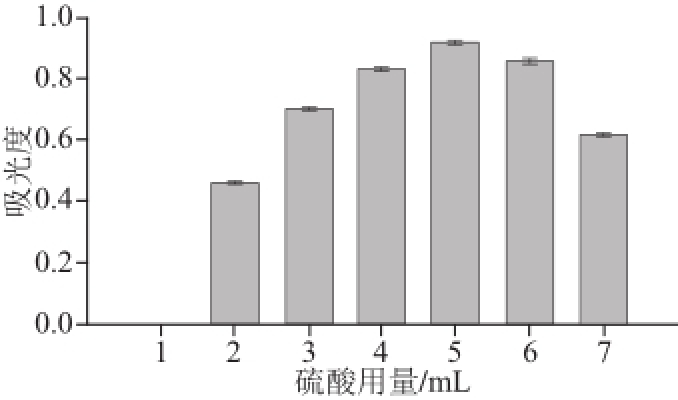
图5 硫酸用量对吸光度的影响
Fig.5 Effect of sulfuric acid dosage on the absorbance
由图5可看出,吸光度随着硫酸用量的增加不断提高,但超过5 mL后,再增加硫酸的量,其吸光度迅速下降,其原因可能是过量的硫酸造成显色物质的分解,因此硫酸的适宜用量应选择5 mL左右。
2.4.4 显色时间的确定
由图6可看出,显色时间较短时,反应进行不完全,吸光度较低,当到达30 min后,吸光度接近稳定,所以适宜的显色时间应选择30 min左右。
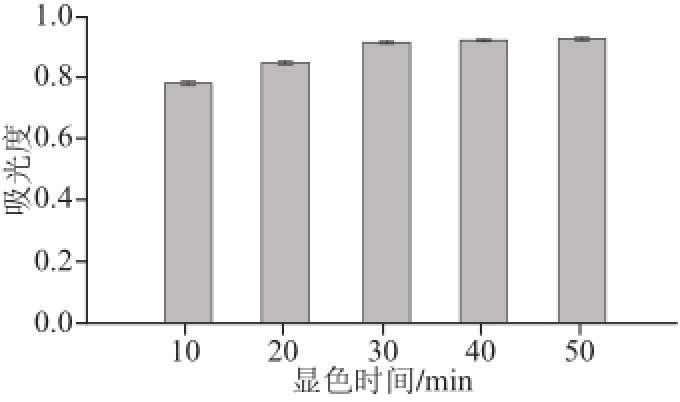
图6 显色时间对吸光度的影响
Fig.6 Effect of color development time on the absorbance
2.5 响应面优化试验结果及数据分析
2.5.1 响应面优化试验结果
在单因素试验的基础上,根据Box-Behnken软件提供的模型,设计了三因素三水平随机共15 个试验点的响应面试验,结果见表4。
表4 响应面试验设计及结果
Table 4 Experimental design and results for response surface analysis
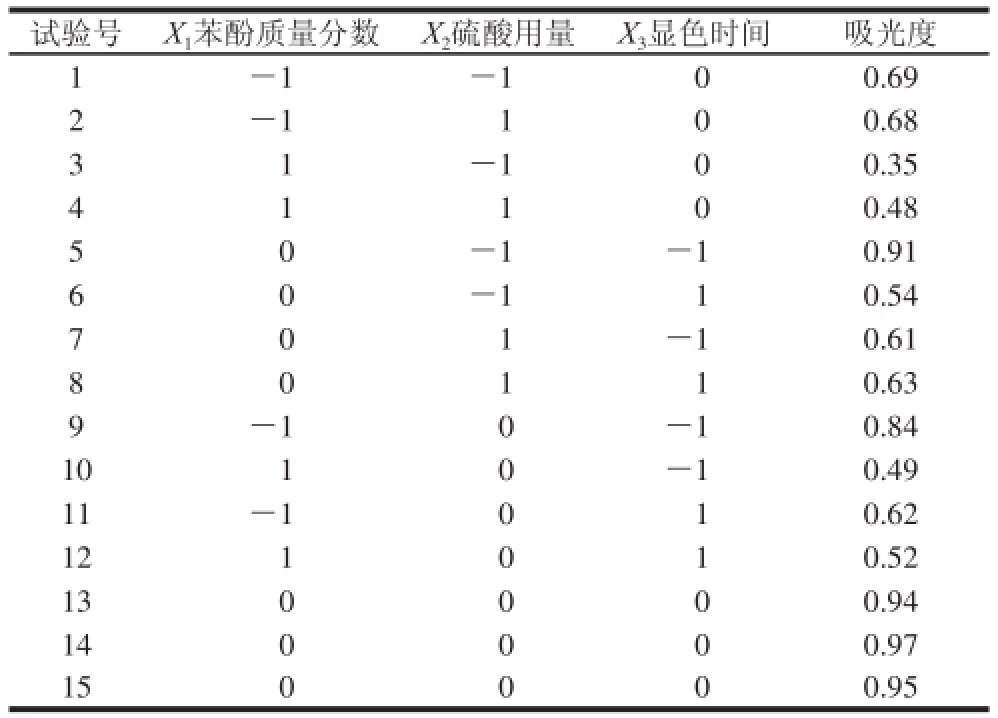
试验号X 1苯酚质量分数X 2硫酸用量X 3显色时间吸光度1-1-100.69 2-1100.68 3 1-100.35 4 0.48 5 0-1-10.91 1 1 0 6-110.54 7 0 1-10.61 0 0.63 9-10-10.84 1010-10.49 11-1010.62 121010.52 130000.94 140000.97 150000.95 8 0 1 1
2.5.2 数据分析
根据表4的试验结果,用SAS统计分析软件进行多元回归分析,得到关于苯酚质量分数、硫酸用量、显色时间的数据模型,经回归拟合后,试验因素对响应值的影响可用回归方程如下:

由表5中对回归方程的分析结果可知,该模型P<0.001,表明试验选择的模型高度显著。因变量和自变量之间的作用关系显著,各因素之间的交互作用也显著。其中一次项,二次项以及硫酸用量与显色时间这一组交互项对试验结果的影响表现出极高显著性,苯酚质量分数与显色时间这一组交互项对试验结果的影响表现为一般显著,如图7所示。回归方程的系数R 2为98.37%,说明回归方程的拟合程度很好,不存在模型拟合不足的现象,用上述回归方程描述各因素与响应值之间的关系能够真实地反映数据结果。
表5 回归方程方差和显著性差异
Table 5 Significance test of regression equation coefficients for the regression mooddeell
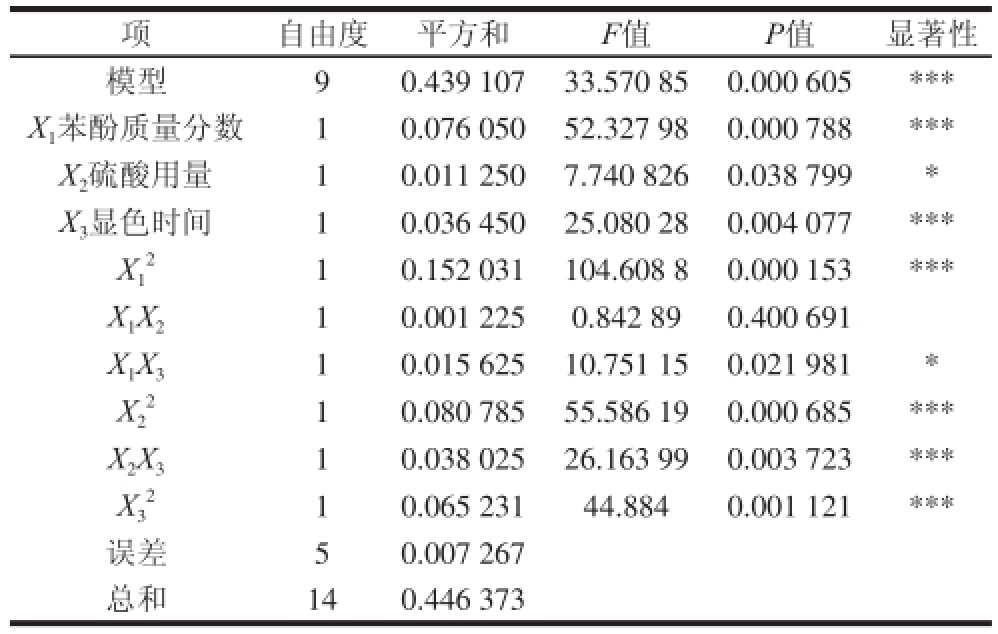
注: *.差异显著,P<0.05; * *.差异极显著;P<0.01; * * *.差异极高显著,P<0.001。
自由度平方和F值P值显著性模型90.439 10733.570 850.000 605 * * *X 1苯酚质量分数10.076 05052.327 980.000 788 * * *X 2硫酸用量10.011 2507.740 8260.038 799 *X 3显色时间10.036 45025.080 280.004 077 * * *X1项10.152 031104.608 80.000 153 * * *X 1X 210.001 2250.842 890.400 691 X 1X 310.015 62510.751 150.021 981 *X2 2 10.065 23144.8840.001 121 * * *误差50.007 267总和140.446 373 10.080 78555.586 190.000 685 * * *X 2X 310.038 02526.163 990.003 723 * * *X3 2 2
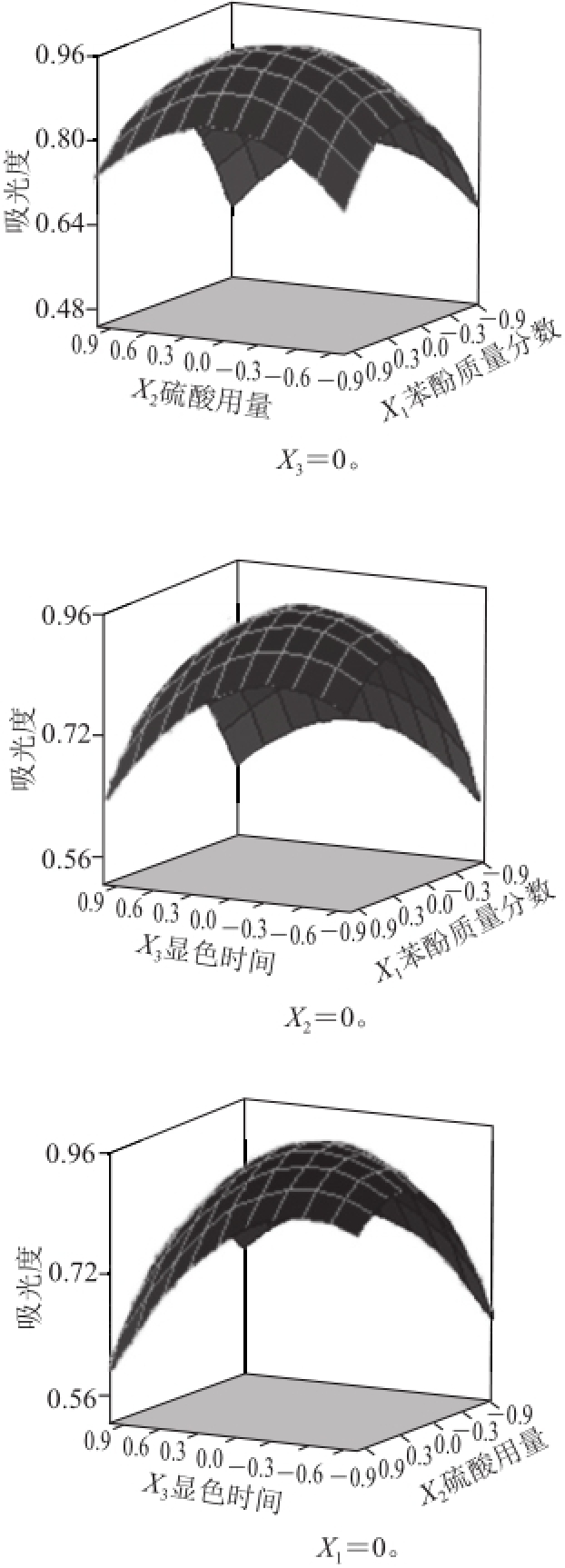
图7 各因素交互作用对吸光度影响的响应面图
Fig.7 Response surface plots for the interactive effects of experimental conditions on the absorbance value
2.5.3 寻求最佳测定条件
由响应面曲面图可知,该模型存在最大值,通过SAS软件分析得到,苯酚质量分数(X 1)为4.747%、硫酸用量(X 2)为4.820 mL,显色时间(X 3)为28.787 min,考虑到方便实际操作等因素,选苯酚质量分数(X 1)为4.8%,硫酸用量(X 2)为5 mL,显色时间(X 3)为29 min。
2.6 葡萄糖标准曲线的绘制
取配制好的葡萄糖标准溶液,采用优化后的检测条件,在488 nm波长处测定吸光度,以吸光度(X)对葡萄糖质量浓度(Y)作回归处理,得出标准曲线的回归方程为Y=5.777 9X-0.015 5,R 2=0.999 6,说明该标准曲线在0~0.2 mg/mL范围内呈良好线性关系。
2.7 茶多糖测定结果
2.7.1 茶多糖含量的测定
取茶多糖样品,采用优化后的苯酚-硫酸法对其进行测定,根据公式计算,得茶多糖含量为6.37%,校正因子为1.72。
2.7.2 加标回收率
表6 加标回收率实验结果
Table 6 Results of recovery experiments using the optimized phenol-sulfuric acid method
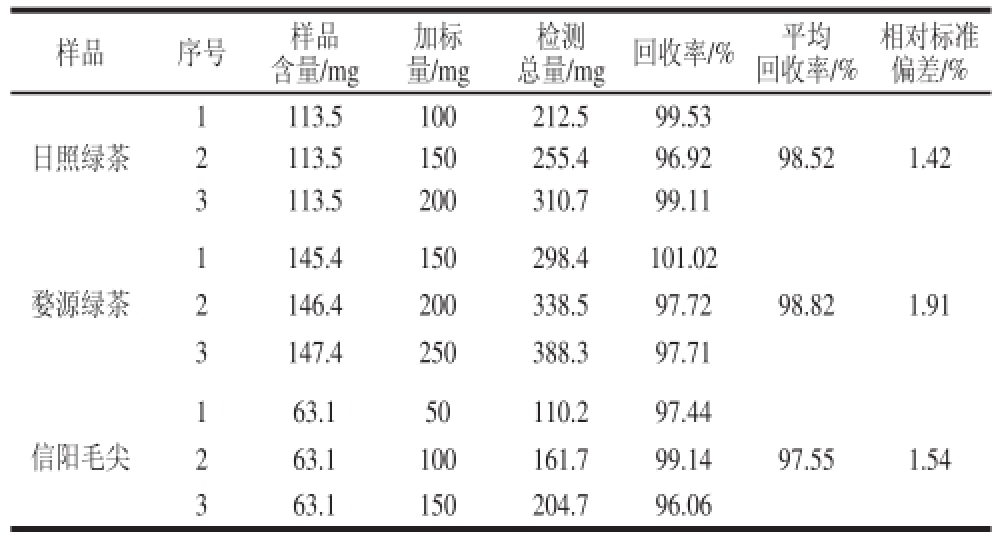
样品序号样品含量/mg加标量/mg 总量/mg回收率/%平均回收率/%检测相对标准偏差/%日照绿茶1113.5100212.599.53 2113.5150255.496.9298.521.42 3113.5200310.799.11婺源绿茶1145.4150298.4101.02 2146.4200338.597.72 98.82 1.91 3147.4250388.397.71信阳毛尖163.150110.297.44 263.1100161.799.14 97.55 1.54 363.1150204.796.06
对3 个样品进行加标回收率实验,如表6所示,通过计算日照绿茶、婺源绿茶和信阳毛尖的加标回收率分别为98.52%(相对标准偏差为1.42%)、98.82%(相对标准偏差为1.91%)、97.55%(相对标准偏差为1.54%),说明该检测方法准确可信。
2.7.3 重复性
表7 重复性实验结果
Table 7 Results of reproducibility experiments using the optimized phenol-sulfuric acid method
实验次数1234567平均值相对标准偏差/%茶多糖含量/%6.23 6.41 6.21 6.32 6.54 6.36 6.436.361.82
从表7可看出,苯酚-硫酸法测定结果重复性好,其相对标准偏差为1.82%,说明此测定方法稳定可靠。
本实验分别对苯酚-硫酸法、蒽酮-硫酸法2 种检测对茶多糖的测定进行了比较,通过最大吸收波长扫描、精确度实验以及样品回收率实验发现苯酚-硫酸法在稳定性和准确性上均优于蒽酮-硫酸法。对苯酚-硫酸法的检测条件进行了优化,在单因素试验的基础上,选定苯酚质量分数、硫酸用量、显色时间3 个因素,进行响应面分析试验。通过SAS软件得到的试验模型显著性高,拟合程度好,可靠性高,能够真实地反映数据情况。通过优化得到苯酚-硫酸法的最佳测定条件为4.8%苯酚溶液1 mL、浓硫酸5 mL、显色时间29 min、检测波长488 nm。标准曲线在0~0.2 mg/mL范围内呈良好线性关系。该方法3 种样品的加标回收率不小于97.55%,重复性实验相对标准偏差为1.82%,说明此方法准确可靠、稳定性高,适合于茶多糖的测定,具有较好的使用价值。
参考文献:
[1] 管曦, 曹露莎. 中国茶产业和茶饮料产业组织对比分析研究[J]. 福建茶叶, 2008(2): 39-40. DOI:10.3969/j.issn.1005-2291.2008.02.019.
[2] 聂少平, 谢明勇, 申明月, 等. 应用高效液相色谱法测定茶叶多糖[J]. 食品科学, 2006, 27(4): 177-181. DOI:10.3321/ j.issn:1002-6630.2006.04.042.
[3] 梁丽军, 曾哲灵, 熊涛, 等. 蒽酮-硫酸法测定大蒜多糖含量[J]. 食品科学, 2008, 29(9): 499-502. DOI:10.3321/ j.issn:1002-6630.2008.09.118.
[4] 傅博强, 谢明勇, 聂少平, 等. 茶叶中多糖含量的测定[J]. 食品科学, 2001, 22(11): 69-73. DOI:10.3321/j.issn:1002-6630.2001.11.023.
[5] 李景恩, 聂少平, 杨美艳, 等. 香薷中多糖含量的测定[J]. 食品科学, 2008, 29(9): 487-490. DOI:10.3321/j.issn:1002-6630.2008.09.114.
[6] 方崇波, 赵夏雨, 吴巧凤. 苯酚-硫酸法测定猕猴桃多糖注射剂中多糖的含量[J]. 海峡科学, 2010, 22(10): 64-66. DOI:10.3969/ j.issn.1006-3765.2010.10.033.
[7] 姜琼, 谢妤. 苯酚-硫酸法测定多糖方法的改进[J]. 江苏农业科学, 2013, 41(12): 316-318. DOI:10.3969/j.issn.1002-1302.2013.12.114.
[8] 于瑞涛, 朱鹏程, 陶燕铎, 等. 苯酚硫酸法测定迷果芹多糖的含量[J]. 分析实验室, 2008, 27(增刊2): 222-224. 10.3969/ j.issn.1000-0720.2008.z2.065.
[9] 夏永刚, 梁军, 杨炳友, 等.苯酚-硫酸法测定麻黄多糖含量研究[J]. 中医药信息, 2011, 28(1): 33-35. DOI:10.3969/ j.issn.1002-2406.2011.01.014.
[10] 王向红, 吉爽爽, 生庆海, 等. 柱前衍生高效液相色谱法检测8 种枣水溶性多糖的单糖组成[J]. 中国食品学报, 2014, 14(9): 257-262.
[11] 周鹏, 谢明勇, 王远兴. 高效液相色谱-电喷雾质谱法用于茶多糖蛋白的纯度和相对分子质量的测定[J]. 色谱, 2004, 22(1): 27-29. DOI:10.3321/j.issn.1000-8713.2004.01.007.
[12] 马定远, 陈君, 李萍, 等. 柱前衍生化高效液相色谱法分析多糖中的单糖组成[J]. 分析化学, 2002, 30(6): 702-705. DOI:10.3321/ j.issn.0253-3820.2002.06.016.
[13] 徐扬, 杨保伟, 柴博华, 等. 超声波-酶法提取海带多糖及其抑菌活性[J].农业工程学报, 2010, 26(1): 356-362.
[14] 王力, 董乐, 杨秋明, 等. 海带提取物的鉴定及抗菌活性的研究[J].食品科学, 2009, 30(11): 58-61.
[15] 陈晖, 闰治攀, 陈方圆, 等. 改进差示苯酚-硫酸法测定维血宁颗粒多糖含量[J]. 中国中医药信息杂志, 2014, 21(3): 84-86. DOI:10.3969/ j.issn.1005-5304.2014.03.025.
[16] 徐斌, 董英, 林琳, 等. 改良苯酚-硫酸法测定苦瓜多糖含量[J]. 食品科技, 2005, 30(7): 79-82. DOI:10.3969/j.issn.1005-9989.2005.07.024.
[17] 刘晓涵, 陈永刚, 林励, 等. 蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J]. 食品科技, 2009, 34(9): 270-272.
[18] 耿霞, 梁冰, 梁玉祥, 等. 苯酚-硫酸光谱法快速测定中药中多糖的研究[J]. 四川大学学报, 2002, 34(11): 62-63.
[19] 巴媛媛, 王莹, 朴美子. 苯酚-硫酸法测定瓦尼木层孔菌菌丝体多糖含量的条件优化[J]. 食品工业科技, 2011, 32(5): 389-391.
[20] 李艳玲, 史仁玖, 张显忠, 等. 蒽酮-硫酸法测定泰山灰树花中海藻糖含量的研究[J]. 食品科学, 2009, 30(8): 218-220.
[21] 何佳奇, 姚振生, 熊耀康. 苯酚-硫酸法测定麦冬须根中多糖的含量[J]. 中国中医药信息杂志, 2006, 13(10): 51-52. DOI:10.3969/ j.issn.1005-5304.2006.10.022.
[22] 张彬, 谢明勇, 殷军艺, 等. 响应面分析法优化超声提取茶多糖工艺的研究[J]. 食品科学, 2008, 29(9): 234-238. DOI:10.3321/ j.issn:1002-6630.2008.09.050.
[23] 张红, 王腾, 李翠清. 响应面分析优化蒽酮-硫酸法测定桑叶中多糖的含量[J]. 食品工业科技, 2012, 33(24): 62-65.
[24] 朱素英. 响应面法优化三七花多酚的提取工艺及其抗氧化性分析[J].食品科学, 2015, 36(10): 65-69. DOI:10.7506/spkx1002-6630-201510013.
[25] 顾仁勇, 杨万根, 余佶. 响应面优化超临界CO 2萃取八月瓜幼果多酚工艺[J]. 食品科学, 2015, 36(10): 76-80. DOI:10.7506/spkx1002-6630-201510015.
Comparison of Phenol-Sulfuric Acid and Anthrone-Sulfuric Methods for Determination of Polysaccharide in Green Tea
ZHANG Yuanyuan, ZHANG Bin
(Shijiazhuang University, Shijiazhuang 050035, China)
Abstract:This study aimed to establish a phenol-sulfuric acid method for the determination of the polysaccharide content in green tea and evaluate its performance in comparison with that of the anthrone-sulfuric method. In the phenol-sulfuric acid method, three experimental conditions including phenol concentration, sulfuric acid dosage and color development time were optimized by single factor experiments and response surface methodology using absorbance value as the dependent variable. A mathematical regression model was established. The optimum experimental conditions were found as followes: 1 mL of 4.8% aqueous phenol solution, 5 mL of concentrated sulfuric acid, and detection at 488 nm after 29 min of color development. There was a good linear relationship between absorbance and concentration in the range from 0 to 0.2 mg/mL. The experimental results showed that the average recovery rate was equal to or higher than 97.55% with good reproducibility (RSD = 1.82%, n = 7). The phenol-sulfuric acid method was rapid, accurate, sensitive and suitable for the determination of polysaccharide in green tea.
Key words:tea polysaccharide; phenol-sulfuric acid method; anthrone-sulfuric method; response surface methodology
DOI:10.7506/spkx1002-6630-201604028
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)04-0158-06
引文格式:
张媛媛, 张彬. 苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J]. 食品科学, 2016, 37(4): 158-163.
DOI:10.7506/spkx1002-6630-201604028. http://www.spkx.net.cn
ZHANG Yuanyuan, ZHANG Bin. Comparison of phenol-sulfuric acid and anthrone-sulfuric methods for determination of polysaccharide in green tea[J]. Food Science, 2016, 37(4): 158-163. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604028. http://www.spkx.net.cn
收稿日期:2015-05-19
作者简介:张媛媛(1983—),女,讲师,博士,研究方向为天然产物开发与应用。E-mail:zhyy701@163.com