
图1 空白(a)、标准品20 ng/mL(b)、加标500 ng/mL样品(c)和实际样品(d)典型色谱图
Fig.1 Typical chromatogram of blank (a), ribavirin standard (20 ng/mL) (b), plasma spiked with 500 ng/mL (c), and real sample (d)
郑 锌
1,汤晓艳
2,
*,曹兴元
3,齐 凯
1,陶 瑞
2,王 敏
2
(1.南京农业大学食品科技学院,肉品加工与质量控制教育部重点实验室,江苏 南京 210095;2.中国农业科学院农业质量标准与检测技术研究所,农业部农产品质量安全重点实验室,北京 100081;3.中国农业大学动物医学院,北京 100094)
摘 要:为研究禁用抗病毒药物利巴韦林在蛋鸡体内的残留性,对11 只京红蛋鸡以30 mg/kg体质量单次口服灌喂利巴韦林药物,采集给药后不同时间的静脉血,以超高效液相色谱-串联质谱法检测利巴韦林,多反应监测模式和同位素内标法定量。利巴韦林线性范围为5~5 000 ng/mL,检出限为1 ng/mL。在10~1 000 ng/mL范围内样品添加回收率为86.4%~97.1%,批内、批间相对标准偏差均满足定量要求。结果表明,给药后血浆中利巴韦林质量浓度迅速升高,随着代谢消除进行,血浆中利巴韦林质量浓度逐渐下降,至24 h血浆中利巴韦林质量浓度低于方法检出限。蛋鸡口服给药利巴韦林后吸收迅速,到达峰值时间短,体内分布广,消除速度快,残留性不高。
关键词:利巴韦林;代谢;蛋鸡;超高效液相色谱-串联质谱法
利巴韦林,又名病毒唑,三氮唑核苷,化学名1-β-D-呋喃核糖基-1H-1,2,4,-三氮唑-3-甲酰胺,是一种嘌呤核苷类似物,自1972年合成 [1-2]以来,被广泛用于人类呼吸道合胞病毒、流感病毒、脊髓灰质炎病毒、丙型肝炎病毒等的治疗 [3]。长期以来,为了预防畜禽流感,利巴韦林也被广泛应用于畜禽养殖过程中。为了保证人类用药安全和动物防疫安全,2005年农业部发布第560号公告,禁止利巴韦林、金刚烷胺、吗啉胍等抗病毒药物在动物养殖中使用。然而利巴韦林在畜禽养殖过程违规使用的现象仍然普遍存在,畜禽产品质量安全受到一定的威胁 [4-5]。目前,对于血浆中的利巴韦林残留检测方法研究比较多,多以液相色谱 [6]、液相色谱-串联质谱法测定 [7-8],灵敏度不高,分析时间略长。本研究建立了一种灵敏快速检测鸡血浆中利巴韦林的超高效液相色谱-串联质谱方法,分析时间短,并对蛋鸡体内利巴韦林的药物代谢规律进行了初步研究,可为禽产品中利巴韦林残留检测提供一定的参考依据。
1.1 材料与试剂
4 3 周龄京红蛋鸡1 1 只,平均体质量(1.8±0.2) kg,购于北京市顺义某鸡场。
利巴韦林标准品(1-β-D-ribofuranosyl-1,2,4-triazole-3-carboxamide,C 8H 12N 4O 5,M r:244.20,CAS号:36791-04-5,纯度99.9%) 德国Dr.Ehrenstorfer有限责任公司; 13C 5-利巴韦林(1-β-D-ribofuranosyl-1H-1,2,4-triazole-3-carboxamide- 13C 5,C 3 13C 5H 12N 4O 5,M r:249.17,货号:R414477) 加拿大TRC公司;利巴韦林注射液(批号:1312263,规格0.1 g/mL) 杭州民生药业有限公司;甲醇(色谱纯) 德国Merck公司;甲酸(色谱纯) 美国Mreda Technology公司;实验用水为Milli-Q纯水仪制备的超纯水(≥18 MΩ•cm);0.22 μm水系滤膜 上海安谱科学仪器有限公司。
1.2 仪器与设备
ACQUITY UPLC超高效液相色谱 美国Waters公司;串联AB SCIEX QTRAP 6500型线性离子阱质谱仪(配有Turbo V离子源、Analyst 1.6.2数据处理软件)美国 AB Sciex公司;XS105分析天平(感量0.01 mg)瑞士Mettler Toledo公司;TTL-DC II型氮气浓缩仪 北京同泰联科技发展有限公司;MicroSmart微型离心机 北京昊诺斯科技有限公司;VORTEX-5涡旋振荡器 海门市其林贝尔有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Agilent ZORBAX SB-Aq(3.0 mm×100 mm,1.8 μm);流动相A:甲醇,B:0.1%甲酸溶液。梯度洗脱程序:0~2.5 min,99% B;2.5~4 min,99%~85% B;4~5 min,85%~10% B;5~6 min,10%~99% B;保持3 min。流速:0.3 mL/min;柱温:30 ℃;样品室温度:20 ℃;进样量:10 μL。
1.3.2 质谱条件
电喷雾离子源,正离子模式扫描,多反应监测模式,监测离子对m/z 245/113和m/z 245/96,碰撞能分别为15 eV和40 eV,其中m/z 245/113为定量离子对; 13C 5-利巴韦林监测m/z 250/113离子对,碰撞能15 eV。碰撞气为氮气,气帘气压力:0.14 MPa;雾化气压力:0.21 MPa;辅助加热气压力:0.14 MPa;离子源电压:5 000 V;离子源温度:550℃;碰撞室出口电压:10 V;射入电压:10 V;离子对驻留时间:50 ms。
1.3.3 蛋鸡给药及采血
给蛋鸡适应性饲喂全价饲料7 d,给药前禁食12 h,自由采水。给药前采空白血,给药后分别于0.25、0.5、1、2、3、8、10、24、34、48、58、72 h翼下静脉采血1 mL,肝素钠抗凝,3 000 r/min离心10 min,分离上层血浆,置于1.5 mL离心管中,-20 ℃冻存,待测。
1.3.4 血浆样品前处理
将冻存血浆解冻,涡旋均匀,取300 μL置于2 mL离心管中,加入适量内标工作液(空白血浆不加,以相同体积纯水替换),涡旋1 min,加入1.3 mL甲醇,振荡10 min,12 000 r/min离心10 min,取上清液,40 ℃水浴氮气吹干,加0.9 mL纯水,涡旋30 s复溶,15 000 r/min,离心10 min,上清液过0.22 μm水系滤膜,进样测定。
1.4 数据处理
采用AB Sciex质谱自带的Analyst 1.6.2软件,对峰面积进行积分,并计算相关的血浆中利巴韦林质量浓度数据。用非房室模型药代动力学软件WinNonlin 6.3来处理血浆中利巴韦林质量浓度-时间数据,计算每只鸡的药代动力学参数,并计算平均值及标准差。
2.1 方法特异性考察结果
在1.3.1和1.3.2节条件下,对空白血浆、标准品、空白加标血浆,以及给药后2 h实际样品色谱图进行分析。如图1所示,本方法前处理简单,色谱柱对利巴韦林保留效果较好,且不受内源性成分(保留时间4.13 min)的干扰。利巴韦林保留时间为3.08 min。

图1 空白(a)、标准品20 ng/mL(b)、加标500 ng/mL样品(c)和实际样品(d)典型色谱图
Fig.1 Typical chromatogram of blank (a), ribavirin standard (20 ng/mL) (b), plasma spiked with 500 ng/mL (c), and real sample (d)
2.2 方法线性范围、检出限、准确度和精密度
以空白样品配制含利巴韦林5、10、20、100、500、1 000、5 000 ng/mL质控样品,每个质量浓度2 个平行,以内标校准峰面积(Y)对校准质量浓度(X,ng/mL)进行线性拟合,得线性方程Y=0.027 2X+2.187 5,线性范围5~5 000 ng/mL。方法检出限、定量限分别以信噪比3、10 倍计算,检出限和定量限分别为1、5 ng/mL。
设置高、中、低(1 000、100、10 ng/mL)3 个质量浓度利巴韦林质控样品,每个质量浓度样品重复数为5,结果如表1所示,利巴韦林的平均回收率为86.4%~97.1%,批内、批间相对标准偏差均满足定量要求。
表1 血浆添加利巴韦林回收率及相对标准偏差
Table 1 Linear equations, correlation coefficients, LODs, recoveries and relative standard deviations for ribavirin

(ng/mL)线性方程相关系数线性范围/检出限/(ng/mL)定量限/(ng/mL)添加量/(ng/mL)回收率/%批内相对标准偏差(n=5)/%批间相对标准偏差/% 5~5 000Y=0.027 2X+2.187 50.994 715 1086.413.416.9 10097.15.16.8 1 00094.26.35.2
2.3 蛋鸡体内利巴韦林代谢规律
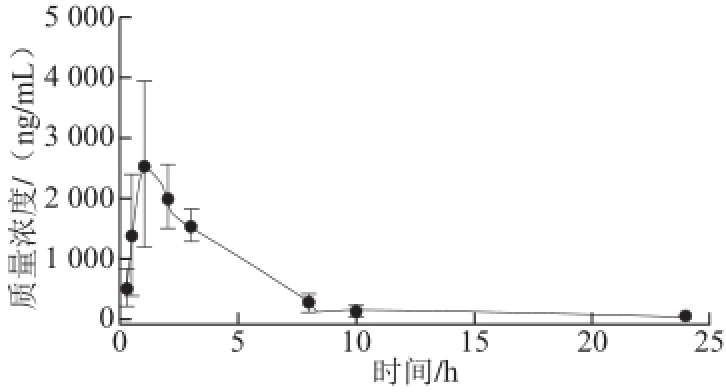
图2 口服给药30 mg/kg后蛋鸡血浆中利巴韦林质量浓度随时间变化曲线(n=11)=11
Fig.2 Mean concentration of ribavirin in plasma of laying hens following oral administration of ribavirin at 30 mg/kg BW (n=11=11)
蛋鸡单剂量口服灌喂利巴韦林30 mg/kg后,以该方法测定11 只蛋鸡各时间点的血浆中利巴韦林质量浓度,数据经WinNonlin 6.3软件分析,绘制成血浆中利巴韦林质量浓度-时间曲线(图2)。利巴韦林吸收迅速,给药后(1.59±0.74) h即达到最大值,血浆中利巴韦林最大质量浓度为(2 796.54±1 120) ng/mL,蛋鸡肠道对利巴韦林的吸收程度不高,药时曲线下面积仅为(AUC 0~t)(10 658.18±2 627.348)(h•ng)/mL。利巴韦林在蛋鸡体内消除快,血浆消除半衰期(T 1/2β)为(2.94±0.90) h,在1 0 h下降到(1 3 6.6 1±6 7.2 8) n g/m L,此后血浆中利巴韦林质量浓度进入平稳期,在34 h低于检出限。总的来说,蛋鸡对利巴韦林的代谢快,药物的残留性不高,平均驻留时间为(3.58±0.73) h。
3.1 方法色谱及质谱条件优化
利巴韦林极性强,且结构与核苷类似,易受到血浆中的核苷的影响。文献报道,一般采用Agilent SBAq [9]、XDB C 18 [10]、Waters HILIC [11]、T3 [12]、Atlantis dC 18 [13]等对极性化合物有一定保留的色谱柱进行利巴韦林分离。根据实验,利巴韦林在Agilent ZORBAX SB-Aq(3.0 mm×100 mm,1.8 μm)亲水性色谱柱上保留效果好,峰形尖锐,且该色谱柱能分离基质中的内源性干扰。本方法选择99%的水相作为起始比例,在流动相中添加了0.1%的甲酸,并提高离子源温度,保证了高比例水相条件下的有效离子化。此外,实验还对比了甲醇和乙腈的洗脱效果。结果显示,相比于乙腈,甲醇洗脱能分离利巴韦林和内源性干扰,且保留效果更好。研究中还发现,采用甲醇溶解样品上机会产生溶剂效应,色谱出现双峰,因此,样品提取及复溶试剂均采用纯水。本方法灵敏度高,线性范围宽,不受基质干扰,前处理方法简单、经济。
利巴韦林在正离子模式条件下易电离,产生[M+H] +m/z 245和[M+Na] +m/z 267,加钠峰响应略高,但不稳定,不宜选用。以[M+H] +为母离子进行碎片离子扫描,m/z 113、m/z 96和m/z 133为主要例子碎片。根据文献[14]的研究,m/z 113、m/z 133碎片是呋喃核糖和三氮唑环断裂形成,m/z 96是由三氮唑乙胺中性丢失NH 2获得。根据2002/657/EEC关于确证法4 个确证点的要求,选取丰度强,干扰小的两对离子对m/z 245/113和m/z 245/96为定性离子对,同时选取m/z 245/113为定量离子对,并优化离子源电压、温度等参数。
3.2 不同动物体内利巴韦林药物代谢规律对比
利巴韦林在蛋鸡体内的药代动力学研究尚属空白,相关数据的缺失,不利于残留研究中给药剂量、采样时间点的确认。本研究表明,蛋鸡口服利巴韦林呈现出吸收快、分布广、消除较快的特点。达峰时间T max反映了药物在机体内的吸收快慢,利巴韦林在蛋鸡体内T max为(1.59±0.74) h。利巴韦林在蛋鸡血浆中的达峰时间与其在猪 [15]和大鼠 [16]等动物中的达峰时间相比,并没有太大差别,均在1~3 h。利巴韦林口服给药的吸收受到肠道首关效应的影响,生物利用度不高。据报道,利巴韦林的吸收受到ENT1 [17]、CNT2 [18]、CNT3 [19]的调控。而平衡型核苷载体和依赖Na +的浓缩型核苷载体的种属差异并不大。
利巴韦林在不同动物体内的代谢消除差异较大。利巴韦林在蛋鸡血浆消除半衰期(T 1/2β)为(2.95±0.9) h,消除较快。利巴韦林在猪和猴体内的残留蓄积时间长,消除半衰期分别为23.5 h和8.1 h。猕猴静脉注射,消除半衰期可达130 h。消除半衰期主要与清除率和代谢转化有关。研究表明,利巴韦林的代谢转化是利巴韦林消除的主要途径,通过肾脏代谢消除的部分只占5%~15% [20]。利巴韦林在动物体内可能的代谢途径有两条:一条代谢途径是去核糖基化或酰胺水解形成三唑羧酸代谢物;另一条是可逆的磷酸化途径 [13],涉及多种酶的作用,包括腺苷激酶,嘌呤核苷磷酸化酶。磷酸化的活性产物包括利巴韦林单磷酸、利巴韦林二磷、利巴韦林三磷酸 [21-22]。利巴韦林在哺乳动物体内的消除半衰期比较长,而蛋鸡体内却很短,这提示利巴韦林的残留性与种属差异有一定关系,还需进一步研究确证。
此外,本研究显示,利巴韦林在蛋鸡体内的代谢存在较大的个体差异,如9、10号鸡C max分别为4 920、1 485 ng/mL。这可能是由于不同个体对利巴韦林的吸收程度不同或存在一定的个体生理差异。
本研究建立了蛋鸡血浆中利巴韦林的超高效液相色谱-串联质谱检测方法,该方法灵敏快速,线性范围5~5 000 ng/mL,检出限和定量限分别为1、5 ng/mL,平均回收率为86.4%~97.1%,满足生物样品定量相关要求,并将此方法应用于蛋鸡体内利巴韦林的代谢规律的初步研究。
参考文献:
[1] STREETER D G, MILLER J P, ROBINS R K, et al. The enzymic conversion of 1,2,4-triazole-3-carboxamide to ribavirin-5’-phosphate and its relationship to the proposed mechanism of action[J]. Annals of the New York Academy of Sciences, 1977, 284(1): 201-210. DOI:10.1111/j.1749-6632.1977.tb21952.x.
[2] SIDWELL R W, HUFFMAN J H, LOIS G P K, et al. Broad-spectrum antiviral activity of virazole: 1-β-D-ribofuranosyl-1,2,4-triazole-3-carboxamide[J]. Science, 1972, 177: 705-706. DOI:10.1126/ science.177.4050.705.
[3] NAIK G S, TYAGI M G. A pharmacological profile of ribavirin and monitoring of its plasma concentration in chronic hepatitis C infection[J]. Journal of Clinical and Experimental Hepatology, 2012, 2(1): 42-54. DOI:10.1016/S0973-6883(12)60090-5.
[4] 谭胜国. 因误用利巴韦林治疗猪流感而引发药物中毒的诊疗报告[J].当代畜牧, 2014(30): 34-35.
[5] 蒋增海, 邓同炜, 李文刚, 等. 猪群利巴韦林中毒病例[J]. 中国兽医杂志, 2013, 49(9): 83; 51. DOI:10.3969/j.issn.0529-6005.2013.09.035.
[6] D’AVOLIO A, IBAÑEZ A, SCIANDRA M, et al. Validation of liquid/liquid extraction method coupled with HPLC-UV for measurement of ribavirin plasma levels in HCV-positive patients[J]. Journal of Chromatography B, 2006, 835(1): 127-130. DOI:10.1016/ j.jchromb.2006.03.019.
[7] LIU Y F, XU C, YAN R Z, et al. Sensitive and specific LC-MS/MS method for the simultaneous measurements of viramidine and ribavirin in human plasma[J]. Journal of Chromatography B, 2006, 832(1): 17-23. DOI:10.1016/j.jchromb.2005.12.034.
[8] DANSO D, LANGMAN L J, SNOZEK C L. LC-MS/MS quantitation of ribavirin in serum and identification of endogenous i sobaric interferences[J]. Clinica Chimica Acta, 2011, 412(23/24): 2332-2335. DOI:10.1016/j.cca.2011.07.016.
[9] 刘凯, 王丽娜, 李建忠. 饲料和鸡肉中利巴韦林的测定: 超高效液相色谱-串联质谱法[J]. 现代畜牧兽医, 2014(5): 15-19. DOI:10.3969/ j.issn.1672-9692.2014.05.004.
[10] 陈燕, 李晓雯, 刘畅. 禽畜肉中利巴韦林残留量检测方法的研究[J].食品安全质量检测学报, 2014, 5(3): 905-911.
[ 11] 邵琳智, 姚仰勋, 谢敏玲, 等. 亲水相互作用色谱-串联质谱法同时测定动物组织中金刚烷胺与利巴韦林[J]. 分析测试学报, 2013, 32(12): 1448-1452.
[12] 强晓妍, 朱监宝, 徐敏, 等. LC-MS/MS法测定大鼠血浆中利巴韦林及其毒代动力学参数[J]. 药学进展, 2012, 36(9): 413-417. DOI:10.3969/j.issn.1001-5094.2012.09. 005.
[13] AGNESOD D, de NICOL A, SIMIELE M, et al. Development and validation of a useful UPLC-MS/MS method for quantification of total and phosphorylated-ribavirin in peripheral blood mononuclear cells of HCV +patients[J]. Journal of Pharmaceutic al and Biomedical Analysis, 2014, 90: 119-126. DOI:10.1016/j.jpba.2013.11.027.
[14] LI W K, LUO S Y, LI S Y, et al. Simultaneous determination of ribavirin and ribavirin base in monkey plasma by high performance liquid chromato graphy with tandem mass spectrometry[J]. Journal of Chromatography B, 2007, 846(1/2): 57-68. DOI:10.1016/ j.jchromb.2006.08.014.
[15] 于宏. 仔猪口服利巴韦林药代动力学及体内外毒性试验研究[D]. 泰安: 山东农业大学, 2010.
[16] LIN C C, YEH L T, LUU T, et al. Pharmacokinetics and metabolism of [14C]ribavirin in rats and cynomolgus monkeys[J]. Antimicrobial Agents and Chemotherapy, 2003, 47(4): 1395-1398. DOI:10.1128/ AAC.47.4.1395-1398.2003.
[17] IIKURA M, FURIHATA T, MIZUGUCHI M, et al. ENT1, a ribavirin transporter, plays a pivotal role in antiviral efficacy of ribavirin in a hepatiti s C virus replication cell system[J]. Antimicrobial Agents and Chemotherapy, 2012, 56(3): 1407-1413.
[18] FUKUCHI Y, FURIHATA T, HASHIZUME M, et al. Characterization of ribavirin uptake systems in human hepatocytes[J]. Journa l of Hepatology, 2010, 52(4): 486-492. DOI:10.1016/j.jhep.2010.01.011.
[19] MOSS A M, ENDRES C J, RUIZ-GARCIA A, et al. Role of the equilibrative and conc entrative nucleoside transporters in the intestinal absorption of the nucleoside drug, ribavirin, in wild-type and Ent1(−/−) mice[J]. Molecular Pharmaceutics, 2012, 9(9): 2442-2449. DOI:10.1021/mp200647a.
[20] GLUE P, SCHENKER S, GUPTA S, et al. The single dose pharmacokinetics of ribavirin in subjects with chronic liver disease[J]. British Journal of Clinical Pharmacology, 2000, 49(5): 417-421. DOI:10. 1046/j.1365-2125.2000.00186.x.
[21] WU J Z, WALKER H, LAU J Y N, et al. Activation and deactivation of a broad-spectrum antiviral drug by a single enzyme: adenosine deaminase catalyzes two consecutive deamination reactions[J]. Antimicrobial Agents and Chemotherapy, 2003, 47(1): 426-431. DOI:10.1128/AAC.47.1.426-431.2003.
[22] WU J Z, LARSON G, WALKER H, et al. Phosphorylation of ribavirin and viramidine by adenosine kinase and cytosolic 5’-nucleotidase Ⅱ: implications for ribavirin metabolism in erythrocytes[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(6): 2164-2171. DOI:10.1128/ AAC.49.6.2164-2171.2005.
Detection of Antiviral Drug Ribavirin in Laying Hens by Ultra High Performance Liquid Chromatography-Tandem Mass Spectrometry
ZHENG Xin
1, TANG Xiaoyan
2,
*, CAO Xingyuan
3, QI Kai
1, TAO Rui
2, WANG Min
2
(1. Key Laboratory of Meat Processing and Quality Control, Ministry of Education, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. Key Laboratory of Agro-food Safety and Quality, Ministry of Agriculture, Institute of Quality Standards and Testing Technology for Argo-products, Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3. College of Veterinary Medicine, China Agricultural University, Beijing 100094, China)
Abstract:This study aimed to examine the residues of the banned antiviral drug ribavirin in poultry. Eleven Jinghong laying hens were fed with 30 mg/kg BW ribavirin via single oral administration and their blood samples were collected from a vein under the wing at different time points. The ribavirin in the plasma samples was measured by using ultra high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) under the multiple reaction monitoring mode (MRM) and quantified using isotope-labeled internal standard. The calibration curve for ribavirin exhibited good linearity over the concentration range from 5 to 5 000 ng/mL, and the limit of detection (LOD) was 1 ng/mL. Average recoveries for ribavirin spiked at 3 levels ranged from 86.4% to 97.1%, and the inter-batch and intra-batch relative standard deviations (RSDs) both met the quantitative requirement. Ribavirin concentration in laying hens plasma increased rapidly after oral administration but then decreased gradually with metabolic elimination. The results suggested that the pharmacokinetic characteristics of ribavirin in hens include quick absorption, broad distribution, rapid elimination, and lower residue in tissue.
Key words:ribavirin; metabolism; laying hens; ultra high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS)
DOI:10.7506/spkx1002-6630-201604035
中图分类号:TS251.1
文献标志码:A
文章编号:1002-6630(2016)04-0197-05
引文格式:
郑锌, 汤晓艳, 曹兴元, 等. 超高效液相色谱-串联质谱法检测蛋鸡体内抗病毒药物利巴韦林[J]. 食品科学, 2016, 37(4): 197-201.
DOI:10.7506/spkx1002-6630-201604035. http://www.spkx.net.cn
ZHENG Xin, TANG Xiaoyan, CAO Xingyuan, et al. Detection of antiviral drug ribavirin in laying hens by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2016, 37(4): 197-201. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201604035. http://www.spkx.net.cn
收稿日期:2015-04-21
基金项目:中国农业科学院基本科研增量项目(2014ZL015);“十二五”国家科技支撑计划项目(2012BAD28B03)
作者简介:郑锌(1990—),男,硕士研究生,研究方向为畜产品质量安全。E-mail:522859476@qq.com
*通信作者:汤晓艳(1976—),女,研究员,博士,研究方向为畜产品质量安全。E-mail:txycaas@126.com