王金霞
1,2,林江丽
1,鹿 毅
2,
*,王吉德
1
(1.新疆大学化学化工学院,石油天然气精细化工教育部和新疆维吾尔自治区共建重点实验 室,新疆 乌鲁木齐 830046;2.新疆产品质量监督检验研究院,新疆 乌鲁木齐 830004)
摘 要:建立荧光衍生化法快速、准确测定新疆特色葡萄干中总亚硫酸盐的分析方法。用N-(9-吖啶基)马来酰亚胺为 衍生化试剂,使其与葡萄干中的亚硫酸盐发生衍生化反应产生具有强荧光的衍生化产物,采用荧光光谱仪对其进行分析检测。结果表明,在1.0~43.2 mg/L质量浓度范围内相关系数(R 2)为0.999 3,方法的检出限为0.50 mg/L,3 个添加水平时,平均回收率为92.2%~100.2%,相对标准偏差(n=3)不大于3.80%。利用该法对葡萄干中总亚硫酸盐的测定结果与国标法测得结果一致,说明该方法可快速准确地对新疆特色葡萄干中总亚硫酸盐进行测定,为干果中亚硫酸盐残留量的测定提供参考。
关键词:葡萄干;总亚硫酸盐;荧光衍生化法
食品中添加亚硫酸盐起漂白、抗氧化、防腐保鲜及防止褐变的作用 [1]。葡萄干干制过程中常添加亚硫酸及其盐类来抑制褐变,防止果粒霉变,保持葡萄干色泽亮黄 [2]。但过量添加的亚硫酸盐会对呼吸道及人体其他器官产生危害 [3-4]。因此,世界各国对食品中亚硫酸盐最大限量做了规定 [5]。美国食品和药物管理局要求对亚硫酸盐使用量高于10 mg/kg的食品予以标明;欧美国家的食品中的SO 2残留标准小于10 mg/kg。我国农业行业标准NY/T 1041—2010《绿色食品干果》规定:葡萄干等干果中SO 2的残留量不大于50 mg/kg [6-7]。
食品中亚硫酸盐常用的测定方法是Monier-Williams法 [8]、碘量法 [9]、盐酸副玫瑰苯胺法 [10]。Monier-Williams法在蒸馏中易发生焦糖化反应 [11];碘量法灵敏度不高 [12];盐酸副玫瑰苯胺法(即国标法)是常采用的方法,但吸收液毒性大,且色素对测定结果产生干扰 [13]。随着分析科学新方法和新技术的发展,化学发光 [14]、电化学 [15]、酶 [16]、流动注射 [17]、离子色谱 [18]、毛细管电泳 [19]等方法逐渐应用到亚硫酸盐的分析检测中,这些新方法虽然检测灵敏度高,但样品的前处理复杂,操作繁琐,均无法快速、准确地对基质复杂样品中总亚硫酸盐含量进行分析检测。因此,建立一种样品基质相对复杂葡萄干中总亚硫酸盐含量快速准确的分析方法,在食品安全备受关注的当今社会具有重要的意义。
荧光法因具有灵敏度和选择性高、线性范围宽、准确快速和不易受到样品中阴阳离子和色素的干扰等优点,常应用于样品中荧光化合物的分析检测 [20-21]。本实验利用N-(9-吖啶基)马来酰亚胺为荧光衍生化试剂,使其与葡萄干中的亚硫酸盐发生衍生化反应产生具有强荧光的衍生化产物,采用荧光法对葡萄干中的亚硫酸盐含量进行分析检测。
1.1 材料、试剂与仪器
葡萄干、鲜葡萄、葡萄酒、榨菜、虾皮等 市购。
N-(9-吖啶基)马来酰亚胺(色谱纯);乙二胺四乙酸二钠、硼酸、无水碳酸钠、氯化钾、亚硫酸氢钠均为国产分析纯试剂;所有实验用水均为电阻率18.2 MΩ/cm的超纯水。
RF-5301荧光分光光度计、UV-2550紫外分光光度计日本岛津公司;Coulter Avanti J-25高速离心机 美国Beckman公司;DF-101S集热式磁力加热搅拌器 金坛市医疗仪器厂;KQ5200E型超声波清洗器 昆山市超声仪器有限公司;FW-80高速万能粉碎机 北京市永光明医疗仪器有限公司;XS105DU分析天平 梅特勒-托利多仪器有限公司;PHB-8型笔式pH计 上海佑科仪器仪表有限公司。
1.2 方法
1.2.1 溶液的配制
N-(9-吖啶基)马来酰亚胺溶液:准确称取1 mg N-(9-吖啶基)马来酰亚胺溶解于4.0 mL丙酮,待用。
缓冲溶液:A溶液:称取6.18 g硼酸、7.46 g氯化钾和7.4 g乙二胺四乙酸二钠,用水溶解定容至1 L容量瓶中;B溶液:称取10.6 g碳酸钠和7.4 g乙二胺四乙酸二钠,用水溶解定容至1 L容量瓶中。两溶液按照不同体积比混合,配成pH值范围5.0~10.0的缓冲溶液。
1.2.2 样品前处理
将冷冻的葡萄干样品加入液氮低温粉碎,准确称取粉碎后的葡萄干样品10.0 g左右,加入0.1 mol/L氢氧化钠溶液20.0 mL,混匀,超声提取15 min,10 000 r/min离心10 min,取上层清液定容至25 mL容量瓶中,于4 ℃冰箱保存。
1.2.3 衍生化反应及测定
准确移取样品溶液50.0、150.0 øL N-(9-吖啶基)马来酰亚胺溶液和3.0 mL缓冲溶液置于反应瓶中,混匀,放置10 min,于50 ℃水浴中反应20 min后,立即放入冰水中冷却至室温,使衍生化反应停止。在激发波长360 nm、发射波长442 nm、狭缝宽度5 nm条件下,在380~600 nm波长处对反应体系进行荧光光谱扫描。
1.2.4 盐酸副玫瑰苯胺法测定总亚硫酸盐
参照GB/T 5009.34—2003《食品中亚硫酸的测定》方法,对样品进行测定。
1.2.5 标准溶液的配制
称取0.5 g亚硫酸氢钠,1.85 g乙二胺四乙酸二钠,用水定容至250 mL容量瓶,使用前用碘量法标定,于4 ℃冰箱保存至多3 d,使用时用0.1 mol/L乙二胺四乙酸二钠溶液稀释至所需质量浓度。
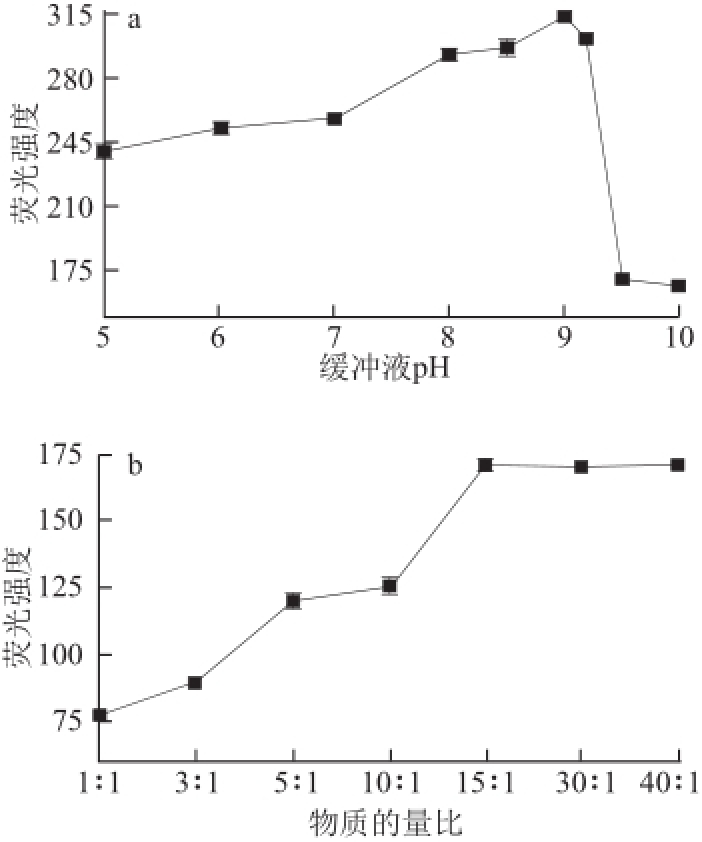
2.1 衍生化反应条件优化


图1 缓冲液pH值(a)、物质的量比(b)和反应温度(c)对体系荧光强度的影响
Fig.1 Effect of buffer pH (a), molar ratio (b) and reaction temperature (c) on the fluorescence intensity
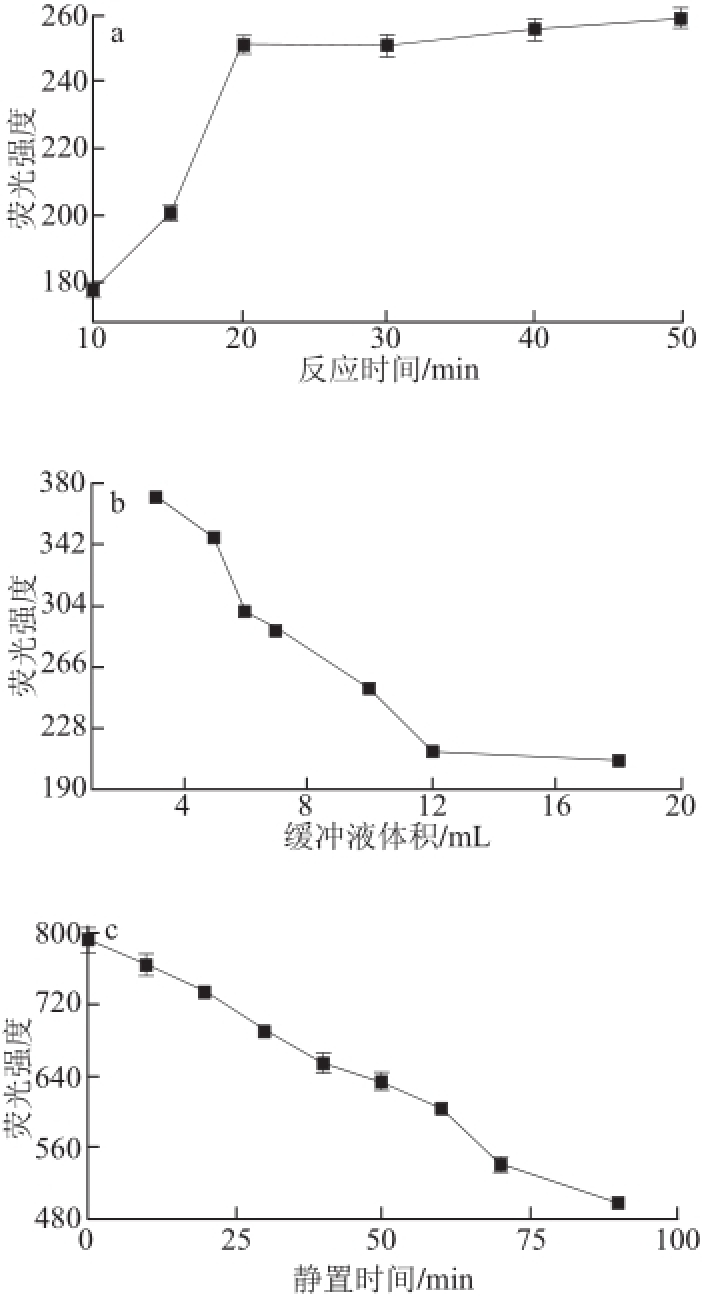
图2 反应时间(a)、缓冲液体积(b)和静置时间(c)对体系荧光强度的影响
Fig.2 Effect of reaction time (a), buffer solution volume (b) and standing time (c) on the fluorescence intensity
为使亚硫酸盐与衍生化试剂充分反应,对影响衍生化反应的缓冲液pH值、N-(9-吖啶基)马来酰亚胺与亚硫酸物质的量比、反应温度、反应时间、缓冲液体积和静置时间等条件进行优化。如图1、2所示,pH 9.0(图1a)、N-(9-吖啶基)马来酰亚胺亚硫酸盐物质量比15∶1(图1b)、反应温度50 ℃(图1c)、 缓冲盐体积3.0 mL(图2b,小于3 mL无法进行荧光检测)、反应时间20 min(图2a)为最佳衍生化反应条件,从图2c可以看出,衍生化反应结束应立即进行荧光强度测试。
2.2 样品中亚硫酸盐超声提取条件的优化
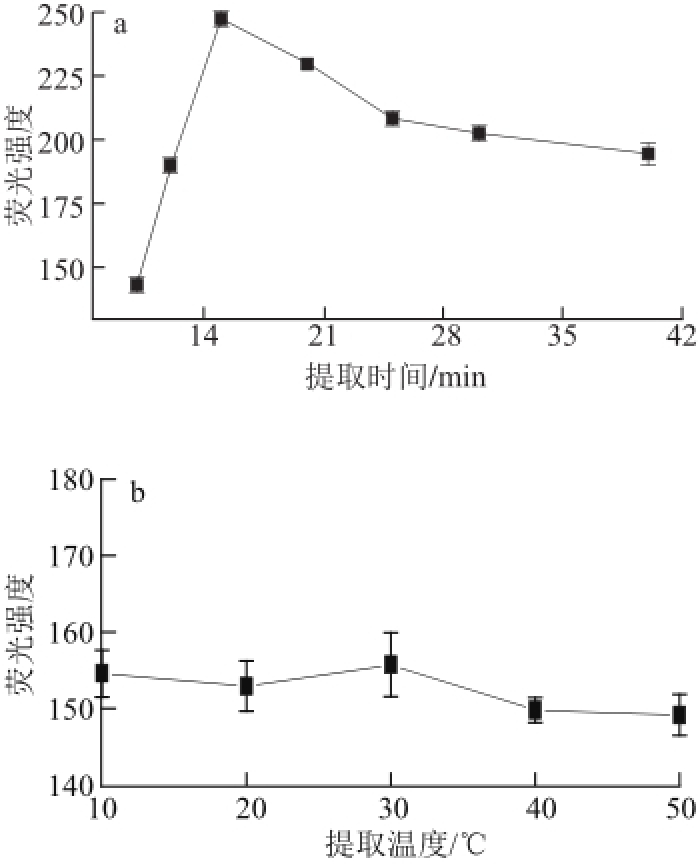
图3 提取时间(a)和提取温度(b)对样品中亚硫酸盐提取的影响
Fig.3 Effect of extraction time (a) and temperature (b) on the extraction of sulfite from raisin
为使样品中亚硫酸盐充分浸提,对样品中亚硫酸盐的提取时间和提取温度等提取条件进行了优化。如图3所示,随着提取时间的延长(图3a),亚硫酸盐提取量增大,荧光强度逐渐增大。提取时间15 min时,荧光强度达到最大值,说明样品中的亚硫酸盐被充分浸提。提取时间超过15 min后,荧光强度逐渐降低。故选择提取时间15 min为样品提取最佳时间。另外,从图3b可以看出,提取温度对样品中亚硫酸盐提取的影响较小。故选择室温作为对样品中亚硫酸盐提取的适宜温度。
2.3 标准曲线、线性范围及检出限
用亚硫酸盐氢钠储备液配制一系列不同质量浓度的标准溶液,按1.2.3节衍生化反应方法测定反应混合液的荧光强度。以亚硫酸氢钠质量浓度为横坐标,荧光强度为纵坐标,绘制标准曲线,得到亚硫酸氢钠的线性回归方程、线性范围、相关系数,以3 倍空白标准偏差除以校准曲线的斜率得到亚硫酸盐的检出限。由表2可知,亚硫酸氢钠与荧光强度在质量浓度1.0~43.2 mg/L范围内呈现良好的线性关系,相对标准偏差(relative standard deviation,RSD)不大于3.33%。
表2 两种方法线性方程、相关系数、线性范围、检出限、RRSSDD(n==33)
TTaabbllee 22 RReeggrreessssiioonn eeqquuaattiioonnss aanndd ccoorrrreellaattiioonn ccooeeffffiicciieennttss,, lliinneeaarr ranges, LODs, and RSDs of the pararosaniline method and fluorescence derivatizatiioonn ((n == 33))

方法线性方程相关系数R 2线性范围/(mg/L)检出限/(mg/L)RSD/%荧光衍生化法Y=38.99X+398.880.999 31.0~43.2 0.503.33盐酸副玫瑰苯胺法Y=0.061 8X+0.252 10.999 00.2~3.00.202.37
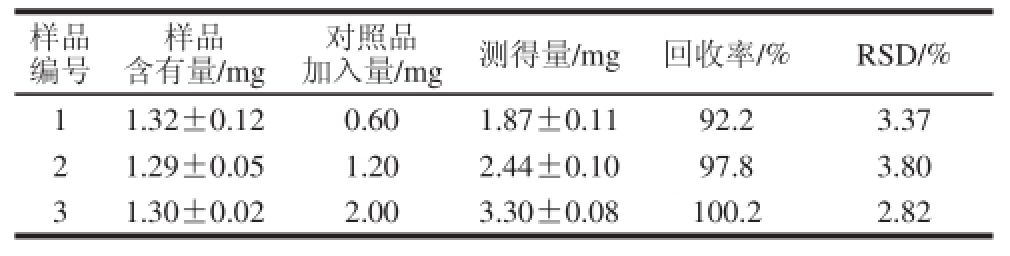
2.4 加标回收率
取葡萄干样品9 份,分别按低、中、高3 个水平(0.60、1.2、2.0 mg)添加亚硫酸盐标准溶液。按1.2.2节样品处理方法与1.2.3节衍生化反应方法操作,测定反应混合液的荧光强度,结果见表3,加标回收率范围为92.2 %~100.2%,RSD不大于3.80%,说明本方法满足定量分析实验要求。
表3 加标回收率实验结果( =3)
Table 3 Recoveries of the fluorescence derivatization method for spiked sampples ( = 3)
?
2.5 实际样品分析
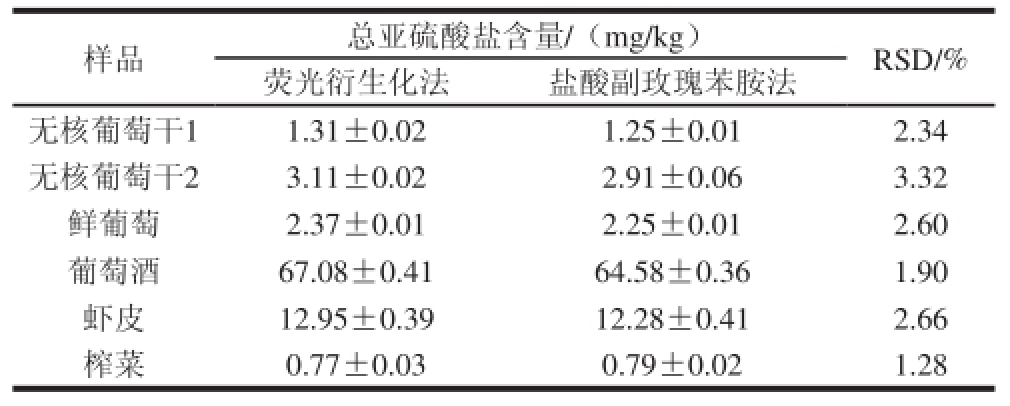
采用荧光衍生化法对两种无核葡萄干、葡萄、葡萄酒、虾皮、榨菜中总亚硫酸盐含量进行测定。结果见表4,两种无核葡萄干中总亚硫酸盐含量分别为1.31 mg/kg和3.11 mg/kg。鲜食葡萄、葡萄酒、虾皮、榨菜中的总亚硫酸盐含量分别为2.37、67.08、12.95、0.77 mg/kg。
表4 实际样品中总亚硫酸盐含量的测定( =4)
Table 4 Contents of total sulfite in real samples determined by the pararosaniline method and fluorescence derivatization ( = 4)
?
2.6 两种方法的比较
为了验证荧光衍生化法的准确性,采用荧光衍生化法和盐酸副玫瑰苯胺法对两种无核葡萄干、葡萄、葡萄酒、虾皮及榨菜6 个样品中总亚硫酸盐含量进行测定。从表2可以看出,荧光衍生化法的线性范围比盐酸副玫瑰苯胺法高一个数量级,且荧光衍生化法样品前处理所需时间不到盐酸副玫瑰苯胺法的一半。从表4也可以看出,两种方法的RSD不大于3.32%,说明本实验建立的方法准确可靠。
建立一种荧光衍生化法测定新疆特色葡萄干中总亚硫酸盐的分析方法。利用N-(9-吖啶基)马来酰亚胺与葡萄干样品中的亚硫酸盐反应生成具有强荧光的衍生化产物,采用荧光光谱仪对新疆特色葡萄干中总亚硫酸盐含量进行检测,线性范围、相关系数及RSD均较好。与盐酸副玫瑰苯胺法相比较,线性范围宽、检出限低、样品前处理所需时间较短,同时避免了有毒试剂的使用。而且荧光法检测所需试样量少,不易受色素的干扰,有利于大批样品的分析检测。利用该法对葡萄干、鲜食葡萄等5 种样品中总亚硫酸盐含量进行测定,其结果与国标法测定结果一致。说明该法测定结果准确可靠,重复性好,对样品基质较为复杂的干果中总亚硫酸盐的分析检测具有一定的参考价值。
参考文献:
[1] 周德庆, 张双灵, 辛胜昌. 亚硫酸盐在食品加工中的作用及其应用[J]. 食品科学, 2004, 25(12): 198-201. DOI:10.3321/ j.issn:1002-6630.2004.12.044.
[2] 李道敏, 赵美萍. 亚硫酸盐: 食品的美容和保鲜剂[J]. 大学化学, 2009, 24(1): 62-65. DOI:10.3969/j.issn.1000-8438.2009.01.017.
[3] 党卫红, 任平国. 亚硫酸盐生殖毒性研究[J]. 现代食品科技, 2009, 25(4): 373-375. DOI:10.3969/j.issn.1673-9078.2009.04.008.
[4] 尹洁, 朱军莉, 励建荣. 食品中二氧化硫的来源与检测方法[J]. 食品科技, 2009, 34(11): 292-296. DOI:10.13684/j.cnki.spkj.2009.11.031.
[5] 美国食品和药物管理局. FDA食品法规[M]. 北京: 中国轻工业出版社, 2001.
[6] 于杰, 于晓婕, 王旭, 等. 食品中亚硫酸盐使用及检测方法的研究进展[J]. 石家庄学院学报, 2011, 13(3): 8-13. DOI:10.3969/ j.issn.1673-1972.2011.03.002.
[7] 吴凤武, 何治柯, 罗庆尧, 等. 二氧化硫分析研究进展[J]. 分析科学学报, 2000, 16(3): 248-252. DOI:10.3969/j.issn.1006-6144.2000.03.018.
[8] MONTES C, VÉLEZ J H, RAM¸REZ G, et al. Critical comparison between modified Monier-Williams and electrochemical methods to determine sulfite in aqueous solutions[J]. The Scientific World Journal, 2012: 1-6. DOI:10.1100/2012/168148.
[9] 杨文志, 高宇, 张引, 等. 盐酸副玫瑰苯胺法测定人参中二氧化硫残留含量的研究[J]. 人参研究, 2014(2): 23-25. DOI:10.3969/ j.issn.1671-1521.2014.02.007.
[10] 何红梅, 薛则尧, 曹小彦. 碘吸收滴定法测定食品中SO 2残留量[J]. 食品与机械, 2006, 22(3): 142-153. DOI:10.13652/ j.issn.1003-5788.2006.03.047.
[11] WARNER C R, DANIELS D H, JOE F L Jr., et al. Reevaluation of Monier-Williams method for determining sulfite in food[J]. Journal Association of Official Analytical Chemists, 1985, 69(1): 3-5.
[12] 吴卫平, 张磊, 李洁, 等. 食品中二氧化硫残留快速检测方法的研究[J]. 上海预防医学杂志, 2006, 18(9): 470-471. DOI:10.3969/ j.issn.1004-9231.2006.09.020.
[13] 杨文英, 王芳. 甲醛吸收-盐酸副玫瑰苯胺法测定食品中的亚硫酸盐[J]. 中国卫生检验杂志, 2006, 16(4): 400-402. DOI:10.3969/ j.issn.1004-8685.2006.04.007.
[14] AKSAK K, SUZUKI T, OHRUI H, et al. Fluorometric determination of sulfites in rainwater[J]. Analytical Sciences, 1986, 2(5): 443-446.
[15] 汤晓勤, 向仕学, 伍曩, 等. 单扫描极谱法测定糖类等食品中亚硫酸盐[J]. 预防医学情报杂志, 2001, 17(4): 296-298. DOI:10.3969/ j.issn.1006-4028.2001.04.054.
[16] 王晓辉, 白志辉, 罗湘南, 等. 硫化物和亚硫酸盐微生物电极的研究[J].化学传感器, 2000, 20(1): 53-58.
[17] 李紫薇, 陶冠红. 流动注射褪色光度法测定食品中的亚硫酸盐[J]. 分析试验室, 2007, 26(7): 31-33. DOI:10.3969/ j.issn.1000-0720.2007.07.008.
[18] 彭晓俊, 邓爱华, 庞晋山. 柱后衍生-高效液相色谱法测定金针菜中亚硫酸盐[J]. 理化检验, 2011, 47(12): 1488-1490.
[19] 杨蕾. 水产品中亚硫酸盐毛细管电泳检测方法的建立及其保鲜替代品的产初步开发[D]. 杭州: 浙江工商大学, 2014.
[20] MEGURO H, AKASAKA K, OHRUI H, et al. Highly sensitive N-(9-acridinyl) maleimide (NAM) fluorometry to determine sulfite below ppm level in environmental and biological samples[J]. Journal of Trace and Microprobe Techniques, 2002, 20(4): 463-472. DOI:10.1081/ TMA-120015608.
[21] CHANG W, OKAMOTO M, KORENAGA T. A simple fluorometric method for the determination of sulfur dioxide in ambient air with a passive sampler[J]. Environmental Sciences: an International Journal of Environmental Physiology and Toxicology, 2005, 13(5): 257-262.
Determination of Total Sulfite in Xinjiang Specialty Raisin by Fluorescence Derivatization
WANG Jinxia
1,2, LIN Jiangli
1, LU Yi
2,
*, WANG Jide
1
(1. Key Laboratory of Oil and Gas Fine Chemicals Ministry of Education and Xinjiang Uyghur Autonomous Region, College of Chemistry and Chemical Engineering, Xinjiang University, Ürümqi 830046, China; 2. Xinjiang Supervision and Inspection Institute for Product Quality, Ürümqi 830004, China)
Abstract:A rapid and accurate method for the determination of total sulfite in Xinjiang specialty raisin was developed using fluorescence derivatization. N-(9-Acridinyl) maleimide (NAM) reacted with the sulfite in raisin to form strong fluorescent derivatives, which were then detected by fluorometry. The linear range of the method was between 1.0 and 43.2 mg/L, with a correlation coefficient (R 2) of 0.999 3. At three spiked levels, the average recoveries of sulfite in raisin ranged from 92.2% to 100.2% with relative standard deviations lower than 3.80% (n = 3). Furthermore, the results obtained by this method for the total sulfite content of raisin were consistent with those obtained by the pararosaniline method. These results indicate that the fluorescence derivatization method can accurately and rapidly determine total sulfite in Xinjiang specialty raisin.
Key words:raisin; total sulfite; fluorescence derivatization
DOI:10.7506/spkx1002-6630-201604038
中图分类号:O657.3
文献标志码:A
文章编号:1002-6630(2016)04-0212-04
引文格式:
王金霞, 林江丽, 鹿毅, 等. 荧光衍生化法测定新疆特色葡萄干中总亚硫酸盐含量[J]. 食品科学, 2016, 37(4): 212-215.
DOI:10.7506/spkx1002-6630-201604038. http://www.spkx.net.cn
WANG Jinxia, LIN Jiangli, LU Yi, et al. Determination of total sulfite in Xinjiang specialty raisin by fluorescence derivatization[J]. Food Science, 2016, 37(4): 212-215. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604038. http://www.spkx.net.cn
收稿日期:2015-03-24
基金项目:新疆维吾尔自治区自然科学基金项目(2013211A015)
作者简介:王金霞(1989—),女,硕士研究生,研究方向为天然产物分析。E-mail:372467867@qq.com
*通信作者:鹿毅(1966—),男,教授级高级工程师,博士,研究方向为农产品成分分析及质量监控。E-mail:wangjinxia6868@163.com