重庆地区猪肉样品中猪链球菌污染、血清型、耐药性及致病性
彭少静,邓华英,张媛媛,胡书月,丁玲玲,李继祥
*
(西南大学荣昌校区动物医学系,重庆 402460)
摘 要:采集于重庆地区屠宰场的猪颌下淋巴结398 份和农贸市场猪肉样品140 份,经选择增菌培养后分离出猪链球菌132 株,平均检出率为24.5%(132/538),其中屠宰场和农贸市场样品的检出率分别为26.7%(106/398)和18.6%(26/140)。经血清型特异性聚合酶链式反应检测,样品中猪链球菌血清1型、2型、7型和9型菌株的检出率分别3.16%(17/538)、3.16%(17/538)、6.88%(37/538)和1.67%(9/538);药敏纸片法检测18 株细菌的耐药性,发现对青霉素类和头孢菌素类药物100%敏感,对氨基糖苷类、四环素类和磺胺类药物耐药性严重;小白鼠用于部分菌株的感染实验,结果显示分离菌株均有致病性。研究结果表明,屠宰生猪及农贸市场猪肉存在多种血清型的致病性猪链球菌污染。
关键词:猪链球菌;猪肉;血清型;耐药性;致病性
猪链球菌(Streptococcus suis,S. suis)归类于链球菌属(Streptococcus),为卵圆形、短链状排列的G
+兼性厌氧菌,是重要的人畜共患病的病原菌
[1]。猪链球菌感染最初由荷兰学者Janson和van Dorssen于1951年报道,随后在所有养猪发达国家均有报道检出
[2]。从发病猪中分离到的猪链球菌大多属于血清1~8型,其中又以血清2型菌株占主导
[3-4];不常见的血清型菌株也可以引起严重感染,如血清9型菌株较频繁地发生于比利时、荷兰和德国,且与断奶仔猪的败血症、脑膜炎和肺炎的爆发有关
[5]。自1968年首次在丹麦报道人感染猪链球菌以来,世界许多国家或地区也相继报道
[6]。猪链球菌主要通过破损的皮肤、伤口和消化道黏膜等途径感染人,多发生于与猪密切接触的人群(如养猪场工人、兽医、屠夫、肉品加工人员等)和食用未煮熟的污染肉品的人群
[7-8]。我国自1998年以来,有多起由此引起的食品安全事件,尤其是2005年6—8月在四川地区发生的人感染猪链球菌事件最为严重
[9-10],但在猪肉安全性评价过程中更关注致泻性大肠杆菌、沙门氏菌和单增李斯特菌等,而忽略猪链球菌的污染。
本实验从重庆地区2 个区县的屠宰场采集猪颌下淋巴结及农贸市场采集鲜猪肉(精瘦肉),经选择增菌培养后分离鉴定猪链球菌,并对分离菌株的血清型、耐药性、致病性进行测定,了解屠宰生猪及市售鲜猪肉猪链球菌污染状况及污染菌特性,为防止人感染猪链球菌提供监测数据和资料。
1 材料与方法
1.1 试剂与仪器
托-休氏培养基(Todd-Hewitt broth,THB) 北京奥博星生物技术有限责任公司;多黏菌素E、萘啶酮酸 上海圻明生物技术有限公司;聚合酶链式反应(polymerase chain reaction,PCR)试剂、DL2000 DNA Maker 大连TaKaRa公司;琼脂糖 美国Invitrogen公司;Gold View核酸染料 北京赛百胜生物技术公司;药敏纸片(批号20140901) 杭州微生物试剂有限公司;T100
TMThermal Cycler、琼脂糖电泳系统、凝胶成像系统 美国Bio-Rad公司。
1.2 方法
1.2.1 样品采集与选择增菌培养
于2014年3—11月随机采集重庆地区生猪定点屠宰场猪颌下淋巴结和农贸市场鲜猪肉样品,4 ℃保存并立即送实验室处理。在无菌条件下取样品深层组织约1.0 g并用无菌眼科剪制成肉浆,加入5.0 mL选择增菌培养液(THB液体培养基中含15.0 μg/mL多黏菌素E和30.0 μg/mL萘啶酮酸),置于37 ℃恒温培养24 h。培养物在室温条件下混匀并放置10 min以自然沉淀组织块,上层液体用于猪链球菌的检测。
1.2.2 猪链球菌的分离与鉴定
将增菌培养液在选择营养琼脂平板(THB,1.2%琼脂粉,15.0 μg/mL多黏菌素E,30.0 μg/mL萘啶酮酸)上划线接种,37 ℃培养16~18 h;挑取圆形、表面光滑湿润、无色透明、直径1~2 mm的单菌落进行纯培养并革兰氏染色镜检,将革兰阳性、成对或链状排列的球菌判为疑似猪链球菌。按文献[11]的方法提取细菌基因组DNA;按文献[12]的报道,以猪链球菌种特异性基因gdh为靶基因合成特异性引物gdh-1(CCATGGACAGATAAAGATGG)和g d h-2(G C AG C G TAT T C T G T C A A AC G)(上海立菲生物技术有限公司合成)并进行PCR分析。猪链球菌的预期扩增片段为688 bp。PCR体系(25.0 μL):10×PCR Buffer 2.5 μL(不含M g
2+)、M g C l
22.0 m m o l/L、d N T P s 0.2 mmol/L、引物gdh-1和gdh-2各0.4 μmol/L、基因组DNA 1.0 μL、Taq酶1.5 U,加去离子水至25.0 μL。PCR在Bio-Rad T100 Thermal cycler上进行,反应参数为:95 ℃预变性5 min;95 ℃、1 min,55 ℃、1 min,72 ℃、1 min,循环35 次;72 ℃终延伸 7 min。取6.0 μL PCR产物于1.2%琼脂糖凝胶中进行电泳,然后在凝胶成像系统下观察。
1.2.3 猪链球菌的血清型鉴定
利用血清型特异性PCR对猪链球菌分离菌株进行血清型鉴定。血清1型和9型按文献[13]、血清2型按文献[14]和血清7型按文献[15]的报道合成血清型特异性引物并进行PCR。
1.2.4 猪链球菌的体外药物敏感性测定
药敏实验采用纸片扩散法
[16],质控菌为金黄色葡萄球菌ATCC29213。待测细菌单菌落接种于THB液体培养基,37 ℃振荡培养16 h,稀释菌液至1.5×10
8CFU/mL;用灭菌棉拭子蘸取菌液并在管内壁挤压去除多余菌液后涂布THB营养琼脂平板(平皿直径90 mm,培养基中琼脂含量1.2%,培养基厚度约4 mm);每个培养皿均匀放置7 个药敏纸片,4 ℃放置1 h后置37 ℃培养24 h后测定抑菌圈的直径。根据杭州微生物试剂有限公司药敏纸片法的抑菌范围解释标准进行细菌对药物敏感性判定。
1.2.5 猪链球菌的致病性测定
猪链球菌经THB液体培养基在37 ℃振荡培养24 h,离心,沉淀用灭菌生理盐水悬浮成1.5×10
8CFU/mL。7 周龄昆明系小鼠腹腔接种0.5 mL/只,每菌株接种3 只。空白对照组小鼠腹腔注射THB液体培养基0.5 mL/只。攻毒后,连续观察至少15 d,记录精神状态、饮欲、食欲、发病及死亡情况。死亡小鼠立刻剖检,存活小鼠15 d后捕杀、剖检,观察病理变化。无菌条件下采取心、肝、脾等进行病原菌分离,鉴定所分离菌株是否为攻毒细菌。
2 结果与分析
2.1 猪链球菌的分离与鉴定
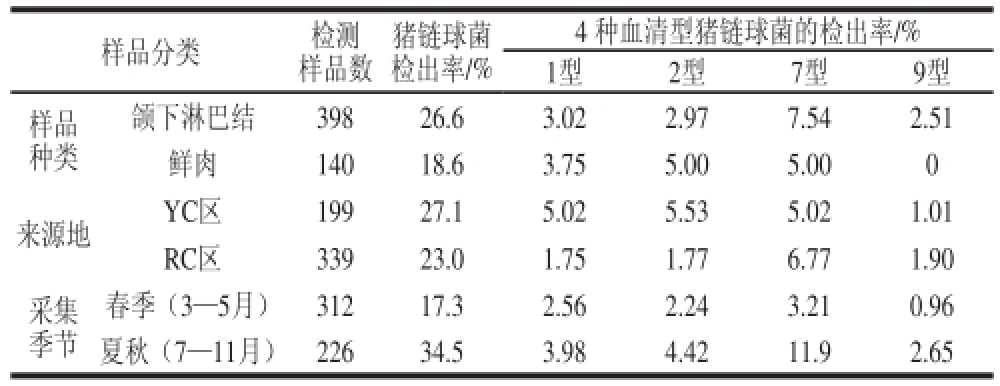
538 份样品经选择增菌培养、分离纯化、gdh基因PCR检测,共获得132 株猪链球菌,检出率为24.5%;其中颌下淋巴结样品的检出率为26.6%(106/398),鲜肉的检出率为18.6%(26/140)(表1)。按样品来源地,重庆YC区和RC区样品的检出率分别为27.1%(54/199)和23.0%(78/339);按采样时间,春季(3—5月)和夏秋季(7—11月)的检出率分别为17.3%(54/312)和34.5%(78/226)。经χ
2检验,春季和夏秋季样品猪链球菌检出率间差异极显著(χ
2= 20.03),颌下淋巴结和鲜肉的检出率差异不显著(χ
2= 3.21),YC区和RC区样品的检出率差异不显著(χ
2= 0.94)。
表1 样品中猪链球菌的检出率
Table 1 Detection rate of S. ssuuiiss from pork samples
样品分类检测样品数猪链球菌检出率/%颌下淋巴结39826.63.022.977.542.51鲜肉14018.63.755.005.000来源地YC区19927.15.025.535.021.01 RC区33923.01.751.776.771.90采集季节4 种血清型猪链球菌的检出率/% 1型2型7型9型样品种类春季(3—5月)31217.32.562.243.210.96夏秋(7—11月)22634.53.984.4211.92.65
2.2 猪链球菌的血清型
132 株猪链球菌,经血清分型特异性PCR鉴定,猪链球菌血清1型、2型、7型和9型菌株数分别为17、17、37 株和9 株,其中不同样品的检出情况见表1。颌下淋巴结样品中7型检出率最高(7.54%),鲜肉中没有检出9型菌株,而2型菌株的检出率分别为2.97%和5.00%。YC样品的血清1型、2型和7型的检出率均在5%左右;RC区样品以7型为主(6.77%),血清2型的检出率为1.77%。夏秋季节采集样品中4 种血清型菌株的检出率均高于春季样品,其中血清7型菌株在夏秋样品中的检出率最高(11.9%),2型菌株的检出率为4.42%。
猪链球菌按照荚膜抗原性的差异可分为35 个血清型,最具有公共卫生意义的是血清1型、2型、7型和9型菌株。本工作采集的屠宰场猪颌下淋巴结和农贸市场鲜肉样品通过选择增菌培养后猪链球菌的检出率分别为26.6%和18.6%,其中血清1型、2型、7型和9型菌株的检出率分别为3.16%、3.16%、6.88%和1.67%,尤其是夏秋季节的污染要高于春季。王楷宬等
[17]调查重庆市17 个区县表观健康猪腭扁桃体的猪链球菌带菌率为16.54%(225/1 360),其中血清1型、2型、7型和9型菌株的检出率分别为0(0/1 360)、0.29%(4/1 360)、0.22%(3/1 360)和0.22%(3/1 360)。杨珍等
[18]从我国20 个不同地区采集的248 份猪扁桃体样品中共检出14 株猪链球菌,检出率为5.65%,其中3 株为猪链球菌2型,2 株为猪链球菌7型,1 株为猪链球菌9型,8 株未定血清型;20 个采样点中7 个采样点检出猪链球菌,其他13 个采样点未检出猪链球菌。杨筱薇等
[19]对上海地区屠宰场猪扁桃体样品的检测,猪链球菌的检出率10.4%(24/231),其中2型、7型和9型的检出率分别为4.33%(10/231)、1.30%(3/231)和1.30%(3/231);臧莹安等
[20]对广州某大型农贸市场表观健康的猪肉携带猪链球菌的调查,阳性率13.6%(9/66),但未分离出血清1型、2型、7型和9型菌株。由此可见,重庆地区采样调查的2个区县猪链球菌及1型、2型、7型和9型菌株对屠宰生猪及农贸市场鲜肉的污染较为严重。
2.3 体外药物敏感性
从分离鉴定的132 株猪链球菌中随机抽取的18 株细菌对β-内酰胺类抗生素中的青霉素、氨苄西林、阿莫西林、头孢噻吩、头孢曲松、头孢吡肟和头孢拉定等100%敏感;对氨基糖苷类抗生素链霉素、丁胺卡那霉素和庆大霉素的耐药菌株分别为15、10 株和4 株;对磺胺异恶唑和复方新诺明的耐药菌株分别为18 株和16 株;对氟苯尼考耐药1 株;对四环素、多西环素、米诺环素、阿奇霉素、红霉素、克拉霉素和氟苯尼考的耐药菌株分别为16、14、8、7、6、5 株和1 株;对氟喹诺酮类药物左氧氟沙星、氟罗沙星和环丙沙星的耐药菌株分别为1、2 株和1 株。质控菌株金黄色葡萄球菌ATCC29213对各药物的敏感性实验结果符合要求。
猪链球菌基因组中广泛存在与四环素类、氨基糖苷类、大环内酯类等药物耐药相关的基因元件,这些元件可以通过不同的方式插入并整合到化脓链球菌、肺炎链球菌和无乳链球菌等细菌中
[21]。猪链球菌已成为动物和人的重要耐药性病原性细菌
[22]。本实验对18 株猪链球菌进行的体外药敏实验结果显示,对青霉素类和头孢类药物敏感性最高,其次是喹诺酮类及酰胺醇类药物,对氨基糖苷类、四环素类和磺胺类药物耐药性严重。因此,在临床用药上,青霉素对猪链球菌保持良好的效果,依然是主要治疗药物,其次选择头孢菌素类、喹诺酮类药物等药物作为辅助沿疗。由于滥用和不合理使用抗菌药物是导致病原性细菌耐药性日趋严重的主要因素,建议选择性地避免、控制或限制某些或某类抗生素的应用,或者轮换应用抗生素。在我国养殖业中,加强兽用抗菌药物的监管,做好病原学诊断及敏感药物筛选,既可以减少盲目性、节约成本、达到有效防治,更重要的是降低耐药性的产生。
2.4 对小白鼠的致病性
猪链球菌血清1型菌株、2型、7型和9型分离菌株中各随机抽取5 株用于致病性测定,实验菌株均能导致小白鼠100%感染发病,小鼠死亡情况见表2。从表2可知,除7型的R345株、9型的Y188株和Y1983株细菌引起部分小鼠死亡外,其他17 株分离细菌都能全部致死实验小白鼠。急性发病死亡小鼠表现为被毛松乱、四肢及尾部末梢发青,临死前呼吸急促、呈趴卧状;剖检呈现肝脏和脾脏肿大出血、肺脏充血出血;所有死亡小鼠均能从心、肝和脾检出与接种一致的猪链球菌。病程超过120 h的接种小鼠均表现出神经症状,死亡后解检呈现脑膜充血出血,仅在肝脏中分离鉴定出与接种相一致的猪链球菌;未死亡小鼠,捕杀后剖检无明显病变,但可从肝脏中检出与接种一致的猪链球菌。空白对照组小鼠在实验过程中未表现出明显异常,在实验结束时捕杀,剖检无明显异常,未检出猪链球菌。
表2 20 株猪链球菌接种后不同时间致病性结果
Table 2 Pathogenicity of 20 S. suis strains at different times postinoculation

血清型菌株动物数死亡动物数12 h24 h48 h72 h96 h288 h Y16721 1型Y187111 R298111 R31712 R33021 3 Y1953 2型Y20021 R2613 R31612 R26012 3 Y165 7型21 Y189111 R29912 R34212 R345 3 1 Y1881 9型Y1981 R32111 R5521 R26621对照3 3
猪链球菌不同血清型或同一血清型间不同菌株间的致病性差异也较大,有报道指出国内许多分离株接种普通小鼠后均不能使小鼠发病
[23],而本研究测定的20 株细菌对小白鼠均有致病性。猪链球菌2型能引起猪的急性败血症、脑膜炎、关节炎、支气管炎、心内膜炎,可通过带菌动物和污染肉品感染饲养、屠宰、肉品加工等人员,甚至导致食源性感染;除2型以外的其他血清型菌株也有感染动物和人的报道
[24-25]。因此,在关注猪链球菌2型菌株的污染及危害的同时,也应重视其他血清型菌株对养殖业和人类健康的威胁。
3 结 论
重庆地区2 区县屠宰场的猪颌下淋巴结和农贸市场猪肉经选择增菌培养及细菌分离鉴定,猪链球菌的检出率为24.5%(132/538),其中血清1型、2型、7型和9型菌株的检出率分别为3.16%、3.16%、6.88%和1.67%。药敏纸片法检测18 株猪链球菌的耐药性,发现对青霉素类和头孢菌素类药物100%敏感,对氨基糖苷类、四环素类和磺胺类药物耐药性严重。腹腔接种,20 株猪链球菌均能100%致小白鼠发病,除7型的R345和9型的Y188、Y198不能完全致死小白鼠外,其余17 株细菌能100%致死小白鼠,但2型菌株R260和R316引起死亡发生在接种后288 h。本实验结果显示,重庆地区屠宰生猪及农贸市场猪肉存在多种血清型的致病性猪链球菌污染。
参考文献:
[1] 文心田, 于恩庶, 徐建国, 等. 当代人兽共患病学[M]. 成都: 四川科学技术出版社, 2011: 517-528.
[2] KING S J, HEATH P J, LUQUE I, et al. Distribution and genetic diversity of suilysin in Streptococcus suis isolated from different disease of pigs and characterization of the genetic basis of suilysin absence[J]. Infection and Immunity, 2001, 69(12): 7572-7582. DOI:10.1128/IAI.69.12.7572-7582.2001.
[3] HIGGINS R, GOTTSCHALK M. Distribution of Streptococcus suis capsular types in 2000[J]. Canadian Veterinary Journal, 2001, 42(3): 223.
[4] GOTTSCHALK M, SEGURA M. The pathogenesis of the meningitis caused by Streptococcus suis: unresolved questions[J]. Veterinary Microbiology, 2000, 76(3): 259-272. DOI:10.1016/S0378-1135(00)00250-9.
[5] WISSELINK H J, SMITH H E, STOCKHOFE-ZURWIEDEN N, et al. Distribution of capsular types and production of muramidasereleased protein (MRP) and extracellular factor (EF) of Streptococcus suis strains isolated from diseased pigs in seven European countries[J]. Veterinary Microbiology, 2000, 74(3): 237-248. DOI:10.1016/S0378-1135(00)00188-7.
[6] GOTTSCHALK M, XU J, CALZAS C, et al. Streptococcus suis: a new emerging or an old neglected zoonotic pathogen?[J]. Future Microbiology, 2010, 5(3): 371-391. DOI:10.2217/fmb.10.2.
[7] 黄革, 李建明. 人感染猪链球菌病流行态势[J]. 疾病监测与控制杂志, 2013, 7(7): 410-413.
[8] WERTHEIM H F, NGHIA H D, TAYLOR W, et al. Streptococcus suis: an emerging human pathogen[J]. Clinical Infectious Diseases, 2009, 48(5): 617-625. DOI:10.1086/596763.
[9] TANG J, WANG C, FENG Y, et al. Streptococcal toxic shock syndrome caused by Streptococcus suis serotype 2[J]. PLoS Medicine, 2006, 3(5): 668-676. DOI:10.1371/journal.pmed.0030151.
[10] YU H, JING H, CHEN Z, et al. Human Streptococcus suis outbreak, Sichuan, China[J]. Emerging Infectoius Diseases, 2006, 12(6): 914-920. DOI: 10.3201/eid1206.051194.
[11] MAKIN S, OKADA Y, MARUYAMA T. A new method for direct detection of Listeria monocytogenes from foods by PCR[J]. American Society for Microbiology, 1995, 61(10): 3745-3747.
[12] OKWUMABUA O, O’CONNOR M, SHULL E. A polymerase chain reaction (PCR) assay specific for Streptococcus suis based on the gene encoding the lutamate dehydrogenase[J]. FEMS Microbiology Letters, 2003, 218(1): 79-84. DOI:10.1111/j.1574-6968.2003.tb11501.x.
[13] SMITH H E, VEENBERGEN V, van der VELDE J, et al. The cps genes of Streptococcus suis serotypes 1, 2, and 9: development of rapid serotype-specific PCR assays[J]. Journal Clinical Microbiology, 1999, 37(10): 3146-3152.
[14] MAROIS C, BOUGEARD S, GOTTSCHALK M, et al. Multiplex PCR assay for detection of Streptococcus suis species and serotypes 2 and 1/2 in tonsils of live and dead pigs[J]. Journal Clinical Microbiology, 2004, 42(7): 3169-3175. DOI:10.1128/JCM.42.7.3169-3175.2004.
[15] SMITH HE, BRUIJNSVOORT L, BUIJS H, et al. Rapid PCR test for Streptococcus suis serotype 7[J]. FEMS Microbiology Letters, 1999, 178(2): 265-270. DOI:10.1111/j.1574-6968.1999.tb08686.x.
[16] Clinical and Laboratory Standards Institute. CLSI Document M100-S20-2013 Performance standards for antimicrobial susceptibility testing[S]. Waynet Pennsylvania: Clinical and Laboratory Standards Institute, 2013.
[17] 王楷宬, 熊忠良, 尚延明, 等. 重庆地区表观健康猪中猪链球菌的检测[J]. 畜牧兽医学报, 2010, 41(5): 594-599.
[18] 杨珍, 王楷宬, 范伟兴, 等. 表观健康猪群携带猪链球菌情况流行病学调查[J]. 中国人兽共患病学报, 2009, 25(10): 977-981. DOI:10.3969/j.issn.1002-2694.2009.10.013.
[19] 杨筱薇, 郑升博, 王开功, 等. 上海屠宰样品中猪链球菌感染率调查研究[J]. 国外畜牧学(猪与禽), 2010, 30(3): 64-65. DOI:10.3969/ j.issn.1001-0769.2010.03.030.
[20] 臧莹安, 谢乐新, 李家侨, 等. 表观健康的猪肉携带猪链球菌的调查[J]. 中国兽医杂志, 2012, 48(8): 30-31. DOI:10.3969/ j.issn.0529-6005.2012.08.010.
[21] HENDRIKSEN R S, MEVIUS D J, SCHROETER A, et al. Occurrence of antimicrobial resistance among bacterial pathogens and indicator bacteria in pigs in different European countries from year 2002–2004: the ARBAO-Ⅱ study[J]. Acta Veterinaria Scandinavica 2008, 50: 19. DOI:10.1186/1751-0147-50-19.
[22] PALMIERI C, VARALDO P E, FACINELLI B. Streptococcus suis, an emerging drug-resistant animal and human pathogen[J]. Front Microbiology, 2011, 2: 235. DOI:10.3389/fmicb.2011.00235.
[23] 余炜烈, 李春玲, 王贵平, 等. 猪链球菌2型和9型广东分离株的病原特性[J]. 中国兽医科学, 2007, 37(8): 650-654. DOI:10.3969/ j.issn.1673-4696.2007.08.004.
[24] NGHIA H D, HOA N T, LINH L D, et al. Human case of Streptococcus suis serotype 16 infection[J]. Emerging Infectious Diseases, 2008, 14(1): 155-157. DOI:10.3201/eid1401.070534
[25] HALEIS A, ALFA M, GOTTSCHALK M, et al. Meningitis caused by Streptococcus suis serotype 14, North America[J]. Emerging Infectious Diseases, 2009, 15(2): 350-352. DOI:10.3201/eid1502.080842.
Contamination, Serotype, Drug Resistance and Pathogenicity of Streptococcus suis from Pork Samples in Chongqing
PENG Shaojing, DENG Huaying, ZHANG Yuanyuan, HU Shuyue, DING Lingling, LI Jixiang
*
(Department of Veterinary Medicine, Rongchang Campus, Southwest University, Chongqing 402460, China)
Abstract:A total of 132 strains of Streptococcus suis (S. suis) were isolated from 398 submaxillary lymphonodi samples collected from pig slaughterhouses and 140 pork samples collected from farmers’ markets in Chongqing. The average contamination rate of S. suis in the total samples was 24.5% (132/538). In addition, the S. suis contamination rates of submaxillary lymphonodi and pork were 26.7% (106/398) and 18.6% (26/140), respectively. The serotype-speci
 c PCR assays were used to identify the serotypes and the detection rates of serotype 1, 2, 7, and 9 were 3.16% (17/538), 3.16% (17/538), 6.88% (37/538) and 1.67% (9/538) in samples, respectively. The drug resistance of 18 isolates was evaluated by K-B method. The results exhibited that these isolates were strongly tolerant to aminoglycosides, tetracyclines and sulfonamides, but sensitive to penicillins and cephalosporins. Infection experiments in mice were conducted to determine the virulence of 15 of the isolates. It was shown that these isolates were pathogenic differently to mice. The results of this study indicated that much attention should be paid to multi-serotype S. suis contamination of pig carcass and pork in quarantine.
c PCR assays were used to identify the serotypes and the detection rates of serotype 1, 2, 7, and 9 were 3.16% (17/538), 3.16% (17/538), 6.88% (37/538) and 1.67% (9/538) in samples, respectively. The drug resistance of 18 isolates was evaluated by K-B method. The results exhibited that these isolates were strongly tolerant to aminoglycosides, tetracyclines and sulfonamides, but sensitive to penicillins and cephalosporins. Infection experiments in mice were conducted to determine the virulence of 15 of the isolates. It was shown that these isolates were pathogenic differently to mice. The results of this study indicated that much attention should be paid to multi-serotype S. suis contamination of pig carcass and pork in quarantine.
Key words:Streptococcus suis; pork; serotype; drug resistance; pathogenicity
DOI:10.7506/spkx1002-6630-201604042
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2016)04-0233-05
引文格式:
彭少静, 邓华英, 张媛媛, 等. 重庆地区猪肉样品中猪链球菌污染、血清型、耐药性及致病性[J]. 食品科学, 2016, 37(4): 233-237. DOI:10.7506/spkx1002-6630-201604042. http://www.spkx.net.cn
PENG Shaojing, DENG Huaying, ZHANG Yuanyuan, et al. Contamination, serotype, drug resistance and pathogenicity of Streptococcus suis from pork samples in Chongqing[J]. Food Science, 2016, 37(4): 233-237. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604042. http://www.spkx.net.cn
收稿日期:2015-05-07
作者简介:彭少静(1990—),女,硕士研究生,研究方向为动物疫病与动物性食品安全。E-mail:1003708128@qq.com
*通信作者:李继祥(1968—),男,教授,博士,研究方向为动物疫病与动物性食品安全。E-mail:jixianglucky@126.com


 c PCR assays were used to identify the serotypes and the detection rates of serotype 1, 2, 7, and 9 were 3.16% (17/538), 3.16% (17/538), 6.88% (37/538) and 1.67% (9/538) in samples, respectively. The drug resistance of 18 isolates was evaluated by K-B method. The results exhibited that these isolates were strongly tolerant to aminoglycosides, tetracyclines and sulfonamides, but sensitive to penicillins and cephalosporins. Infection experiments in mice were conducted to determine the virulence of 15 of the isolates. It was shown that these isolates were pathogenic differently to mice. The results of this study indicated that much attention should be paid to multi-serotype S. suis contamination of pig carcass and pork in quarantine.
c PCR assays were used to identify the serotypes and the detection rates of serotype 1, 2, 7, and 9 were 3.16% (17/538), 3.16% (17/538), 6.88% (37/538) and 1.67% (9/538) in samples, respectively. The drug resistance of 18 isolates was evaluated by K-B method. The results exhibited that these isolates were strongly tolerant to aminoglycosides, tetracyclines and sulfonamides, but sensitive to penicillins and cephalosporins. Infection experiments in mice were conducted to determine the virulence of 15 of the isolates. It was shown that these isolates were pathogenic differently to mice. The results of this study indicated that much attention should be paid to multi-serotype S. suis contamination of pig carcass and pork in quarantine.