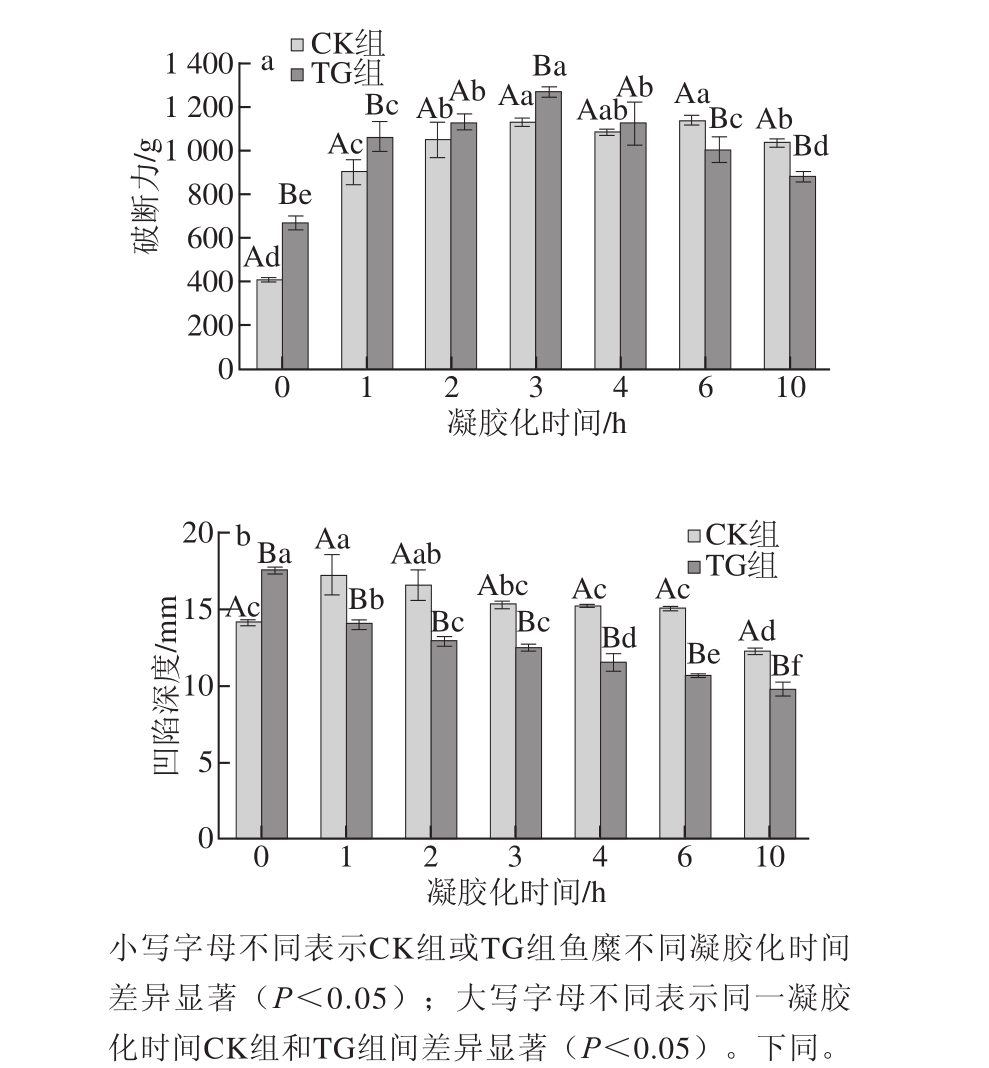
图1 凝胶化时间对鱼糜凝胶破断力和凹陷深度的影响
Fig.1 Effect of setting time on breaking force and deformation of surimi gels
郭秀瑾1,2,胡 杨1,2,尤 娟1,2,熊善柏1,2,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.国家大宗淡水鱼加工技术研发分中心,湖北 武汉 430070)
摘 要:以鲢鱼糜为对象,通过检测微生物转谷氨酰胺酶(microbial transglutaminase,MTGase)诱导下不同凝胶化时间形成的鱼糜凝胶的质地特性、交联程度及网络微观结构,探讨鲢鱼糜凝胶的结构演化规律。力学特性结果表明,未添加MTGase(对照组)的鱼糜凝胶的破断力、凹陷深度、硬度、咀嚼性等随凝胶化时间延长显著增大(P<0.05),破断力在3~6 h达到平衡(约1 100 g),凹陷深度在1~2 h达到最大值(约17 mm),随着凝胶时间延长呈下降趋势;添加MTGase的鱼糜凝胶破断力在3 h时就达到最大值(P<0.05),硬度和咀嚼性随时间增加到3 h后趋于平衡,凹陷深度随时间延长逐渐降低(P<0.05)。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)结果显示,鲢鱼糜凝胶中肌球蛋白重链含量随凝胶化时间延长显著下降,添加MTGase组肌球蛋白重链含量明显低于对照组。两组鱼糜凝胶的网络孔隙当量直径均随凝胶化时间延长先减小后增大,在3 h时分别达到最致密的网络结构(P<0.05)。对照组和添加MTGase的鲢鱼糜凝胶分别在40 ℃凝胶化3~6 h或2~4 h时凝胶特性较好,通过凝胶化时间的调节可控制鱼糜凝胶的结构演化方向,获得高品质鱼糜制品。
关键词:鱼糜凝胶;微生物转谷氨酰胺酶;结构演化;微观结构;交联程度
引文格式:
郭秀瑾,胡杨,尤娟,等.转谷氨酰胺酶诱导下鲢鱼糜凝胶的结构演化规律[J].食品科学,2016,37(5):6-11.DOI:10.7506/spkx1002-6630-201605002.http://www.spkx.net.cn
GUO Xiujin,HU Yang,YOU Juan,et al.Structural evolution of MTGase-induced silver carp surimi gels[J].Food Science,2016,37(5):6-11.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605002.http://www.spkx.net.cn
近年来,全球海洋渔业资源由于过度捕捞和环境污染等原因日益匮乏,淡水鱼作为原料生产鱼糜及其制品已成为主要发展趋势。我国是淡水鱼养殖大国,白鲢鱼是我国大宗低值淡水鱼之一,2012年产量达368.78 万t[1],因其具有产量大、价格便宜等特点,可作为鱼糜及其制品生产的优良原料。但鲢鱼属于难凝胶化、易凝胶劣化鱼种[2],单纯以鲢鱼糜为原料形成的鱼糜凝胶强度较低,添加微生物转谷氨酰胺酶(microbial transglutaminase,MTGase)后因其能够催化鱼蛋白中的谷氨酸(Glu)γ-羧基酰胺基与赖氨酸(Lys)的ε-氨基发生共价交联作用而显著增强鱼糜凝胶特性[3-5]。国内外的研究多集中在单独的内源TGase或外源MTGase添加量对鱼糜凝胶化过程的影响,如Yongsawatdigul等[6]研究发现金线鱼鱼糜在自身存在的内源TGase作用下适当延长凝胶化时间,其鱼糜凝胶强度和肌球蛋白重链交联程度显著增加。Benjakul等[7]研究了内源TGase对大眼鲷鱼鱼糜凝胶化过程的影响。还有学者研究了高压处理对TGase诱导阿拉斯加鳕鱼鱼糜及鱼明胶和MTGase联合作用对金线鱼鱼糜凝胶特性的影响[5,8]。本课题组前期研究发现在鱼糜自然pH值(接近中性)下,6~10 U/g pro是鲢鱼糜中MTGase的最适宜添加量,能显著提高其凝胶特性[9-10]。然而,对内源转谷氨酰胺酶(endogenous transglutaminase,ETGase)或外源添加的MTGase诱导鲢鱼糜凝胶的对比及随凝胶化时间延长过程中其凝胶结构的演化规律却鲜有报道。本实验以鲢鱼冷冻鱼糜为原料,根据前期实验结果固定MTGase添加量为10 U/g pro,以未添加MTGase为对照组,研究40 ℃条件下凝胶化时间对该酶诱导的鲢鱼糜凝胶的质地特性、交联程度、微观结构的影响,探讨其结构演化规律,以期为开发高品质鱼糜制品奠定基础。
1.1材料与试剂
冷冻白鲢鱼糜(AAA级),购于洪湖井力水产食品有限 公司。
MTGase(酶活力3 000 U/g,生化级) 瑞士科纳提克公司;氯化钠、无水乙醇等(分析纯) 国药集团化学试剂有限公司。
1.2仪器与设备
CA-1擂溃机 金盛号铁工厂;TA-XT Plus质构仪美国Stable Micro Surrey公司;JSM-6390 PLV型扫描电子显微镜 日本JEOL公司;TDL-5A台式离心机 上海菲恰尔分析仪器有限公司;Bio-Rad电泳仪 美国Bio-Rad公司;UV-2600型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司。
1.3方法
1.3.1 鱼糜凝胶的制备
以白鲢冷冻鱼糜为材料,经刨冰、空擂5 min,添加MTGase(10 U/g,以鱼糜总蛋白含量计)和质量分数2.5%食盐等,再经擂溃25 min、灌入肠衣、封口,置于40 ℃条件下凝胶化不同时间(0、1、2、3、4、6、10 h)、再于90 ℃条件下加热30 min制成鱼糜凝胶(TG组),以不添加MTGase的鱼糜凝胶作对照(CK组)。制得的鱼肠迅速用流水冷却后置于4 ℃冷藏过夜,检测。
1.3.2 鱼糜凝胶穿刺性能的测定
将鱼糜凝胶切成2 5 m m长的圆柱体,参考Tadpitchayangkoon等[11]的方法,在室温下用TA-XT Plus质构仪进行穿刺实验,测定破断强度、凹陷深度。测试参数如下:P/0.25S探头,触发力5 g,测试前速率5.0 mm/s,测试中速率1.0 mm/s,测试后速率5.0 mm/s,穿刺距离20 mm。
1.3.3 鱼糜凝胶质地剖面分析(texture profile analysis,TPA)质构性能的测定
将鱼糜凝胶切成25 mm长的圆柱体,参考Pons等[12]的方法,将断面的中心置于TA-XT Plus质构仪探头的正下方的样品台上,每个样品进行两次轴向压缩测定,测定指标为硬度、弹性、内聚性、咀嚼性。测试条件如下:P/36R探头;触发力5 g;测试前速率2.0 mm/s;测试中速率1.0 mm/s;测试后速率1.0 mm/s;压缩比50%;停留时间:5 s。
1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
SDA-PAGE参照Yin等[13]方法略做改进后进行。取2 g鱼糜凝胶加入18 mL 50 g/L SDS后采用高速分散均质机均质,再于85 ℃的水浴中保温1 h来溶解样品中的蛋白质,随后11 000 r/min离心30 min取上清液,用Lowry法测上清液中蛋白质含量,并调整到蛋白质量浓度为2 mg/mL,进样体积为5 μL。用质量浓度1.25 g/L的考马斯亮蓝R-250染色,脱色液(体积分数50%甲醇、体积分数10%醋酸)脱色后进行扫描成像。
1.3.5 鱼糜凝胶微观结构的观察
将鱼糜凝胶切成小块,用0.1 mol/L pH 7.2磷酸盐缓冲液配制的2.5%戊二醛固定2 h。上述样品分别经体积分数分别为30%、50%、70%、80%、95%和100%的乙醇梯度脱水各20 min,用醋酸异戊酯和100%乙醇等体积混合液脱乙醇20 min,最后用醋酸异戊酯脱乙醇,在HCP-2临界点干燥仪上采用临界点干燥法进行干燥,离子溅射仪喷金后,采用扫描电子显微镜进行观察[14]。
1.3.6 扫描电镜图片处理
本实验采用公共软件ImageJ 1.42q及其插件FracLac-2.5 Release 1 d对扫描电镜图片进行二值化处理[15-16]。
1.4数据处理
所有实验重复3 次。采用SAS 8.1软件和Excel 2003软件进行数据处理及统计分析[17]。
2.1凝胶化时间对鱼糜凝胶力学特性的影响

图1 凝胶化时间对鱼糜凝胶破断力和凹陷深度的影响
Fig.1 Effect of setting time on breaking force and deformation of surimi gels
由图1a可知,TG组和CK组鱼糜凝胶的破断力都在保温0~3 h内显著增加(P<0.05),但对照组在3~6 h时达到平衡,添加MTGase的鱼糜凝胶在保温3 h后破断力迅速下降(P<0.05)。凝胶质地的增加主要是由于凝胶化过程中鱼糜中内源性ETGase和外源添加的MTGase催化更多的肌球蛋白交联形成ε-(γ-Glu)-Lys非二硫共价键,相对于直接90 ℃加热,低温凝胶化时间的适当延长有助于蛋白逐渐缓慢伸展从而增强疏水相互作用和二硫键,当热变性蛋白缓慢变性时,蛋白聚集将以一种有序的形式形成更规则的凝胶网络[18-19]。同时发现添加TGase的鱼糜凝胶的破断力,在凝胶化时间为0~4 h时均高于对照组,即向鱼糜中添加外源MTGase在一定的凝胶化时间内可以诱导形成更坚固的凝胶[20]。进一步延长保温时间到10 h后,两组破断力都明显下降,主要是由于鱼糜凝胶中内源酶的作用使鱼糜凝胶劣化导致[6]。由图1b可知,对照组鱼糜凝胶的凹陷深度随保温时间延长呈先显著升高后下降的趋势,添加MTGase的鱼糜凝胶凹陷深度则随凝胶化时间的延长而明显下降,且添加MTGase的鱼糜凝胶的凹陷深度基本都明显低于对照组的,可能是由于过度凝胶化将导致鱼糜凝胶质地变硬且可压缩性变弱[21]。
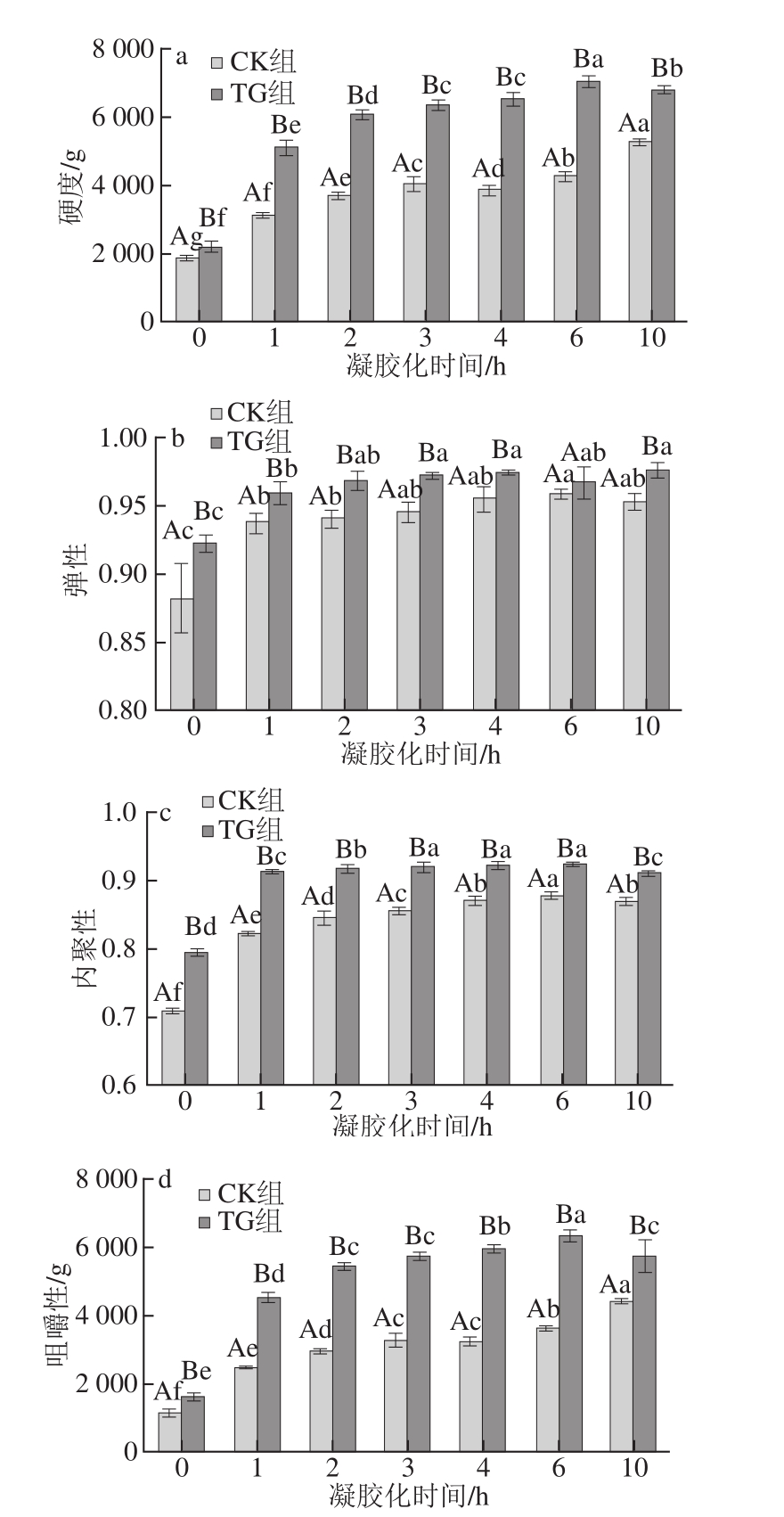
图2 凝胶化时间对鱼糜凝胶质构的影响
Fig.2 Effect of setting time on texture properties of surimi gels
TPA广泛应用于分析测定鱼糜凝胶的多种质地特性[22]。由图2可知,添加MTGase的鱼糜凝胶的TPA参数均大于CK组,因为适量外源MTGase将明显增加鱼糜凝胶的强度(主要包括硬度和内聚性)[23]。对照组鱼糜凝胶的硬度随凝胶化时间的延长呈显著增大趋势(P<0.05),添加MTGase的鱼糜凝胶硬度随时间延长先迅速上升(P<0.05),3 h后趋于平衡,10 h出现下降。咀嚼性的变化规律与硬度类似,说明硬度与咀嚼性之间具有良好的正相关性。两组鱼糜凝胶的内聚性和弹性都随着保温时间延长先迅速增大后趋于平衡。凝胶化时间对鱼糜凝胶的TPA参数有显著影响(P<0.05),适当的凝胶化时间有助于促进内、外源TGase的催化作用及鱼肉蛋白的舒展,从而提高其质地特性,但凝胶化时间过度延长将使内源酶分解作用增加,不利于鱼糜凝胶的形成,且添加外源MTGase的鱼糜凝胶相对于对照组可提前达到质地平衡状态,缩短凝胶化时间[18]。
2.2凝胶化时间对鱼糜凝胶中肌球蛋白交联程度的影响
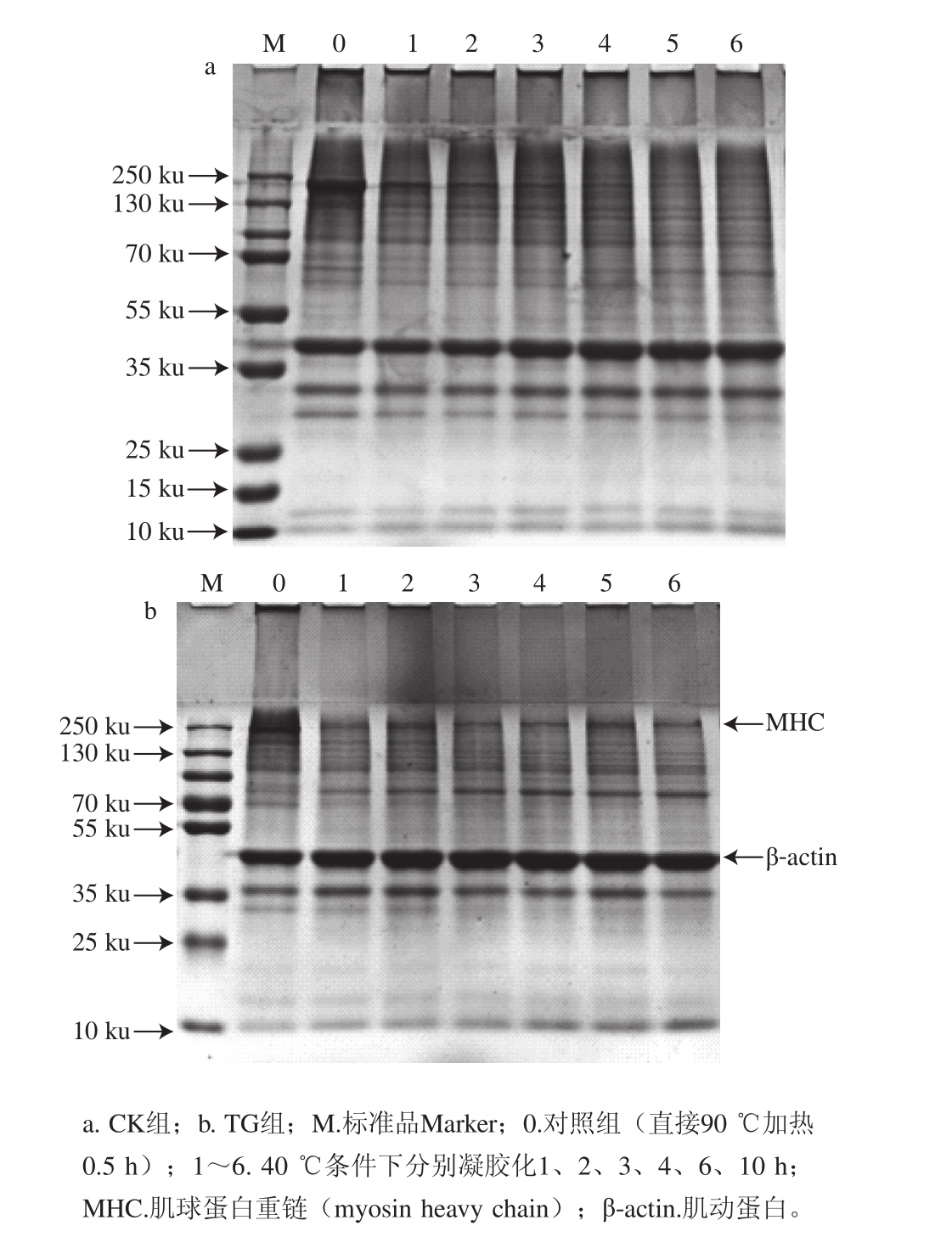
图3 凝胶化时间对鱼糜凝胶中肌球蛋白交联程度的影响
Fig.3 Effect of setting time on MHC cross-linkage of surimi gels
SDS-PAGE结果如图3所示,反映了40 ℃条件下凝胶化不同时间的肌球蛋白交联程度,进而了解鱼糜在凝胶化过程中蛋白的聚集和降解行为。对照组鱼糜凝胶的肌球蛋白重链含量随凝胶化时间的延长呈逐渐下降趋势,但6 h后在100~130、55~70 ku分子质量范围内出现新的条带,说明6 h后内源酶催化肌球蛋白重链分解形成小分子质量链段,即发生凝胶劣化现象[24]。而在前4 h内肌球蛋白重链的下降则主要是由于凝胶化过程中内源TGase催化肌球蛋白重链交联导致的,这与凝胶质地特性的测定结果基本吻合。在40 ℃条件下可以发生两种相矛盾的行为(TGase诱导凝胶增强和内源酶作用导致凝胶软化),最终的凝胶状态取决于凝胶化时间[6]。添加MTGase的鱼糜凝胶肌球蛋白重链条带相比于对照组明显减少,说明加入外源MTGase后显著促进蛋白交联。
2.3凝胶化时间对鱼糜凝胶微观结构的影响
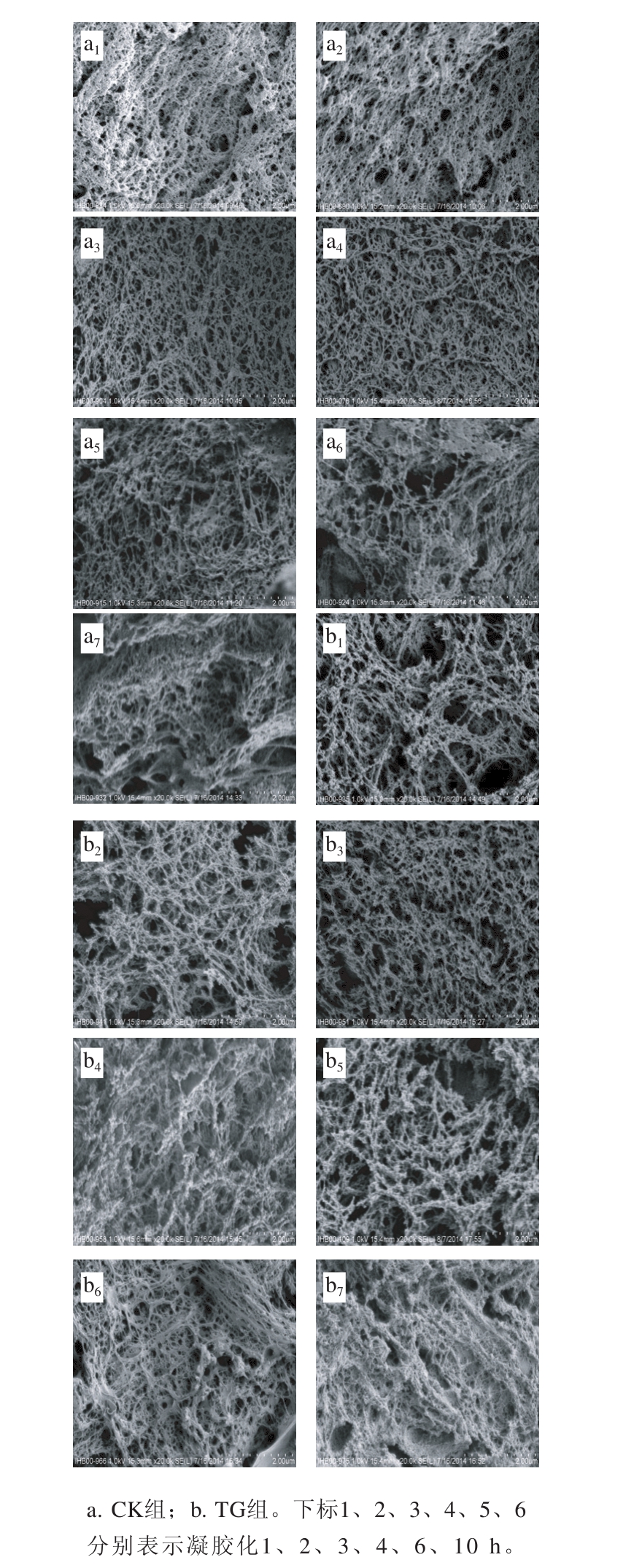
图4 凝胶化时间对鱼糜凝胶微观结构的影响
Fig.4 Effect of setting time on microstructure of surimi gels
鱼糜凝胶的三维结构是影响其质地特性的重要因素[25]。图4显示了添加MTGase和对照组白鲢鱼糜在40 ℃条件下保温不同时间、再于90 ℃加热0.5 h所制得的鱼糜凝胶的扫描电子显微镜图。分形维数和孔隙当量直径可从不同角度反映鱼糜凝胶网络结构的致密度及空间复杂度。孔隙当量直径可直观地反映鱼糜凝胶网络孔径的大小,从而表征鱼糜凝胶网络结构的致密度;分形维数反映了体系复杂程度,当体系越复杂时,分形维数也越大[26]。由图4可知,随保温时间的延长,鱼糜凝胶微观结构越来越规则和致密,主要是由于适当延长凝胶化时间促进蛋白缓慢舒展并在TGase的催化作用下交联形成大量多聚体,从而形成更加稳定的三维凝胶网络结构[27],但6 h后变得粗糙、不均匀,甚至出现片状结构,凝胶网络的破坏与肌球蛋白重链被蛋白酶水解有关[28]。对图片中网络孔隙进行分析所得鱼糜凝胶的孔隙当量直径和分形维数见表1。
表1 凝胶化时间对鱼糜凝胶孔隙当量直径和分形维数的影响
Table 1 Effect of setting time on pore size and fractal dimension of surimi gels

注:同列小写字母不同表示差异显著(P<0.05)。
由图4和表1可知,凝胶化时间对鱼糜凝胶的孔隙当量直径有显著影响(P<0.05),对照组和添加MTGase的鱼糜凝胶网络的孔隙当量直径均随时间延长呈先下降后升高的趋势,在保温3 h时孔隙当量直径最小,说明此时凝胶网络最为致密,继续延长保温时间,凝胶孔径变大,网络变得疏松粗糙,与之前的凝胶质地特性和交联程度的测定结果相对应;鱼糜凝胶网络的分形维数随保温时间延长变化差异不是很显著。1~3 h范围内添加MTGase组的鱼糜凝胶网络的孔隙当量直径显著小于对照组,说明添加MTGase可提高鱼糜凝胶网络的致密度,改善鱼糜凝胶网络的弹性、提高鱼糜凝胶的脆度。
未添加MTGase(CK组)和添加MTGase(TG组)制备的鱼糜凝胶的质地特性、交联程度及微观网络致密度都随着凝胶化时间的延长显著提高。与对照组相比,实验组能够在更短的凝胶化时间内获得更好的力学性能(破断力在3 h时达到1 268 g),且表现出显著性差异;在一定的凝胶化时间范围内(0~4 h),实验组肌球蛋白交联程度高于对照组,MTGase的引入能够相对延缓凝胶劣化现象的发生;鱼糜凝胶的微观网络孔隙度随时间延长先减小后增大,与力学特性(破断力)的变化规律相对应,且实验组鱼糜凝胶网络结构更为致密、脆性更好。因此,通过MTGase添加和凝胶化时间的调节可控制鱼糜凝胶的结构演化方向、获得不同质构特性和脆性的鱼糜制品,结果可用于指导不同口感的鱼糜制品的生产。
参考文献:
[1]农业部渔业局.2013中国渔业统计年鉴[M].北京:中国农业出版社,2013:1-45.
[2]吴汉民,王海洪.几种淡水鱼鱼糜特性的研究[J].食品科学,1999,20(9):15-19.DOI:10.3321/j.issn:1002-6630.1999.09.004.
[3]GASPAR A L C,de GŁES-FAVONI S P.Action of microbial transglutaminase(MTGase)in the modification of food proteins:a review[J].Food Chemistry,2015,171:315-322.DOI:10.1016/j.foodchem.2014.09.019.
[4]CHANARAT S,BENJAKUL S.Impact of microbial transglutaminase on gelling properties of Indian mackerel fish protein isolates[J].Food Chemistry,2013,136(2):929-937.DOI:10.1016/j.foodchem.2012.09.021.
[5]KAEWUDOM P,BENJAKUL S,KIJROONGROJANA K.Properties of surimi gel as influenced by fish gelatin and microbial transglutaminase[J].Food Bioscience,2013,1:39-47.DOI:10.1016/j.fbio.2013.03.001.
[6]YONGSAWATDIGUL J,WORRATAO A,PARK J W.Effect of endogenous transglutaminase on threadfin bream surimi gelation[J].Journal of Food Science,2002,67(9):3258-3263.DOI:10.1111/j.1365-2621.2002.tb09575.x.
[7]BENJAKUL S,CHANTARASUWAN C,VISESSANGUAN W.Effect of medium temperature setting on gelling characteristics of surimi from some tropical fish[J].Food Chemistry,2003,82(4):567-574.DOI:10.1016/S0308-8146(03)00012-8.
[8]ZHU Z W,LANIER T C,FARKAS B E,et al.Transglutaminase and high pressure effects on heat-induced gelation of Alaska pollock(Theragra chalcogramma)surimi[J].Journal of Food Engineering,2014,131:154-160.DOI:10.1016/j.jfoodeng.2014.01.022.
[9]刘海梅.鲢鱼糜凝胶及形成机理的研究[D].武汉:华中农业大学,2007.
[10]严菁,熊善柏.转谷氨酰胺酶对淡水鱼糜制品凝胶强度的影响[J].食品科学,2002,23(8):59-62.
[11]TADPITCHAYANGKOON P,PARK J W,YONGSAWATDIGUL J.Gelation characteristics of tropical surimi under water bath and ohmic heating[J].LWT-Food Science and Technology,2012,46(1):97-103.DOI:10.1016/j.lwt.2011.10.020.
[12]PONS M,FISZMAN S M.Instrumental texture profile analysis with particular reference to gelled systems[J].Journal of Texture Studies,1996,27(6):597-624.DOI:10.1111/j.1745-4603.1996.tb00996.x.
[13]YIN T,PARK J W.Effects of nano-scaled fish bone on the gelation properties of Alaska pollock surimi[J].Food Chemistry,2014,150:463-468.DOI:10.1016/j.foodchem.2013.11.041.
[14]D˘VILA E,PARES D.Structure of heat-induced plasma protein gels studied by fractal and lacunarity analysis[J].Food Hydrocolloids,2007,21(2):147-153.
[15]D˘VILA E,TOLDR˘ M,SAGUER E,et al.Characterization of plasma protein gels by means of image analysis[J].LWT-Food Science and Technology,2007,40(8):1321-1329.
[16]柴春祥,赵杰文,邱白晶.鱼糜微结构的几何描述及分析[J].江苏理工大学学报(自然科学版),1999,20(5):8-11.
[17]赵思明.食品科学与工程中的计算机应用[M].北京:化学工业出版社,2005:1-150.
[18]YIN T,PARK J W.Optimum processing conditions for slowly heated surimi seafood using protease-laden pacific whiting surimi[J].LWTFood Science and Technology,2015,63:490-496.DOI:10.1016/j.lwt.2015.02.033.
[19]YONGSAWATDIGUL J,PARK J W.Linear heating rate affects gelation of Alaska pollock and Pacific whiting surimi[J].Journal of Food Science,1996,61(1):149-153.DOI:10.1111/j.1365-2621.1996.tb14746.x.
[20]ABE Y,YASUNAGA K,KITAKAMI S,et al.Quality of kamaboko gels from walleye pollack frozen surimis of different grades on applying additive containing TGase[J].Nippon Suisan Gakkaishi,1996,62:439-445.DOI:10.2331/suisan.62.439.
[21]KOK N,THAWORNCHINSOMBUT S,PARK J W.Surimi and surimi seafood[M].3rd ed.Boca Raton,Florida:CRC Press,2014:285-299.
[22]KIM B Y,PARK J W,YOON W B.Surimi and surimi seafood[M].2nd ed.Boca Raton,Florida:CRC Press,2005:468-471.
[23]SEKI N,UNO H,LEE N H,et al.Transglutaminase activity in Alaska pollack muscle and surimi(minced fish meat),and its reaction with myosin B[purified from carp][J].Bulletin of the Japanese Society of Scientific Fisheries(Japan),1990,56(1):125-132.
[24]TOYOHARA H,SHIMIZU Y.Relation between the modori phenomenon and myosin heavy chain breakdown in threadfin-bream gel[J].Agricultural and Biological Chemistry,1988,52(1):255-257.DOI:10.1271/bbb1961.52.255.
[25]JAFARPOUR A,GORCZYCA E M.Rheological characteristics and microstructure of common carp(Cyprinus carpio)surimi and kamaboko gel[J].Food Biophysics,2009,4(3):172-179.DOI:10.1007/s11483-009-9115-x.
[26]倪静安.分形理论及其在食品科学领域中的应用[J].食品与生物技术,2004,23(2):104-110.DOI:10.3321/j.issn:1673-1689.2004.02.025.
[27]TSUKAMASA Y,SHIMIZU Y.Factors affecting the transglutaminase-associated setting phenomenon in fish meat sol[J].Nippon Suisan Gakkaishi,1991,57(3):535-540.
[28]PHU N V,MORIOKA K,ITOH Y.Microstructure of white croaker surimi protein gels set at low temperature under the inhibition of the polymerization and degradation of protein[J].Journal of Biological Sciences,2010,10(6):499-506.
GUO Xiujin1,2,HU Yang1,2,YOU Juan1,2,XIONG Shanbai1,2,*
(1.College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China; 2.National R&D Branch Center for Conventional Freshwater Fish Processing(Wuhan),Wuhan 430070,China)
Abstract:The texture,cross-linkage and microstructure of MTGase-induced silver carp surimi gels at various setting times were measured to explore the pattern of structural evolution.The mechanical testing results showed that the breaking force,deformation,hardness and chewiness of surimi gels without MTGase addition(control group)increased significantly(P < 0.05)with extended setting time.The equilibrium breaking force(1 100 g)was achieved when the setting time was 3–6 h and the highest deformation(17 mm)was obtained in non-MTGase group when the setting time was 1–2 h,followed by a decrease with extended setting time.The highest breaking force,hardness and chewiness were obtained when the setting time was extended up to 3 h in MTGase group,while the deformation decreased significantly(P < 0.05)with the extension of setting time.SDS-PAGE results showed that myosin heavy chain(MHC)content decreased with the extension of setting time and the MHC content of the MTGase group was lower than that of the control group.The pore size of surimi gels decreased first and then increased significantly(P < 0.05),achieving the most compact network structure when the setting time was 3 h.Better properties of surimi gels were obtained when the setting time was 3–6 h in the absence of MTGase or 2–4 h in the presence of MTGase at 40 ℃.To conclude,structural evolution of surimi gels can be controlled by adjusting the setting time to obtain high-quality surimi gel products.
Key words:surimi gel; microbial transglutaminase(MTGase); structure evolution; microstructure; cross-linkage
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2016)05-0006-06
DOI:10.7506/spkx1002-6630-201605002
*通信作者:熊善柏(1963—),男,教授,硕士,研究方向为水产品加工及贮藏工程。E-mail:xiongsb@mail.hzau.edu.cn
作者简介:郭秀瑾(1989—),女,硕士研究生,研究方向为水产品加工及贮藏工程。E-mail:xiujin.hi@163.com
基金项目:国家自然科学基金面上项目(31371796);国家现代农业(大宗淡水鱼)产业技术体系建设专项(CARS-46-23);中央高校基本科研业务费专项资金项目(2662015QC014;2662014BQ053)
收稿日期:2015-04-06