切分、汽蒸及脱水对甘蓝叶片中硫苷-黑芥子酶系统的影响
方孟玮1,杨润强1,郭丽萍1,王建善2,王一淳2,顾振新1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.江苏省兴化盛源食品有限公司,江苏 兴化 225700)
摘 要:以结球甘蓝(Brassica oleracea var.capitata L.)为材料,研究切分、汽蒸及脱水对甘蓝叶片中硫苷(glucosinolates,GLs)和异硫氰酸盐(isothiocyanate,ITCs)含量、黑芥子酶(myrosinase,MYR)活性的影响。结果表明:切分度为1.00 cm2时,总GLs、脂肪族GLs含量最低,ITCs含量最高,比新鲜原料提高38.91%;随汽蒸时间的延长,MYR活性降低,汽蒸时间为60 s时,ITCs含量最高,比新鲜原料提高53.70%,此时总GLs、脂肪族GLs含量最低;添加葡萄糖质量分数为5%时,ITCs含量最高,比新鲜甘蓝提高76.26%;热风干燥温度为50 ℃时,ITCs含量比新鲜原料高89.88%,总GLs、脂肪族GLs含量最低。获得合适的条件为:切分大小1.00 cm2,汽蒸60 s,添加质量分数5%的葡萄糖,50 ℃热风干燥。
关键词:甘蓝;硫代葡萄糖苷;异硫氰酸盐;黑芥子酶;脱水
引文格式:
方孟玮,杨润强,郭丽萍,等.切分、汽蒸及脱水对甘蓝叶片中硫苷-黑芥子酶系统的影响[J].食品科学,2016,37(5):41-45.
FANG Mengwei,YANG Runqiang,GUO Liping,et al.Effects of cutting,steaming and dehydration on glucosinolatemyrosinase system of cabbage[J].Food Science,2016,37(5):41-45.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605008.http://www.spkx.net.cn
结球甘蓝(Brassica oleracea var.capitata L.),俗称包菜、卷心菜,是十字花科芸薹属蔬菜,食用部位为叶球。甘蓝中富含营养与保健物质,其中硫代葡萄糖苷(glucosinolates,GLs)及其代谢产物具有抗癌特性[1-2]。硫苷结构包括β-D-硫葡糖基、磺酸肟以及由氨基酸衍生而成的支链,根据其支链的不同可将GLs分为脂肪族、芳香族和吲哚族GLs三大类[2]。甘蓝等蔬菜的细胞受到破碎等机械损伤后,GLs迅速与黑芥子酶(myrosinase,MYR)接触,水解成异硫氰酸盐(isothiocyanate,ITCs)、硫氰酸盐、腈类等物质[3-4]。近年来,富含ITCs的功能性呈味食品日益受到关注。ITCs具有高度的生物学活性,能够有效地防止饮食中多种致癌物包括多环芳烃、杂环胺和亚硝胺引起的DNA损伤和癌症[5-6]。ITCs还具有杀菌、抗虫、抗氧化、抑制血小板聚集等作用[7-8]。因此,甘蓝制品市场前景广阔。甘蓝常用的干燥方法有冷冻干燥、微波干燥、渗透脱水和热风干燥等。冷冻干燥产品质量高,营养保存好,但设备昂贵,生产成本高;微波干燥温和、均匀,但干燥时间短,容易局部过热,引起产品质量下降;渗透脱水条件温和,不经受热处理,对蔬菜的品质影响小,脱水的程度较小,产品水分含量高,多用于前处理阶段;热风干燥最经济,适宜工业化生产[9]。
本研究以江苏地区主栽结球甘蓝为试材,研究切分、汽蒸、糖渍、热风干燥等加工工艺对其叶片中MYR活性、GLs和ITCs含量的影响,旨在探索甘蓝加工过程中富集ITCs的条件。
1 材料与方法
1.1材料与试剂
结球甘蓝:品种为帕特(小平头型)甘蓝,于2014年10月16日播种,2014年2月5日达到食用成熟度时采摘于江苏省南京市溧水甘蓝基地,减震塑料泡沫包装,2 h内运至南京农业大学食品科技学院实验室。
烯丙基硫苷、硫酸酯酶 美国Sigma公司;DEAE Sephadex A-25树脂 北京索莱宝科技有限公司;乙腈(色谱纯) 上海陆都化学试剂厂;二氯甲烷、甲醇、乙醇、醋酸钠、盐酸、氢氧化钠、乙酸、硼砂缓冲液、1,2-苯二硫醇(均为分析纯)、考马斯亮蓝G-250 国药集团(上海)化学试剂有限公司。
1.2仪器与设备
WH-3型微型旋涡混合仪 上海沪西分析仪器厂有限公司;Orion818型pH计 美国Orion Research公司;755B型分光光度计 上海精密科学仪器有限公司;DZF-6020型真空冷冻干燥系统 美国Labconce公司;1200液相色谱仪(配示差检测器) 美国安捷伦公司;HH-6数显恒温水浴锅 常州国华电器有限公司;TDL-40B离心机 上海安亭科学仪器厂。
1.3方法
1.3.1 实验步骤
1.3.1.1 机械切分处理
剔除甘蓝球叶主叶脉,沿着叶脉垂直方向切分成1.0 cm×1.0 cm、1.5 cm×1.5 cm、2.0 cm×2.0 cm叶片,以完整叶片为对照组(CK)。
1.3.1.2 汽蒸处理
将机械切分后的甘蓝叶用90 ℃蒸汽漂烫0、30、60、90、120 s。
1.3.1.3 糖渍处理
将汽蒸后的甘蓝沥水后糖渍,添加质量分数为0、3%、5%、7%的葡萄糖。
1.3.1.4 热风干燥处理
将糖渍处理后的甘蓝分别置于热风温度为30、40、50、60 ℃条件下干燥,风速为2.5 m/s。
经上述处理后的甘蓝叶经冷冻干燥、粉碎后,过200 目筛,测定GLs等含量。
1.3.2 GLs的提取与分析
参照Font等[10]方法并做适当修改。称取0.20 g样品,加入4 mL煮沸的体积分数70%甲醇,80 ℃水浴20 min后,10 000 r/min离心20 min,收集上清液,沉淀再用甲醇提取,合并上清液。取1 mL上清液流经DEAE Sephadex A-25离子交换柱,排干提取液后,用2 mL 0.02 mol/L醋酸钠溶液冲洗柱子,加入200 μL硫酸酯酶,于30 ℃条件下反应16 h后洗脱,过0.45 μm滤膜,用于高效液相色谱(high performance liquid chromatography,HPLC)分析。
HPLC分析条件:色谱柱为Eclipse XDB-C18柱(4.6 mm× 150 mm,5 μm);流动相为超纯水和乙腈,先用水洗脱1 min,1~21 min内,0%~20%乙腈,21~26 min内,20%~0% 乙腈;检测波长226 nm;流速1 mL/min;柱温30 ℃;进样量20 μL;以烯丙基硫苷作为内标。
1.3.3 ITCs含量测定
参照Guo Qianghui等[11]的方法。准确称取0.20 g样品加入4 mL蒸馏水,40 ℃条件下酶解3 h,加入3 mL二氯甲烷,10 000 r/min离心20 min。离心后取100 μL上清液,加入0.2 mol/L 1.8 mL pH 8.5的硼砂缓冲液、2 mL甲醇、200 μL 7 nmol/L 1,2-苯二硫醇,混匀后65 ℃条件下反应1 h,冷却,过0.45 μm滤膜后,用HPLC检测ITCs含量,以萝卜硫素的标准曲线来计算。
H P L C条件:E c l i p s e X D B - C1 8柱(4.6 mm×150 mm,5 μm)色谱柱;流动相为甲醇-水(70∶30,V/V);流速1.00 mL/min;进样量:20 μL;检测波长:365 nm。
1.3.4 MYR酶活力测定
参照Kim等[12]的方法。取0.2 g样品,用3 mL 0.1 mol/L pH 6.5磷酸盐缓冲液冰浴研磨,离心。取上清液0.5 mL,加入0.5 mL 0.1 mol/L烯丙基硫苷,水浴反应后沸水灭酶,以葡萄糖试剂盒测定葡萄糖的含量。以每分钟被MYR转化生成1 nmol葡萄糖为1 个酶活力单位(U/mg pro)。
1.4数据分析
实验设3 次重复,每次3 组平行实验。数据采用统计SPSS 18.0分析软件进行统计分析,均值间比较采用Duncan’s多重比较,P<0.05表示差异显著。
2 结果与分析
2.1切分处理对甘蓝叶片中GLs含量的影响
表1 不同切分大小下甘蓝叶片中GLss含量
Table 1 Effect of segmentation size on the content of GLs in cabbage leaves μmol/g
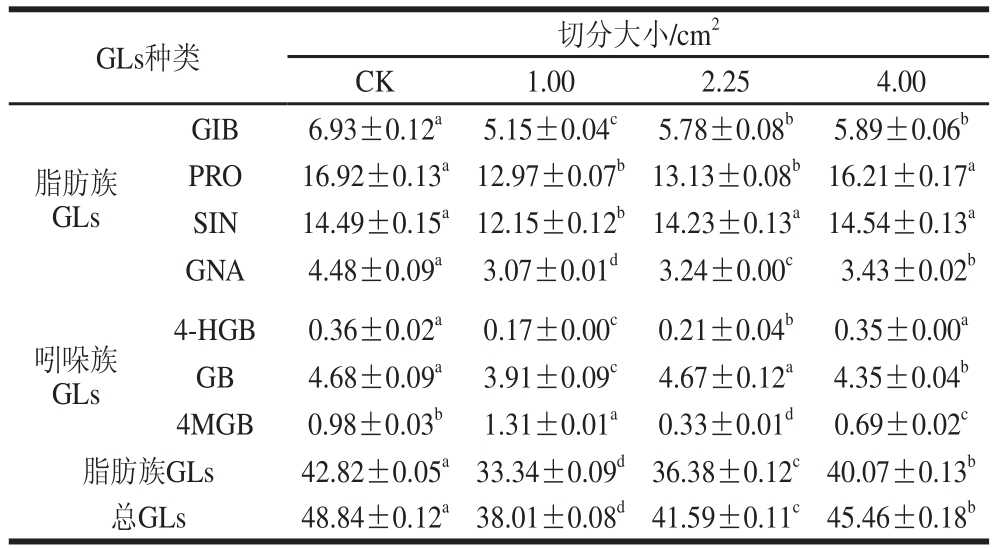
注:表中数据以干质量计;GIB.3-甲基亚磺酰基丙基硫苷(3-methy sulfinyl propyl glucosinate);PRO.2-羟基-3-丁烯基硫苷(progoitrin);SIN.2-丙烯基硫苷(sinigrin);GNA.3-丁烯基硫苷(gluconapin);4-HGB.4-羟基-3-吲哚甲基硫苷(4-hydroxy glucobrassicin);GB.1-磺酸-3-吲哚甲基硫苷(1-sulfonic-3-methylindole glucosinate);4MGB.4-甲氧基-3-吲哚甲基硫苷(4-methoxy-3-methylindole glucosinate)。同行小写字母不同表示差异显著(P<0.05)。下同。
GLs种类 切分大小/cm2CK 1.00 2.25 4.00脂肪族GLs GIB 6.93±0.12a 5.15±0.04c 5.78±0.08b 5.89±0.06bPRO 16.92±0.13a12.97±0.07b13.13±0.08b16.21±0.17aSIN 14.49±0.15a12.15±0.12b14.23±0.13a14.54±0.13aGNA 4.48±0.09a 3.07±0.01d 3.24±0.00c 3.43±0.02b4-HGB 0.36±0.02a 0.17±0.00c 0.21±0.04b 0.35±0.00aGB 4.68±0.09a 3.91±0.09c 4.67±0.12a 4.35±0.04b4MGB 0.98±0.03b 1.31±0.01a 0.33±0.01d 0.69±0.02c脂肪族GLs 42.82±0.05a33.34±0.09d36.38±0.12c40.07±0.13b总GLs 48.84±0.12a38.01±0.08d41.59±0.11c45.46±0.18b吲哚族GLs
由表1可知,总GLs含量随着甘蓝切分大小增大呈递增趋势。切分大小为1.00 cm2的甘蓝叶中总GLs含量最低,仅为CK组的77.83%。脂肪族GLs含量随切分大小增大呈递增趋势。切分大小为1.00 cm2的甘蓝叶中,脂肪族GLs含量是CK组的77.86%。
2.2切分处理对甘蓝叶片中ITCs含量的影响

图1 不同切分程度下甘蓝叶片中ITCss含量
Fig.1 Effect of segmentation size on the content of ITCs in cabbage leaves
由图1可知,ITCs含量随切分大小的增大呈下降趋势。切分大小为1.00 cm2的甘蓝叶片中ITCs的含量为3.57 mg/100 g,为CK组的1.39 倍,而切分大小为2.25、4.00 cm2时,ITCs含量无显著差异。
2.3汽蒸时间对甘蓝叶片中GLs含量的影响
表2 不同汽蒸时间条件下的甘蓝叶片中GLss含量
Table 2 Effect of steaming time on the content of GLs in cabbage leaves

GLs种类 汽蒸时间/s 0 30 60 90 120脂肪族GLs GIB 5.43±0.05a4.40±0.00b3.54±0.02c3.51±0.01c3.57±0.08cPRO 12.43±0.07a12.42±0.12a10.08±0.05b10.09±0.14b10.02±0.06bSIN 12.11±0.13a10.02±0.07b10.08±0.12b10.09±0.13b10.01±0.09bGNA 3.03±0.01a2.05±0.02c2.09±0.04c2.36±0.01b2.33±0.02b吲哚族GLs 4-HGB 0.35±0.02b0.45±0.01a0.46±0.00a0.36±0.01b0.34±0.00bGB 3.47±0.09a3.45±0.08a2.58±0.03b2.50±0.05b2.55±0.06b4MGB 1.50±0.02a1.48±0.02a1.23±0.02b1.06±0.01c1.05±0.01c脂肪族GLs 33.00±0.10a28.89±0.05b25.79±0.07c26.05±0.07c25.93±0.04c总GLs 38.32±0.12a34.27±0.10b30.06±0.15c29.97±0.07c29.87±0.14c
由表2可知,甘蓝叶中总GLs含量随汽蒸时间增加呈降低趋势。汽蒸时间为120 s时,总GLs含量仅为0 s时的77.95%,汽蒸60、90 s与120 s之间无显著差异。随汽蒸时间增加,脂肪族GLs含量变化趋势和总GLs相同。
2.4汽蒸时间对甘蓝叶片中MYR活力、ITCs含量的影响
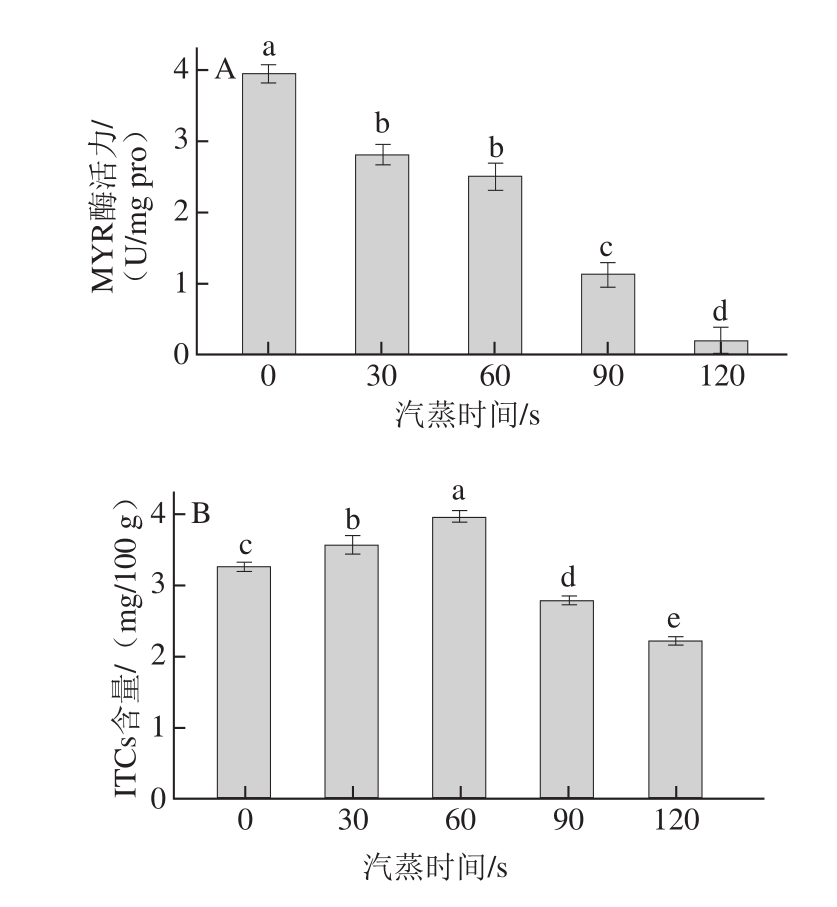
图2 不同汽蒸时间下甘蓝叶片中MYR酶活力、ITCss含量
Fig.2 Effect of steaming time on MRY activity and the content of ITCs in cabbage leaves
由图2可知,甘蓝叶中MYR酶活力随汽蒸时间增加呈降低趋势。汽蒸120 s时,MYR酶活力仅为0.19 U/mg pro,而0 s时MYR酶活力为3.92 U/mg pro,比0 s时降低了95.15%。ITCs含量随汽蒸时间增加呈先升高后降低趋势。汽蒸60 s时,ITCs含量最大,为3.95 mg/100 g,随后降低;120 s时,ITCs含量低于对照组,仅为2.22 mg/100 g。
2.5葡萄糖添加量对甘蓝叶片中GLs含量的影响
表3 不同葡萄糖添加量下甘蓝叶片中GLss含量
Table 3 Effect of glucose addition on the content of GLs in cabbage leaves μmol/g

GLs种类 葡萄糖添加量/% 0 3 5 7脂肪族GLs GIB 3.46±0.05a3.40±0.00b2.24±0.02c2.21±0.01cPRO 10.32±0.07a9.08±0.12a8.02±0.05b8.12±0.14bSIN 10.11±0.13a9.02±0.07b8.12±0.12b8.09±0.13bGNA 2.02±0.01a2.05±0.02c2.03±0.04c2.06±0.01b吲哚族GLs 4-HGB 0.34±0.02b0.35±0.01a0.21±0.00a0.22±0.01bGB 3.31±0.09a3.01±0.08a2.55±0.03b2.49±0.05b4MGB 1.57±0.02a1.55±0.02a1.23±0.02b1.20±0.01b脂肪族GLs 25.82±0.06a23.55±0.03b20.41±0.05c20.48±0.07c总GLs 31.04±0.12a28.46±0.10b24.40±0.15c24.39±0.07b
由表3可知,甘蓝叶片中总GLs含量随葡萄糖添加量的增加呈下降趋势。葡萄糖添加量为3%时,总GLs含量比葡萄糖添加量为0%时降低8.31%,葡萄糖添加量为5%、7%时,总GLs含量最低,但两者之间无显著差异。随葡萄糖添加量的增加,脂肪族GLs含量与总GLs变化趋势相同。
2.6葡萄糖添加量对甘蓝叶片中MYR活力、ITCs含量的影响

图3 不同葡萄糖添加量下甘蓝叶片中MYR酶活力、ITCss含量
Fig.3 Effect of glucose addition on MRY activity and the content of ITCs in cabbage leaves
由图3可知,随葡萄糖添加量的增加,MYR酶活力呈先增加后降低的趋势。葡萄糖添加量为3%、5%时,MYR酶活力为最高,且处理间无显著差异。随葡萄糖添加量的增加,ITCs含量呈先增加后降低的趋势,葡萄糖添加量为5%时,ITCs含量最高,为4.53 mg/100 g;葡萄糖添加量为3%、7%时,ITCs含量与对照组无显著差异。
2.7热风干燥温度对甘蓝叶片中GLs含量的影响
表4 不同热风干燥温度下甘蓝叶片中GLss含量
Table 4 Effect of hot air drying temperature on the content of GLs in cabbage leaves μmol/g

GLs种类 干燥温度/℃30 40 50 60脂肪族GLs GIB 4.18±0.07a2.10±0.01c2.11±0.02c2.32±0.00bPRO 6.08±0.17a6.08±0.14a4.08±0.11b5.95±0.17aSIN 5.89±0.14a4.54±0.06c4.17±0.03d5.02±0.10bGNA 2.23±0.02a2.00±0.00c2.12±0.03b2.11±0.04b吲哚族GLs 4-HGB 0.37±0.00a0.35±0.01a0.24±0.02b0.25±0.01bGB 3.87±0.13a3.86±0.11a2.51±0.07b2.05±0.08c4MGB 1.34±0.00b1.55±0.01a1.20±0.02d1.27±0.01c脂肪族GLs 18.38±0.11a14.72±0.09b12.48±0.10c15.40±0.12b总GLs 23.96±0.14a20.48±0.09b16.43±0.15d18.89±0.12c
由表4可知,随热风干燥温度的升高,总GLs含量呈先降低后升高的趋势。30 ℃时总GLs含量最高;而50 ℃时总GLs含量仅为30 ℃时的68.58%。脂肪族GLs的含量变化趋势和总GLs相同,30 ℃时脂肪族GLs含量是50 ℃时的1.47 倍。
2.8热风干燥温度对甘蓝叶片中ITCs含量的影响

图4 不同热风干燥温度下甘蓝叶片中ITCs含量的影响
Fig.4 Effect of hot air drying temperature on the content of ITCs in cabbage leaves
由图4可知,随热风干燥温度的升高,ITCs含量呈先升高后降低的趋势。热风温度为50 ℃时,ITCs含量最高,为4.88 mg/100 g;热风干燥温度为30 ℃时,ITCs含量最低,为3.69 mg/100 g,仅为50 ℃时的75.62%。
3 讨论与结论
蔬菜采后仍是活的有机体,仍在不断地进行着新陈代谢。机械损伤可降解GLs、积累ITCs[13-14]。本实验采用切分法研究甘蓝叶片中GLs、ITCs含量变化,表明切分度小,GLs降解量少、ITCs生成量多,可能原因是是机械切分破坏了甘蓝组织细胞,使其中的MYR被释放,降解GLs生成ITCs。切分程度越小,机械损伤程度越小,GLs损失率越低[15]。切分程度影响ITCs生成量,可能原因是切分造成的机械损伤,使得MYR充分释放,GLs水解生成较多的ITCs[1,16]。Song Lijiang等[17]发现,甘蓝切分度为5 mm2并于室温下放置6 h,GLs的损失率达到60%,且切分度越大,GLs降解程度越小。何娜[1]研究发现,当切分度为0.2 cm2时,甘蓝中GLs含量损失达49.79%。本研究结果与其一致。
干燥和蒸汽对于结球甘蓝而言都属于热胁迫,研究表明热激可使得植物中的ITCs富集[1]。本实验研究发现,随着蒸汽时间增加,总GLs含量降低、MYR活力减少,蒸汽60 s时ITCs含量升高,随后ITCs含量降低。阮思煜等[18]研究表明,温度对红心萝卜中MYR活力影响极显著,经100 ℃热水处理30 min后,MYR活力剩下4.08%。本实验中加热介质为蒸汽,与热水相比,具有更高的温度、更高的热量和更大的比容,且热穿透能力更强,能使MYR活性完全钝化且处理时间较热水处理大为缩短,因而增加蒸汽时间可显著降低MYR活力,从而影响ITCs的生成量。
糖渍等预处理可缩短干燥时间降低耗能,保持产品较高的营养品质[19]。本研究结果表明:添加质量分数为5%葡萄糖后,ITCs含量比葡萄糖添加量为0%时提高18.59%,总GLs含量下降21.39%。添加适当质量分数的葡萄糖可提高MYR活性,为GLs水解成ITCs提供条件。随着葡萄糖质量分数的增加,ITCs含量呈先升高后降低的趋势,说明高质量分数的葡萄糖不利于ITCs的生成。
热风干燥是目前生产上常用的脱水方式,我国90%的脱水蔬菜企业均采用常压热风干燥的方式[20]。本实验研究表明,在设定的30~50 ℃干燥温度范围内,随着热风温度的提高,甘蓝叶片中ITCs的含量呈增加趋势,总GLs含量呈降低的趋势。可能原因是ITCs在高温条件下容易挥发,不利于ITCs的保留。60 ℃时GLs含量升高可能是干燥过程相当于高温和低水分胁迫处理,引发植株的防护机制,在此过程中GLs含量增多[19]。阮思煜等[18]研究发现,短红心萝卜的MYR最佳反应温度为45 ℃,超过55 ℃时酶的稳定性急剧下降。刘月萍[20]研究发现将MYR放在55 ℃以上温度保温30 min时,MYR的活力陡然下降。这表明十字花科植物的MYR最适反应温度基本一致。
切分、汽蒸及脱水工艺影响甘蓝叶片中ITCs含量变化。加工过程富集甘蓝中ITCs的条件为:切分大小1.00 cm2,再蒸汽处理60 s,添加质量分数5%的葡萄糖,热风干燥温度50 ℃,脱水处理后ITCs含量相比于鲜样增加89.88%。
参考文献:
[1]何娜.结球甘蓝富集γ-氨基丁酸工艺研究及其超细微粉开发[D].南京:南京农业大学,2013:1-2.
[2]李晨,薛峰,缪文华,等.硫苷葡萄糖苷降解研究进展[J].食品科学,2010,31(9):71-72.
[3]姜子涛,张清峰,李荣.异硫氰酸酯的产生、化学性质及测定方法[J].中国调味品,2005,314(4):9-14.DOI:10.3969/j.issn.1000-9973.2005.04.002.
[4]刘月萍,王向阳.黑芥子酶研究进展[J].生物技术通讯,2006,17(5):837-840.DOI:10.3969/j.Issn.1009-0002.2006.05.047.
[5]MANCHALI S,MURTHY K N C,PATIL B S.Crucial facts about health benefits of popular cruciferous vegetables[J].Journal of Functional Foods,2012,4(1):94-106.DOI:10.1016/j.Jff.2011.08.004.
[6]HAO L,YUAN Q P,XIAO Q,et al.Effects of metal ions on myrosinase activity and the formation of sulforaphane in broccoli seed[J].Journal of Molecular Catalysis B:Enzymatic,2006,43:19-22.DOI:10.1016/j.Molcatb.2006.03.008.
[7]罗丽娜.硫代葡萄糖苷水解产物抗肿瘤作用的研究[D].武汉:华中科技大学,2007:7-12.DOI:10.7666/d.d089532.
[8]ROUZAUD G,YOUNG S A,DUNCAN A J.Hydrolysis of glucosinolates to isothiocyanates after ingestion of raw or microwaved cabbage by human volunteers[J].Cancer Epidemiology,Biomarkers & Prevention,2004,13:125-131.DOI:10.1158/1055-9965.EPI-085-3.
[9]华丽.甘蓝新型组合干燥技术的研究[D].无锡:江南大学,2012:1-2.
[10]FONT R,R¸O-CELESTINO M,CARTEA E,et al.Quantification of glucosinolates in leaves of leaf rape(Brassica napus ssp.pabularia)by near-infrared spectroscopy[J].Phytochemistry,2005,66(2):175-185.DOI:10.1016/j.Phytochem.2004.11.011.
[11]GUO R,YUAN G,WANG Q.Effect of sucrose and mannitol on the accumulation of health-promoting compounds and the activity of metabolic enzymes in broccoli sprouts[J].Scientia Horticulturae,2011,128(3):159-165.DOI:10.1016/j.Scienta.2011.01.014.
[12]KIM H J,CHEN F,WANG X,et al.Effect of methyl jasmonate on phenolics,isothiocyanate,and metabolic enzymes in radish sprout(Raphanus sativus L.)[J].Journal of Agricultural and Food Chemistry,2006,54(19):7263-7269.DOI:10.1021/jf060568c.
[13]李丽倩,韩永斌.不同胁迫处理方法对西兰花茎中硫苷和异硫氰酸盐含量的影响[J].食品与发酵工业,2015,41(3):144-148.DOI:10.13995/j.Cnki.11-1802/ts.201503026.
[14]MORENO D A,CARVAJAL M,LÓPEZ-BERENGUER C,et al.Chemical and biological characterisation of nutraceutical compounds of broccoli[J].Journal of Pharmaceutical and Biomedical Analysis,2006,41(5):1508-1522.DOI:10.1016/j.Jpba.2006.04.003.
[15]HIGDON J V,DELAGE B,WILLIAMS D E,et al.Cruciferous vegetables and human cancer risk:epidemiologic evidence and mechanistic basis[J].Pharmacological Research,2007,55(3):224-236.DOI:10.1016/j.Phrs.2007.01.009.
[16]KUMAR R,KUMAR S,SANGWAN S,et al.Protein modeling and active site binding mode interactions of myrosinase-sinigrin in Brassica juncea:an in silico approach[J].Journal of Molecular Graphics and Modelling,2011,29:740-746.DOI:10.1016/j.Jmgm.2010.12.004.
[17]SONG L J,THORNALLEY P J.Effect of storage,processing and cooking on glucosinolate content of Brassica vegetables[J].Food and Chemical Toxicology,2007,45(2):216-224.DOI:10.1016/j.fct.2006.07.021.
[18]阮思煜,敬璞,董英.红心萝卜黑芥子酶的性质及热变性动力学研究[J].食品工业科技,2012,33(4):149-152.
[19]王冬梅.脱水甘蓝护色工艺优化及风味物质的研究[D].哈尔滨:东北农业大学,2012:2-5.
[20]刘月萍.黑芥子酶的提取分离、性质及固定化研究[D].杭州:浙江工商大学,2007:33-34.
E-mail:guzx@njau.edu.cn
Effects of Cutting,Steaming and Dehydration on Glucosinolate-Myrosinase System of Cabbage
FANG Mengwei1,YANG Runqiang1,GUO Liping1,WANG Jianshan2,WANG Yichun2,GU Zhenxin1,*
(1.College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China; 2.Jiangsu Xinghua Shengyuan Food Co.Ltd.,Xinghua 225700,China)
Abstract:Onc e plant cells are ruptured,glucosinolates(GLs)are quickly contacted with myrosinase(MYR)and degrade into isothiocyanates(ITCs),which are believed to be anticarcinogens.Effects of cutting,steaming and dehydrating on the contents of GLs and ITCs,and MYR activity in ‘Pate’ cabbage were studied.Results showed that the contents of total GLs and aliphatic GLs were the lo west,and the content of ITCs was the highest when cabbage leaves were cut into 1.0 cm × 1.0 cmpieces,a 38.91% increase over that of the intact cabbage.With increasing steaming time,MYR activity decreased.After steaming for 60 s,the highest content of ITCs was observed,a 53.70% increase compared with the fresh cabbage,as well as the lowest contents of total GLs and aliphatic GLs.The highest content of ITCs was obtained by addition of 5% glucose,a 76.26% increase compared with the fresh cabbage.When the drying temperature was 50 ℃,the content of ITCs was increased by 89.88% compared with the fresh cabbage; meanwhile,the contents of total GLs and aliphatic GLs were the lowest.Therefore,the optimal processing conditions for cabbage were cutting into 1.0 cm × 1.0 cmpieces,steaming for 60 s,addition of 5% glucose,and hot air drying at 50 ℃.
Key words:cabbage; glucosinolates; isothiocyanates; myrosinase; dehydration
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2016)05-0041-05
DOI:10.7506/spkx1002-6630-201605008
10.7506/spkx1002-6630-201605008.http://www.spkx.net.cn
*通信作者:顾振新(1956—),男,教授,博士,研究方向为生物技术与农产食品加工、功能食品创制原理与技术。
作者简介:方孟玮(1991—),女,硕士研究生,研究方向为农产品加工与综合利用。E-mail:2012108083@njau.edu.cn
基金项目:江苏省科技支撑计划项目(BE2013430);江苏高校优势学科建设工程资助项目(PAPD)
收稿日期:2015-06-04







