袁清霞,吴 凡,邱丽淳,叶 红,王晓晴,曾晓雄*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:从鼎湖鳞伞菌发酵液中提取、纯化得到胞外多糖(Pholiota dinghuensis Bi exopolysaccharides,PDEPS)-1,采用体外模拟唾液、胃液、胃肠液模型与分析还原糖含量、分子质量变化及游离单糖含量,探讨了PDEPS-1在体外模拟消化液中的变化。结果表明:PDEPS-1的中性糖含量为97.97%,含少量蛋白、糖醛酸及硫酸基,不含还原糖,分子质量为17.95 kD,由甘露糖及半乳糖组成,物质的量比为53.32∶6.43。PDEPS-1在唾液中不被消化,分子质量不变,没有还原糖及单糖的生成;在模拟胃液及胃肠液中有还原糖产生,但没有检测到单糖。因此,PDEPS-1在体外模拟的3 种消化液中具有一定的耐消化性。
关键词:鼎湖鳞伞菌;胞外多糖;体外消化;还原糖;分子质量;单糖
引文格式:
袁清霞,吴凡,邱丽淳,等.鼎湖鳞伞菌胞外多糖在体外3 种模拟消化液中的消化作用[J].食品科学,2016,37(5):72-77.
YUAN Qingxia,WU Fan,QIU Lichun,et al.Effects of three digestive juices on the in vitro digestion of exopolysaccharide from Pholiota dinghuensis Bi[J].Food Science,2016,37(5):72-77.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605014.http://www.spkx.net.cn
多糖广泛存在于植物、动物、微生物中,越来越多的研究显示多糖具有抗肿瘤、抗氧化、降血糖、降血脂、免疫调节等生理活性,且毒副作用小[1-3]。此外,多糖作为人类日常饮食的重要构成部分,研究表明其大部分在肠道中被微生物利用,代谢过程产气及生成短链脂肪酸[4]。已有研究证实在体外人粪样厌氧发酵模型中,多糖能有效促进短链脂肪酸的生成,促进有益微生物如双歧杆菌、乳杆菌等的生长[5-7]。但由于体内消化研究的复杂性,对多糖在唾液及胃肠道消化液中的消化、吸收情况知之甚少。近年来,体外模拟胃肠液消化模型由于具有简单易行、成本低、重复性好等优点广泛用于分析多糖在消化液中的变化[8-9]。
鼎湖鳞伞菌(Pholiota dinghuensis Bi)为中国特有种,是Pholiota属中的一个新种,发现于我国广东省,由毕志树等[10]于1985年最早报道,2008年被收入到“Dictionary of the Fungi”中[11]。本实验室前期的研究表明,鼎湖鳞伞菌丝体多糖具有显著的抗肿瘤活性[12],此外还具有抗氧化、免疫调节等生物活性[13]。但对其胞外多糖的研究较少,尚未见有关鼎湖鳞伞菌胞外多糖(Pholiota dinghuensis Bi exopolysaccharides,PDEPS)体外消化的研究报道。因此,本实验利用体外模拟唾液、胃液、胃肠液模型探讨鼎湖鳞伞菌胞外多糖的消化情况,为进一步研究鼎湖鳞伞菌胞外多糖对肠道微生物的调节作用提供理论基础。
1.1菌种与试剂
鼎湖鳞伞菌(Pholiota dinghuensis Bi)来源于广东省微生物研究所菌种保藏中心。
甘露糖、阿拉伯糖、半乳糖、半乳糖醛酸、葡萄糖、葡萄糖醛酸、核糖、木糖、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)、乙腈美国Sigma公司;鼠李糖、岩藻糖 阿拉丁试剂(上海)有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS) 国药集团化学试剂有限公司;胃蛋白酶、胃脂肪酶、胰酶 北京索莱宝科技有限公司;其余试剂均为国产分析纯。
1.2仪器与设备
EPED-E2-10TH型实验室级超纯水器 南京易普易达科技发展有限公司;HH-6数显恒温水浴锅 江苏常州国华电器有限公司;Agilent 1100高效液相色谱仪 美国Agilent公司;V-1200型可见分光光度计 上海美谱达仪器有限公司;EYELA旋转蒸发仪 上海爱朗仪器有限公司。
1.3方法
1.3.1 PDEPS的制备
按Gan Dan等[14]报道的方法培养鼎湖鳞伞菌。鼎湖鳞伞菌发酵液过滤、冲洗后合并滤液,减压浓缩,加入3 倍体积无水乙醇醇沉,离心得沉淀,干燥后得PDEPS粗品。PDEPS粗品经DEAE Sepharose Fast Flow凝胶阴离子交换柱及Sephadex G-100凝胶过滤柱纯化得到纯化组分PDEPS-1。
1.3.2 PDEPS-1的表征
苯酚-硫酸法[15]测定中性糖含量;考马斯亮蓝法[16]测定蛋白质含量;间羟联苯法[17]测定糖醛酸含量;氯化钡-明胶比色法[18]测定硫酸基含量;DNS法[19]测定还原糖含量;高效液相凝胶过滤色谱法[3](high performance gel filtration chromatography,HPGFC)测定PDEPS-1的纯度及分子质量;单糖组成分析参考Dai Jun等[20]的方法进行。
1.3.3 PDEPS-1的体外消化
1.3.3.1 模拟唾液对PDEPS-1的消化作用
新鲜唾液样品的采集参考文献[21]。口腔的模拟消化参考文献[22]。PDEPS-1溶解于超纯水中配制成2 mg/mL的溶液,A、B、C管中分别加入2 mL唾液和2 mL多糖、2 mL唾液和2 mL超纯水、2 mL多糖和2 mL超纯水。测试管置于37 ℃水浴锅中反应,在反应0、4、6 h后分别取出部分反应液,沸水浴10 min灭酶活。DNS法测定唾液消化后多糖中还原糖的含量;HPGFC法测定消化后多糖分子质量的变化,色谱柱为TSK-gel G4000 PWXL(7.8 mm×300 mm,10 øm),流动相为纯水,流速为0.7 mL/min,柱温35 ℃,检测器为示差检测器,进样20 øL;PMP单糖衍生法检测消化后产生的单糖,色谱柱为Eclipse Plus C18(4.6 mm×250 mm,5 øm),流动相为0.1 mol/L pH 6.7磷酸盐缓冲液与乙腈的混合液(83∶17,V/V),流速为1.0 mL/min,柱温30 ℃,检测器为二极管阵列检测器,检测波长245 nm,进样20 øL。
1.3.3.2 模拟胃液对PDEPS-1的消化作用
体外模拟胃液的配制参考文献[23]。向装有体外模拟胃液的离心管中加入PDEPS-1多糖溶液,另设一组空白对照,该离心管中以相同体积的超纯水代替多糖溶液。所有离心管于37 ℃、150 r/min的摇床中消化,分别于0、4、6 h取样,沸水浴10 min灭酶活。HPGFC法测定消化后的多糖分子质量变化,色谱条件同1.3.3.1节;以1 mol/L NaHCO3调pH值至7,DNS法测定消化后多糖中还原糖的含量;PMP单糖衍生法检测消化后产生的单糖,色谱条件同1.3.3.1节。
1.3.3.3 模拟胃肠液对PDEPS-1的消化作用
体外模拟肠液的配制参考文献[23]。体外模拟胃液消化多糖6 h后,以1 mol/L NaHCO3调pH值至7,加入一定体积的模拟肠液,混匀后,37 ℃、150 r/min的摇床中消化。分别于消化的0、4、6 h取样,沸水浴10 min灭酶活。DNS法测定唾液消化后多糖中还原糖的含量;HPGFC法测定消化后的多糖分子质量变化,色谱条件同1.3.3.1节;PMP单糖衍生法检测消化后产生的单糖,色谱条件同1.3.3.1节。
1.4数据处理
所有实验重复3 次,数据结果以![]() 表示,所有数据用SPSS 19.0统计软件进行统计分析,不同处理间的差异显著性P<0.05。
表示,所有数据用SPSS 19.0统计软件进行统计分析,不同处理间的差异显著性P<0.05。
2.1PDEPS-1的制备与理化性质
将培养的鼎湖鳞伞菌发酵液过滤、浓缩、醇沉、干燥,制备得到PDEPS粗品。PDEPS粗品经DEAE Sepharose Fast Flow凝胶阴离子交换柱获得3 个组分,分别为水洗脱组分F1、0.1 mol/L NaCl洗脱组分F2和0.3 mol/L NaCl洗脱组分F3(图1a),其中F1为主要组分。将主要组分F1进一步经Sephadex G-100纯化得到纯化组分PDEPS-1,结果如图1b所示。
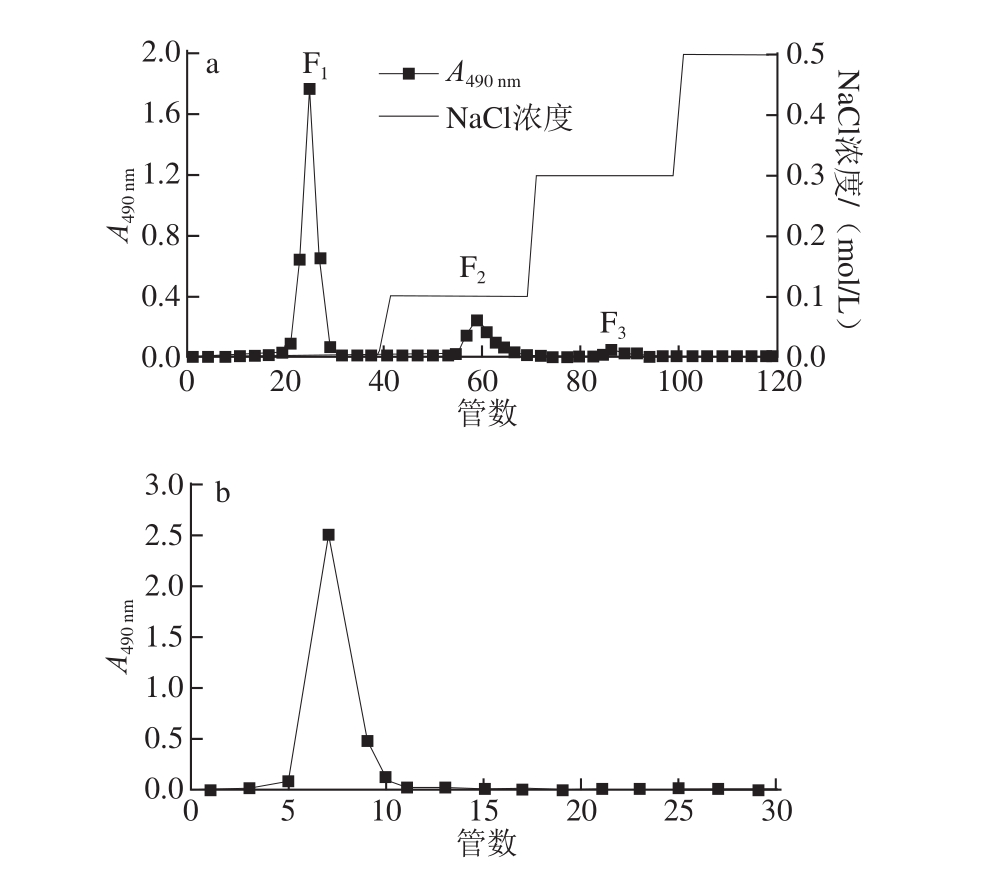
图1 PDEPS粗品在DEAE Sepharose Fast Flow柱的梯度洗脱曲线(a)及PDEPS-1在Sephadex G-100柱上的洗脱曲线(bb)
Fig.1 Stepwise elution curve of crude PDEPS on DEAE Sepharose Fast Flow column(a)and elution curve of PDEPS-1 on Sephadex G-100 column(b)
PDEPS-1的理化性质结果见表1。PDEPS-1的中性糖含量为97.97%,蛋白质、糖醛酸及硫酸基含量较少,不含还原糖,说明PDEPS-1为中性糖。以不同分子质量的P-系列普鲁兰多糖标准品,通过HPGFC法绘制分子质量的标准曲线,并进行线性回归,回归方程为Y=-0.361 2X+9.008 5(R2=0.998 2),其中,X代表保留时间,Y代表标准多糖分子质量的对数值(lgMw)。将PDEPS-1的保留时间代入标准曲线回归方程,计算得其平均分子质量为17.95 kD。标准单糖PMP衍生物的HPGFC色谱图如图2a所示,标准单糖在色谱图上的保留时间依次为甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖及岩藻糖。PDEPS-1单糖组成的HPGFC色谱图如图2b所示,PDEPS-1由甘露糖及半乳糖组成,根据各种单糖的回归方程及PDEPS-1单糖的峰面积计算得甘露糖和半乳糖的物质的量比为53.32∶6.43。
表1 PDEPS-1的理化性质
Table 1 Physicochemical properties of PDEPS-1

图2 单糖混合标准品(a)与PDEPS-1单糖组成(b)的HPLLCC图
Fig.2 HPLC chromatograms of standard monosaccharides(a)and PDEPS-1(b)
2.2PDEPS-1的体外消化
2.2.1 体外消化产物的还原糖含量
在PDEPS-1体外消化产物的还原糖测定实验中,本实验采用DNS法分别测定了不加PDEPS-1的唾液、胃液、肠液及胃肠液中的还原糖含量,结果发现胃液中含少量还原糖(0.7 mg/mL)。为消除消化液自身所含还原糖对结果的影响,本研究以消化液为参比溶液来检测PDEPS-1体外模拟消化液消化产物的还原糖含量,结果如表2所示。PDEPS-1最初不含还原糖。唾液消化后没有产生还原糖,这与文献报道的结果一致[9,24]。在模拟胃液中,随消化时间的增加,还原糖含量逐渐增加,说明在胃液中,较低的pH值可能导致部分糖苷键的断裂。而在模拟胃肠液中,随时间增加,还原糖变化不大。
表2 PDEPS-1体外消化产物的还原糖含量(x±s,n == 33)
Table 2 Reducing sugar contents in digested products of PDEPS-1 x ,= 3)
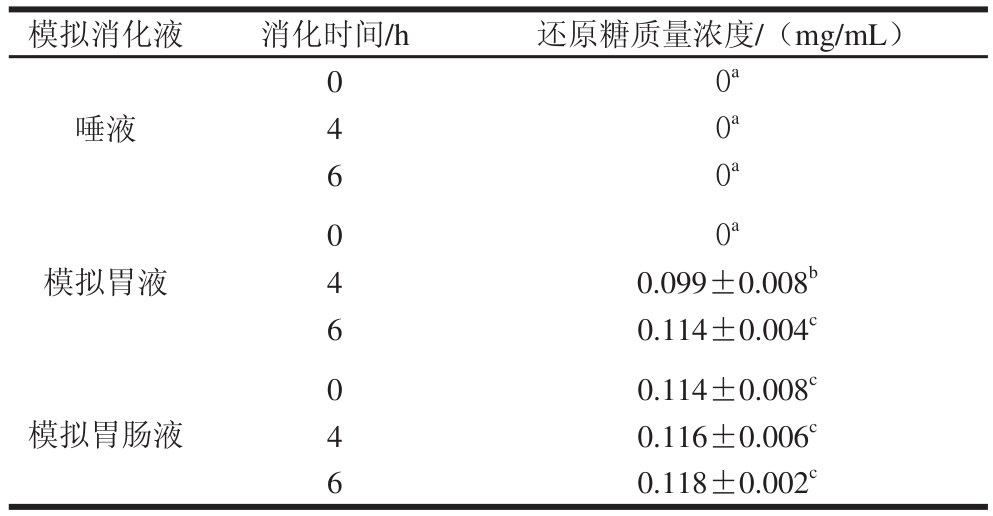
注:同列小写字母不同表示差异显著(P<0.05)。
2.2.2 PDEPS-1消化产物分子质量的变化
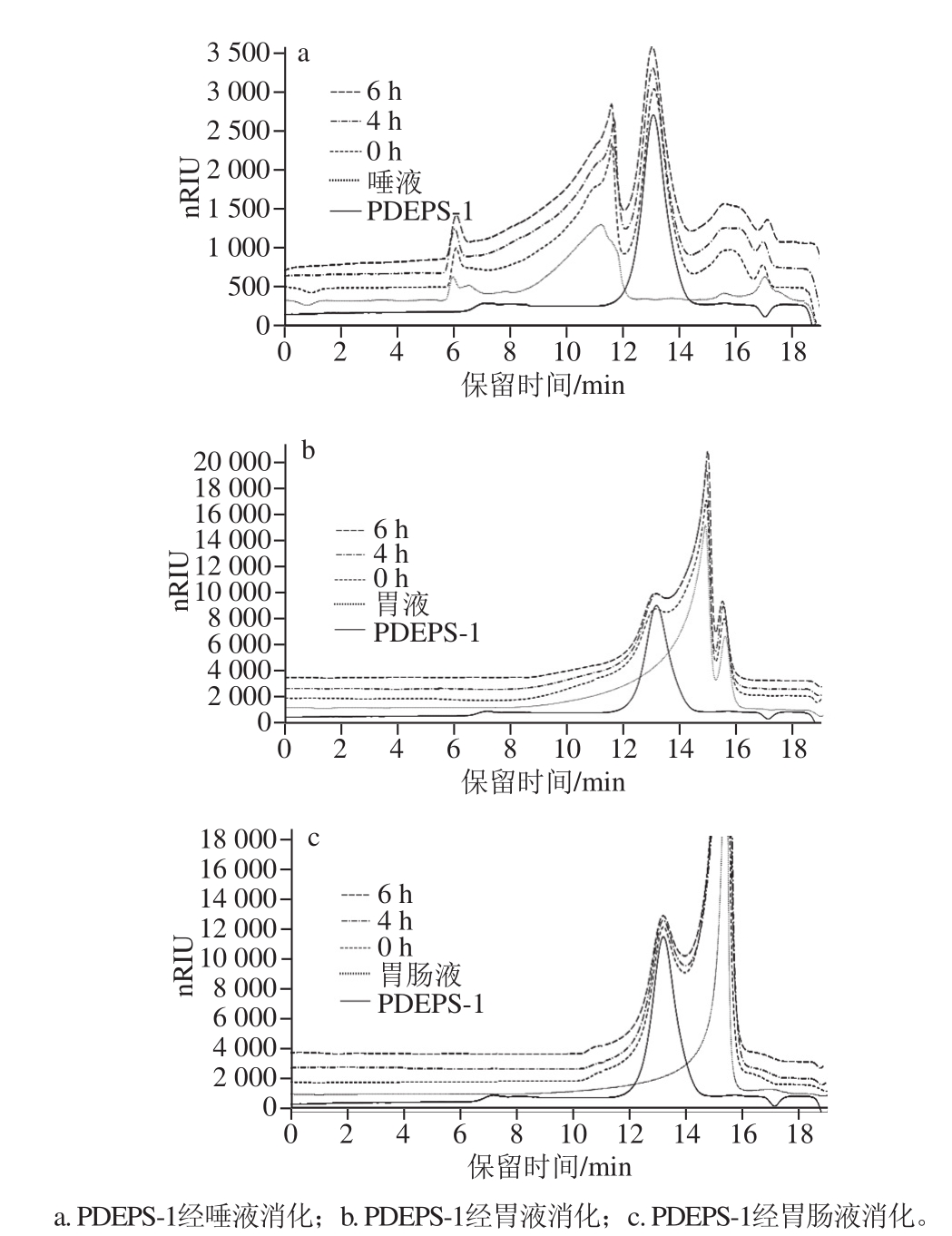
图3 PDEPS-1在不同消化时间点的HPGPPCC图
Fig.3 HPGPC chromatograms of PDEPS-1 at different digestion times
中性多糖主要通过羟基的分子间氢键形成聚集体,不同的处理包括溶剂、超声、过滤等都会影响多糖聚集的生成及分子质量分布[25]。由图3可知,当PDEPS-1溶液与唾液、胃液、胃肠液这3 种消化液混合后,相对于水溶液体系,PDEPS-1的分子质量分布没有发生变化,说明消化液中的自由离子不会影响PDEPS-1的分子质量分布。这与张冠亚等[9]的研究结果一致。在唾液消化过程中,PDEPS-1的分子质量没有发生明显改变(图3a),同时没有还原糖的生成,说明PDEPS-1在唾液中没有被消化。PDEPS-1在胃液及胃肠液中反应4、6h后,分子质量无明显变化,这与还原糖含量的测定结果一致。在胃液中,虽然随着时间的增加,还原糖含量有所增加,但总体而言,生成的还原糖较少,推测糖苷键的断裂程度较轻,分子质量变化不大。
2.2.3 PDEPS-1消化产物游离单糖的分析


图4 PDEPS-1体外模拟消化液消化后PMP衍生化的HPLLCC图
Fig.4 HPLC chromatograms of free monosaccharides from in vitro digestion of PDEPS-1
由图4a、4b可知,B管的唾液与超纯水混合液衍生后并没有单糖的峰,说明唾液自身不含单糖。唾液与多糖混合消化6 h后取样进行衍生,同样没有检测到单糖,这与还原糖含量、分子质量变化的测定结果一致。胃液空白组衍生后出现葡萄糖的峰,说明胃蛋白酶或胃脂肪酶中含一定量的葡萄糖(图4d),这与2.2.1节的测定结果一致。PDEPS-1在胃液中消化6 h后,色谱图中仍然只有一个葡萄糖的峰(图4c),且峰面积没有发生变化,并没有检测到组成PDEPS-1的甘露糖或半乳糖,说明胃液消化后也没有单糖的产生。图4e是肠液衍生后的色谱图,没有任何单糖峰出现,说明肠液中不含单糖。胃液与肠液混合衍生后,胃液中的葡萄糖被稀释,峰变小(图4g)。PDEPS-1在胃肠液中消化6 h后,葡萄糖的峰不变(图4f),说明PDEPS-1在唾液、胃液、胃肠液消化过程中并没有游离单糖的产生。
通过发酵鼎湖鳞伞菌获得鼎湖鳞伞菌发酵液,发酵液经提取与纯化得到纯化组分PDEPS-1。PDEPS-1为一种中性多糖,由甘露糖及半乳糖组成,分子质量为17.95 kD。PDEPS-1在模拟唾液中消化没有还原糖的生成,也没有单糖生成,分子质量不变;在胃液中消化后检测到少量还原糖,分子质量基本不变,没有检测到单糖,PDEPS-1在模拟胃肠液中还原糖含量基本不变,分子质量无明显变化,仍然没有检测到单糖。这些结果表明PDEPS-1在体外模拟的3 种消化液中比较稳定,说明PDEPS-1具有一定的耐消化性。
参考文献:
[1]SCHEPETKINI A,QUINN M T.Botanical polysaccharides:macrophage immunomodulation and therapeutic potential[J].International Immunopharmacology,2006,6(3):317-333.DOI:10.1016/j.intimp.2005.10.005.
[2]LIU Q,TIAN G T,YAN H,et al.Characterization of polysaccharides with antioxidant andhepatoprotective activities from the wild edible mushroom Russulavinosa Lindblad[J].Journal of Agricultural and Food Chemistry,2014,62(35):8858-8866.DOI:10.1021/jf502632c.
[3]YUAN Q X,ZHAO L Y,CHA Q Q,et al.Structural characterization and immunostimulatory activity of a homogeneous polysaccharide from Sinonovacula constricta[J].Journal of Agricultural and Food Chemistry,2015,63(36):7986-7994.DOI:10.1021/acs.jafc.5b03306.
[4]CUMMINGS J H.Short chain fatty acids in the human colon[J].Gut,1981,22(9):763-779.DOI:10.1136/gut.22.9.763.
[5]RAMNANI P,CHITARRARI R,TUOHY K,et al.In vitro fermentation and prebiotic potential of novel low molecular weightpolysaccharides derived from agar and alginate seaweeds[J].Anaerobe,2012,18(1):1-6.DOI:10.1016/j.anaerobe.2011.08.003.
[6]HUGHES S A,SHEWRY P R,LI L,et al.In vitro fermentation by human fecal microflora of wheat arabinoxylans[J].Journal of Agricultural and Food Chemistry,2007,55(11):4589-4595.DOI:10.1021/jf070293g.
[7]HU J L,NIE S P,LI C,et al.In vitro fermentation of polysaccharide from the seeds of Plantago asiatica L.by human fecal microbiota[J].Food Hydrocolloids,2013,33(2):384-392.DOI:10.1016/j.foodhyd.2013.04.006.
[8]CLEARY L J,ANDERSSON R,BRENNAN C S.The behaviour and susceptibility to degradation of highand low molecular weight barley β-glucan in wheat breadduring baking and in vitro digestion[J].Food Chemistry,2007,102(3):889-897.DOI:10.1016/j.foodchem.2006.06.027.
[9]张冠亚,黄晓君,聂少平,等.体外模拟3种消化液对铁皮石斛多糖的消化作用[J].食品科学,2014,35(23):279-283.DOI:10.7506/spkx1002-6630-201423054.
[10]毕志树,李泰辉,郑国杨,等.伞菌目的四个新种[J].真菌学报,1985,4(3):155-161.
[11]KIRK P M,CANNON P F,MINTER D W,et al.Dictionary of the fungi[M].10th ed.Wallingford:Center for Agriculture and Bioscience International,2008:524.
[12]GAN D,ZENG X X,LIU R H,et al.Potential mechanism of myceliumpolysaccharide from Pholiota dinghuensis Bi inregulating the proliferation and apoptosis ofhuman breast cancer MCF-7 cells through p38/MAPK pathway[J].Journal of Functional Foods,2015,12:375-388.DOI:10.1016/j.jff.2014.12.008.
[13]李作美.鼎湖鳞伞液态发酵及其多糖的提取纯化与生物活性的研究[D].南京:南京农业大学,2012:51-62.
[14]GAN D,MA L P,JIANG C X,et al.Production,preliminary characterization and antitumor activity in vitro of polysaccharides from the mycelium of Pholiota dinghuensis Bi[J].Carbohydrate Polymers,2011,84(3):997-1003.DOI:10.1016/j.carbpol.2010.12.058.
[15]DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.DOI:10.1021/ac60111a017.
[16]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.DOI:10.1016/0003-2697(76)90527-3.
[17]BLUMENKRANTZ N,ASBOE-HANSEN G.New method for quantitative determination of uronic acids[J].Analytical Biochemistry,1973,54(2):484-489.DOI:10.1016/0003-2697(73)90377-1.
[18]DOIGSON K S,PRICE R G.A note on the determination of the ester sulfate content of sulfated polysaccharides[J].Biochemistry Journal,1962,84(1):106-110.DOI:10.1042/bj0840106.
[19]MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-428.DOI:10.1021/ac60147a030.
[20]DAI J,WU Y,CHENS W,et al.Sugar compositional determination of polysaccharides from Dunaliella salina by modified RP-HPLC method of precolumn derivatization with 1-phenyl-3-methyl-5-pyrazolone[J].Carbohydrate Polymers,2010,82(3):629-635.DOI:10.1016/j.carbpol.2010.05.029.
[21]STOKES J R,DAVIES G A.Viscoelasticity of human whole saliva collected after acid and mechanical stimulation[J].Biorheology,2007,44(3):141-160.
[22]ASANO I,HAMAGUCHI K,FUJII S,et al.In vitro digestibility and fermentation of mannooligosaccharides from coffee mannan[J].Food Science and Technology Research,2003,9(1):62-66.DOI:10.3136/fstr.9.62.
[23]BLANQUET S,EVELIJIN Z,BEYSSAC E,et al.A dynamic artificial gastrointestinal system for studying the behavior of orally administered drug dosage forms under various physiological conditions[J].Pharmaceutical Research,2004,21(4):585-591.DOI:10.1023/B:PHAM.0000022404.70478.4b.
[24]HU J L,NIE S P,MIN F F,et al.Artificial simulated saliva,gastric and intestinal digestion of polysaccharide from the seeds of Plantago asiatica L.[J].Carbohydrate Polymers,2013,92(2):1143-1150.DOI:10.1016/j.carbpol.2012.10.072.
[25]LI W,WANG Q,CUI S W,et al.Elimination of aggregates of(1→3)(1→4)-β-D-glucan in dilute solutions for light scattering and size exclusion chromatography study[J].Food Hydrocolloids,2006,20(2):361-368.DOI:10.1016/j.foodhyd.2005.03.018.
YUAN Qingxia,WU Fan,QIU Lichun,YE Hong,WANG Xiaoqing,ZENG Xiaoxiong*
(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
Abstract:Pholiota dinghuensis Bi exopolysaccharides(PDEPS-1)was prepared from the fermentation broth of Pholiota dinghuensis Bi through extraction and purification procedures.The changes of PDEPS-1 in simulated digestive juices were investigated by determining the reducing sugar content,molecular weight,and monosaccharide composition before and after digestion using simulated saliva,gastric juice and gastrointestinal juice model in vitro.The results showed that the content of neutral sugar in PDEPS-1 was 97.97%,and PDEPS-1 also contained small amounts of protein,uronic acid,and sulfuric radical.No reducing sugar was detected in PDEPS-1.The average molecular weight of PDEPS-1 was estimated to be 17.95 kD.It was composed of mannose and galactose in a molar ratio of 53.32:6.43.After digestion in saliva,the molecular weight of PDEPS-1 remained unchanged and neither reducing sugar nor monosaccharides were detected,indicating that PDEPS-1 could not be digested in saliva.After digestion,reducing sugar was detected in both simulated gastric juice and gastrointestinal juice,but monosaccharides were not detected.Therefore,the exopolysaccharide PDEPS-1 from Pholiota dinghuensis Bi was resistant to the digestive juices.
Key words:Pholiota dinghuensis Bi; exopolysaccharide; in vitro digestion; reducing sugar; molecular weight; monosaccharide
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)05-0072-06
DOI:10.7506/spkx1002-6630-201605014 1 0.7506/spkx1002-6630-201605014.http://www.spkx.net.cn
*通信作者:曾晓雄(1964—),男,教授,博士,研究方向为食品生物技术。E-mail:zengxx@njau.edu.cn
作者简介:袁清霞(1987—),女,博士研究生,研究方向为生物活性物质与功能分析。E-mail:2013208025@njau.edu.cn
基金项目:江苏高校优势学科建设工程基金项目(PAPD)
收稿日期:2015-10-08