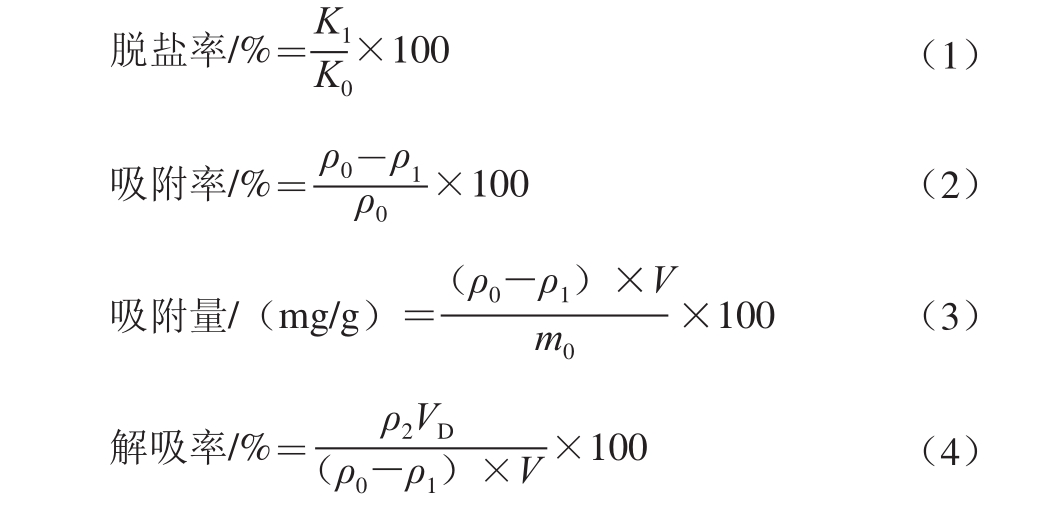
陈丽丽,赵 利*,袁美兰,白春清,冯 飞,王 璐
(江西科技师范大学生命科学学院,国家大宗淡水鱼加工技术研发分中心,江西省生物加工过程重点实验室,江西 南昌 330013)
摘 要:为了脱除草鱼蛋白水解液中的盐,本研究筛选了4 种型号大孔吸附树脂DA201-C、DA201-M、SQT-67 和D002,对水解液中草鱼多肽的吸附能力进行测定,并进行静态吸附和解吸实验。结果表明:大孔吸附树脂DA201-C对草鱼多肽的吸附效果较好,其吸附量随草鱼多肽质量浓度的增加而增加;体积分数75%的乙醇对大孔吸附树脂DA201-C的洗脱效果最佳;DA201-C大孔吸附树脂对水解液脱盐的最佳条件为上样流速0.5 BV/h,上样质量浓度为30 mg/mL,水清洗速率为2 BV/h,洗脱采用体积分数75%的乙醇以2 BV/h的流速洗脱,在此条件下大孔吸附树脂DA201-C对水解液的脱盐率达97.17%。
关键词:草鱼;蛋白水解液;大孔吸附树脂;吸附;解吸
引文格式:
陈丽丽,赵利,袁美兰,等.大孔吸附树脂对草鱼蛋白水解液脱盐的作用[J].食品科学,2016,37(5):84-88.DOI:10.7506/
spkx1002-6630-201605016.http://www.spkx.net.cn
CHEN Lili,ZHAO Li,YUAN Meilan,et al.Desalination of grass carp protein hydrolysate using macroporous adsorption resin[J].Food Science,2016,37(5):84-88.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605016.http://www.spkx.net.cn
鱼蛋白水解物(fish protein hydrolysate,FPH)是鱼蛋白经过蛋白酶水解而得到的,它同时具有鱼蛋白原有的一些优点,例如氨基酸比例平衡、必需氨基酸含量高、赖氨酸含量丰富和消化吸收好等,还具有多肽的一些特殊功能特性及相关生物活性。
研究证明小分子肽相比于大分子蛋白和游离氨基酸吸收性更好[1],同时FPH还具有特殊的生理活性,例如抗氧化、抗疲劳和增强免疫力等,因此越来越受到人们的广泛关注。FPH有蛋白质含量高、营养价值丰富、运输贮存方便快捷的优势,是内陆和山区居民良好的蛋白质来源[2]。早在20世纪,日本已经开发出适合高血压患者使用的低分子鱼肽[3]。国外对鱼蛋白的研究利用主要集中在近海鱼类方面[4-6],国内则主要研究低值海鱼和鱼下脚料酶法水解产物的功能特性、营养评价和风味强化等。酶法水解鱼蛋白制备的肽具有良好的理化性质和功能性质[7-8]。但是草鱼(Ctenopharyngodon idellus)蛋白在酶法水解制备草鱼多肽时,反应体系的pH值会随着水解度的增加而逐步降低,所以反应过程中需要不断用碱来维持反应体系pH值恒定,从而导致样品中存留大量无机盐,对草鱼多肽的口感、纯度及活性产生不良影响,所以必须对草鱼蛋白水解液进行脱盐处理。目前对生物活性物质的脱盐方法主要有透析、超滤、纳滤等。但这些方法对小分子物质脱盐效果不佳或无法实现。尽管电渗析可以用于小分子物质脱盐,但回收率不高,能源消耗较大[9]。
生物活性物质较常用的脱盐方法有离子交换树脂法和大孔吸附树脂法。大孔树脂吸附的作用主要是通过分子间疏水相互作用对分子进行吸附,因此大孔吸附树脂不仅可以脱盐还可以保留水解物中的疏水性肽段。大孔吸附树脂是由苯乙烯、二乙烯苯、二甲丙烯酸酯等聚合而成的网状孔穴结构,为非离子的高分子吸附剂,具有成本低、选择性好、吸附容量大、回收率高、容易再生等特点[10-11]。大孔吸附树脂按其极性大小和所选用的单体分子结构不同,可分为非极性、中极性和极性三类。大孔吸附树脂具有吸附性强、解吸附容易、机械强度好、流体阻力小、条件温和、设备简单等优点,特别适用于从水溶液中分离低极性或非极性的化合物[12]。
本实验研究大孔吸附树脂对草鱼蛋白水解液的最佳脱盐工艺条件,并在此基础上对不同水解度的草鱼多肽进行脱盐,为后续草鱼多肽的开发利用提供有利依据。
1.1材料与试剂
草鱼,购于南昌市乐买佳超市。
Alcalase碱性蛋白酶 丹麦Novozymes公司;大孔吸附树脂(DA201-C、DA201-M、SQT-67、D002) 江苏苏青水处理工程集团有限公司;95%食用乙醇 南昌市天邦化工有限责任公司;牛血清白蛋白 上海蓝季科技发展有限公司;其他试剂均为分析纯。
1.2仪器与设备
DELTA-320精密pH计 瑞士梅特勒-托利多公司;HZ-8812S多用途水浴恒温振荡器 江苏华利达实验设备公司;TDL-5A离心机 上海菲恰尔分析仪器有限公司;大孔吸附树脂层析柱系统 上海沪西分析仪器厂有限公司;JJ-2高速组织捣碎机 上海标本模型厂;层析柱 上海华美实验仪器厂;HB-402微波耦合酶反应器 江南大学;S212恒速搅拌器 上海申顺生物科技有限公司。
1.3方法
1.3.1 多肽质量浓度和水解度的测定
蛋白质含量测定:采用Folin-酚法[13];水解度测定:pH-Stat法并参照袁斌等[14]的方法。
1.3.2 草鱼水解液的制备[15]
称取已绞碎的鱼肉300 g于酶反应器中,加入4 500 mL水,开启搅拌器搅拌均匀(200 r/min),调节水浴温度为55 ℃,1 mol/L NaOH溶液调节pH值为9.0,待底物温度上升至设定温度55 ℃时,加入质量分数为1.8% 的Alcalase碱性蛋白酶进行反应,反应过程中用1 mol/L NaOH溶液维持反应体系pH 9.0恒定。酶解3 h后95 ℃条件下灭酶5 min。待水解液冷却至25 ℃后加入1 mol/L HCl,直至体系pH值为7.0,5 000 r/min离心20 min后,取上清液,上清液即为草鱼水解液。
1.3.3 大孔吸附树脂的预处理
将不同型号大孔吸附树脂浸泡在无水乙醇中,使用时取适量用无水乙醇洗至220 nm波长处无吸收峰,再用去离子水充分润洗,50 ℃条件下真空干燥备用。
1.3.4 大孔吸附树脂的筛选
取250 mL锥形瓶若干,分别加入不同型号经过预处理的树脂10 g,用无水乙醇充分溶胀,然后加入去离子水洗净乙醇。再向其中加入100 mL质量浓度为30 mg/mL的草鱼蛋白水解液[16]。将锥形瓶放入水浴恒温振荡器中,120 r/min室温振荡12 h,使树脂与料液充分接触。振荡结束后静置30 min,测定上清液中草鱼多肽的质量浓度,并计算不同型号的大孔吸附树脂对草鱼蛋白水解液的吸附率和吸附量。脱盐率、吸附率、吸附量和解吸率的计算方法分别见下式。
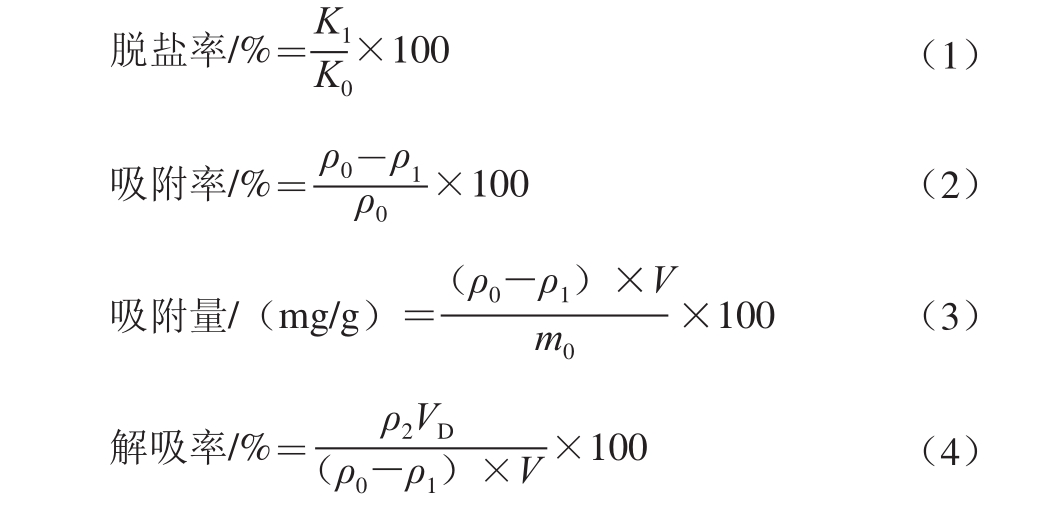
式中:Κ1为吸附后溶液的电导率/(øS/cm);Κ0为原液电导率/(øS/cm);ρ0为草鱼蛋白水解液的起始质量浓度/(mg/mL);ρ1为吸附平衡时草鱼蛋白水解液的质量浓度/(mg/mL);ρ2为解吸液质量浓度/(mg/mL);V为溶液的体积/mL;m0为干树脂质量/g;VD为洗脱液体积/mL。
1.3.5 大孔吸附树脂DA201-C的静态吸附与解吸实验
取250 mL锥形瓶若干,分别加入DA201-C大孔吸附树脂10 g,用无水乙醇充分溶胀,然后加入去离子水洗净乙醇。接着向锥形瓶分别加入质量浓度为30、24、18、12、6 mg/mL的草鱼蛋白水解液100 mL。将锥形瓶放入水浴恒温振荡器中,120 r/min室温振荡12 h,使树脂与料液充分接触。振荡结束后静置30 min,测定上清液中草鱼多肽质量浓度,并计算DA201-C大孔吸附树脂对草鱼蛋白水解液对多肽的吸附量。
将在质量浓度为30 mg/mL条件下已经达到吸附平衡的DA201-C大孔吸附树脂10 g放入250 mL锥形瓶中,分别用体积分数15%、35%、55%、75%和95%的乙醇200 mL进行洗脱,测定解吸率。
1.3.6 DA201-C大孔吸附树脂动态吸附和解吸实验
1.3.6.1 不同流速对DA201-C大孔吸附树脂吸附性能的影响
经过预处理的DA201-C大孔吸附树脂用无水乙醇充分溶胀后装入2.5 cm×60 cm层析柱,用质量浓度为24 mg/mL的草鱼蛋白水解液分别以0.5、1.0、2.0 BV/h的流速流经层析柱,用紫外检测仪检测流出液在220 nm波长处的吸光度,以A220 nm=0.01为穿透点[16],得到不同流速时草鱼多肽溶液的穿透体积,收集洗脱峰,旋转蒸发浓缩,冷冻干燥后得到脱盐草鱼多肽。
1.3.6.2 不同样品质量浓度对DA201-C大孔吸附树脂吸附性能的影响
将质量浓度分别为7.5、15、30 mg/mL的草鱼多肽溶液以0.5 BV/h的流速流经层析柱,同样地,用紫外检测仪检测流出液在220 nm波长处的吸光度,以A220 nm=0.01为穿透点[16],得到不同质量浓度时草鱼多肽溶液的穿透体积和穿透点动态吸附量。
1.3.6.3 DA201-C大孔吸附树脂的动态解吸
将质量浓度为30 mg/mL的草鱼多肽溶液以0.5 BV/h的流速上样,到达穿透点后停止上样。用去离子水分别以1、2、4 BV/h的流速洗涤层析柱,洗脱液每5 mL收集1 管,测定其电导率,直至洗脱液的电导率与去离子水相当。合并清洗液测定多肽质量浓度,计算不同清洗速率下的草鱼多肽损失率。水清洗结束后用75%的乙醇进行洗脱,以2.0 BV/h的流速流经层析柱,每5 mL收集1 管,直到其吸光度A220 nm<0.01为止,绘制动态解吸曲线,并计算草鱼多肽的总损失率。
2.1大孔吸附树脂的初筛选
表1 不同型号的树脂对草鱼多肽吸附性能
Table 1 Adsorption capacity of different resins towards grass carp peptides
由表1可知,对草鱼多肽吸附性能最好的大孔吸附树脂为DA201-C,吸附率达到了62.7%。大孔吸附树脂饱和吸附能力受大孔吸附树脂的比表面积和选择吸附性等因素的影响[17-18],DA201-C树脂是非极性树脂,是由偶极矩很小的单体聚合制得,不带任何功能基团,孔表的疏水性较强,可通过与多肽内的疏水部分的作用吸附溶液中的有机物[19]。所以DA201-C大孔吸附树脂的良好吸附性能也可能是由于其具有较大的比表面积(1 200~1 400 m2/g)和对草鱼多肽较好的选择性。
2.2大孔吸附树脂DA201-C的静态吸附与解吸实验
2.2.1 大孔吸附树脂DA201-C对草鱼多肽的静态吸附动力学曲线
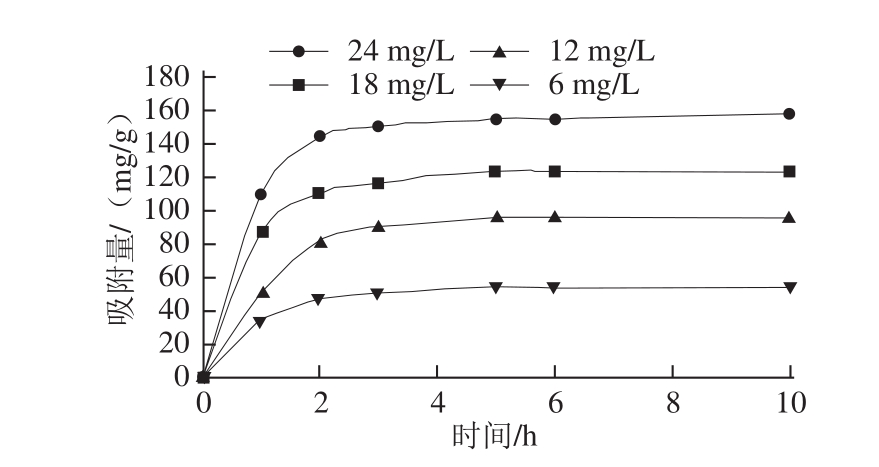
图1 25 ℃条件下大孔吸附树脂DA201-C对草鱼多肽的静态吸附动力学曲线
Fig.1 Adsorption kinetics of DA201-C for grass carp peptides at 25 ℃
由图1可知,大孔吸附树脂DA201-C对草鱼多肽的吸附在2 h之前上升较快,尤其在1 h之前多肽吸附量增加非常迅速,而2 h之后曲线趋于平缓,这说明此时大孔吸附树脂对草鱼多肽的吸收已经达到动态平衡。草鱼多肽的初始质量浓度对DA201-C大孔吸附树脂吸附平衡时的吸附量有较大的影响,质量浓度越大,平衡时的吸附量就越大。
2.2.2 大孔吸附树脂DA201-C的静态解吸

图2 不同体积分数乙醇对草鱼多肽解吸性能的影响
Fig.2 Desorption efficiencies of different concentrations of ethanol for grass carp peptides
大孔吸附树脂对化合物的吸附作用主要是基于化合物的疏水基团与非极性吸附剂之间的范德华引力,因此吸附树脂对分子的吸附作用力微弱,只要改变体系的亲水与疏水平衡,就可以引起吸附的增加或解吸。解吸附剂是以最能溶解吸附质为原则,但要求沸点低、易于蒸馏回收,一般用溶剂的溶解度阐述来预测,对于非极性树脂,洗脱剂溶解度愈小,洗脱能力愈强[16],乙醇是最常用的大孔吸附树脂的解吸剂,而且安全无毒。由图2可知,解吸率随着乙醇体积分数的增加而增加,体积分数75%乙醇的解吸率最高,达到78.85%,草鱼多肽在体积分数95%的乙醇溶液中的溶解度降低则可能是该体积分数下乙醇溶液解吸率降低[20]。此外,由于不同体积分数的乙醇的极性不同,与不同肽段亲和力不一样,所以不同乙醇体积分数对草鱼多肽的洗脱效果不同。
2.3大孔吸附树脂DA201-C的动态吸附
2.3.1 不同上样流速对DA201-C大孔吸附树脂吸附性能的影响

图3 不同上样流速时草鱼多肽的穿透曲线
Fig.3 Breakthrough curves at different feed flow rates
由图3可知,随着上样流速的增加,流出液穿透点的通液量逐步提前。上样流速从2.0 BV/h降低到0.5 BV/h时,穿透点通液量增加了140%。综上所述,草鱼多肽的上样流速确定为0.5 BV/h。大孔吸附树脂DA201-C属于非极性吸附剂,孔隙的表面疏水性较强,它最适合在极性溶剂中吸附非极性物质,其作用力主要是范德华引力[21]。大孔树脂吸附过程一般需要经历3 个阶段:液膜扩散、颗粒内扩散、吸附反应,整个过程可能是一步或多步控制[22]。吸附反应是在一定的温度下进行的,当溶剂与树脂接触时,溶液中的吸附质被树脂吸附,经过足够长的时间,吸附质在两相中的分配达到一个定值,即吸附平衡状态[23](实际上是一个动态平衡的过程)。所以过快的上样速率会使多肽溶液在还没有完成液膜扩散、颗粒内扩散时就流出层析柱,树脂的吸附量就会下降。但是上样速率过低,上样时间就会随之延长。
2.3.2 不同样品质量浓度对DA201-C大孔吸附树脂吸附性能的影响
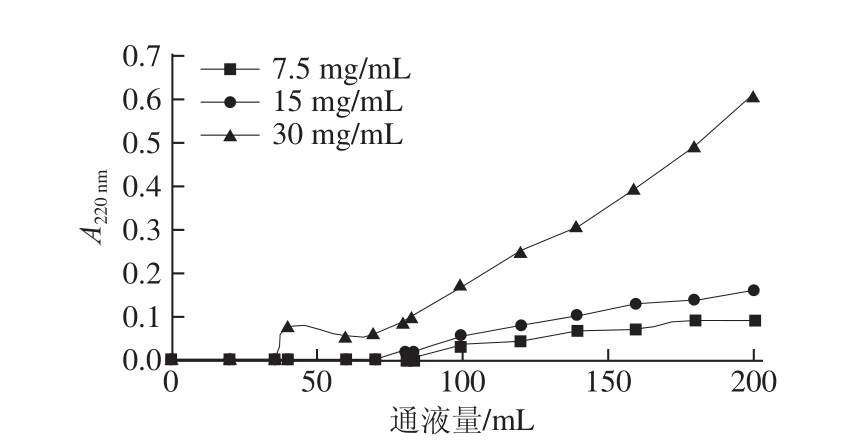
图4 不同样品质量浓度时的草鱼多肽穿透曲线
Fig.4 Breakthrough curves at different sample concentrations
在大孔吸附树脂DA201-C对于草鱼多肽的吸附过程中,吸附量随着上样质量浓度的增大而增大,吸附量与底物质量浓度的关系符合Frendich和Langmur经典吸附方程[24-27]。在上样流速为0.5 BV/h的条件下,用紫外检测仪检测流出液在220 nm波长处的吸光度,以A220 nm=0.01为穿透点[16],得到不同质量浓度时草鱼多肽溶液的穿透体积和穿透点动态吸附量。在上样流速为0.5 BV/h的条件下,DA201-C大孔吸附树脂对不同质量浓度草鱼多肽的穿透曲线见图4,随着上样质量浓度的提高,流出液的穿透点通液量迅速减小。随着上样质量浓度的增大,DA201-C大孔吸附树脂对草鱼多肽的吸附量从31.1 mg/g上升到52.5 mg/g,穿透点通液量从83 mL下降到35 mL。综合考虑吸附量与平衡时间,选择30 mg/mL为最佳上样质量浓度。
2.4大孔吸附树脂DA201-C的动态解吸
2.4.1 大孔吸附树脂DA201-C的脱盐率

图5 大孔吸附树脂DA201-C对草鱼多肽的脱盐作用
Fig.5 Desalination efficiency of DA201-C for grass carp peptides
由图5可知,用去离子水洗涤层析柱时,洗脱液的电导率先升高后降低,洗脱液体积达到75 mL左右时出现一个洗脱峰,在洗脱体积达到100 mL以后,电导率趋于平稳。此时草鱼多肽溶液中的盐分已几乎被水洗脱出来,根据公式(1)计算得出脱盐率为97.17%,未被吸附的多肽含量很少。不同水清洗流速下,电导率随水清洗液体积的变化曲线基本一致。
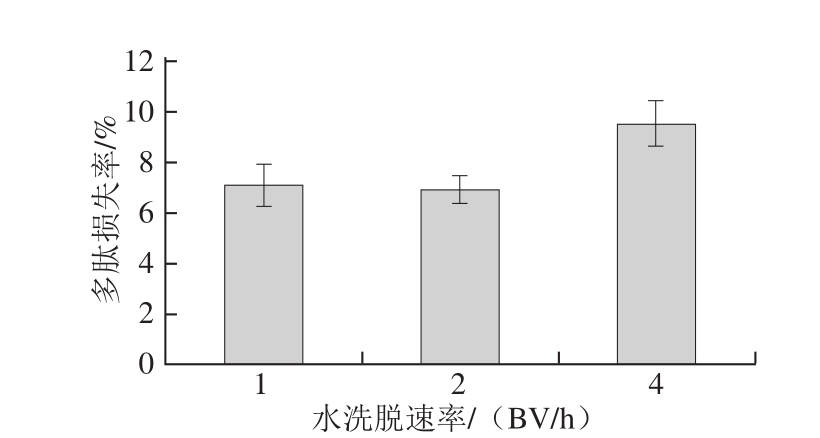
图6 不同水洗脱速率条件下草鱼多肽的损失率
Fig.6 Effect of different water flow rates on peptide loss rate
孙旭等[28]研究了不同体积分数的乙醇溶液对玉米多肽的静态解吸效果,结果表明水对玉米多肽的解吸率达到了9.42%。由图6可知,水清洗速率分别为1、2、4 BV/h时多肽的损失率分别为7.12%、6.93%、9.51%。所以选择水清洗速率最佳条件为2 BV/h。因为在此流速下,由上文可知,计算得出脱盐率为97.17%,多肽的损失率也最小,为6.93%。主要是因为水的流速会影响溶质向树脂表面扩散,流速太大或太小均会增加草鱼多肽的损失率。
2.4.2 大孔吸附树脂DA201-C的解吸率
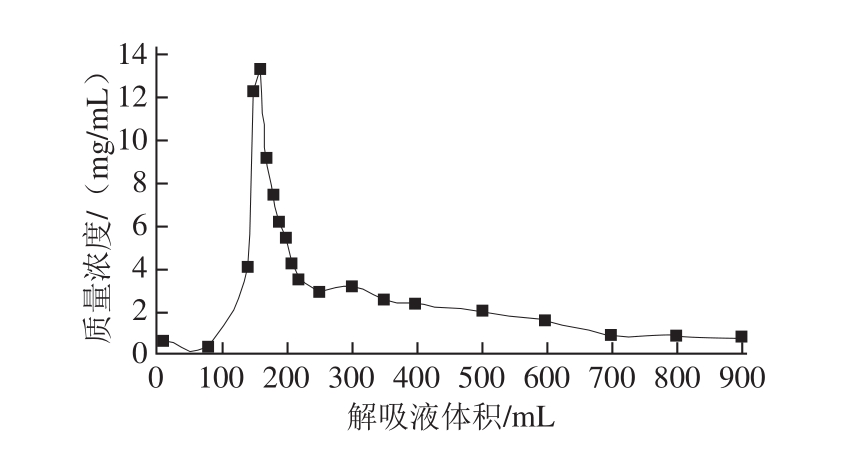
图 77 7755%乙醇对大孔吸附树脂DA201-C动态解吸曲线
Fig.7 Dynamic desorption curve of grass carp peptides from DA201-C(using 75% ethanol as eluent)
[5]RAVALLEC-PLÉ R,CHARLOTC,PIRES C,et al.The presence of bioactive peptides in hydrolysates prepared from processing waste of sardine(Sardina pilchardus)[J].Journal of the Science of Food and Agriculture,2001,81(11):1120-1125.DOI:10.1002/jsfa.921.
[6]BENJAKUL S,MORRISSEY M T.Protein hydrolysates from Pacific whiting solid wastes[J].Journal of Agricultural and Food Chemistry,1997,45(1):3423-3430.DOI:10.1021/jf970294g.
[7]KLOMPONG V,BENJAKUL S,KANTACHOTE D,et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(Selaroides leptolepis)as influenced by the degree of hydrolysis and enzyme type[J].Food Chemistry,2007,102(4):1317-1327.DOI:10.1016/j.foodchem.2006.07.016.
[8]SAITO M,KIYOSE C,HIGUCHI T,et al.Effect of collagen hydrolysates from salmon and trout skins on the lipid profile in rats[J].Journal of Agricultural and Food Chemistry,2009,57(21):10477-10482.DOI:10.1021/jf902355m.
[9]TANG Z G,ZHOU R Q,DUAN Z T.Adsorption and desorption behaviour of taurine on macroporous adsorption resins[J].Journal of Chemical Technology and Biotechnology,2001,76(7):752-756.
[10]董玉秀,宋珍鹏,崔素娟.对休止角测定方法的讨论[J].中国药科大学学报,2008,39(4):312-317.DOI:10.3321/j.issn:1000-5048.2008.04.005.
[11]邓波,史苏华,熊华,等.响应面分析法优化中链甘油三酯微胶囊的制备[J].中国油脂,2011,36(2):30-33.
[12]刘光喜.中药有效成分的分离纯化技术研究概况[J].中医药导报,2008,14(7):118-120.DOI:10.3969/j.issn.1672-951X.2008.07.067.
[13]OWUSU-APENTEN R K.Food protein analysis:quantitative effects on processing[M].New York:Marcel Dekker Inc.,2002:70-71.
[14]袁斌,吕桂善,刘小玲.蛋白质水解度的简易测定方法[J].广西农业生物科学,2002,21(2):113-115.
[15]石岭,赵利,袁美兰,等.响应面法优化碱性蛋白酶酶解草鱼蛋白质[J].食品科学,2014,35(4):26-29.DOI:10.7506/spkx1002-6630-201404006.
[16]宫霞,赵骏.大孔吸附树脂对酪蛋白酶解液的脱盐作用研究[J].食品科学,2006,27(11):301-303.DOI:10.3321/j.issn:1002-6630.2006.11.069.
[17]邓劲光,胡熙恩,朱永.大孔吸附树脂对氢化可的松的吸附与洗脱性能研究[J].离子交换与吸附,2000,16(2):134-139.DOI:10.3321/j.issn:1001-5493.2000.02.006.
[18]MILLS G C.Removal of salts from aromatic amino acids,their metabolites and related compounds using an XAD-4 resin[J].Journal of Chromatography A,1986,335(1):193-200.DOI:10.1016/S0021-9673(01)97315-7.
[19]范文,软长青,王鹤霖.DA201-C大孔吸附树脂对腐乳多肽脱盐作用的研究[J].中国粮油学报,2011,26(8):105-108.
[20]陈季旺,孙勤,夏文水.鱼降压肽的大孔吸附树脂脱盐及理化性质[J].食品科学,2009,30(24):158-162.DOI:10.3321/j.issn:1002-6630.2009.24.033.
[21]鲁坚.大孔吸附树脂分离何首乌中二苯乙烯苷的工艺研究[D].合肥:合肥工业大学,2006:9.DOI:10.7666/d.y870717.
[22]李稳宏,唐璇,李新生,等.黄姜黄色素在大孔树脂上的吸附动力学研究[J].离子交换与吸附,2008,24(6):526-534.
[23]周英新.基于黄酮类分子构型的大孔树脂吸附动力学模型研究[D].北京:北京中医药大学,2012:15.
[24]GAO B J,GAO Y C,LI Y B.Preparation and chelation adsorption property of composite chelating material poly(amidoxime)/SiO2towards heavy metal ions[J].Chemical Engineering Journal,2010,158(3):542-549.
[25]WU F C,TSENG R L,HU C C.Comparisons of pore properties and adsorption performance of KOH-activated and steam-activated carbons[J].Microporous and Mesoporous Materials,2005,80(Suppl 1/3):95-106.DOI:10.1016/j.micromeso.2004.12.005.
[26]JUANG R S,WU F C,TSENG R L.Solute adsorption and enzyme immobilization on chitosan beads prepared from shrimp shell wastes[J].Bioresource Technology,2001,80(3):187-193.DOI:10.1016/S0960-8524(01)00090-6.
[27]PICCIN J S,VIEIRA M L G,GONCALVES J O.Adsorption of FD&C Red No.40 by chitosan:isotherms analysis[J].Journal of Food Engineering,2009,95(1):16-20.DOI:10.1016/j.jfoodeng.2009.03.017.
[28]孙旭,肖志刚,马秀婷,等.大孔吸附树脂对玉米蛋白水解液脱盐效果的研究[J].食品与机械,2012,28(6):43-46.DOI:10.3969/j.issn.1003-5788.2012.06.010.
由图7可知,随着解吸液体积的增加,草鱼多肽质量浓度先增加后减小,大约在160 mL时出现洗脱峰后曲线趋于平缓。由此可见,草鱼多肽的部分组分不能很好地溶解在75%乙醇中,无法完全洗脱,这可能是导致解吸曲线拖尾的原因。为了尽量避免多肽的损失,以便后续测定其活性,将洗脱体积选择为200 mL,这样既能保证草鱼多肽的回收率,也能减少解吸液的体积。
比较不同大孔吸附树脂对草鱼多肽的吸附能力,确定大孔吸附树脂DA201-C对草鱼多肽的吸附效果最佳;大孔吸附树脂DA201-C的吸附量随草鱼多肽的质量浓度增加而增加;75%乙醇对吸附树脂的洗脱效果最佳。
DA201-C大孔吸附树脂脱盐的最佳条件为:上样流速0.5 BV/h,上样质量浓度为30 mg/mL,水清洗速率为2 BV/h,洗脱采用75%乙醇以2 BV/h的流速洗脱。在此条件下大孔吸附树脂DA201-C对酶解液的脱盐率达97.17%。
参考文献:
[1]NESSE K O,NAGALAKSHMI A P,MARIMUTHUP,et al.Efficacy of a fish protein hydrolysate in malnourished children[J].Indian Journal of Clinical Bio-chemistry,2011,26(4):360-365.
[2]夏松养,奚印慈,谢超.水产食品加工学[M].北京:化学工业出版社,2008:199-236.
[3]李维.生物活性肽的研究进展[J].中国畜牧兽医.2012,39(10):105-107.DOI:10.3969/j.issn.1671-7236.2012.10.025.
[4]冯杰龙,林炜铁,徐晓飞,等.生物活性肽及其蛋白酶水解法制备探索[J].广州食品工业科技,2002,18(3):36-38.DOI:10.3969/j.issn.1673-9078.2002.03.015.
CHEN Lili,ZHAO Li*,YUAN Meilan,BAI Chunqing,FENG Fei,WANG Lu
(Jiangxi Province Key Laboratory for Bioprocess Processing,National R&D Branch Center for Freshwater Fish Processing,College of Life Science,Jiangxi Science and Technology Normal University,Nanchang 330013,China)
Abstract:In order to remove salt from grass carp protein hydrolysate,four macroporous adsorption resins including DA201-C,DA201-M,SQT-67 and D002 were selected for the highest adsorption capacity for grass carp peptides through static adsorption and desorption experiments.The results showed that DA201-C had the best adsorption efficiency for grass carp peptides.Its adsorption quantity increased with increasing concentration of grass carp peptides.Seventy-five percent ethanol revealed the best elution efficiency for DA201-C.The optimal conditions for the desalination of grass carp peptides with DA201-C were determined as follows:the sample at 30 mg/mL was passed through the column at a flow rate 0.5 BV/h,and then the column was washed with at a flow rate of 2 BV/h and eluted with 75% ethanol at 2 BV/h.Under these conditions,the desalination efficiency of grass carp peptides was 97.17%.
Key words:grass carp; protein hydrolysate; macroporous adsorption resin; adsorption; desorption
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2016)05-0084-05
DOI:10.7506/spkx1002-6630-201605016
*通信作者:赵利(1967—),女,教授,博士,研究方向为食品化学。E-mail:lizhao618@hotmail.com
作者简介:陈丽丽(1986—),女,助教,硕士,研究方向为食品化学。E-mail:328181539@qq.com
基金项目:江西省大宗淡水鱼产业技术体系项目(JXARS-04-赣中片);江西科技师范大学校级重点项目(2014XJZD005);江西省科技厅科技支撑重大项目(20152ACF60008)
收稿日期:2015-05-04