郭利平1,荣 婧2,杨 宁3,郭善广2
(1.广东轻工职业技术学院轻化工程系,广东 广州 510300;2.华南农业大学食品学院,广东 广州 510642;3.广东省对外科技交流中心,广东 广州 510033)
摘 要:将罗非鱼的酶解产物及其超滤组分(<5 kD酶解肽)加入罗非鱼鱼糜制品中,研究其在冷藏(0~4 ℃)期间对油脂和蛋白质的抗氧化效果。结果表明:酶解产物及超滤组分均可以改善鱼糜的色泽(P<0.05),尤其是超滤组分的效果接近于一定剂量的VC;酶解产物对鱼糜中的油脂、蛋白质均表现出较强的抗氧化能力(P<0.05),其中超滤组分优于酶解液;酶解肽可以有效地保持鱼糜在冷藏期间的品质,超滤分离富集的<5 kD的小分子肽显示出更好的抗氧化效果。
关键词:鱼糜;酶解肽;蛋白质氧化;超滤;抗氧化活性
引文格式:
郭利平,荣婧,杨宁,等.罗非鱼酶解肽抑制冷藏鱼糜中油脂和蛋白质氧化能力[J].食品科学,2016,37(5):89-93.
GUO Liping,RONG Jing,YANG Ning,et al.Peptides derived from enzymatic hydrolysis of tilapia viscera inhibit lipid and protein oxidation in refrigerated surimi[J].Food Science,2016,37(5):89-93.(in Chinese with English abstract)
罗非鱼(tilapia)肉质丰富细嫩、无小刺、容易分割加工,是公认的优质蛋白质来源。有研究表明[1],罗非鱼鱼肉蛋白具有较好的凝胶化能力和耐劣化特性,优于鲢鱼、鳙鱼和团头鲂鱼的凝胶特性,具有良好的鱼糜加工特性,是加工鱼糜的一种重要的原料。
鱼糜制品脂肪及油脂含量较多,且包含较多的不饱和脂肪酸;在加工贮藏过程中,鱼糜脂肪和油脂容易氧化变质,脂肪氧化会进一步引起蛋白质的氧化和损伤,甚至产生一些有毒有害复合物[2]。为防止脂肪和蛋白质氧化,延长保质期,一般需要加入适量的抗氧化剂如特丁基对苯二酚、丁基羟基茴香醚、2,6-二叔丁基-4-甲基苯酚、没食子酸丙酯等。随着消费者安全健康饮食意识的提升,人们对于食物品质的要求有所提高,并开始关注添加剂的使用。人工合成的抗氧化剂由于其安全性问题使其应用受到限制,而一些具有抗氧化性的天然物质或其提取物如香辛料[3]、酚类物质[4-6]及蛋白水解物[7-8]逐渐引起了人们更多的关注和研究。
鱼类产品作为主要优质蛋白质来源,其酶解产物富含氨基酸、肽与核酸等营养物质,而且具有较强的抗氧化活性,近年来成为深度开发的研究热点之一[9]。本实验将罗非鱼的酶解产物及其超滤组分加入罗非鱼糜中,定期采样测定鱼糜的色度、pH值、硫代巴比妥酸反应(thiobarbituric acid reactive substances,TBARS)值、羰基价并通过感官评定来研究水解肽类对鱼糜油脂和蛋白质氧化的抑制效果。
1.1材料与试剂
新鲜罗非鱼、食用盐均购自广州市天河区长湴农贸市场。罗非鱼内脏酶解肽制备及超滤分级分离依照本课题组的前期工作[10]。
二硝基苯肼 天津化学试剂厂;硫代巴比妥酸天津市北联精细化学品开发有限公司;盐酸胍 上海实验试剂有限公司;抗坏血酸 国药集团化学试剂有限公司。以上试剂均为分析纯。
1.2仪器与设备
5804R冷冻高速离心机 德国艾本德仪器公司;UV-1800紫外-可见分光光度计 日本岛津公司;pHS-3C 型精密pH计 上海虹益仪器仪表有限公司;Labscale小型切向流超滤系统 密理博中国有限公司;SP62色差仪 美国X-rite公司;DS-1电动组织捣碎机上海精科实业有限公司。
1.3方法
1.3.1 鱼糜的制作及贮藏处理
新鲜罗非鱼宰杀后去骨取肉,放入高速组织捣碎机中捣碎,添加质量分数1.0%的食盐即为鱼糜样品。取4 组等量的鱼糜,第1组加入等体积蒸馏水作为空白对照组;第2组加罗非鱼内脏蛋白酶解液,其中肽含量为0.5%(以蛋白质质量计);第3组加超滤后分子质量<5 kD的罗非鱼内脏蛋白酶解液,含量为0.5%(以蛋白质质量计);第4组加入抗坏血酸(VC)溶液,添加量为0.5 mg/g。酶解液与VC的添加量以本课题组前期水解肽的抗氧化能力研究[10]为参考依据。混合均匀后将每组分成6 份,塑料袋密封后4 ℃条件下保存,分别在第0、2、4、6、8、10天测定样品的色泽、pH值、TBARS值、羰基含量,并进行感官评定。
1.3.2 理化指标测定
1.3.2.1 色差的测定
样品打开包装30 min后用色差仪测定肉样的L*、 a*、b*值。仪器经自检及调零、黑板、白板校正后,取一定量的肉馅,将其放入比色皿中,并将测试探头放在比色皿上进行测定。每个试样随机取5 点测定,取平均值。L*表示明度,a*和b*表示色度,a*正值表示偏红,负值表示偏绿;b*正值表示偏黄,负值表示片蓝。白度(W)值计算公式如下[11]。
1.3.2.2 pH值的测定
按照GB/T 9695.5—2008《肉与肉制品 pH测定》方法进行测定。
1.3.2.3 TBARS值的测定
参照Sinnhuber等[12]的方法。取0.3 g待测样品加入3 mL 质量分数1% TBARS溶液,再加入17 mL质量分数7.5%三氯乙酸(trichloroacetic acid,TCA)溶液,混匀后,在沸水浴中反应30 min,自然冷却后,取5 mL上述样品溶液加入等体积的氯仿,3 000×g离心10 min,于532 nm波长处测定吸光度。TBARS值以每千克脂质氧化样品溶液含有丙二醛的毫克数表示。计算公式如下:
式中:A为吸光度;V为样品体积/mL;M为丙二醛的摩尔质量72.063 g/mol;ε为摩尔吸光系数,此处为156 000 L/(mol·cm);l为光程/cm;m为肉样质量/g。
1.3.2.4 羰基含量的测定
参照Fagan[13]和Oliver[14]等的方法。取3.0 g鱼糜样品与15 mL磷酸盐缓冲液(pH 7.4)混合后冰浴均质,过滤,取0.5 mL样品溶液,加入1 mL质量分数10% TCA在4 ℃、5 000×g离心10 min,沉淀部分即为提取的蛋白质。样品组加入1 mL 10 mmol/L二硝基苯肼(用2 mol/L HCl溶液溶解),室温下暗处静止1 h(每15 min涡旋振荡一次),添加1 mL质量分数20% TCA,4 ℃、10 000×g离心5 min,弃上清,用1 mL乙酸乙酯-乙醇(1∶1,V/V,现配现用)洗涤沉淀3 次,再重新溶解沉淀在3 mL的6 mol/L盐酸胍溶液中(用20 mmol/L磷酸钾溶解),在37 ℃条件下充分溶解15 min,5 000×g离心3 min,除去不溶解物质,清液在370 nm波长处测定吸光度。空白对照组用1 mL 2 mol/L HCl代替二硝基苯肼,操作同上。羰基含量计算公式如下。
式中:As为测定管吸光度;A0为空白管吸光度;l为比色管光径/cm;ρ为样品蛋白质质量浓度/(mg/L)。
1.3.3 感官评定
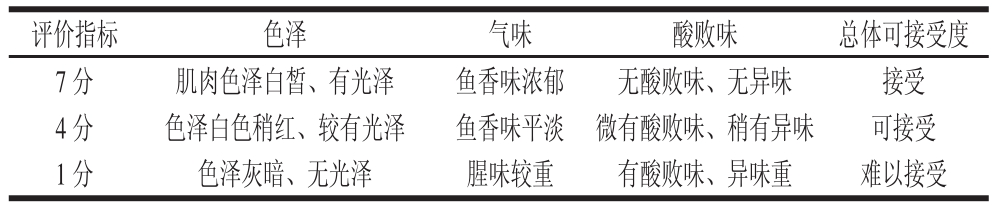
参照文献[15]方法,并略微改动。选定8 位实验人员,对鱼糜进行色泽、气味、酸败味和总体可接受度四方面的感官评价,感官评价标准见表1。
表1 鱼糜感官评定标准
Table 1 Standards for the sensory evaluation of surimi
2.1酶解产物对罗非鱼鱼糜色泽的影响
在鲜肉贮藏期间,表面的肌红蛋白以3 种形态存在(肌红蛋白、氧合肌红蛋白、氧化肌红蛋白)且可以相互转化,导致肉色的变化[16]。在肉品生产中可以通过添加抗氧化剂、发色剂和包装的方法来保持肉品的色泽。这些方法一般都是通过阻止色素氧化或促进某一种色素的形成来体现的。也有研究报道,在牛肉中脂肪氧化和色素氧化是相伴而生的[17],而且脂肪氧化是色素氧化的促进因子。冻藏、蛋白质变性则会影响鱼糜凝胶的色泽[18],鱼糜中变性蛋白质、氧化油脂和氧化肌红蛋白的累积导致褐变发生。由图1可知,在贮藏期内,添加VC和酶解产物样品的白度值均高于空白对照组样品。其中,添加了VC和<5 kD酶解肽的鱼糜样品白度值无显著差异(P>0.05),色泽保持较好,均显著优于添加酶解原液鱼糜的色泽(P<0.05);酶解液鱼糜白度值与空白对照组无显著性差异(P>0.05)。这一结果与骨蛋白[19]、鲤鱼蛋白[20]酶解物的相关研究结果一致,很可能是因为酶解肽的抗氧化能力抑制了鱼糜色泽的劣变。前期的研究结果[10]也表明罗非鱼内脏的酶解液具有较强的抗氧化能力,尤其是超滤后<5 kD的小分子肽的抗氧化能力更接近VC。
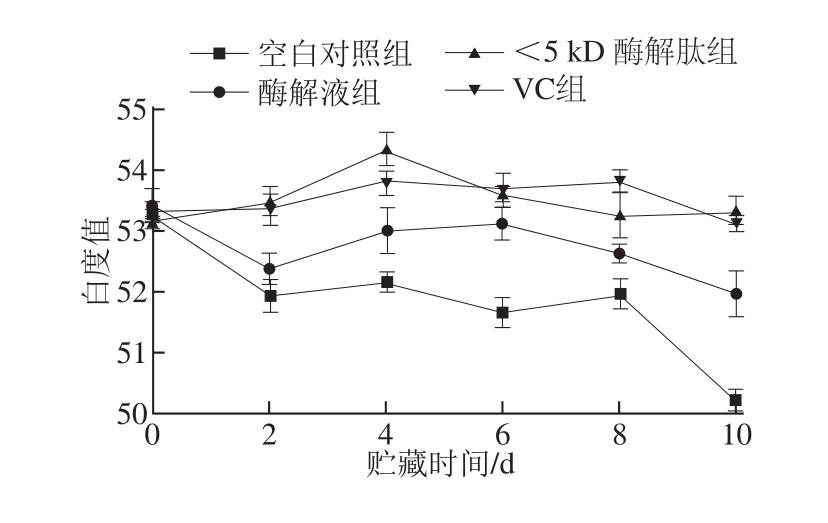
图1 不同处理组罗非鱼鱼糜在贮藏期间的白度值变化
Fig.1 Whiteness change of tilapia surimi with different treatments during storage
2.2酶解产物对罗非鱼鱼糜pH值的影响
活体鱼肌肉的pH值一般在6.8~7.2范围内,宰杀后体内糖原分解和无氧酵解使乳酸累积导致pH值降低[21]。底栖性白肉鱼类(如罗非鱼)由于糖原含量较低(0.2%~0.4%),死后鱼肉的最低pH值可以达到6.0~6.4。由图2可知,随着贮藏时间的延长,不同处理组样品鱼糜的pH值逐渐增大。贮藏过程中,VC和酶解液处理组的pH值接近,空白对照组的pH值较其他处理组高,但各组鱼糜pH值的差异均不显著(P>0.05)。实验结果表明,酶解肽和VC对鱼糜的pH值均无显著影响(P>0.05),罗非鱼鱼糜的pH值相对比较稳定,在冷藏期间基本处于6.5~7.0之间,这是一个非常适合形成鱼糜凝胶的pH值范围。
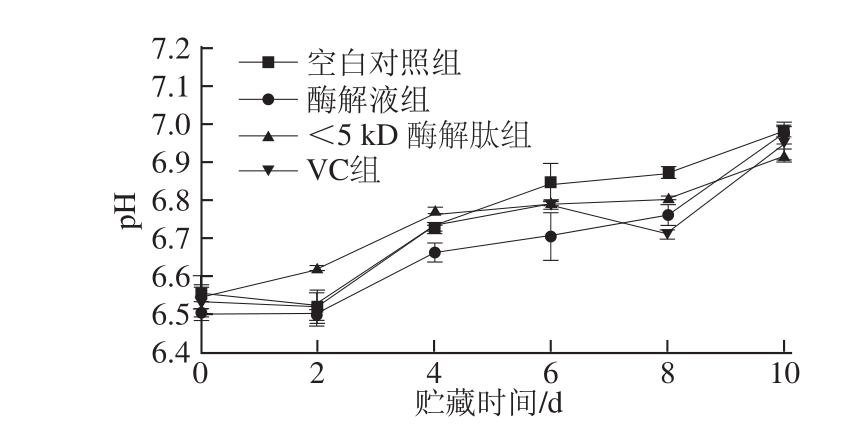
图2 不同处理组罗非鱼鱼糜在贮藏期间的pH值变化
Fig.2 pH Change of tilapia surimi with different treatments during storage
2.3酶解产物对罗非鱼鱼糜TBARS值的影响
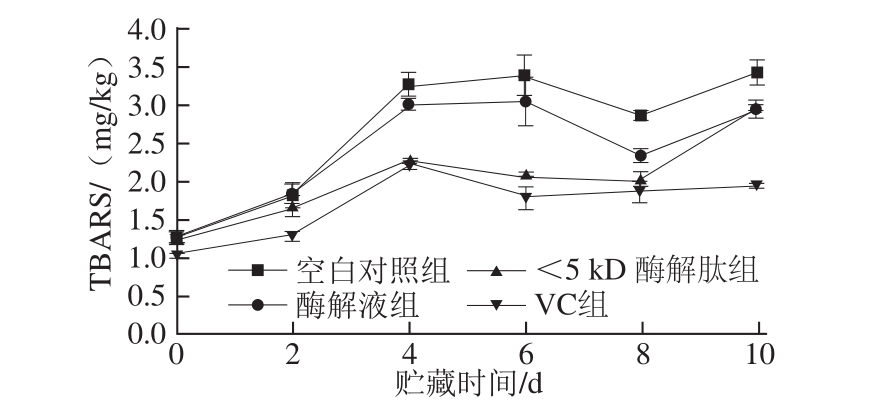
图3 不同处理组罗非鱼糜在贮藏期间TBARS值的变化
Fig.3 TBARS value change of tilapia surimi with different treatments during storage
鱼肉脂肪中含有较高比例的不饱和脂肪酸,因此抑制脂肪氧化是鱼糜加工和贮藏过程中一个极为重要的问题。图3是不同处理鱼糜样品在贮藏过程中TBARS值的变化情况。在贮藏初期,各处理样品之间差异不大(P>0.05);随着贮藏时间延长,样品的TBARS值均呈上升态势,但各处理组鱼糜的TBARS值均低于空白对照组(P<0.05),且各组之间差异均显著(P<0.05)。酶解液和<5 kD酶解肽处理组的TBARS值的变化趋势与VC处理组基本一致,呈现出较强的抗氧化能力,但<5 kD酶解液的抗氧化能力更强,接近于VC的抗氧化效果。说明罗非鱼内脏酶解产物可以作为自由基清除剂,抑制油脂的链式氧化反应,有效控制油脂的氧化。
鱼糜这一复杂的食品体系中存在的金属离子可诱导脂蛋白、磷脂和脂肪酸发生脂质氧化反应及过氧化反应,生成丙二醛。丙二醛会影响线粒体呼吸链复合物及线粒体内关键酶的活性[22-23]。纯丙二醛在中性条件下稳定,但在酸性条件下不稳定,在食品体系中可以继续反应生成更为复杂的终产物;因此图3中丙二醛含量变化呈起伏波动状态,说明在一个阶段丙二醛的生成量大于其进一步反应的消耗量,而在另一个阶段丙二醛的生成量小于其进一步反应的消耗量。
2.4酶解产物对罗非鱼鱼糜羰基含量的影响
蛋白质羰基化是指蛋白质中的氨基酸残基如赖氨酸、精氨酸、脯氨酸、苏氨酸残基侧链中的氨基和/或亚氨基因受H2O2中氧自由基攻击在金属(Fe)离子催化氧化系统中转变为醛基、并释放NH4+的反应过程。蛋白质羰基是一些氨基酸在蛋白质氧化过程中的一个早期标志,也是蛋白质受到自由基攻击的标志,羰基含量直接反映了蛋白质损伤的程度。人类的衰老以及某些疾病如心血管病、糖尿病风湿性关节炎会产生蛋白质羰基并在人体内相关组织中蓄积[24-25]。
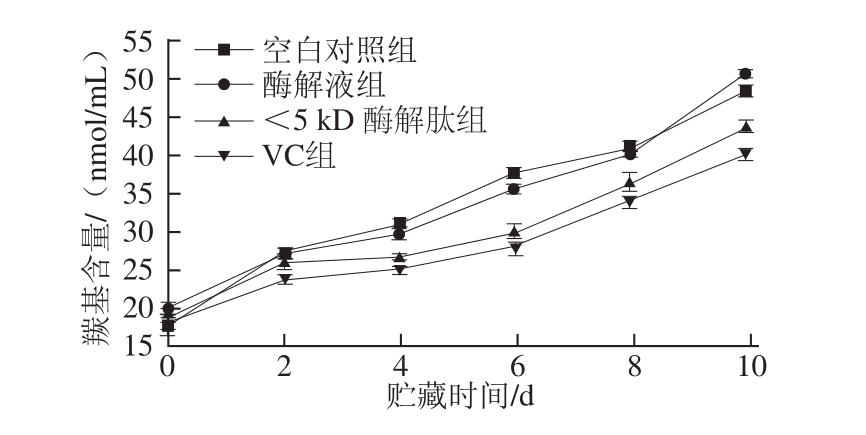
图4 不同处理组罗非鱼鱼糜在贮藏期间的羰基含量的变化
Fig.4 Carbonyl value change of tilapia surimi with different treatments during storage
由图4可知,随着贮藏时间的延长,各处理组样品的羰基含量明显升高,其中空白对照组和酶解液组样品的羰基含量更高,二者无显著差异(P>0.05),说明这两组的蛋白质氧化比较严重;而<5 kD酶解肽处理组和VC组的羰基含量明显低于前两组(P<0.05),<5 kD酶解肽处理组的羰基含量变化势与VC处理组一致,而VC处理组的羰基含量则明显低于<5 kD酶解肽处理组,说明VC抑制蛋白氧化效果最为显著(P<0.05)。酶解液在抗蛋白氧化能力上与VC有差距,但<5 kD的酶解肽抗蛋白质氧化效果优于酶解液(P<0.05)。本课题组的前期实验结果[10]表明,酶解液具有较强的还原力和清除超氧阴离子自由基的能力,这可以在一定程度上抑制羰基化过程中金属离子和H2O2对蛋白质中氨基酸残基的催化、氧化作用,从而降低羰基的形成。此外,酶解液可以有效地清除羟自由基,而羟自由基可直接作用于肽键,使其断裂,在断裂处即产生羰基。
2.5酶解产物对罗非鱼鱼糜感官品质的影响
由表2可知,随着贮藏时间的增加,各处理组鱼糜的各项感官评分逐渐降低。贮藏初期各处理组样品的色泽亮白,气味具有鱼糜特有的气味,没有脂肪氧化味、异味,总体接受度较高;贮藏后期各组处理样品的色泽出现变化,出现异味,尤其是空白对照组样品在感官上已难以被人接受,但VC和<5 kD酶解肽处理组在气味和酸败味方面极显著优于其他组别(P<0.01)。在整个贮藏过程中,各组样品的总体可接受度均呈下降趋势,空白对照组在贮藏末期与其他处理组之间呈显极著差异(P<0.01),无法被消费者接受。实验表明酶解液小分子肽具有抗氧化活性,能较好地控制鱼糜品质的氧化劣变,其中<5 kD的蛋白酶解肽液对于鱼糜的品质保藏效果更好,与VC接近。
表2 不同处理组罗非鱼糜在贮藏期间的感官评定结果
Table 2 Sensory evaluation scores of tilapia surimi with different treatments during storage
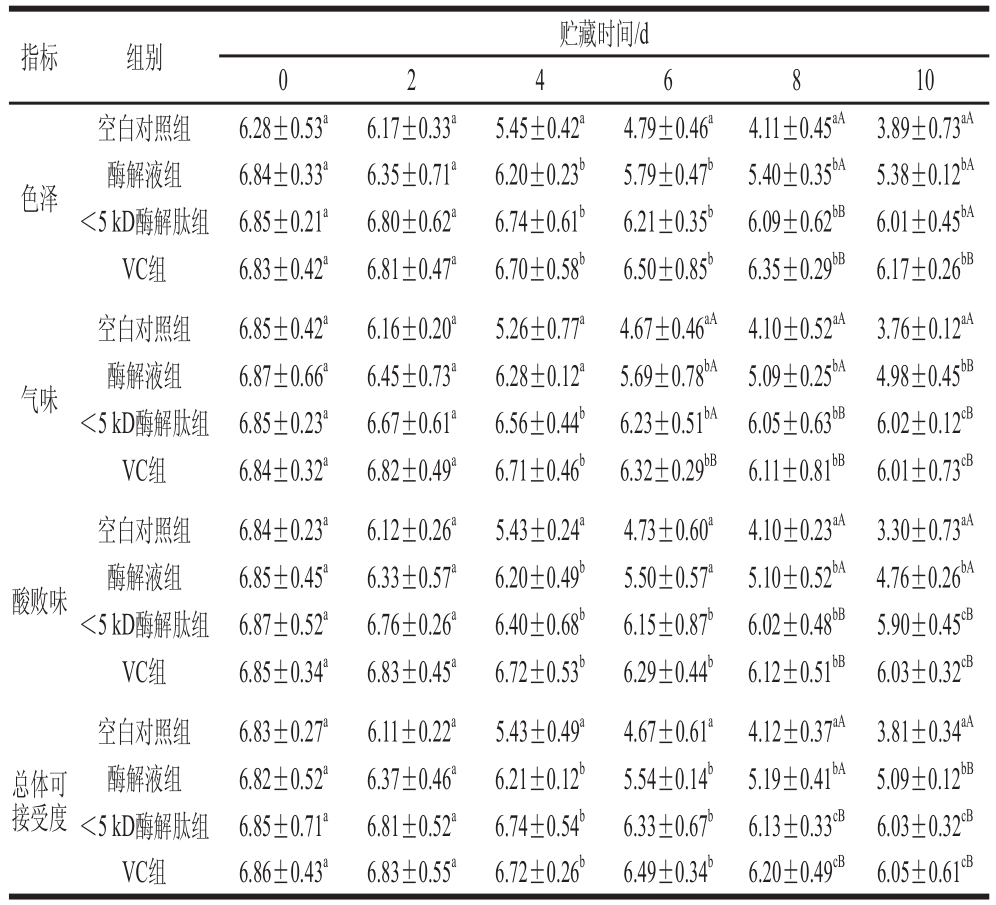
注:在同一评价指标内同列小写字母不同表示差异显著(P<0.05);大写字母不同表示差异极显著(P<0.01)。
添加酶解产物的鱼糜样品白度值在贮藏期内高于空白对照组样品,<5 kD酶解肽样品白度值与添加VC的样品没有显著性差异(P>0.05),色泽保持地较好。酶解肽对鱼糜的pH值无显著性影响(P>0.05),冷藏期间罗非鱼鱼糜的pH值稳定在6.5~7.0之间,不会影响鱼糜凝胶的形成。酶解液和<5 kD酶解肽处理组的TBARS值的变化趋势显示肽具有较强的抗氧化能力,但<5 kD酶解肽处理组的抗氧化能力更接近于VC的抗氧化效果。酶解液具有抗蛋白氧化能力,尤其是<5 kD酶解肽抗蛋白质氧化效果优于酶解液(P<0.05)。实验表明,酶解液小分子肽具有抗氧化活性,能较好地控制鱼糜蛋白质品质的氧化劣变,其中<5 kD的蛋白酶解肽液对于鱼糜的品质保藏效果更好,与VC接近。酶解肽作为鱼糜中油脂和蛋白质抗氧化剂具有令人期待的应用前景。
参考文献:
[1]王磊.罗非鱼肉及下脚料在食品工业中应用研究[J].肉类研究,2008,22(11):91-93.DOI:10.3969/j.issn.1001-8123.2008.11.022.
[2]ESTÉVEZ M,VENTANAS S,HEINONEN M,et al.Protein carbonylation and water-holding capacity of pork subjected to frozen storage:effect of muscle type,premincing,and packaging[J].Journal of Agricultural and Food Chemistry,2011,59(10):5435-5443.DOI:10.1021/jf104995j.
[3]KONG B H,ZHANG H Y,XIONG Y L.Antioxidant activity of spice extracts in a liposome system and in cooked pork patties and the possible mode of action[J].Meat Science,2010,85(4):772-778.DOI:10.1016/j.meatsci.2010.04.003.
[4]王媛,殷红,陈小波,等.茶多酚抗氧化作用的研究[J].安徽农业科学,2013,41(3):1232-1235.DOI:10.13989/j.cnki.0517-6611.2013.03.043.
[5]王猛,王敏,李环宇,等.海红果酚类物质种类及其抗氧化能力的研究[J].现代食品科技,2013,29(11):2633-2637; 2787.DOI:10.13982/j.mfst.1673-9078.2013.11.025.
[6]SOTO-VACA A,GUTIERREZ A,LOSSO J N,et al.Evolution of phenolic compounds from color and flavor problems to health benefi ts[J].Journal of Agricultural and Food Chemistry,2012,60(27):6658-6677.DOI:10.1021/jf300861c.
[7]BOUGATEF A,HAJJI M,BALTI R,et al.Antioxidant and free radical -scavenging activities of smooth hound(Mustelus mustelus)muscle protein hydrolysates obtained by gastrointestinal proteases[J].Food Chemistry,2009,114(4):1198-1205.DOI:10.1016/j.foodchem.2008.10.075.
[8]CHAY B P,MINE Y,JUNEJA L R,et al.Comparative composition and antioxidant activity of peptide fractions obtained by ultrafi ltration of egg yolk protein enzymatic hydrolysates[J].Membranes,2011,1(3):149-161.DOI:10.3390/membranes1030149.
[9]肖月娟,李润丰,郑立红,等.斑鰶鱼蛋白控制酶解及其酶解物抗氧化活性研究[J].中国食品学报,2010,10(5):91-97.DOI:10.3969/j.issn.1009-7848.2010.05.014.
[10]郭善广,荣婧,郭利平,等.罗非鱼内脏蛋白酶解超滤产物的抗氧化活性研究[J].食品与机械,2014,30(1):179-183.
[11]汪之和.水产品加工与利用[M].北京:化学工业出版社,2002:219.
[12]SINNHUBER R O,YU T C.2-Thiobarbituric acid method for the measurement of rancidity in fishery products.Ⅱ.The quantitative deter-mination of malonaldehyde[J].Food Technology,1958,12:9-12.
[13]FAGAN J M,SLECZKA B G,SOHAR I.Quantitation of oxidative damage to tissue proteins[J].International Journal of Biochemistry and Cell Biology,1999,31(7):751-757.DOI:10.1016/S1357-2725(99)00034-5.
[14]OLIVER C N,AHN B W,MOERMAN E J,et al.Aged-related changes in oxidized proteins[J].Journal of Biological Chemistry,1987,262(12):5488-5491.
[15]陆烨,王锡昌,刘源,等.冷冻鱼糜及其制品品质评价方法的研究进展[J].食品科学,2010,31(11):278-281.
[16]van LAACK R L,SMULDER F J.Colour stability of bovine longissimus and psoas major muscles as affected by electrical stimulation and hot boning[J].Meat Science,1990,28:211-221.DOI:10.1016/0309-1740(90)90005-Q.
[17]GUIGNOT F,QUILICHINI Y,RENERRE M,et al.Relationships between muscle type and some traits influencing veal colour[J].Journal of the Science of Food and Agriculture,1992,58(4):523-529.DOI:10.1002/jsfa.2740580411.
[18]BALLIN N Z,LAMETSCH R.Analytical methods for authentication of fresh vs.thawed meat:a review[J].Meat Science,2008,80(2):151-158.DOI:10.1016/j.meatsci.2007.12.024.
[19]丁一,杨明,王松,等.骨蛋白水解物对冷藏鱼糜品质和蛋白结构特性的影响[J].食品工业科技,2013,34(12):145-148; 152.
[20]施雪,孔保华,刘骞,等.鲤鱼肉蛋白水解物在熟猪肉糜中的抗氧化效果[J].食品科学,2011,32(5):5-9.DOI:10.3969/j.issn.1001-8123.2011.05.002.
[21]ACERETE L,REIG L,ALVAREZ D,et al.Comparison of two stunning slaughtering methods on stress response and quality indicators of European sea bass(Dicentrarchus labrax)[J].Aquaculture,2009,287(1/2):139-144.DOI:10.1016/j.aquaculture.2008.10.012.
[22]BERGER R G,LUNKENBEIN S,STRÖHLE A,et al.Antioxidants in food:mere myth or magic medicine?[J].Critical Reviews in Food Science and Nutrition,2012,52(2):162-171.DOI:10.1080/10408398.2010.499481.
[23]PENA-RRAMOS E A,XIONG Y L.Whey and soy protein hydrolysates inhibit lipid oxidation in cooked pork pattie[J].Meat Science,2003,64(3):259-563.DOI:10.1016/S0309-1740(02)00187-0.
[24]DALLE-DONNE I,ROSSI R,GIUSTARINI D,et al.Protein carbonyl groups as biomarkers of oxidative stress[J].Clinica Chimica Acta,2003,329(1/2):23-38.DOI:10.1016/S0009-8981(03)00003-2.
[25]UTRERA M,ESTÉVEZ M.Oxidation of myofibrillar proteins and impaired functionality:underlying mechanisms of the carbonylation pathway[J].Journal of Agricultural and Food Chemistry,2012,60(32):8002-8011.DOI:10.1021/jf302111j.
GUO Liping1,RONG Jing2,YANG Ning3,GUO Shanguang2
(1.Department of Light Chemical Engineering,Guangdong Industry Polytechnic,Guangzhou 510300,China; 2.College of Food Science,South China Agricultural University,Guangzhou 510642,China; 3.Guangdong Science and Technology Exchange Centre,Guangzhou 510033,China)
Abstract:The enzymatic hydrolysate of tilapia viscera and its ultrafi ltration fraction(peptide < 5 kD)were separately added to tilapia surimi to explore their inhibitory effects on lipid and protein oxidation during refrigeration(0–4 ℃).The results showed that both the hydrolysate and its fraction improved the color of tilapia surimi(P < 0.05),especially the latter,which was nearly as effective as VC at a certain dose.The hydrolysate demonstrated strong antioxidant capacity against both lipid and protein oxidation in surimi during storage(P < 0.05),which,however,was inferior to that of its ultrafi ltration fraction.To sum up,the hydrolysate can effectively maintain the quality of surimi during refrigerated storage,and the peptides < 5 kD separated from it by ultrafi ltration possess better antioxidant activity.
Key words:surimi; peptides derived from enzymatic hydrolysis; protein oxidation; ultrafi ltration; antioxidant activity
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2016)05-0089-05
DOI:10.7506/spkx1002-6630-201605017 10.7506/spkx1002-6630-201605017.http://www.spkx.net.cn 10.7506/spkx1002-6630-201605017.http://www.spkx.net.cn
作者简介:郭利平(1963—),女,副教授,硕士,主要从事食品生物技术研究。E-mail:glp336@126.com
基金项目:广东省科技计划项目(2009B020313003)
收稿日期:2015-03-25