余祖华1,2,丁 轲1,2,*,刘赛宝1,李亚菲2,李 旺1,李元晓1,曹平华1,刘一尘2,孙二刚3
(1.河南科技大学宏翔发酵饲料实验室,河南 洛阳 471003;2.河南省动物疫病与公共安全院士工作站,河南 洛阳 471003;3.河南宏翔生物科技有限公司,河南 汝州 467500)
摘 要:目的:分离筛选能够降解呕吐毒素(deoxynivalenol,DON)的芽孢杆菌,以用于该毒素的生物降解。方法:采集霉变秸秆、土壤和粪便样品,先将样品加热80 ℃后,取上清液接种到以DON为唯一碳源的分离培养基富集DON降解菌。以LB培养基分离纯化富集菌,然后对分离到的菌株进行DON毒素降解能力检测。对降解能力最强的菌株进行形态学观察、生理生化实验和16S rDNA序列鉴定。结果:从16 株分离菌中筛选得到一株对DON降解能力最强的菌株B.JG05,降解率最高可达80.61%,且对含DON饲料的降解率为82.68%。该菌株呈短杆状,能形成芽孢;生理生化特性符合蜡样芽孢杆菌的基本特征;16S rDNA序列进化树分析表明该菌株与蜡样芽孢杆菌的亲缘关系最近。结论:筛选获得了一株高效降解DON的蜡样芽孢杆菌B.JG05,为饲料和食品中DON毒素的生物降解提供了可能。
关键词:呕吐毒素;蜡样芽孢杆菌;降解;筛选;鉴定
河南科技大学大学生研究训练计划(SRTP)项目(2013251)
引文格式:
余祖华,丁轲,刘赛宝,等.一株降解呕吐毒素蜡样芽孢杆菌的筛选与鉴定[J].食品科学,2016,37(5):121-125.
YU Zuhua,DING Ke,LIU Saibao,et al.Screening and identification of a Bacillus cereus strain able to degradate deoxynivalenol[J].Food Science,2016,37(5):121-125.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605022.http://www.spkx.net.cn
呕吐毒素,又名脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),化学名称为3,7,15-三羟基-12,13-环氧单端孢霉-9-烯-8-酮,主要由禾谷镰刀菌和黄色镰刀菌产生[1]。该毒素在粮谷类原料中污染较为普遍,可严重影响谷物的产量和质量,进入食物链后可对消化道黏膜产生强烈的刺激反射而作用于呕吐中枢,从而引起食欲减退,影响生产性能[2-3];DON可影响免疫细胞的增殖、凋亡和免疫细胞因子的生成,从而降低机体的免疫力[4];DON具有细胞毒性,能够抑制mRNA的翻译、p38和细胞外调节蛋白激酶活性,从而加速细胞死亡[5-6]。畜禽对DON比较敏感,尤其是猪,饲料中DON超过5 mg/kg时就会拒食,超过14 mg/kg时就会出现呕吐,种畜服用后会引起流产[7]。因此,国家标准规定家禽饲料中DON的限量应<5 mg/kg,猪饲料中DON的限量应<1 mg/kg[8]。所以降解谷物等原料中的DON对于人和畜禽的健康非常重要。
微生物作为大自然的分解者,可以分解自然界的任何物质,因此,开发微生物降解DON具有非常重要的意义。前人也曾在这方面做过一些研究探讨[9-10],但对于芽孢杆菌降解DON的报道还很少。因为芽孢杆菌作为一种抗逆性最好的菌株,又可产各种消化酶以及抗菌物质,所以在人畜上是应用最广泛的益生菌之一。筛选具有降解DON的芽孢杆菌将会获得多功能菌株,将可利用单一菌株发酵获得多种功能产物。所以本实验的目的是分离一株能够高效降解DON的芽孢杆菌,为利用该菌株去除禾谷原料中或发酵产品中的DON毒素奠定基础,从而保证人畜的食品和饲料安全。
1.1材料与试剂
从河南不同地方采集霉变的禾谷秸秆及其下层土壤、不同动物的粪便等样品85 份。
DON(纯度99%) 上海酶联生物科技有限公司;DON酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)检测试剂盒 北京华安麦科生物技术有限公司;聚合酶链式反应(polymerase chain reaction,PCR)试剂盒、基因组抽提试剂盒 北京天根生化科技有限公司;微量生化发酵管 杭州天和微生物试剂有限公司。
1.2培养基
富集培养基:蛋白胨10 g、NaCl 1 g、KH2PO41 g、葡萄糖1 g、DON 0.05 g,加水至1 L,调pH值至7.0。
基础盐培养基:K2HPO42.5 g、KH2PO41.2 g、NH4NO31.0 g、MgSO4·7H2O 0.2 g、Ca(NO3)2·4H2O 0.4 g、NaCl 0.5 g、Fe2(SO4)30.001 g,加水至1 L,pH 7.0。
营养培养基:LB培养基。
1.3仪器与设备
Multiskan MK3酶标仪 美国Thermo公司;9700型PCR仪 美国ABI公司;GelDoc XR System凝胶成像系统 美国Bio-Rad公司。
1.4 方法
1.4.1 样品的处理
每个样品各取1 g左右加入到3 mL生理盐水中,80 ℃加热10 min,除去不耐热菌。
1.4.2 降解DON菌株的富集
将处理过的样品各取0.1 mL加入到5 mL的富集培养基中,37 ℃振荡培养3 d。
1.4.3 降解DON菌株的筛选
取富集培养液200 μL,于3 000 r/min离心5 min,弃上清,加入200 μL生理盐水混匀后涂于含100 μg/mL DON的基础盐培养基平板,37 ℃培养48 h,挑取单菌落,接种于LB培养基进行纯化。纯化的菌株进行革兰氏染色,筛选能形成芽孢的菌株。
1.4.4 不同菌株DON降解率的测定
1.4.4.1 菌株DON降解实验
取上述纯化的菌株,分别按1%接种于含0.1 mg/mL DON的基础盐培养基,每株菌培养3 管,37 ℃振荡培养,于72 h取样检测。
1.4.4.2 发酵液中DON的残留量及降解率计算
各取培养液1 mL,3 000 r/min离心5 min,分离上清液为待测液。然后按照DON ELISA检测试剂盒说明书检测上清液中DON的残余量,同时以未接菌的含0.1 mg/mL DON的基础盐培养基为阳性对照,培养条件与实验组相同。每个菌株做3 个重复,计算平均值。按照下列公式计算DON的降解率。
式中:ρ0为阳性对照组的DON残留量/(mg/mL);ρn为每个菌株发酵液中的DON残留量/(mg/mL)。
1.4.5 分离菌株的鉴定
取上述降解率最高的菌株,分别通过生理生化和分子生物学进行鉴定。
1.4.5.1 菌株的生理生化实验
参照文献[11]对菌株进行生理生化实验,包括硝酸盐还原、明胶液化、硫化氢产生各种糖利用等。
1.4.5.2 菌株16S rDNA序列扩增与分析
根据杆菌科的16S rDNA序列设计一对引物,P1:5’-AGAGTTTGATCCTGGCTCAG-3’,P2:5’-ACGGTTACCTTGTTACGACTT-3’。按照基因组抽提试剂盒提取的菌体基因组为模板,PCR反应体系如下:上下游引物(10 mol/L)各1.5 μL,10×PCR buffer 5 μL,dNTPs(10 mol/L)1 μL,MgCl22 μL,Taq DNA 聚合酶(5 U/μL)0.5 μL,模板DNA 1 μL,加超纯水至50 μL。反应参数:95 ℃预热3 min;95 ℃解链50 s,55 ℃退火45 s,72 ℃延伸90 s,35 个循环;72 ℃最终延伸10 min,于4 ℃保存。取5 μL产物于1%的琼脂糖凝胶中电泳,与预期大小相符的PCR扩增产物送至生工生物工程(上海)股份有限公司测序。将测序结果提交到GenBank中进行BLAST比对,选取相似性较高的序列,利用MEGA4.0软件包中的Kimura2-parameter法计算遗传距离,用邻接(neighborjoining,NJ)法构建系统发育树。
1.4.6 菌株B.JG05对饲料中DON的降解
称取常规饲料600 g,高压灭菌后向其中加入DON毒素至终水平20 mg/kg,充分混匀后平均分成6 份,设两个处理,每个处理3 个重复,第1个处理为对照组,每个重复加入90 mL 水+10 mL LB培养基;第2个处理为实验组,每个重复加入90 mL水+10 mL LB培养基(含B.JG05菌浓度为107CFU/mL),同时放入37 ℃培养箱培养,分别于24、36、48、60、72、84、96 h各取样0.2 g,按照DON ELISA检测试剂盒说明书利用甲醇提取饲料中的DON,检测DON的残留量。
2.1降解DON菌株的分离筛选

图1 部分菌株显微形态图
Fig.1 Microscopic morphology of some isolates
样品中的特异性菌株富集后,在以DON为唯一碳源的基础盐培养基上进行分离,再通过划线纯化培养,最终初步分离出16 株菌。将这些菌进行革兰氏染色,均为G+菌,筛选出能产芽孢的菌株14 株,且均呈短杆状,单个或链状排列,芽孢有的中生,有的端生(部分显微形态见图1)。分离自秸秆的编号为B.JG01、B.JG02、 B.JG03、B.JG04、B.JG05、B.JG06、B.JG07;分离自土壤的编号为B.TR01、B.TR02、B.TR03;分离自猪粪便的编号为B.ZF01、B.ZF02、B.ZF03;分离自牛粪便的编号为B.NF01。这些菌株能够在以DON为唯一碳源的基础盐培养基上生长,说明这些菌株均能以DON为营养进行分解利用,即均具有DON降解能力。
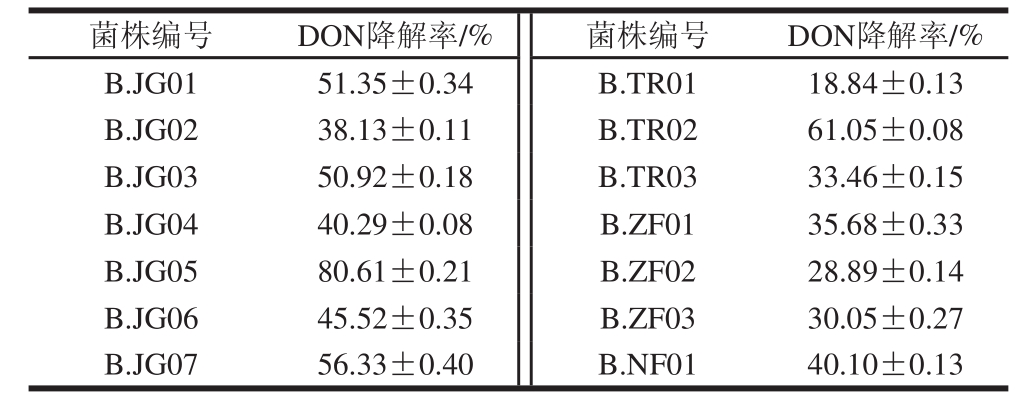
2.2不同菌株DON降解率测定结果
将14 株分离菌接种到含有DON的培养基中进行过培养发酵,取发酵后的培养液测定其中DON的残留量。由表1可知,所分离的菌株对DON均有不同程度的降解能力,但不同样品来源的菌株对DON的降解率差异较大,来源于秸秆和土壤样品中的分离菌株对DON的降解效果较好,其中分离自秸秆的菌株B.JG05对培养基中DON的降解率最高可达80.61%,因此选择该菌株做进一步鉴定。
表1 不同菌株对DON降解率
Table 1 Degradation efficiencies of different isolates for DON
2.3菌株B.JG05生理生化特性
菌株B.JG05的生理生化特性见表2,该菌株能够分解淀粉,明胶液化、接触酶、硝酸盐还原、H2S产生等实验均为阳性,可利用葡萄糖、乳糖、果糖、鼠李糖、木糖等,不能利用纤维素、棉子糖。参照文献[11]可以发现,以上特征与芽孢杆菌属极为相似。
表2 菌株B.JG05生理生化特性
Table 2 Physiological and biochemical characteristics of strain B.JG05

注:+.实验结果为阳性;—.实验结果为阴性。
2.4菌株B.JG05的16S rDNA序列扩增结果
以菌株B.JG05基因组DNA为模板,经PCR扩增产物电泳,在约1 500 bp处有一条特异性条带,与预期大小相符,见图2。测序结果也表明该菌株的16S rDNA序列长度为1 436 bp。将该序列提交到GenBank获得登录号为KR078342。

图2 菌株B.JG05 的16S rDNA片段PCR扩增结果
Fig.2 PCR amplification of 16S rDNA sequence from B.JG05
2.5基于16S rDNA序列系统进化树分析
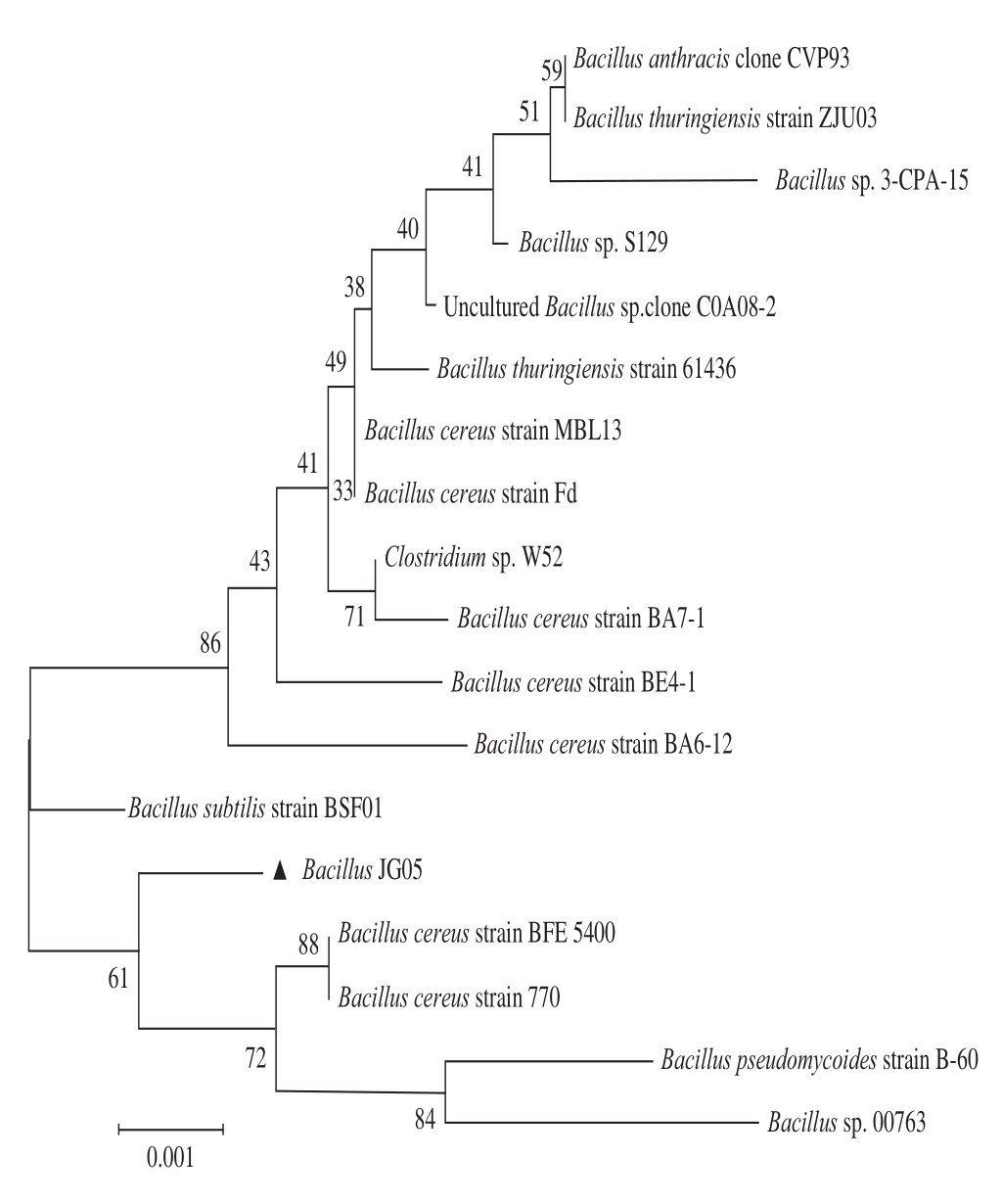
图3 基于Neighbor-Joining 法构建B.JG05的 16S rDNA序列遗传进化树
Fig.3 Phylogenetic tree analysis based on 16S rDNA sequences from B.JG05 and other 17 reference strains by Neighbor-Joining method
将2.4节序列提交到GenBank进行BLAST比对,发现该菌株与芽孢杆菌属具有较高的同源性,选取序列同源性在98%以上具有代表性的菌株17 株,通过MEGA5.0软件构建系统发育树(图3),结果显示菌株B.JG05与蜡样芽孢杆菌(Bacillus cereus)、假蕈状芽孢杆菌(Bacillus pseudomycoides)和球形芽孢杆菌(Bacillus sp.)处于同一主分支,但从遗传距离分析与蜡样芽孢杆菌的亲缘关系更近,因此,将菌株B.JG05鉴定为蜡样芽孢杆菌。
2.6菌株B.JG05对饲料中DON的降解

图4 菌株B.JG05不同发酵时间对饲料中DON的降解
Fig.4 Degradation of DON in feed by B.JG05 strain at different fermentation time
采用ELISA法检测各处理组饲料中DON的残留量,结果如图4所示,对照组样品中DON的量基本上没有变化,而加入菌株B.JG05的样品,随着发酵时间的延长DON的量逐渐减少,0~48 h,样品中DON的量呈直线下降,48~60 h,DON的量缓慢下降,60 h以后DON的量基本没有变化。所以,从饲料样品中的DON的降解曲线看,样品在60 h时即可达最大降解率82.68%。
呕吐毒素是食品和饲料原料中仅次于黄曲霉毒素的最常见的真菌毒素之一,在小麦、玉米和大豆等常规粮食中普遍存在,严重影响了人畜安全。欧洲4 000 例样品中DON检出率为57%,且含量为0.91~5 mg/kg[12];2012年对中国饲料和原料调查发现DON阳性率高达93%[13]。2007年Binder等[14]对亚太地区釆集的1 290 份代表性样品分析发现,DON的检出率达71%,其中毒素含量最高的样品来自中国的小麦,其DON含量为18.99 mg/kg,超标近18 倍。2009年樊平声等[15]对南京市场上随机抽取的74 份小麦食品(包括方便面、饼干、面包和蛋糕等)中DON的含量进行了测定,结果发现有37 份样品中DON的含量高于1 mg/kg的限量标准。而且由于DON比较稳定,食品和饲料的加工过程不仅不能破坏DON,而且还存在毒素浓缩效应[16-17]。目前还有许多研究者正在研究将玉米秸秆发酵后作为粗饲料原料,本课题组前期研究发现曝晒过的秸秆中的DON含量最高可达20 mg/kg,即使能将纤维素降到可用阶段,而由于DON含量远远超标也无法应用。因此,DON已严重威胁了食品安全和人畜健康,必须采用合适的方法将其中的DON降解或去除才能消除其危害。
对于DON的降解,传统的物理法,如硅铝酸盐(膨润土、蒙脱石、高岭土) 、活性炭等只是采用微颗粒吸附或螯合,并不能从根本上消除DON,吸附效率也不理想,而且经人畜排出后会在土壤中重新分解造成二次污染[18-19];化学反应法需要应用大量的酸或碱,不仅会破坏原料的营养,而且也会造成二次污染[20-21]。所以最理想的方法是通过微生物发酵降解,但关于这方面的报道并不多见。徐剑宏等[22]分离获得了一株德沃斯氏菌DDS-1,对饲料中的DON降解率可达75.47%,程亮等[23]分离鉴定了一株假单胞杆菌对无机盐培养基中的DON的降解率可达56.6%。Binder等[24]发现真菌DSM11789也能降解DON。Fuchs等[25]分离的真菌BBSH797后来被Biomin GmbH公司开发为降解饲料中DON的菌株。本实验采用DON为唯一碳源对多种来源的样品进行分离,通过平板筛选,ELISA检测,初步分离出14 株能够降解DON的菌株,从降解效率上分析,来自秸秆和土壤样品的菌株的降解效果相对较好,可能是因为这类样品中的DON的含量较高,通过自然共生或长期驯化导致其能够大量降解样品中的DON。分离筛选出的降解DON效果最好的菌株B.JG05,对无机盐培养基中的DON降解率可高达80.61%,而对饲料中DON,采用该菌株发酵60 h后降解率可达82.68%,可能是在营养丰富的条件下,菌株的生长速率较快,能够充分与DON接触,从而能更有效地降解DON。另外本实验还发现,饲料经发酵后,总质量损耗约5.2%,所以该菌株对DON的降解效率理论上比检测值还要更高。从菌株B.JG05对无机盐培养基和饲料中DON的降解效果来看,该菌株完全可以用于其他任何需要芽孢杆菌发酵的食品、饲料或秸秆中DON的降解。通过形态学、生理生化特性和16S rDNA序列鉴定该菌株为蜡样芽孢杆菌。下一步将对该菌株的发酵条件进行优化以更进一步提高其降解效率。同时进行毒性实验,若无毒,则可直接将其用于食品或饲料的发酵,在获得发酵产品的同时又可除去原料中的DON,而不再需要二次处理,可简化工艺过程,节约成本,提高产品品质,有望开发为一种高效的防霉菌添加剂。还将进一步分析菌株B.JG05降解DON后的分解产物,探讨其生物降解机理。
参考文献:
[1]PITT J I.Mycotoxins:deoxynivalenol and other trichothecenes[J].Encyclopedia of Food Safety,2014,2:295-298.DOI:10.1016/B978-0-12-378612-8.00193-1.
[2]尹杰,伍力,彭智兴,等.脱氧雪腐镰刀菌烯醇的毒性作用及其机理[J].动物营养学报,2012,24(1):48-54.DOI:10.3969/j.issn.1006-267x.2012.01.008.
[3]MARESCA M,MAHFOUD R,GARMY N,et al.The mycotoxin deoxynivalenol affects nutrient absorption in human intestinal epithelial cells[J].The Journal of Nutrition,2002,132(9):2723-2731.
[4]LI Daotong,MA Haoran,YE Yaqiong,et al.Deoxynivalenol induces apoptosis in mouse thymic epithelial cells through mitochondriamediated pathway[J].Environmental Toxicology and Pharmacology,2014,38(1):163-171.DOI:10.1016/j.etap.2014.05.015.
[5]PINTON P,ACCENSI F,BEAUCHAMP E,et al.Ingestion of deoxynivalenol(DON)contaminated feed alters the pig vaccinal immune responses[J].Toxicology Letters,2008,177(3):215-222.DOI:10.1016/j.toxlet.2008.01.015.
[6]AZCONA J I,OUYANG Y L,MURTHA J,et al.Induction of cytokine mRNAs in mice after oral exposure to the trichothecene vomitoxin(deoxynivalenol):relationship to toxin distribution and protein synthesis inhibition[J].Toxicology and Applied Pharmacology,1995,133(1):109-120.DOI:10.1006/taap.1995.1132.
[7]VERONIKA N,BETTINA W,HEIDI E,et al.Metabolism of the masked mycotoxin deoxynivalenol-3-glucosied in pigs[J].Toxicology Letters,2014,229(1):190-197.DOI:10.1016/j.toxlet.2014.06.032.
[8]GB 13078.3—2007 配合饲料中脱氧雪腐镰刀菌烯醇的允许量[S].
[9]IKUNAGA Y,SATO I,GROND S,et al.Nocardioides sp.strain WSN05-2,isolated from a wheat field,degrades deoxynivalenol,producing the novel intermediate 3-epi-deoxynivalenol[J].Applied Microbiology and Biotechnology,2011,89(2):419-427.DOI:10.1007/s00253-010-2857-z.
[10]GARDA-BUFFON J,BADIALE-FURLONG E.Kinetics of deoxynivalenol degradation by Aspergillus oryzae and Rhizopus oryzae in submerged fermentation[J].Journal of the Brazilian Chemical Society,2010,21(4):710-714.DOI:10.1590/S0103-50532010000400018.
[11]布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[M].中国科学院微生物研究所翻译组,译.8版.北京:科学出版社,1984:125-200.
[12]SCHOTHORST R C,van EGMOND H P.Report from SCOOP task 3.2.10 “collection of occurrence data of fusarium toxins in food and assessment of dietary intake by the population of EU member states”:subtask:trichothecenes[J].Toxicology Letters,2004,153:133-143.DOI:10.1016/j.toxlet.2004.04.045.
[13]王金勇,刘颖莉.2012年上半年中国霉菌毒素普查报告[J].中国畜牧杂志,2012,48(18):25-28.
[14]BINDER E M,TAN L M,CHIN L J,et al.Worldwide occurrence of mycotoxins in commodities,feeds and feed ingredients[J].Animal Feed Science and Technology,2007,137(3/4):265-282.DOI:10.1016/j.anifeedsci.2007.06.005.
[15]樊平声,沙国栋,张勇,等.南京市售小麦食品中DON毒素含量调查与风险评估[J].山地农业生物学报,2009,28(5):421-424.DOI:10.15958/j.cnki.sdnyswxb.2009.05.002.
[16]HUWIG A,FREIMUND S,KAPPELI O,et al.Mycotoxin detoxication of animal feed by different adsorbents[J].Toxicology Letters,2001,122(2):179-188.DOI:10.1016/S0378-4274(01)00360-5.
[17]ZHOU T,GONG J H,YU H,et al.Detoxification of vomitoxin with biotransforming microorganisms[C]//Proceeding of the 23rd Annual Centralia Swine Research Update.Kirkton Ontario,2005b:28-30.
[18]BOCOY S A,ADAMOVIC M,SALMA N,et al.In vitro efficacy of mycotoxins adsorption by natural mineral adsorbents[J].Biotechnology in Animal Husbandry,2011,27(3):1241-1251.
[19]SABATER V M,MALEKINEJAD H,SELMAN M,et al.In vitro assessment of adsorbents aiming to prevent deoxynivalenol and zearalenone mycotoxicoses[J].Mycopathologia,2007,163:81-90.DOI:10.1007/s11046-007-0093-6.
[20]BRETZ M,BEYER M,CRAMER B,et al.Thermal degradation of the Fusarium mycotoxin deoxynivalenol[J].Journal of Agricultural and Food Chemistry,2006,54(17):6445-6451.DOI:10.1021/jf061008g.
[21]YOUNG J C,SUBRYAN L M,POTTS D,et al.Reduction in levels of deoxynivalenol in contaminated wheat by chemical and physical treatment[J].Journal of Agricultural and Food Chemistry,1986,34(3):461-465.DOI:10.1021/jf00069a022.
[22]徐剑宏,祭芳,王宏杰,等.脱氧雪腐镰刀菌烯醇降解菌的分离和鉴定[J].中国农业科学,2010,43(22):4635-4641.DOI:10.3864/j.issn.0578-1752.2010.22.010.
[23]程亮,伍松陵,沈晗,等.脱氧雪腐镰刀菌烯醇降解菌的筛选与鉴定[J].粮油食品科技,2013,21(5):95-97.
[24]BINDER E M,BINDER J,ELLEND N,et al.Microbiological degradation of deoxynivalenol and 3-acetyl-deoxynivalenol[M]//MICRAGLIA M,van EGMOND H,BRERA C,et al.Mycotoxins and phycotoxins-developments in chemistry,toxicology and food safety.Fort Collins:Alaken Inc.,1998:279-285.
[25]FUCHS E,BINDER E M,HEIDLER D,et al.Structural characterization of metabolites after the microbial degradation of type a trichothecenes by the bacterial strain BBSH797[J].Food Additives and Contaminants,2002,19(4):379-386.
YU Zuhua1,2,DING Ke1,2,*,LIU Saibao1,LI Yafei2,LI Wang1,LI Yuanxiao1,CAO Pinghua1,LIU Yichen2,SUN Ergang3
(1.Hongxiang Biological Feed Laboratory,Henan University of Science and Technology,Luoyang 471003,China;
2.Animal Disease and Public Safety Academician Workstation of Henan Province,Luoyang 471003,China; 3.Henan Hongxiang Biotechnology Co.Ltd.,Ruzhou 467500,China)
Abstract:Objective:To isolate and identify a Bacillus strain used for biodegradation of deoxynivalenol(DON).Methods:Samples of moldy straw,soil and faeces were collected and heated to 80 ℃.The supernatant was inoculated into an isolation medium with DON as the sole carbon source to enrich DON-degrading strains.The enriched strains were isolated and purified on LB medium plates,and then the isolates were detected for their ability to degrade DON.The optimal strain was identified by morphological observation,physiological and biochemical tests and 16S rDNA sequences.Results:The optimal strain B.JG05 was screened out of 16 isloates,which could degrade up to 80.61% of DON in inorganic salt medium.The degradation efficiency of DON in feed by B.JG05 was 82.68%.The strain B.JG05 was a rod-shaped and sporeforming bacterium.Its physiological and biochemical characteristics were consistent with those of Bacillus cereus,and the phylogentic tree analysis based on 16S rDNA sequence showed that it was the most close to Bacillus cereus.Conclusion:The strain B.JG05 with high DON degradation capacity was identified as Bacillus cereus,and it could off er a basis for the biodegradation of DON in feed or food.
Key words:deoxynivalenol; Bacillus cereus; degradation; screening; identification
中图分类号:Q939.99
文献标志码:A
文章编号:1002-6630(2016)05-0121-05
DOI:10.7506/spkx1002-6630-201605022 10.7506/spkx1002-6630-201605022.http://www.spkx.net.cn
*通信作者:丁轲(1977—),男,副教授,博士,主要从事动物微生态与动物传染病学研究。E-mail:keding19@163.com
作者简介:余祖华(1977—),女,讲师,博士,主要从事动物微生态与动物传染病学研究。E-mail:yzhd05@163.com
基金项目:河南省科技厅重大科技攻关项目(131100110300);河南省教育厅科学技术研究重点项目(14B230002);
收稿日期:2015-04-13