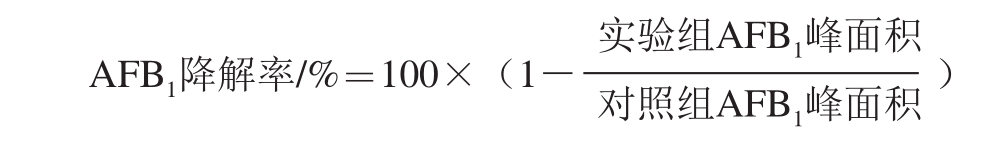
邵 帅,戴 军,杜 馨,王常高,林建国,蔡 俊*
(湖北工业大学 发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,湖北 武汉 430068)
摘 要:目的:鉴定一株降解黄曲霉毒素B1(aflatoxin B1,AFB1)的霉菌HSK8,通过优化其发酵条件提高AFB1降解率,并初步探索其降解机制。方法:通过形态学和内部转录间隔区(internal transcribed spacer,ITS)、18S rRNA和26S rRNA序列分析对该菌株进行鉴定,并通过单因素试验对发酵条件进行优化,采用薄层层析对AFB1降解产物进行研究。结果:经鉴定该株霉菌为夏孢生枝孢(Cladosporium uredinicola)。其发酵条件经优化确定为:发酵温度28 ℃、装液量75 mL/250 mL、接种量15%、发酵时间36 h、初始pH 8.0。薄层层析观察到一个不同于AFB1的荧光斑点。结论:发酵条件优化后,AFB1降解率从40.68%提升到68.96%,提高了69.52%;AFB1降解产物能在365 nm波长处发出蓝色荧光。
关键词:黄曲霉毒素B1;鉴定;发酵条件;降解产物
引文格式:
邵帅,戴军,杜馨,等.降解黄曲霉毒素B1菌株的发酵条件优化及降解机制[J].食品科学,2016,37(5):138-143.
SHAO Shuai,DAI Jun,DU Xin,et al.Optimization of fermentation condition for an AFB1-degrading strain and preliminary exploration of degradation mechanism[J].Food Science,2016,37(5):138-143.(in Chinese with English abstract)
黄曲霉毒素(aflatoxin,AF)是寄生曲霉(Aspergillus parasiticus)和黄曲霉(A.fl avus)的典型次级代谢产物[1],具有极强的毒性、致癌性和致畸性。除上述两种曲霉外,模式曲霉(A.nominus)[2]、溜曲霉(A.tamarii)[3]和A.pseudotamarii[4]也被报道具有合成黄曲霉毒素的能力,但以寄生曲霉和黄曲霉为主。食品贮藏不当,极容易发霉变黄,产生黄曲霉毒素。在各类黄曲霉毒素中,黄曲霉毒素B1(AFB1)毒性最强,对人畜皆有很大的致癌、致突变、致畸性、肝毒性及免疫抑制性[5]。
生物法去除AFB1使得去除食品、饲料中的AFB1可在温和的条件下进行,而同时又不影响食品和饲料中的营养[6]。化学法和物理法的主要缺点在于要么反应条件过于激烈、脱毒效果不理想,要么耗资大、破坏营养成分及适口性[7-8],导致这两类方法难以得到广泛应用。
自AFB1被发现初就有用生物法来去除AFB1的相关研究[9]。生物法基于微生物对真菌毒素或产毒真菌的作用从而去除AFB1,这些微生物包括酵母、丝状真菌、细菌、藻类等,作用机制包括营养和空间竞争、反应、抗生等[10]。国内报道的降解AFB1的微生物有:假蜜环菌(Armillariell a tabescens)[11]、施氏假单胞菌(Pseudomonas stutzeri)[12]、嗜麦芽窄食单胞菌(Stenotrophomonas sp.)[13]等;国外报道的有指孢霉(Dactylium dendroides NRRL2575)[14]、棒状杆菌(Corynebacterium rubrum)、黑曲霉(Aspergillus niger)、绿色木霉(Trichoderma viride)、不明毛霉(Mucor ambiguus)[15]、恶臭假单胞菌(Pseudomonas putida)[16]、红蹿红球菌(Rhodococcus erythropolis)[17]、橙色黄杆菌(Flavobacterium aurantiacum)[9,18]等。其中一些降解AFB1的酶被分离纯化和深入研究,比如黄曲霉毒素氧化酶[19-20]、锰过氧化物酶[21]、漆酶[22-23]及其他[24-25]。除微生物外,近年来还有文献报道一些药用植物也具有降解AFB1的能力[26-27],Vijayanandraj等[26]研究表明植物中降解AFB1的活性物质可能是生物碱。关于生物降解AFB1的文献报道越来越多,这说明生物法降解AFB1成为研究的热点。尽管如此,关于AFB1降解的应用研究仍然很少[27-29]。
AFB1为含双呋喃环结构的香豆素衍生物,前人利用香豆素作为唯一碳源来进行AFB1降解菌的筛选已取得了良好效果[13],湖北工业大学生物工程学院蔡俊教授研究室借用此方法筛得了一株丝状真菌HSK8,经鉴定为夏孢生枝孢(Cladosporium uredinicola),并对该株真菌的发酵条件进行了优化,以期提高其对AFB1的降解率。同时对其降解机理也做了初步探索。
1.1菌种与培养基
一株以香豆素为唯一碳源筛得的丝状真菌HSK8,由湖北工业大学生物工程学院蔡俊教授研究室提供,4 ℃保藏于土豆葡萄糖琼脂(potato dextroseagar agar,PDA)培养基。
斜面培养基(g/L):土豆200、葡萄糖20、琼脂20;种子培养基(g/L):土豆200、葡萄糖20,吐温-80 1.0 mL;发酵培养基(g/L):蔗糖30、NaNO32.0、K2HPO4·3H2O 1.0、KCl 0.5、MgSO40.5、FeSO4·7H2O 0.01。
1.2试剂与仪器
AFB1以色列Fermentek公司;二氯甲烷(分析纯) 国药集团化学试剂有限公司;甲醇、乙腈(色谱级) 美国Fisher Scientific公司。
PHS-25 PH计 上海雷磁公司;3K15冷冻离心机德国Sigma公司;薄层层析(thin-layer chromatography,TLC)板 青岛海洋化工厂分厂;LC-20AD高效液相色谱仪 日本Shimadzu公司。
1.3 方法
1.3.1 菌种鉴定
菌种鉴定由中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)执行。内容包括:微生物菌株的形态特征鉴定,内部转录间隔区(internal transcribed spacer,ITS)序列、26S rRNA基因序列和18S rRNA基因序列的测定与分析。
1.3.2 生长曲线的测定
采用干质量法对HSK8菌株生长曲线进行测定。将HSK8菌株接种于种子培养基中后,于28 ℃条件下、180 r/min恒温培养,每4 h测定一次干质量。以培养时间为横坐标、菌体干质量为纵轴绘制生长曲线。
1.3.3 发酵温度对AFB1降解率的影响
以10%的接种量将HSK8种子液转接于发酵培养基中,分别于25、28、31、34、37、40 ℃条件下培养48 h,转速为180 r/min,装液量为50 mL/250 mL。研究发酵温度对AFB1降解率的影响。
1.3.4 装液量对AFB1降解率的影响
以10%的接种量将种子转接于发酵培养基中28 ℃、180 r/min条件下培养48 h,发酵培养基的装液量梯度为:25、50、75、100、125 mL/250 mL。研究装液量对AFB1降解率的影响。
1.3.5 接种量对AFB1降解率的影响
接种量梯度分别为1%、3%、6%、9%、12%、15%,发酵温度28 ℃,转速180 r/min,装液量75 mL/250 mL,培养时间48 h。研究接种量对AFB1降解率的影响。
1.3.6 发酵时间对AFB1降解率的影响
在发酵温度28 ℃,转速180 r/min,装液量75 mL/250 mL,接种量15%的条件下分别培养24、48、72、96、120、144 h。研究发酵时间对AFB1降解率的影响。
1.3.7 初始发酵液pH值对AFB1降解率的影响
在上述最优条件下,研究初始发酵液pH值对AFB1降解率的影响。初始pH值梯度设为:5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0。
1.3.8 AFB1降解率的测定
AFB1降解率的测定参考Teniola等[30]的方法。发酵液经10 000 r/min、4 ℃离心10 min,取上清液(950 μL)与AFB1(50 μL,终质量浓度1 μg/mL)混合,37 ℃条件下暗处反应24 h。反应混合液用等体积(1 mL)的二氯甲烷旋涡振荡萃取3 次,萃取液于50 ℃条件下真空干燥。之后用1 mL色谱甲醇溶解残余物,并用有机相滤膜(0.22 øm)过滤,混匀进样。以灭菌发酵培养基(950 μL)添加AFB1(50 μL)为对照组,对照组处理同上。高效液相色谱条件为:色谱柱:C18色谱柱(150 mm×4.6 mm,5 μm);流动相:甲醇-乙腈-水(1∶3∶6,V/V);流速:1 mL/min;进样量:20 μL;柱温:30 ℃;检测波长:370 nm和254 nm双波长检测。AFB1降解率按下式计算。
1.3.9 TLC检测AFB1及其降解产物
对上述的样品浓缩后于TLC上点样,点样量以AFB1(50 ng)为准。展开剂为:氯仿-丙酮(85∶15,V/V)。展开完毕后,将薄层板自然风干,然后于254 nm和365 nm波长紫外灯下检测。通过与AFB1标准品及上清组进行对照,观察实验组AFB1残余含量,以及其他物质的荧光特性。以此初步探索HSK8降解AFB1的机制。
2.1菌种鉴定
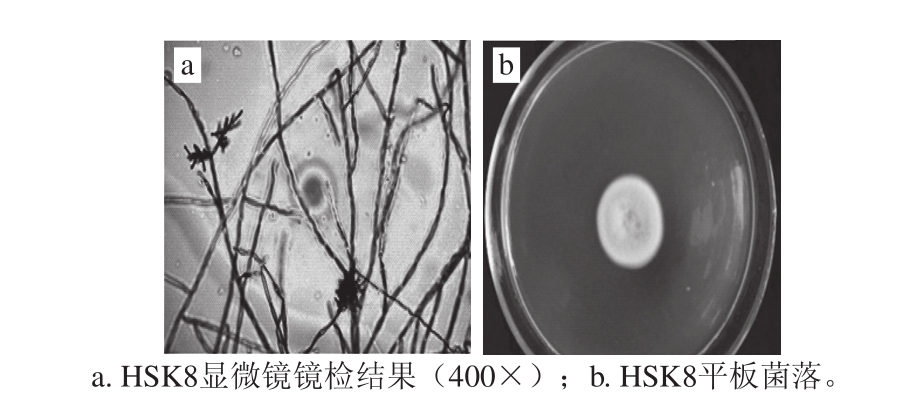
图1 HSK8形态学特征
Fig.1 Morphological properties of HSK8
如图1所示,HSK8的形态特征为:菌落粉状,反面黑绿色。分生孢子顶生或侧生,形成分枝的孢子链,椭圆形,淡橄榄绿色。
经BLAST验证,HSK8的ITS序列与夏孢生枝孢(Cladosporium uredinicola(GenBank登录号KJ913698.1))、尖孢枝孢(Cladosporium oxysporum isolate PJ12-36(GenBank登录号KC137278.1)、Cladosporium sp.B08(GenBank登录号HQ696043.1))具有99%的相似度;26S rRNA基因序列与珊瑚状枝孢菌(Cladosporium coralloides strain F-J555-1.1(GenBank登录号JQ388759.1)、Cladosporium sp.SF-6101(GenBank登录号KM458634.1)、Cladosporium sp.CB1(GenBank登录号KM232484.1))也具有99%的相似度;18S rRNA序列与布氏枝孢Cladosporium bruhnei strain USN 11(GenBank登录号JN397376.1)具有100%相似度。根据以上分析结果,HSK8菌株鉴定为夏孢生枝孢(Cladosporium uredinicola)。
2.2HSK8生长曲线
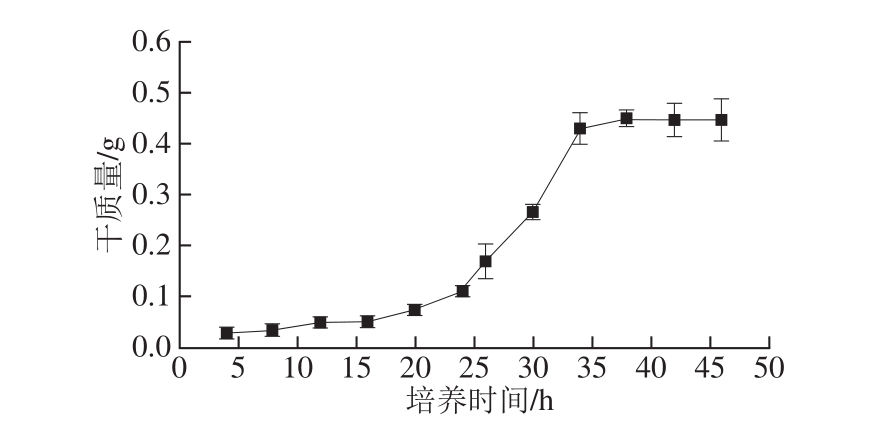
图2 28 ℃条件下HSK8于种子培养基中生长曲线
Fig.2 Growth curve of HSK8 in seed broth at 28 ℃
由图2可知,HSK8在0~24 h生长非常缓慢,24 h后开始进入对数生长期,于37 h后进入稳定期。鉴于真菌生长较慢,选择了34 h作为菌种生长时间。
2.3发酵温度对HSK8降解AFB1的影响

图3 发酵温度对AAFFBB1降解率的影响
Fig.3 Effect of fermentation temperature on AFB1degradation efficiency
由图3可知,25~34 ℃范围内AFB1降解率变化并不大,而对菌体生物量(干质量)有显著性影响,37 ℃和40 ℃条件下,发酵液一直处于澄清状态,无明显菌体生长现象,说明C.uredinicola不宜在较高温度下生长。在不严重影响微生物生长的情况下,选择降解率最高(40.68%)的28 ℃作为发酵温度。
2.4装液量对HSK8降解AFB1的影响

图4 装液量对AAFFBB1降解率的影响
Fig.4 Effect of medium loading volume on AFB1degradation efficiency
由图4可知,装液量25 mL/250 mL对应的AFB1降解率最高(44.36%),但经过48 h的发酵,菌体都黏在瓶底,剩余可流动的液体很少,这不利于以后活性物质的提取。从图4还可以看到,随着装液量的提高,发酵液p H值不断降低,这可能与溶氧有关。碱性环境(pH≥8.0)中AFB1的内酯环易被打开而导致荧光特性消失,并形成水溶性盐[31-32],不利于后期的降解机制研究。为了消除发酵液pH值对C.uredinicola降解AFB1的影响,一般在与AFB1反应前将发酵液pH值调至≤7.5(若最初≤7.5则不调节),对照组也调至相同pH值(下同)。文献[16,26]报道的降解率虽然很高,却常常忽略高pH值环境对AFB1的降解作用,所以在本研究中,发酵液的pH值也作为一个参考因素。图中AFB1降解率并不随装液量变化而梯度变化可能也是受发酵液pH值的影响。75 mL/250 mL时所对应的降解率与25 mL/250 mL时的相差不多,且pH值适中,综合考虑,把75 mL/250 mL作为发酵装液量。125 mL/250 mL装液量所对应的发酵液黏稠,在萃取过程中出现比较严重的乳化现象,严重影响萃取过程,也阻碍了对降解AFB1的活性物质的进一步分析,所以该组数据不作考虑。
2.5接种量对HSK8降解AFB1的影响
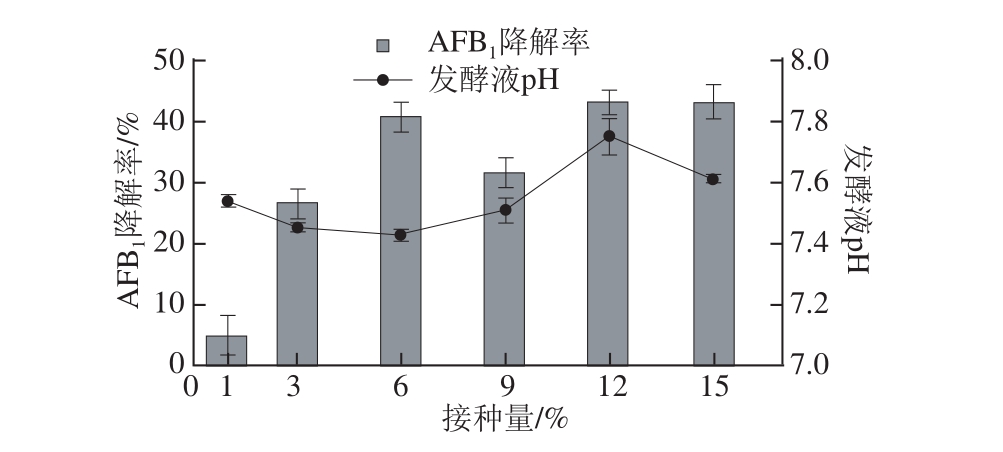
图5 接种量对AAFFBB1降解率的影响
Fig.5 Effect of inoculum size on AFB1degradation efficiency
如图5所示,接种量对AFB1降解率的影响是很明显的,6%、12%和15%的接种量条件下降解率相对较高,且相差不多。其中以15%的接种量对应的降解率最高,为43.14%,其发酵液pH值也相对较低,可能是因为培养基溶氧已达不到庞大的生物量的需求而导致酸性物质的产生,综合考虑,将15%选为发酵的接种量。15%接种量偏大,生产上不太实际,仅作为摇瓶发酵用,在后期的放大实验中会对该因素做进一步优化。
2.6发酵时间对HSK8降解AFB1的影响
如图6a所示,发酵时间对AFB1的降解率影响并不大,但发酵液pH值变化明显,基本上呈上升趋势。在3~6 d的时候发酵液变得特别黏稠,萃取时出现轻微的乳化现象。为了考虑到乳化现象对AFB1萃取的影响以及发酵液pH值的控制,对3 d后的实验结果不予考虑,同时对发酵时间进行更细化的优化,其结果如图6b所示,发酵36 h时对AFB1降解效果最好,达到70.31%。

图6 发酵时间对AAFFBB1降解率的影响
Fig.6 Effect of fermentation time on AFB1degradation efficiency
2.7初始pH值对HSK8降解AFB1的影响
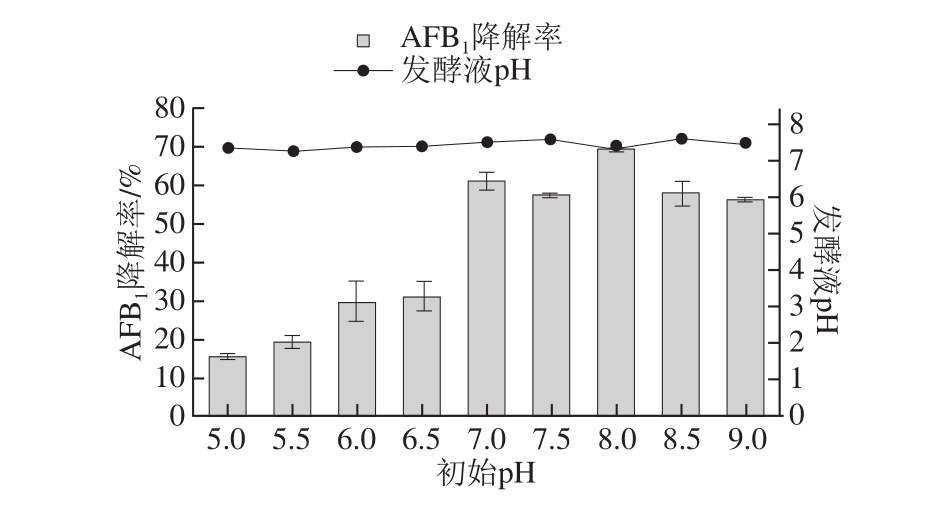
图7 初始pH值对AAFFBB1降解率的影响
Fig.7 Effect of initial pH on AFB1degradation efficiency
如图7所示,初始pH 8.0(不调节pH值)时AFB1降解率达到最高68.96%,与发酵时间优化后的结果类似。还可以看出,无论初始pH值高低,发酵完毕的发酵液pH值都约为7.5,可见微生物对环境有很强的适应性。
2.8降解机理初探
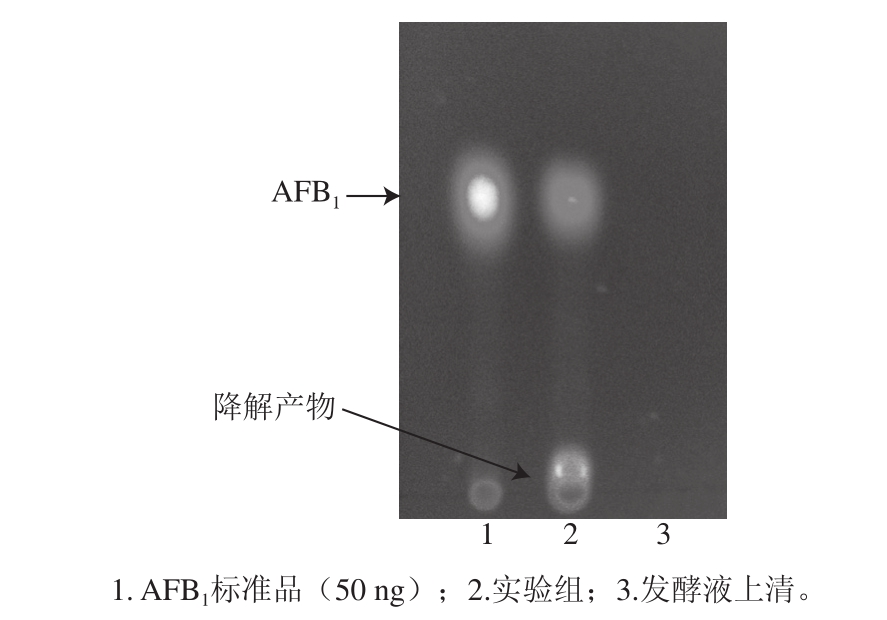
图8 AAFFBB1的TTLLCC检测
Fig.8 Detection of AFB1by TLC
由图8可知,实验组在接近点样点处有一新的荧光斑点,而AFB1斑点的亮度相对标准品则暗了许多,这说明AFB1被降解,且生成了一新的荧光物质。另外,产物的迁移率(Rf=0.038)相对AFB1(Rf=0.381)要小很多,而所用的展开剂是弱极性的,这一点说明产物的极性要明显强于AFB1。
Lee等[31]曾指出内酯环的破坏会导致AFB1荧光特性的消失,也有一些文献报道了具有荧光特性的AFB1降解产物,如Aflatoxicol可由Dactylium dendroides NRRL2575[14]、Corynebacterium rubrum、Aspergillus niger、Trichoderma viride、Mucor ambiguus[15]转化AFB1得到;刘大岭实验组发现假蜜环菌胞内酶可降解AFB1得到一具荧光特性产物[11]。Parker等[32]研究发现碱可以使AFB1荧光特性消失,而添加酸后,AFB1的荧光特性又得到恢复。因此从图8可以判断AFB1降解产物的内酯环是完整的,并未被破坏,猜测有可能是AFB1的双吡喃环发生改变。
通过形态学和系统发育研究分析确定HSK8为夏孢生枝孢(Cladosporium uredinicola)。通过单因素试验法优化,其发酵条件最终确定为:装液量75 mL/250 mL、发酵时间36 h、初始pH 8.0、接种量15%、发酵温度28 ℃,并且AFB1降解率从40.68%提高到了68.96%,提高了69.52%。在以上这些发酵条件中,发酵时间对AFB1降解率的影响最大,特别是在发酵时间为36 h条件下,AFB1降解率有了很大的提升。最后,经薄层层析检测样品发现了AFB1的一个降解产物,该产物能于365 nm波长处发出荧光,该特性能说明其内酯环未被破坏,同时其相对较小的Rf值还说明该产物的极性要比AFB1要大。接下来HSK8降解AFB1的发酵工艺的优化将继续进行,进一步提高AFB1降解率。同时对AFB1降解机理的研究也将更深入地进行,为以后的应用做铺垫。
参考文献:
[1]MARAGOS C.Measurement of aflatoxins using capillary electrophoresis[M]//TRUCKSESS M W,POHLAND A E.Mycotoxin protocols.New York:Humana Press,2001:51-58.DOI:10.1385/1-59259-064-0:51.
[2]GOTO T,WICKLOW D T,ITO Y.Aflatoxin and cyclopiazonic acid production by a sclerotium-producing Aspergillus tamarii strain[J].Applied and Environmental Microbiology,1996,62(11):4036-4038.
[3]KURTZMAN C P,HORN B W,HESSELTINE C W.Aspergillus nomius,a new aflatoxin-producing species related to Aspergillus fl avus and Aspergillus tamarii[J].Antonie van Leeuwenhoek,1987,53(3):147-158.
[4]ITO Y,PETERSON S W,WICKLOW D T,et al.Aspergillus pseudotamarii,a new aflatoxin producing species in Aspergillus section Flavi[J].Mycological Research,2001,105(2):233-239.
[5]PIERIDES M,El-NEZAMI H,PELTONEN K,et al.Ability of dairy strains of lactic acid bacteria to bind aflatoxin M1in a food model[J].Journal of Food Protection,2000,63(5):645-650.DOI:10.1016/S0278-6915(97)00160-9.
[6]WU Q,JEZKOVA A,YUAN Z,et al.Biological degradation of aflatoxins[J].Drug Metabolism Reviews,2009,41(1):1-7.DOI:10.1080/03602530802563850.
[7]LINE J E,BRACKETT R E.Factors affecting aflatoxin B1removal by Flavobacterium aurantiacum[J].Journal of Food Protection,1995,58(1):91-94.
[8]El-NEZAMI H,KANKAANPAA P,SALMINEN S,et al.Ability of dairy strains of lactic acid bacteria to bind a common food carcinogen,aflatoxin B1[J].Food and Chemical Toxicology,1998,36(4):321-326.DOI:10.1016/S0278-6915(97)00160-9.
[9]CIEGLER A,LILLEHOJ E B,PETERSON R E,et al.Microbial detoxification of aflatoxin[J].Applied Microbiology,1966,14(6):934-939.
[10]FAZELI M R,HAJIMOHAMMADALI M,MOSHKANI A,et al.Aflatoxin B1binding capacity of autochthonous strains of lactic acid bacteria[J].Journal of Food Protection,2009,72(1):189-192.
[11]LIU D L,YAO D S,LIANG R,et al.Detoxification of aflatoxin B1by enzymes isolated from Armillariella tabescens[J].Food and Chemical Toxicology,1998,36(7):563-574.
[12]李超波,李文明,杨文华,等.黄曲霉毒素B1降解菌的分离鉴定及其降解特性[J].微生物学报,2012,52(9):1129-1136.
[13]李俊霞,梁志宏,关舒,等.黄曲霉毒素B1降解菌株的筛选及鉴定[J].中国农业科学,2008,41(5):1459-1463.
[14]DETROY R W,HESSELTINE C W.Aflatoxicol:structure of a new transformation product of aflatoxin B1[J].Canadian Journal of Biochemistry,1970,48(7):830-832.
[15]MANN R,REHM H J.Degradation products from aflatoxin B1by Corynebacterium rubrum,Aspergillus niger,Trichoderma viride and Mucor ambiguus[J].European Journal of Applied Microbiology and Biotechnology,1976,2(4):297-306.
[16]SAMUEL M S,SIVARAMAKRISHNA A,MEHTA A.Degradation and detoxification of aflatoxin B1by Pseudomonas putida[J].International Biodeterioration & Biodegradation,2014,86:202-209.DOI:10.1016/j.ibiod.2013.08.026.
[17]ALBERTS J F,ENGELBRECHT Y,STEYN P S,et al.Biological degradation of aflatoxin B1by Rhodococcus erythropolis cultures[J].International Journal of Food Microbiology,2006,109(1):121-126.DOI:10.1016/j.ijfoodmicro.2006.01.019.
[18]LINE J E,BRACKETT R E,WILKINSON R E.Evidence for degradation of aflatoxin B1by Flavobacterium aurantiacum[J].Journal of Food Protection,1994,57(9):788-791.
[19]LIU D L,YAO D S,LIANG Y Q,et al.Production,purification,and characterization of an intracellular aflatoxin-detoxifizyme from Armillariella tabescens(E-20)[J].Food and Chemical Toxicology,2001,39(5):461-466.
[20]CAO H,LIU D,MO X,et al.A fungal enzyme with the ability of aflatoxin B1conversion:purification and ESI-MS/MS identification[J].Microbiological Research,2011,166(6):475-483.DOI:10.1016/j.micres.2010.09.002.
[21]WANG J,OGATA M,HIRAI H,et al.Detoxification of aflatoxin B1by manganese peroxidase from the white-rot fungus Phanerochaete sordida YK-624[J].FEMS Microbiology Letters,2011,314(2):164-169.DOI:10.1111/j.1574-6968.2010.02158.x.
[22]ALBERTS J F,GELDERBLOM W C A,BOTHA A,et al.Degradation of aflatoxin B1by fungal laccase enzymes[J].International Journal of Food Microbiology,2009,135(1):47-52.DOI:10.1016/j.ijfoodmicro.2009.07.022.
[23]ZEINVAND-LORESTANI H,SABZEVARI O,SETAYESH N,et al.Comparative study of in vitro prooxidative properties and genotoxicity induced by aflatoxin B1and its laccase-mediated detoxification products[J].Chemosphere,2015,135:1-6.DOI:10.1016/j.chemosphere.2015.03.036.
[24]MOTOMURA M,TOYOMASU T,MIZUNO K,et al.Purification and characterization of an aflatoxin degradation enzyme from Pleurotus ostreatus[J].Microbiological Research,2003,158(3):237-242.DOI:10.1078/0944-5013-00199.
[25]ZHAO L H,GUAN S,GAO X,et al.Preparation,purification and characteristics of an aflatoxin degradation enzyme from Myxococcus fulvus ANSM068[J].Journal of Applied Microbiology,2011,110(1):147-155.
[26]VIJAYANANDRAJ S,BRINDA R,KANNAN K,et al.Detoxification of aflatoxin B1by an aqueous extract from leaves of Adhatoda vasica Nees[J].Microbiological Research,2014,169(4):294-300.DOI:10.1016/j.micres.2013.07.008.
[27]SANDOSSKUMAR R,KARTHIKEYAN M,MATHIYAZHAGAN S,et al.Inhibition of Aspergillus fl avus growth and detoxification of aflatoxin B1by the medicinal plant zimmu(Allium sativum L.× Allium cepa L.)[J].World Journal of Microbiology and Biotechnology,2007,23(7):1007-1014.DOI:10.1007/s11274-006-9327-x.
[28]SALATI S,D’IMPORZANO G,PANSERI S,et al.Degradation of aflatoxin B1during anaerobic digestion and its effect on process stability[J].International Biodeterioration & Biodegradation,2014,94:19-23.DOI:10.1016/j.ibiod.2014.06.011.
[29]DAS A,BHATTACHARYA S,PALANISWAMY M,et al.Aflatoxin B1degradation during co-cultivation of Aspergillus flavus and Pleurotus ostreatus strains on rice straw[J].Biotech,2015,5(3):1-6.DOI:10.1007/s13205-014-0228-7.
[30]TENIOLA O D,ADDO P A,BROST I M,et al.Degradation of aflatoxin B1by cell-free extracts of Rhodococcus erythropolis and Mycobacterium fluoranthenivorans sp.nov.DSM44556 T[J].International Journal of Food Microbiology,2005,105(2):111-117.DOI:10.1016/j.ijfoodmicro.2005.05.004.
[31]LEE L S,DUNN J J,DELUCCA A J,et al.Role of lactone ring of aflatoxin B1in toxicity and mutagenicity[J].Experientia,1981,37(1):16-17.
[32]PARKER W A,MELNICK D.Absence of aflatoxin from refined vegetable oils[J].Journal of the American Oil Chemists Society,1966,43(11):635-638.
SHAO Shuai,DAI Jun,DU Xin,WANG Changgao,LIN Jianguo,CAI Jun*
(Hubei Collaborative Innovation Center for Industrial Fermentation,Key Laboratory of Fermentation Engineering,Ministry of Education,Hubei University of Technology,Wuhan 430068,China)
Abstract:In this study,a mould isolated for degrading aflatoxin B1was reported.Morphological studies coupled with internal transcribed spacer(ITS),18S ribosomal RNA gene sequence,26S ribosomal RNA gene sequence analyses indicated that the mould was Cladosporium uredinicola.Through single-factor experiments,the fermentation conditions were determined as follows:temperature 28 ℃,medium loading volume 75 mL/250 mL,inoculumamount 15%(V/V),fermentation time 36 h,initial pH 8.0.Under these conditions,the AFB1degradation efficiency was 68.96%,a 69.52% increase over that before optimization(40.68%).On the thin-layer chromatography(TLC)plate,a new dot was found which exhibited blue fluorescence at 365 nm.
Key words:aflatoxin B1(AFB1); identification; fermentation condition; degradation product
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)05-0138-06
DOI:10.7506/spkx1002-6630-201605025 10.7506/spkx1002-6630-201605025.http://www.spkx.net.cn 10.7506/spkx1002-6630-201605025.http://www.spkx.net.cn
*通信作者:蔡俊(1968—),男,教授,博士,研究方向为发酵工程,食品科学与工程,农产品加工与贮藏工程。
作者简介:邵帅(1991—),男,硕士研究生,研究方向为发酵工程。E-mail:1458674697@qq.com
基金项目:湖北省自然科学基金重点项目(2009CDA059)
收稿日期:2015-04-08