表1 小鼠灌胃剂量
Table 1 Gavage doses for mice in different groups
明 珠1,陈庆森1,*,刘雪姬1,闫亚丽1,赵林森2,赵 培1
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.河北一然生物科技有限公司,河北 石家庄 050899)
摘 要:研究乳源酪蛋白糖巨肽(casein glycomacropeptide,CGMP)对溃疡性结肠炎(ulcerative colitis,UC)小鼠肠道菌群多样性的影响,从肠道菌群角度探讨乳源CGMP改善溃疡性结肠炎与肠道菌群变化关系的可能机制。恶唑酮(oxazolone,OXZ)诱导小鼠UC模型,设立正常对照组、模型对照组、乳源CGMP组(50 mg/(kg·d))和柳氮磺胺吡啶(salazosulfapyridine,SASP)治疗组(40 mg/(kg·d)),其中正常对照组和模型对照组灌胃相应剂量的生理盐水,连续灌胃7 d。利用Ion Torrent PGM技术检测实验期间小鼠肠道菌群多样性的变化。UC小鼠肠道菌群结构失调,其肠道菌群多样性降低以及优势菌群比例下降。对测序序列通过主成分分析(principal component analysis,PCA)、UniFrac等统计分析发现,UC小鼠肠道中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroi detes)的丰度降低而放线菌门(Actinobacteria)和变形菌门(Proteobacteria)的丰度升高。乳源CGMP干预后UC小鼠肠道菌群多样性增加,厚壁菌门和拟杆菌门的相对比例高于模型组,提示乳源CGMP可通过调节失衡的肠道菌群来改善UC。
关键词:乳源酪蛋白糖巨肽;恶唑酮;溃疡性结肠炎;肠道菌群;Ion Torrent PGM技术
E-mail:ming_zhu999@126.com
引文格式:
明珠,陈庆森,刘雪姬,等.乳源酪蛋白糖巨肽对溃疡性结肠炎小鼠肠道菌群多样性的影响[J].食品科学,2016,37(5):154-161.DOI:10.7506/spkx1002-6630-201605028.http://www.spkx.net.cn
MING Zhu,CHEN Qingsen,LIU Xueji,et al.Effect of bovine casein glycomacropeptide(CGMP)on fecal microbiota community in mice with ulcerative colitis analyzed by Ion Torrent PGM platform[J].Food Science,2016,37(5):154-161.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605028.http://www.spkx.net.cn
乳源酪蛋白糖巨肽(casein glycomacropeptide,CGMP)是Delfour等[1]于1965年发现的一种含有唾液酸的糖肽,它来自于酪蛋白中唯一含有糖成分的蛋白质——牛乳κ-酪蛋白(κ-casein,κ-CN)。在干酪制作中,牛乳κ-CN被凝乳酶酶解后生成不溶性的副κ-CN(肽链的1~105部分)和可溶性的亲水多肽(肽链的106~169部分,称为酪蛋白巨肽,caseinomacropeptide,CMP)两部分。其中有30%~50%的CMP是以糖基化形式存在的,称为酪蛋白糖巨肽[2]。乳源CGMP具有多种生物学功能,如抑制细菌和病毒的黏附[3]、促进益生菌的增殖[4]和调节免疫系统应答[5]等。许多研究已对乳源CGMP在动物肠道内促进益生菌增殖的作用进行了探索,天津市食品生物技术重点实验室陈庆森团队研究证实乳源CGMP可以促进正常小鼠肠道内有益菌的增殖,抑制有害菌的生长[6],近期利用荧光原位杂交技术(fluorescence in situ hybridization,FISH)结合DNA染色技术又证实了乳源CGMP作为益生菌增殖性底物的显著功效。
炎症性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),是人类主要代谢性疾病之一。目前认为IBD的发病原因[7-8]为肠道微环境(肠道菌群)、宿主遗传易感性[9]和黏膜免疫[10]因素三者间的相互作用。Sellon等[11]曾在IL-10-/-敲除的小鼠中发现在肠道无菌条件下小鼠保持健康状态,但当在肠道内定植入典型的肠道共生菌时即引发结肠炎,说明肠道菌群与结肠炎的发生有关。Thompson等[12]随后的研究表明,肠道菌群在IBD的发生发展中起着重要作用,IBD患者的炎症部位和病变部位通常位于肠道内菌群浓度非常高的区域(如回肠和结肠)。在IBD的发病中,肠道菌群是作为一个整体而非某种单一细菌起作用,并提出IBD产生于宿主对共生菌群免疫应答的改变而非致病菌[13]。2010年华大基因分别对IBD患者和健康人群的肠道菌群进行测序,发现肠道菌群的基因有一部分基因与细菌在肠道内的功能有关,如对宿主细胞和蛋白质的附着作用等[14]。研究证明某些肽类物质可缓解UC的症状[15],并在UC的治疗上存在潜在的应用性[16]。López-Posadas[17]和Chen Qingsen[18]等发现CGMP可较好地保护结肠上皮细胞。同时研究发现Th1/Th2型细胞因子失衡是IBD发病的一个重要原因[19],贾玉臣等[20]发现CGMP可以调节Th1/Th2的平衡,抑制肠道免疫病理损伤。还有研究表明乳源CGMP可通过抑制核转录因子(nuclear factor,NF)-κB途径和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径来改善小鼠的UC[21]。
本实验在建立恶唑酮诱导小鼠UC模型的基础上,灌胃乳源CGMP进行连续干预7 d,取粪便,利用Ion Torrent PGM技术检测干预期间模型小鼠肠道菌群多样性的变化,以确定乳源CGMP是否通过调整肠道内微生物菌群结构变化来预防和改善溃疡性结肠炎作用。本研究将为生物活性短肽调控肠道微生物菌群改善肠道健康具有重要的理论价值和应用价值。
1.1实验动物与试剂
BALB/c小鼠(SPF级),雄性,体质量(25±2) g、小鼠常规饲料购自中国人民解放军军事医学科学院实验动物中心,许可证号SYXK(津)2012-0004。
CGMP(纯度71%) 新西兰Tatua公司;柳氮磺胺吡啶(salazosulfapyridine,SASP) 上海三维制药有限公司;恶唑酮(oxazolone,OXZ) 美国Sigma公司;琼脂糖凝胶 法国Biowest公司;DNA聚合酶、Buffer、dNTP 日本TaKaRa公司;Aidlab纯化试剂盒 北京艾德莱生物科技有限公司;通用引物 生工生物工程(上海)股份有限公司。
1.2仪器与设备
2.0Qubit®定量分析试剂盒、磁力架 美国Invitrogen公司;DYY-2电泳仪 北京六一仪器厂;N8050200 GeneAmp PCR System 美国ABI公司;508-U001 Ion Torrent测序平台、INS1005527Ion One TouchTM2、8441-21 Ion One TouchTMES 美国Life Technologies公司。
1.3实验分组与UC模型构建
BALB/c小鼠100 只,适应性喂养一周随机分为4 组:正常对照组、模型对照组、乳源CGMP组(50 mg/(kg·d))以及SASP治疗组(40 mg/(kg·d))。参考王姮等[22]的方法,略有改动。对小鼠腹部皮肤剃毛(2 cm×2 cm),涂搽3% OXZ 2 d进行致敏,致敏后的第2天晚上开始对小鼠禁食不禁水36 h,于第6天将硅胶管从肛门插入小鼠肠道约4 cm处,正常对照组灌注50%乙醇0.15 mL,模型对照组、CGMP组和SASP治疗组均灌注1% OXZ (OXZ溶于50%乙醇)0.15 mL。
灌胃:造模后,对每组小鼠进行灌胃,具体灌胃剂量见表1。灌胃开始记为第 1天,连续灌胃7 d。
表1 小鼠灌胃剂量
Table 1 Gavage doses for mice in different groups

1.4肠道菌群结构的分子分析
1.4.1 小鼠粪便细菌总DNA提取与扩增
1.4.1.1 粪便细菌总DNA的提取
分别于灌胃前(0 d)以及实验的第3、5、7、11天以及第21天用逼迫法分别采集4 组小鼠新鲜粪便约0.2 g,采用传统酚-氯仿法提取小鼠粪便细菌基因组DNA。具体操作步骤参考文献[23]。提取后的DNA用0.8%的琼脂糖凝胶电泳检测DNA的完整性,并使用Qubit®定量分析试剂盒测定DNA浓度。
1.4.1.2 粪便样本16S rRNA V3和V6区基因的扩增
本研究中2 4 个样本分别与V 3和V 6区带有1 0 b p b a r c o d e标记的引物进行聚合酶链式反应(polymerase chain reaction,PCR),并分别设有阴性对照,V 3区上游引物序列为5’-NNNNNNNNNNATTACCGCGGCTGCT-3’,下游引物序列为5’-NNNNNNNNNNCCTACGGGAGGCAGC AG-3’,其中下划线部分为扩增细菌16S rRNA基因V3区的通用引物。V 6区上游引物序列为5’-NNNNNNNN NNCGACAGCCATGCANCACC-3’,下游引物序列为5’-NNNNNNNNNNCNACGCGAAGAACCTTANC-3’,其中下划线部分为扩增细菌16S rRNA基因V6区的通用引物。NNNNNNNNNN为区别不同样本的10 个随机组合的核苷酸碱基。V3区PCR反应体系(25 μL)包括:1.25 U Pyrobest DNA聚合酶,2.5 μL 10×buffer(含2.5 mmol/L MgCl2),2 μL 2.5 mmol/L dNTP,引物各0.75 μL和300 ng模板DNA。PCR反应在Life Pro基因扩增仪内进行,扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共30 个循环;最后72 ℃延伸10 min。PCR产物用1.2%的琼脂糖凝胶电泳检测。V6区PCR反应体系(25 μL)包括:1.25 U Pyrobest DNA聚合酶,2.5 μL 10×Buffer(含2.5 mmol/L MgCl2),2 μL 2.5 mmol/L dNTP,引物各0.5 μL,模板DNA为3 μL。PCR反应在Life Pro基因扩增仪内进行,扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30 个循环,最后72 ℃延伸5 min。PCR产物用2%的琼脂糖凝胶 电泳检测。电泳结果显示,各样本电泳条带单一,说明所设计引物特异性较高,其中V6区PCR产物片段大小为108 bp,V3区为204 bp。V3区和V6区电泳凝胶使用Aidlab纯化试剂盒纯化并用Qubit测定浓度。每个样品取200 ng进行等量混合纯化进行后续的测序。测序在Ion Torrent平台上进行。
1.4.2 Ion Torrent测序
1.4.2.1 Ion Torrent测序结果的质控
根据Ion Torrent操作流程进行测序,对所得的测序结果进行质控,符合以下标准的序列给予保留:1)至少有一端的引物能被匹配;2)序列中未知碱基数≤2;3)序列长度≥50 bp。
1.4.2.2 生物信息分析
根据Barcode区分各样本序列,通过在线的QIIME (quantitative insights into microbial ecology)对序列进行划分分类操作单元(operational taxonomic units,OTU)和聚类分析。在种(97%相似度)的水平划分OTU,在每个OTU中选择冗余的序列作为OTU的代表序列,在Greengene上进行BLAST比对,鉴定其分类地位。利用OTU聚类产生的稀疏曲线(rarefaction curve)对取样深度进行分析,最后使用UniFrac分析样本间的进化关系。
1.5 统计分析
所有实验数据利用SPSS 11.5统计软件,进行单因素方差分析,处理结果均用![]() 表示。
表示。
2.1小鼠一般状态及体质量的变化
根据实验动物分组情况,观察并测定实验期间小鼠精神状态及体质量的变化,结果见图1。实验期间观察和测定的结果显示,OXZ模型对照组的小鼠表现为进食量减少,活动程度降低,并伴随有腹泻,肛部黏连等现象;而正常对照组小鼠表现为大便及饮食正常,毛发有光泽,乳源CGMP组与SASP治疗组的小鼠在实验的前3 d有腹泻反应。由图1可知,模型对照组、乳源CGMP组和SASP治疗组小鼠体质量在第3天与第0天相比下降,从第5天开始体质量上升,至实验结束与正常对照组接近一致。在第3天时,模型对照组小鼠体质量的下降程度较大,与乳源CGMP组和SASP治疗组产生显著性差异(P<0.05),乳源CGMP组和SASP治疗组与正常对照组的小鼠体质量也存在一定差异性(P<0.05)。
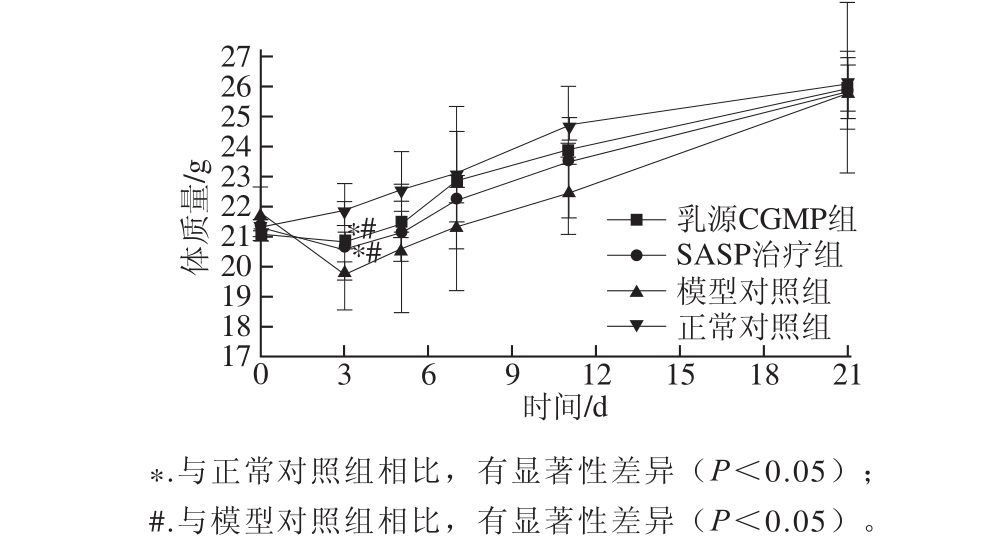
图1 各组小鼠体质量变化
Fig.1 Change in body weights of mice from various groups
2.2生物信息学分析
2.2.1 测序质量评估
通过对细菌16S rRNA基因V3和V6可变区的PCR扩增及测序,共得到748 361 条有效序列,本研究基于种的水平,经过97%序列相似度归并后V3区得到57 053 个OTUs,V6区得到64 312 个OTUs(图2)。群落的丰度和多样性以稀疏曲线、Shannon指数等形式进行说明。

图2 测序结果读长统计
Fig.2 Statistics of sequencing reads
2.2.2 小鼠肠道菌群的多样性分析
根据每个样本文库中的OTU丰度信息,使用稀疏曲线(rarefaction curve)、Shannon指数来评估个体化基因组测序(personal genome machine,PGM)结果的多样性,如图3、4所示。图3所示的稀释曲线显示序列较少时OTUs的数目显著增加,随着测序量的增大OTUs的数目增加缓慢,但仍未达到饱和,进一步提示小鼠肠道内仍有新的物种未被检测到。图4用来预测样本微生物菌群的多样性,虽然随着测序量的增加不断有新的物种出现,但Shannon指数曲线趋于平缓,基本达到饱和,说明本研究的测序量已基本能够反映小鼠肠道菌群的多样性。由Shannon多样性指数可以看出,UC小鼠肠道菌群多样性降低,其中以模型对照组表现最为明显,乳源CGMP组小鼠肠道菌群的多样性高于模型对照组和正常对照组,且乳源CGMP组第5天时的菌群多样性为所有样本中最高。说明灌胃一定剂量的乳源CGMP可以提高肠道菌群的多样性,促进肠道微生态平衡,从而具有与SASP治疗组相当的改善UC的效果。

图3 稀疏曲线
Fig.3 Rarefaction curve for human gut microbiome
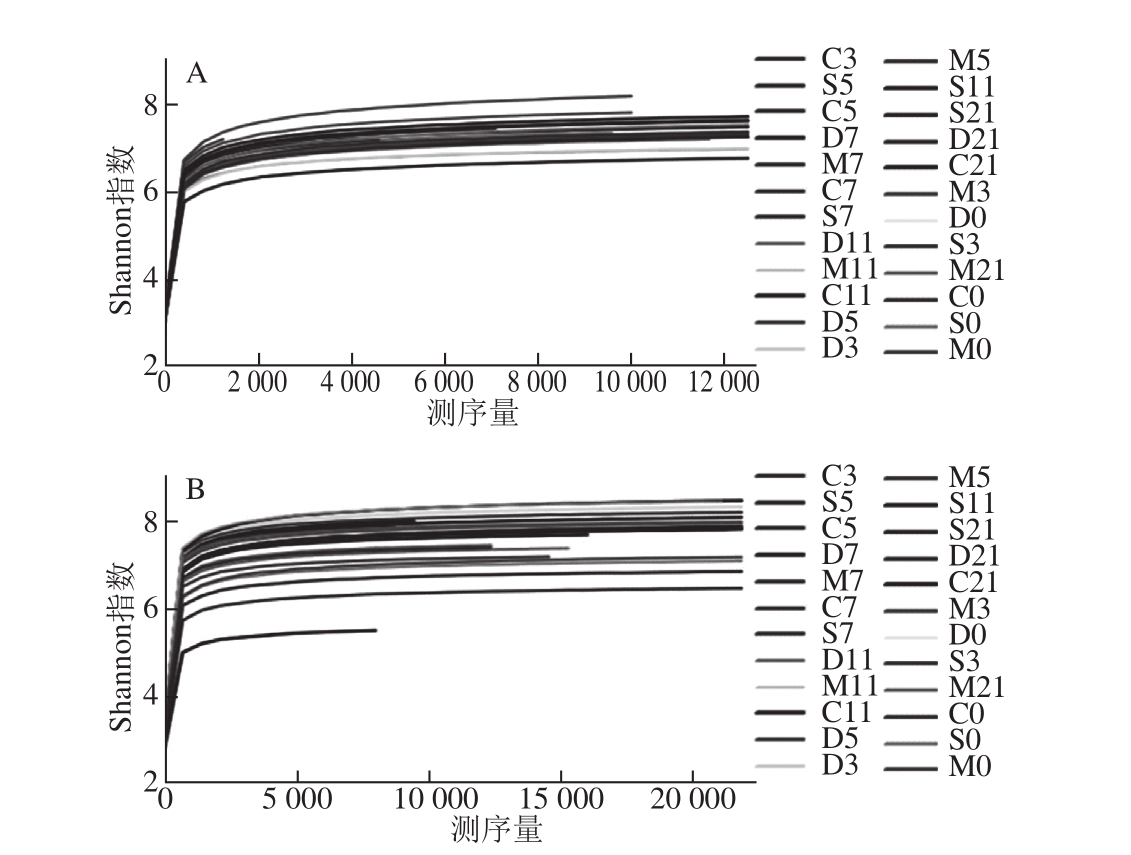
图4 Shannon多样性指数
Fig.4 Shannon’s diversity index
2.2.3 乳源CGMP对UC小鼠肠道菌群丰度影响的分析
图5从门的水平上对小鼠肠道内菌群的相对丰度变化进行了说明,V3区菌群丰度图(图5A)显示各组小鼠肠道菌群主要由拟杆菌门和厚壁菌门组成,总比例达到90%以上,其次为变形菌门和放线菌门。实验第5天模型对照组小鼠肠道内拟杆菌门由70%下降至48%,而乳源CGMP组和SASP治疗组小鼠中拟杆菌门的数量始终高于模型对照组,且乳源CGMP组与SASP治疗组相比无显著性差异,说明乳源CGMP可 促进肠道内拟杆菌门细菌的生长。此外,从图5A可以看出,柔膜菌门仅出现在乳源CGMP组,且比例较小。由图5B可以看出,V6区厚壁菌门在各组小鼠肠道中占有相当大的比例,拟杆菌门在各组小鼠肠道内的比例明显低于厚壁菌门,但模型对照组的厚壁菌门在乳源CGMP干预第3天数量最低。柔膜菌门在实验各组均有出现,但是重复性不高。
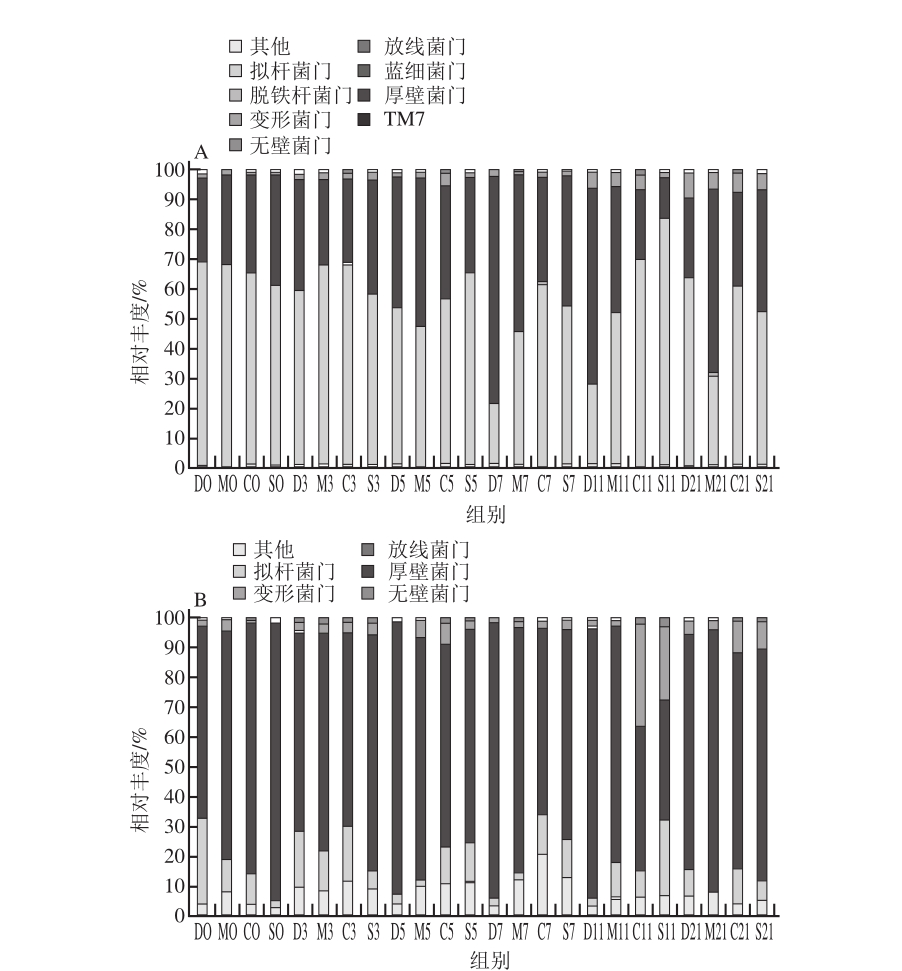
图5 各组小鼠肠道菌群门水平的丰度分析
Fig.5 Relative abundance of mouse intestinal flora in the phylum level
小鼠肠道菌群经V3区门水平的相对丰度分析表明,各组小鼠肠道内的主要菌属为拟杆菌属、普雷沃菌属(Prevotella)、Alistipes、梭菌属和乳杆菌属。实验的第3天,除正常对照组外,其余3 组拟杆菌属比例均有大幅度下降,到实验的第5天时达到最低水平(比例<5%),与正常对照组有极显著性差异(P<0.01)。灌胃结束时UC小鼠肠道内拟杆菌属有所上升,至实验结束时回到正常水平。普雷沃菌属在实验初始各组水平相差不大,第3天 UC小鼠肠道内该菌比例显著升高,在第5、7天时SASP治疗组内该菌属的比例超过总菌属的一半以上。Alistipes在各组小鼠肠道内的比例不大,但在乳源CGMP干预第5天,在乳源CGMP组内数量显著升高。此外,在第11天可看到乳源CGMP组内Blautia的水平高于其他3 组,且模型对照组在实验结束时肠道内出现一定比例的Mucispirillum。对实验各组在实验期间菌属种类和水平的变化进行比较发现,乳源CGMP组小鼠肠道菌属种类多,研究提示对UC模型小鼠灌胃乳源CGMP可以增加肠道内菌群的多样性。各组小鼠肠道内除未检测到的菌属外,主要包含Blautia、梭菌属、粪球菌属、普雷沃氏菌属、螺杆菌属和拟杆菌属6 种。在实验第3天开始对各组肠道菌属比较发现,模型对照组不含Alistipes。乳源CGMP组肠道菌属的多样性高于其余各组,且Blautia在实验第11天的乳源CGMP组合药物组内比例较高,并出现有较小比例的链球菌属,提示乳源CGMP有可能有益于Blautia和链球菌属的增殖。
2.2.4 UC模型小鼠肠道菌群结构的比较
从肠道菌群多样性的比较发现模型组小鼠出现菌群多样性减少的现象。应用主成分分析法(principal component analysis,PCA)研究各组小鼠菌群整体结构的差异性。如图6、7所示,对所有样本在97%序列相似性水平下划分的OTU进行主成分分析,图6表明实验开始时各组小鼠肠道菌群之间具有差异性,模型对照组与其余3 组的差异主要在PC2方向上,PC2能够解释6.43%的差异性。在整个实验过程中除模型对 照组在第11天与其余各组菌群相似性不大,在实验结束时发现SASP治疗组的菌群结构与正常对照组的相似性极高,而乳源CGMP组与实验开始时的正常对照组菌群相似性较为一致,说明乳源CGMP可以调节UC小鼠肠道菌群的平衡。由图6C可以看出M7、M11、M21与S21和其余各组结构相似性均较低,在PC3方向上具有差异,PC3可解释5.77%的差异性。即模型对照组肠道菌群结构与其余各组具有差异性,SASP治疗在一定程度上也会改变肠道菌群的结构特征。
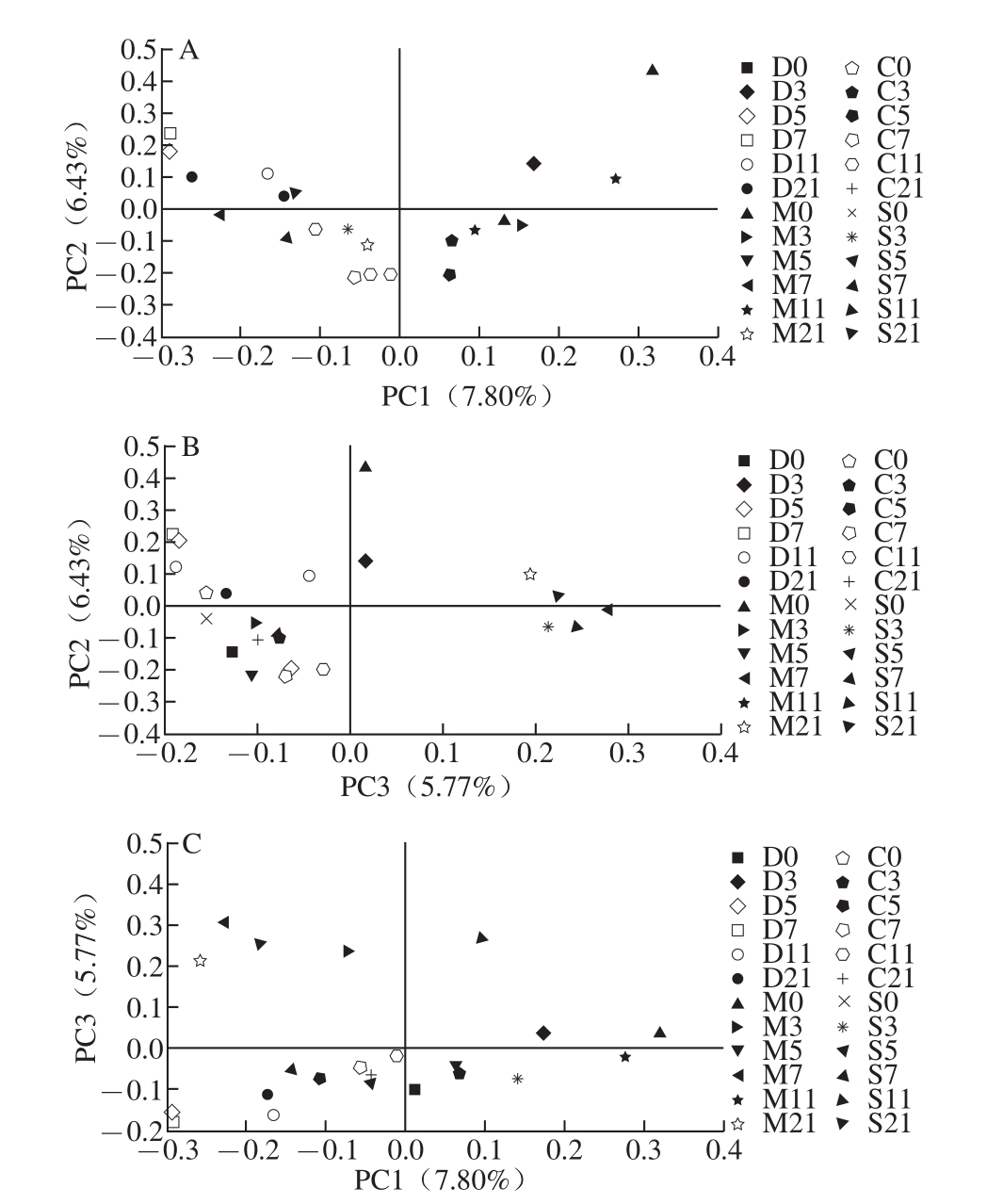
图6 V3区主成分分析图
Fig.6 Comparison of gut microbiota composition among four groups based on 16S rRNA gene V3 region by principal components analysis(PCA)
如图7B所示,M1 1、C11、S1 1、C7与实验开始时4 组(D0、M0、C0和S0)的菌群结构有一定的相似性。但以上实验样本与其余样本相比,在PC3方向具有差异性,且PC3可解释5.11%。说明UC小鼠在实验的第11天肠道菌群基本恢复到正常水平。在乳源CGMP干预第5天显示乳源CGMP组和SASP治疗组肠道菌群与正常对照组第21天的结构相似,其中乳源CGMP组的相似性稍高,进一步揭示乳源CGMP具有调节肠道菌群的能力,且作用效果优于药物治疗。图7C显示模型对照组在乳源CGMP干预结束时肠道菌群结构发生显著变化,与其他3 组的菌群结构差异显著。以上分析表明UC小鼠肠道内的确存在肠道菌群失调现象,对UC模型进行乳源CGMP和SASP干预后发现在较短短期内便可调节肠道菌群的平衡,且乳源CGMP的调节效果优于药物治疗,由此可得出适宜剂量的乳源CGMP可以通过调整肠道微生态平衡达到改善UC的病理状况。

图7 V6区主成分分析图
Fig.7 Comparison of gut microbiota composition among four groups based on 16S rRNA gene V6 region by principal components analysis(PCA)
2.2.5 聚类分析
由PCA分析可知模型组在UC的恢复期与SASP治疗组的菌群结构具有相似性,聚类分析结果(图8)显示在乳源CGMP干预的第3天正常对照组与其余3 组的肠道菌群结构有明显的差异性,说明UC模型对照小鼠与正常对照小鼠相比,肠道菌群结构发生改变。乳源CGMP组和SASP治疗组除第7天具有一定的差异性外,其余各取样点的菌群结构均呈现一致性,进一步揭示在调节肠道菌群方面,乳源CGMP具有和肠道炎症治疗药物相当的作用效果;从图8B中也可以得出以上结论。
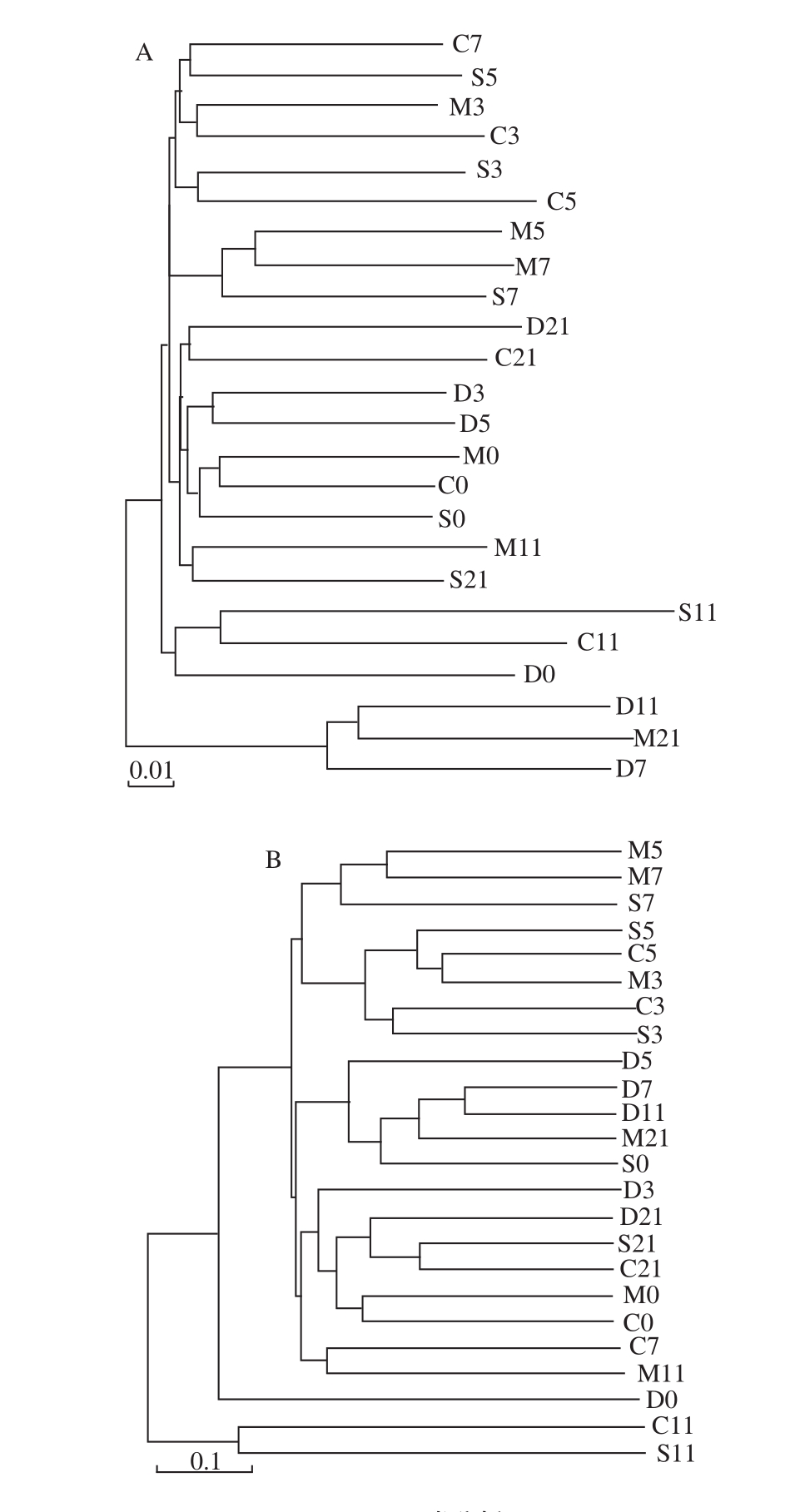
图8 聚类分析图
Fig.8 Cluster diagram
2.2.6 UC相关的特定细菌类群的鉴定
通过对测序序列信息进行分类分析,在97%相似度下对24 个样本从门到属进行各个水平的分类汇总。对V3和V6两个可变区综合分析发现,在门的水平上,Firmicutes和Bacteroidetes在UC模型的第3天总的比例出现下降。将这两大菌门在属水平上进行比较,UC模型Bacteroides属的比例下降,与正常对照组相比差异极显著(P<0.01),Prevotella属的比例则升高,说明Bacteroidetes门水平上的差异主要是由Bacteroides和Prevotella属水平变化引起的。另一方面,Firmicutes中Clostridium在UC小鼠肠道内的比例增加,且Coprococcus在模型对照组中的比例较其他3 组始终处于较低水平,但差异不显著。到乳源CGMP干预的第21天发现模型对照组出现有一定比例的Mucispirillum。在对实验各组中的Lactobacillus的丰度进行比较发现,Lactobacillus在实验的第11天乳源CGMP组比例急剧升高,与正常对照组和模型组有极显著性差异(P<0.01),与SASP治疗组相比差异显著(P<0.05),而在其他取样点发现无差异。
宿主内的肠道菌群受遗传因素、生活环境、饮食习惯以及年龄等诸多因素的影响,宿主肠道菌群结构具有个体差异性。健康动物肠道菌群保持平衡,宿主与肠道菌群之间维持一种互惠共生的关系。但当受到宿主自身以及外界环境的干扰时,肠道菌群结构发生改变。越来越多的研究表明,肥胖、糖尿病以及炎症性肠病等慢性代谢疾病均伴随有肠道菌群失调现象[24]。Manichanh等[25]应用宏基因组文库研究CD患者肠道菌群的多样性,结果说明Firmicutes在CD患者肠道中的比例明显减少,应用FISH技术对该菌门内的细菌进行定量分析后发现有益菌的数量显著降低,揭示CD患者肠道菌群多样性降低。本研究发现UC模型小鼠肠道内存在肠道菌群失调现象,主要为菌群组成的改变和多样性的降低。表现在厚壁菌门 (Firmicutes)和拟杆菌门(Bacteroidetes)两大菌门在肠道中比例的下降,变形菌门(Proteobacteria)和放线菌门(Actinobacteria)丰度相对升高,通过对各组实验样品进行相似性比较及聚类分析发 现,UC小鼠肠 道菌群多样性降低,其中以模型对照组表现最为明显,乳源CGMP组在对UC模型进行干预后,其组内小鼠肠道菌群的多样性高于模型对照组和正常对照组,说明灌胃一定剂量的乳源CGMP可以提高肠道菌群的多样性。研究结果与Frank等[26]的研究结论有一定的相关性。通过属水平的研究得到UC小鼠肠道内Bacteroides水平与正常对照组相比急剧降低,而Clostridium和Prevotella group出现升高趋势,其中SASP治疗组中Prevotella group在乳源CGMP干预的第5、7天比例显著升高,含量超过所含总菌属的一半以上。Bacteroidetes门中的Prevotella为机会致病菌,且有研究证明该菌属细菌表面的脂多糖(lipopolysaccharide,LPS)可促进人体成纤维细胞分泌IL-8 mRNA,进而加重炎症反应[27]。Bacteroides是人结肠内优先产生丁酸盐和短链脂肪酸(short chain fatty acid,SCFA)的主要菌,本研究中结果发现Bacteroides水平降低,这与之前发现的IBD患者粪便样本中SCFA的浓度降低相一致。此外,丁酸盐为结肠上皮细胞的主要能量来源,可以通过组蛋白的高度 乙酰化和抑制NF-κB信号通路来作为肠黏膜促炎细胞因子表达的抑制剂,丁酸盐还可以促进黏蛋白和抗菌肽的产生来增强肠屏障功能,通过直接提高紧密结合蛋白的表达来增强肠上皮细胞的完整性[28]。因此,丁酸盐水平的降低被认为与IBD的炎症反应增强有关,并已被作为治疗IBD的可能靶点[29]。Furet等[30]在研究肥胖患者经胃旁路术(roux-en-y gastric bypass,RYGB)治疗后肠道菌群的变化时发现肥胖患者手术前体内Bacteroides/Prevotella group的比例明显低于健康人群,且在手术治疗后的3 个月比例有所升高。本研究中UC模型小鼠灌胃SASP前后,Bacteroides/Prevotella group的比例明显下降。因此,推测药物治疗组虽能有效治疗UC,但可能会导致肥胖症的产生。Walker等[31]应用高通量克隆文库技术和Q-PCR研究了IBD患者炎症部位和非炎症部位肠黏膜相关的菌群结构的变化,研究表明IBD患者肠道炎症部位和非炎症部位菌群结构存在很大差异性,Firmicutes在IBD患者肠道内比例降低,而Bacteroidetes和Enterobacteriaceae在CD病人中发现呈现升高趋势。揭示IBD所出现的菌群失调现象可能是肠道环境的改变所引起,与疾病的发生无关。本研究认为乳源CGMP可以在较短时间内纠正UC模型小鼠肠道内的菌群状态,且乳源CGMP的调节效果优于药物治疗,因此,本研究证实适宜剂量的乳源CGMP可以通过调整肠道微生态平衡达到改善UC的效果,对聚类分析结果亦得出相同的结论。
本研究采用个体化基因组测序(PGM)系统(Ion Torrent测序)探讨了乳源CGMP对UC模型小鼠肠道菌群多样性的影响,发现UC模型小鼠肠道中厚壁菌门和拟杆菌门的丰度降低而放线菌门和变形菌门的丰度升高。研究结果还显示乳源CGMP具有调节肠道菌群的能力,提示乳源CGMP干预UC小鼠后,其肠道菌群多样性增加,在改善结肠炎症方面,本研究结果发现且调控修复的效果优于SASP药物治疗。因此,CGMP可通过纠正肠道菌群失衡,维护肠道屏障功能来减轻炎症反应,为乳源生物活性肽在营养性治疗IBD方面提供一定的理论支持。
参考文献:
[1]DELFOUR A,JOLLES J,ALAIS C,et al.Caseinoglycopeptides:characterization of a methionin residue and of the N-terminal sequence[J].Biochemical and Biophysical Research Communications ,1965,13(19):452-455.DOI:10.1016/0006-291X(65)90145-2.
[2]THOME W C,SORENSEN J,LOPEZ F R.Health effects and technological features of caseinomacropeptide[J ].International Dairy Journal,2006,16(11):1324-1 333.DOI:10.1016/j.id airyj.2006.06.012.
[3]VACCA S A M,BOWEN W H.The effects of milk and κ-casein on salivary pellicle formed on hydroxyapatite discs in situ[J].Caries Research,2000,34(1):88-93.DOI:10.1159/000016558.
[4]BRUCK W M,KELLEHER S L,GIBSON G R,et al.rRNA probes used to quantify the effects of glycomacropeptide and alphalactalbumin supplementation on the predominant groups of intestinal bacteria of infant rhesus monkeys challenged with enteropathogenic Escherichia coli[J].Journal of Pediatric Gastroenterology and Nutrition,2003,37:273-280.DOI:10 .1097/00005176-200309000-00014.
[5]OTAIN H,HATA I.Inhibition of proliferative responses of mouse spleen lymphocytes and rabbit Peyer’s patch ceils by bovine milk caseins and their digests[J].Journal of Dairy Research,1995,62(2):339-348.DOI:10.1017/S0022029900031034.
[6]曹晋宜,陈庆森,王友湘,等.酪蛋白糖巨肽(CGMP)对小鼠肠道菌群消长规律的影响[J].食品科学,2007,28(11):536-540.DOI:10.3321/j.issn:1002-6630.2007.11.130.
[7]BIASI F,LEONARDUZZI G,OTEIZA P I,et al.Inflammatory bowel disease:mechanisms,redox considerations,and therapeutic targets[J].Antioxidants & Redox Signaling,2013,19(14):1711-1747.DOI:10.1089/ars.2012.4530.
[8]HUTTENHOWER C,KOSTIC A D,XAVIER R J.Inflammatory bowel disease as a model for translating the microbiome[J].Immunity,2014,40(6):843-845.DOI:10.1016/j.immuni.2014.05.013.
[9]KNIGHTS D,LASSEN K G,XAVIER R J.Advances in inflammatory bowel disease pathogenesis:linking host genetics and the microbiome[J].Gut,2013,62(10):1505-1510.DOI:10.1136/gutjnl-2012-303954.
[10]ORD˘S I,ECKMANN L,TALAMINI M,et al.Ulcerative colitis[J].The Lancet,2012,380:1606-1619.DOI:10.1016/S0140-6736(12)60150-0.
[11]SELLON R K,TONKONOGY S,SCHULTZ M,et al.Resident enteric bacteria are necessary for development of spontaneous colitis and immune system activation in interleukin-10-deficient mice[J].Infection and Immunity,1998,66:5224-5231.
[12]THOMPSON C O C,MALDONADO J,GIL A.Aetiology of inflammatory bowel disease(IBD):role of intestinal microbiota and gutassociated lymphoid tissue immune response[J].Clinical Nutrition,2005,24:339-352.DOI:10.1016/j.clnu.2005.02.009.
[13]SHANAHAN F.Probiotics in inflammatory bowel disease-therapeutic rationale and role[J].Advanced Drug Delivery Reviews,2004,56:809-818.DOI:10.1016/j.addr.2003.11.003.
[14]QIN J,LI R,RAES J,et al.The human gut microbial gene catalogue established by matagenomic sequencing[J].Nature,2010,464:59-65.DOI:10.1007/978-1-4614-6418-1_752-1.
[15]AZUMA K,OSAKI T,TSUKA T,et al.Effects of fish scale collagen peptide on an experimental ulcerative colitis mouse model[J].Pharmanutrition,2014,2:161-168.DOI:10.1016/j.phanu.2014.10.001.
[16]KIM S D,KWON S,LEE S K,et al.The immune-stimulating peptide WKYMVm has therapeutic effects against ulcerative colitis[J].Experimental & Molecular Medicine,2013,45(5):875-884.DOI:10.1038/emm.2013.77.
[17]LŁPEZ-POSADAS R,REQUENA P,GONZ˘LEZ R,et al.Bovine glycomacropeptide has intestinal antiinflammatory effects in rats with dextran sulfate-induced colitis[J].Journal of Nutrition,2010,140(11):2014-2019.DOI:10.3945/jn.109.118448.
[18]CHEN Q,WANG H,ZHU C,et al.Anti-apoptotic effects of milkderived casein glycomacropeptide on mice with ulcerative colitis[J].Food & Agricultural Immunology,2014,25(4):453-466.DOI:10.108 0/09540105.2013.823912.
[19]RADFORD-SMITH G,JEWELL D P.Cytokines and inflammatory bowel disease[J].Bailliere’s Clinical Gastroenterology,1996,10(1):151-164.DOI:10.1016/S0950-3528(96)90045-7.
[20]贾玉臣,陈庆森.乳源糖巨肽对小鼠IFN-γ和IL-4的调节作用[J].中国乳品工业,2010,38(11):11-14.DOI:10.3969/j.issn.1001-2230.2010.11.003.
[21]MING Z,JIA Y C,CHEN Q,et al.Amelioration effect of bovine casein glycomacropeptide on ulcerative colitis in mice[J].Food & Agricultural Immunology,2015,26(5):717-728.DOI:10.1080/09540105.2015.1018874.
[22]王姮,欧阳钦,罗文杰.恶唑酮结肠炎小鼠模型的建立[J].胃肠病学,2004,9(2):77-80.DOI:10.3969/j.issn.1008-7125.2004.02.004.
[23]金晶,彭颖,李晓波.快速提取肠道微生物基因组DNA的方法[J].现代生物医学进展,2007,7(1):100-103.DOI:10.3969/j.issn.1673-6273.2007.01.034.
[24]贾玉臣,陈庆森.乳源酪蛋白糖巨肽改善小鼠溃疡性结肠炎的研究[J].食品科学,2010,31(21):365-368.DOI:10.3969/j.issn.1001-2230.2010.11.003.
[25]MANICHANH C,RIGOTTIER G L,BONNAUD E,et al.Reduced diversity of fecal microbiota in Crohn’s disease revealed by a metagenomic approach[J].Gut,2006,55(2):205-211.DOI:10.1136/gut.2005.073817.
[26]FRANK D N,AMAND A L S,FELDMAN R A,et al.Molecularphylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases[J].Proceedings of the National Academy of Sciences,2007,104(34):13780-13785.DOI:10.1073/pnas.0706625104.
[27]TAMURA M,TOKUDA M,NAGAOKA S,et al.Lipopolysaccharides of Bacteroides intermedius(Prevotella intermedia)and Bacteroides(Porphyromonas)gingivalis induce interleukin-8 gene expression in human gingival fibroblast cult ures[J].Infection and Immunity,1992,60(11):4932-4937.
[28]VANHOUTVIN S A,TROOST F J,HAMER H M,et al.Butyrateinduced transcriptional changes in human colonic mucosa[J].PLoS ONE,2009,4(8):e6759.DOI:10.1371/journal.pone.0006759.
[29]GALVEZ J,RODR¸GUEZ C M E,ZARZUELO A.Effects of dietary fiber on inflammatory bowel disease[J].Molecular Nutrition & Food Research,2005,49(6):601-608.DOI:10.1002/mnfr.200500013.
[30]FURET J P,KONG L C,TAP J,et al.Differential adaptation of human gut microbiota to bariatric surgery-induced weight loss:links with metabolic and low-grade inflammation markers[J].Diabetes,2010,59(12):3049-3057.DOI:10.2337/db10-0253.
[31]WALKER A W,SANDERSON J D,CHURCHER C,et al.Highthroughput clone library analysis of the mucosa-associated microbiota reveals dysbiosis and differences between inflamed and non-inflamed regions of the intestine in inflammatory bowel disease[J].BMC Microbiology,2011,11(2):7.DOI:10.1186/1471-2180-11-7.
MING Zhu1,CHEN Qingsen1,*,LIU Xueji1,YAN Yali1,ZHAO Linsen2,ZHAO Pei1
(1.Tianjin Key Laboratory of Food Biotechnology,College of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134,China; 2.Hebei Inatural Biological Technical Company,Shijiazhuang 050899,China)
Abstract:In order to investigate the modulation of casein glycomacropeptide(CGMP)on the diversity of intestinal flora in mice with ulcerative colitis(UC),an oxazolone-induced mouse model with ulcerative colitis was used to explore the intestinal flora in the presence of CGMP and the mechanism underlying the treatment of ulcerative colitis through CGMP.The mice with oxazolone-induced ulcerative colitis were divided into four groups including normal control group,model control group,CGMP group and salazosulfapyridine(SASP)group.After oxazolone challenge,the mouse in model control group were given regular feed as same as that provided to normal control group,and the mice in CGMP group and SASP group were administrated with CGMP at 50 mg/(kg·d)and SASP at 40 mg/(kg·d)for 7 consecutive days.Ion Torrent sequencing technology was appl ied to detect the diversity of intestinal flora in mice.Marked structural cha nges were discovered i n the gut microbiota of mice with ul cerative colitis,showing a reduction in intestinal flora diversity and decline in dominant bacterial populations.The sequencing data were analyzed by multivariate statistical methods and the results s howed that the abundance of Bacteroidetes and Firmicutes were significantly decreased,whereas Actinobacteria and Proteobacteria were increased.The intestinal bacterial diversity in UC mice was increased after the intervention of CGMP,indicating that CGMP could improve the oxazolone-induced ulcerative colitis of mice by adjusting the imbalanced intestinal flora.
Key words:casein glycomacropeptide(CGMP); oxazolone; ulcerative colitis; intestinal microbiota; Ion Torrent PGM platform
中图分类号:book=155,ebook=162TS201.3
文献标志码:A
文章编号:1002-6630(2016)05-0154-08
DOI:10.7506/spkx1002-6630-201605028
*通信作者:陈庆森(1957—),男,教授,硕士,研究方向为发酵生物技术、功能成分与肠道健康的关系。
作者简介:明珠(1992—),女,硕士研究生,研究方向为发酵生物技术、功能成分与肠道健康的关系。
基金项目:国家自然科学基金面上项目(31071522)
收稿日期:2015-07-22