
王炎炎1,宋志秀1,2,杨立刚1,夏 惠1,孙桂菊1,*
(1.东南大学公共卫生学院营养与食品卫生学系,环境医学工程教育部重点实验室,江苏 南京 210009;2.南京中医药大学第二临床医学院,江苏 南京 210046)
摘 要:目的:研究二十碳五烯酸(eicosapentaenoic acid,EPA)对THP-1巨噬细胞源性泡沫细胞形成的影响。方法:将THP-1单核细胞、佛波酯(phorbol myristate acetate,PMA)和氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)共同培养建立泡沫细胞模型,以不同浓度(200、100、50 μmol/L)的EPA处理细胞48 h后,采用酶法测定细胞内总胆固醇(total cholesterol,TC)及胆固醇酯(cholesterol ester,CE)含量,采用酶联免疫吸附实验(euzyme-linked immunosorbent assay,ELISA)测定细胞上清液中白细胞介素-6(interleukin-6,IL-6)及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的含量,采用半定量反转录聚合酶链式反应(reverse transcript polymerase chain reaction,RT-PCR)测定三磷酸腺苷结合盒转运体A1(ATP binding cassette transporter A1,ABCA1)mRNA表达水平。结果:与模型组比较,EPA干预组细胞内TC及CE含量均降低,并存在显著差异(P<0.05);细胞上清液中IL-6及TNF-α含量也显著降低(P<0.05),并具有量-效关系;低浓度的EPA具有上调ABCA1 mRNA表达的作用。结论:EPA能够降低泡沫细胞内TC的蓄积,抑制泡沫细胞的形成,降低IL-6及TNF-α炎性因子的分泌水平,能够上调ABCA1 mRNA表达水平,进而预防动脉粥样硬化的发生发展。
关键词:二十碳五烯酸;泡沫细胞;动脉粥样硬化
江苏省普通高校研究生科研创新计划项目(SJZZ_0031);中国营养学会营养科研基金-帝斯曼专项科研基金项目(201326)
Effect of Eicosapetaenoic Acid on THP-1 Macrophage-Derived Foam Cell Formation and Its Mechanism of Action
WANG Yanyan1,SONG Zhixiu1,2,YANG Ligang1,XIA Hui1,SUN Guiju1,*
(1.Key Laboratory of Environmental Medicine and Engineering,Ministry of Education,Department of Nutrition and Food Hygiene,School of Public Health,Southeast University,Nanjing 210009,China; 2.Second Clinical Medical College,Nanjing University of Chinese Medicine,Nanjing 210046,C hina)
Abstract:Objective:To investiga te the effect of eicosapetaenoic acid(EPA)on the formation of THP-1 monocyte-derived foam cells.Methods:THP-1 monocytes were cultured with phorbol myristate acetate(PMA)and oxidized low-density lipoprotein(ox-LDL),and intervened by EPA at concentrations of 200,100 and 50 μmol/L for 48 hours.The cholesterol content of foam cells was measured by cholesterol kit.The concentrations of IL-6 and TNF-α in culture supernatant were detected by ELISA.The expression of ATP-binding cassette transporter A1(ABCA1)was detected by semi-quantitative reverse transcription-polymerase chain reaction(RT-PCR).Results:EPA decreased the intracellular concentration of cholesterol(P < 0.05)when compared with the control group.EPA decreased the concentrations of IL-6 and T NF-α in culture supernatant(P < 0.05)in a dose-dependent manner and low-dose EPA increased the expression of ABCA1 mRNA.Conclusion:EPA reduces the accumulation o f intracellular cholesterol and inhibits the transformation of macrophages into foam cells.EPA decreases the secret ion of inflammatory factor and low-dose of EPA increases the expression of ABCA1 mRNA,which may partially explain its anti-atherosclerotic activity. Phycobiliprotein is a light-harvesting pigment in red and blue-green algae.It is widely used in the pharmaceutical industry due to its antioxidant activity and anticancer activity.In Nostoc sphaeroides Kützing,phycocyanin and phycoerythrin are major varieties of phycobiliprotein.However,the effect of Nostoc sphaeroides Küting phycobiliprotein(NSKP)on immune functions remains unclear.In the present study,the immunoenhancing effect of NSKP in Kunming mice was explored.The mice were administered with NSKP at dosages of 100,300 and 500 mg/(kg·d)(body mass)by gavage once a day.After administration for 30 consecutive days,the immune parameters including the phagocytosis of peritoneal macrophages,natural killer cell activity,the proliferation of T lymphocytes,cytokines levels,antibody production,hemolytic complement activity and delayed-type hypersensitivity were measured.The results showed that NSKP promoted the phagocytosis of peritoneal macrophages,the function of natural killer cells,and the proliferation of T lymphocytes,as well as increased the levels of interleukin(IL)-2 and IL-4 and serum hemolysin.Meanwhile,the response of delayed-type hypersensitivity in NSKP group was also dramatically higher than that in the control group.Therefore,NSKP is a potential immunoenhancing agent.
Key words:eicosapetaenoic acid; foam cell; atherosclerosis Nostoc sphaeroides Küting; phycobiliprotein; immune function; cytokine
引文格式:
王炎炎,宋志秀,杨立刚,等.二十碳五烯酸对THP-1巨噬细胞源性泡沫细胞形成的影响及机制[J].食品科学,2016,37(5):162-166.DOI:10.7506/spkx1002-6630-201605029.http://www.spkx.net.cn
WANG Yanyan,SONG Zhixiu,YANG Ligang,et al.Effect of eicosapetaenoic acid on THP-1 macrophage-derived foam cell formation and its mechanism of action[J].Food Science,2016,37(5):162-166.(in Chinese with English abstract)
心血管疾病(cardiovascular disease,CVD)是发展中国家居民的主要死因之一[1],动脉粥样硬化(atherosclerosis,AS)是CVD的主要病因,AS形成和发展的核心步骤是巨噬细胞源性泡沫细胞的形成[2]。巨噬细胞摄取氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)导致细胞内大量胆固醇酯(cholesterol ester,CE)积聚是泡沫细胞形成的主要机制[3]。近年来,大量研究表明二十碳五烯酸(eicosapentaenoic acid,EPA)具有抗单核细胞募集、抗炎、抗血栓、调节血脂水平等抗动脉粥样硬化作用[4-6]。但EPA抑制AS发生和发展的分子机制尚不明确,需要进一步研究。本实验通过检测不同浓度EPA对THP-1巨噬细胞源性泡沫细胞内总胆固醇(total cholesterol,TC)和CE含量、炎性因子表达水平及三磷酸腺苷结合盒转运体A1(ATP binding cassette transporter A1,ABCA1)mRNA表达水平的影响,研究EPA对THP-1巨噬细胞源性泡沫细胞形成的影响,探讨其预防AS的相关机制。
1.1细胞与试剂
TH P-1人单核细胞 中国科学院上海生命科学研究院细胞资源中心。
胎牛血清 美国Gibco公司;无脂肪酸牛血清白蛋白(bovine serum albumin,BSA) 美国Equitech-Bio公司;ox-LDL 广州奕源生物科技有限公司;EPA、佛波酯(phorbol myristate acetate,PMA)、油红O、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT) 美国Sigma公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 武汉博士德生物工程有限公司;RNA提取试剂盒 美国Invitrogen公司;反转录试剂盒 北京全式金生物技术有限公司;反转录聚合酶链式反应(reverse transcript polymerase chain reaction,RT-PCR)相关引物 生工生物工程(上海)股份有限公司;白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附实验(euzymelinked immunosorbent assay,ELISA)试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒 烟台赛尔斯公司;总蛋白质测定试剂盒、二甲基亚砜(dimethyl sulfoxide,DMSO)、RPMI-1640培养基 南京凯基生物制药有限公司;TC测定试剂盒、游离胆固醇(free cholesterol,FC)测定试剂盒 北京普利莱公司。
1.2泡沫细胞模型的建立
取处于对数生长期的THP-1人单核细胞,加入适量PMA贮备液使PMA终浓度为160 nmol/L,静置培养48 h。取经PMA诱导分化后的巨噬细胞,经80 mg/L的ox-LDL刺激48 h即可形成泡沫细胞。采用油红O染色法观察泡沫细胞内脂滴分布情况,判断泡沫细胞模型是否建立。
1.3分组及处理
EPA充分溶解于无水乙醇,获得母液,临用前再用含0.5%无脂肪酸BSA的无血清RPMI-1640培养液稀释至适当浓度。THP-1人单核细胞分化成巨噬细胞,分别注于96 孔板培养后弃残余液体,分别加入含有50、100、200、400、600 μmol/L EPA的新鲜培养基,每个浓度设5 个复孔,培养48 h后去除培养液,加入5 mg/mL MTT 20 μL,37 ℃孵育4 h后终止培养,弃上清液,每孔加入100 μL DMSO溶液,振荡1 min,用酶标仪在490 nm波长处测定吸光度,以无细胞孔作为空白组,无EPA处理作为对照组。按照下式计算泡沫细胞存活率,确定EPA对细胞的无毒性剂量。

根据MTT结果设定EPA高、中、低3 个干预剂量(200、100、50 μmol/L),即实验细胞共分为4 组,分别为模型组和3 个不同剂量的EPA干预组。
1.4指标检测方法
1.4.1 TC、FC和CE水平的测定
采用酶法测定泡沫细胞内TC、FC和CE水平:裂解泡沫细胞,分别取500 μL细胞裂解液用E1015和E1016两种试剂盒进行TC、FC和CE水平测定,按照说明书方法进行操作,用酶标仪在550 nm波长处读各管光密度(OD550 nm)值,同样测定标准品、空白对照组(乙醇)的OD550 nm,绘制标准曲线并计算待测样品中的胆固醇含量。以试剂盒所测定出的是TC和FC含量,两者差值即为CE含量,胆固醇含 量的单位以nmol/mg pro表示。
1.4.2 细胞内蛋白质含量的测定
采用二辛可酸(bicinchoninic acid,BCA)蛋白浓度测定法测定泡沫细胞内蛋白质含量:取1.4.1节剩余的细胞裂解液,用BCA蛋白质测定试剂盒进行蛋白质含量测定,按照说明书方法进行操作,在562 nm波长处比色测定读取样品及标准品OD562 nm,绘制出标准曲线,计算各样品蛋白质含量。
1.4.3 炎性因子水平的测定
收集细胞培养上清液,采用IL-6 ELISA试剂盒及TNF-α ELISA试剂盒测定细胞上清液中IL-6和TNF-α的水平,按照说明书方法进行操作,用酶标仪以空白孔调0,在450 nm波长处读取OD450 nm,根据标准品的炎性因子水平以及对应的OD450 nm分别绘制出标准曲线,根据样品的OD450 nm计算出样品中的IL-6和TNF-α水平。
1.4.4 ABCA1 mRNA表达水平测定
收集各处理组细胞,用Trizol法提取总RNA,保存于-70 ℃备用。利用常规半定量RT-PCR技术,以GAPDH基因作为内参,测定ABCA1基因转录表达水平。其中PCR引物序列为:ABCA1上游:5’-ATCAAGGGCATCGTGTATGAG-3’,下游:5’-AGGATTGTCACCACAGCAAAC-3’;GAPDH上游:5’-AGGTCGGAGTCAACGGATTTG-3’,下游:5’-GTGATGGCATGGACTGTGGT-3’。PCR循环参数:94 ℃、5 min(预变性);94 ℃、30 s,56 ℃、45 s,72 ℃、30 s,30 个循环,72 ℃延伸5 min。PCR产物用2%琼脂凝胶电泳检测,用Quantity ONE软件对电泳结果进行灰度扫描,通过灰度值统计分析结果间接推测各处理组相关基因的相对表达水平。
1.5统计学处理
实验所得数据以![]() 表示,组间比较采用t检验及方差分析,用SPSS 11.0软件进行统计学分析,P<0.05或P<0.01时认为差异具有显著性。
表示,组间比较采用t检验及方差分析,用SPSS 11.0软件进行统计学分析,P<0.05或P<0.01时认为差异具有显著性。
2.1THP-1细胞泡沫化结果
倒置显微镜下观察,明显可见THP-1人单核细胞在PMA的诱导下由规则的圆形悬浮细胞变为形态不规则梭形贴壁细胞,并可见大量细胞伸出伪足(图1a)。随后用80 mg/L的ox-LDL孵育48 h,经油红O染色,在显微镜下观察可见细胞浆内大量 脂滴存在,符合泡沫细胞的特点(图1b),即泡沫细胞模型建立成功。
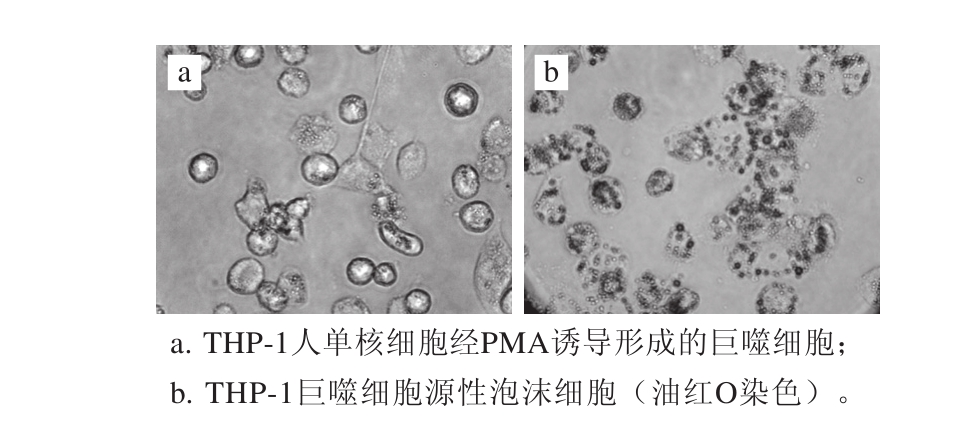
图1 THP-1巨噬细胞及THP-1巨噬细胞源性泡沫细胞形态
Fig.1 THP-1 monocyte-derived macrophages and macrophage-derived foam cells stained by Oil Red O
2.2EPA干预对泡沫细胞存活率的影响
采用MTT法进行泡沫细胞存活率的测定,如图2所示,EPA干预48 h后,与模型组(EPA浓度为0 μmol/L)相比,200、100、50 μmol/L这3 个剂量组泡沫细胞存活率无显著差异(P>0.05),这3 个剂量的EPA均不具有细胞毒性。400、600 μmol/L EPA干预组的泡沫细胞存活率急剧下降,且与模型组相比存在显著差异(P<0.05)。因此,后续实验选取200、100、50 μmol/L 这3 个剂量的EPA,以保证细胞处于较好的状态。
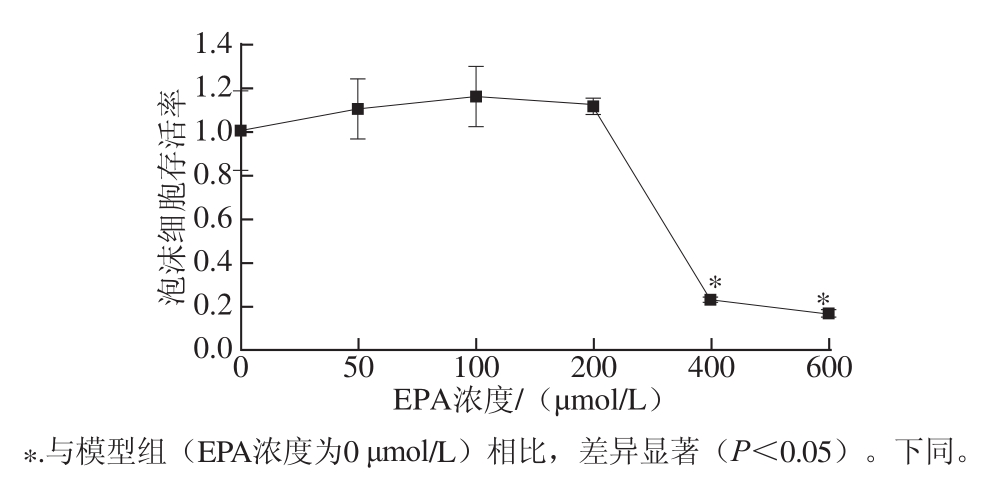
图2 不同浓度EPA干预下泡沫细胞生存率(x ±s,n=55)
Fig.2 Cell viability after EPA treatment(x ± s,n = 5)
2.3不同浓度EPA对泡沫细胞内胆固醇含量的影响#
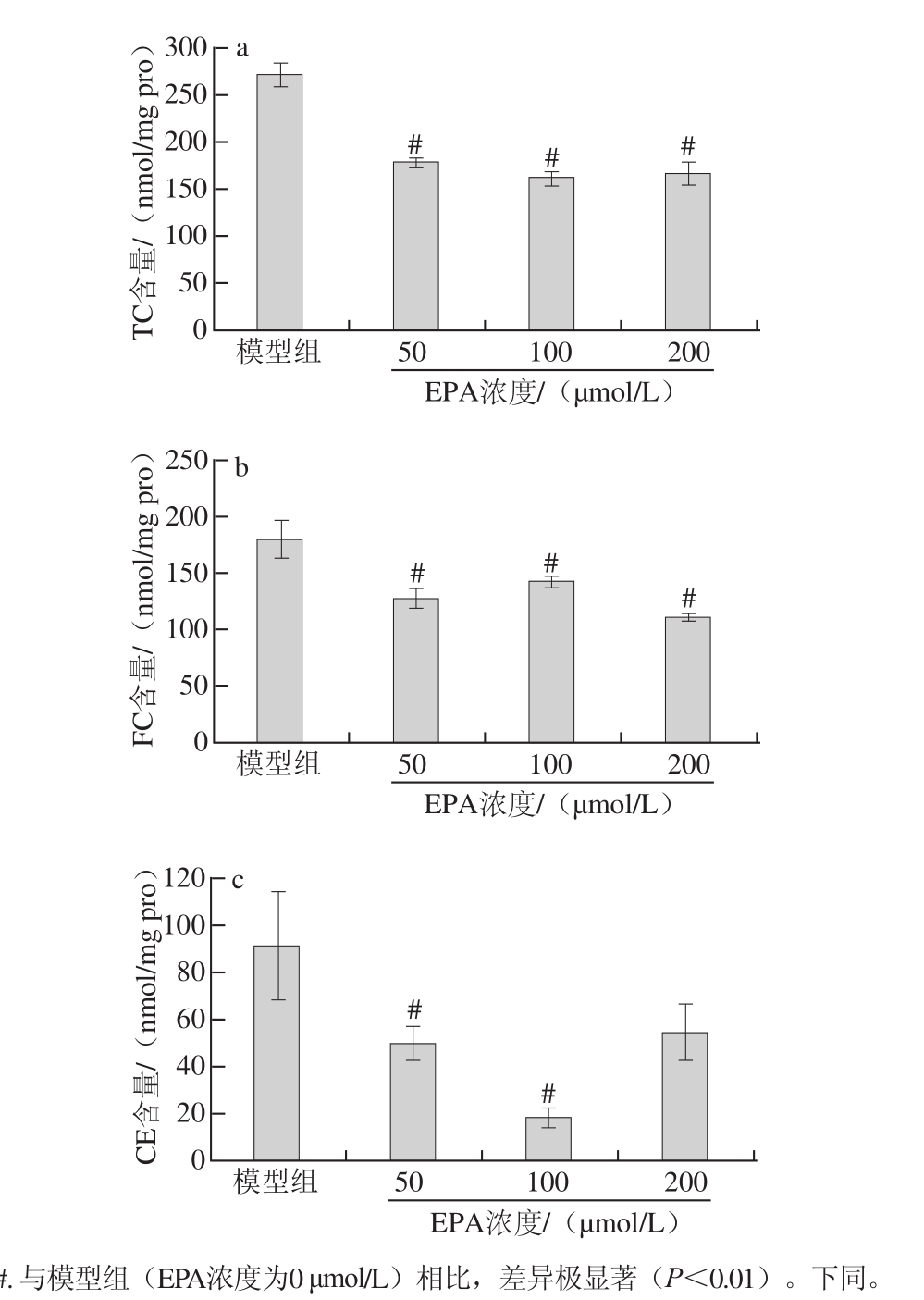
图3 不同浓度EPA对泡沫细胞内胆固醇含量的影响(x ±s,n=33)
Fig.3 Effect of EPA on intracellular cholesterol level in foam cells(x ± s,n = 3)
由图3可知,与模型组相比,各EPA干预组细胞内TC、FC水平均极显著降低(P<0.01),50、100 μmol/L组细胞内CE水平与模型组相比极显著降低(P<0.01),200 μmol/L组细胞内CE水平虽然有所降低,但与模型组间无显著差异(P>0.05)。细胞内的TC、FC、CE水平在50、100、200 μmol/L这3 个剂量组之间并不存在量-效关系,200 μmol/L EPA对细胞内胆固醇水平的降低作用低于100 μmol/L EPA。这可能是由于EPA属于产能营养素,在产生生物活性的同时也会进行β-氧化供能,当EPA浓度过高时,过量的EPA会进入非氧化代谢途径,此时会产生大量活性氧和活性氮类物质,使细胞功能受损[7-8]。200 μmol/L组对细胞内胆固醇水平的降低作用不如100 μmol/L组明显,可能是因为高剂量EPA作用下,细胞的部分功能受损。Song Yue等[9]用200 μmol/L 的EPA干预THP-1巨噬细胞源泡沫细胞72 h后,细胞存活率显著降低。另一个可能的原因是EPA不饱和程度高,浓度过高会加剧脂质过氧化的发生,使得EPA不仅功效丧失,还会产生有害作用。张奕等[10]用200 μmol/L EPA干预细胞48 h后发现培养液中丙二醛的浓度显著增加。由此推测,本实验中虽然200 μmol/L EPA干预48 h对细胞存活率没有影响,但是细胞功能可能同样受到了损害。因此,3 个EPA干预剂量没有呈现良好的量-效关系,以100 μmol/L EPA的干预效果最好。
2.4不同浓度EPA对泡沫细胞ABCA1 mRNA表达水平的影响
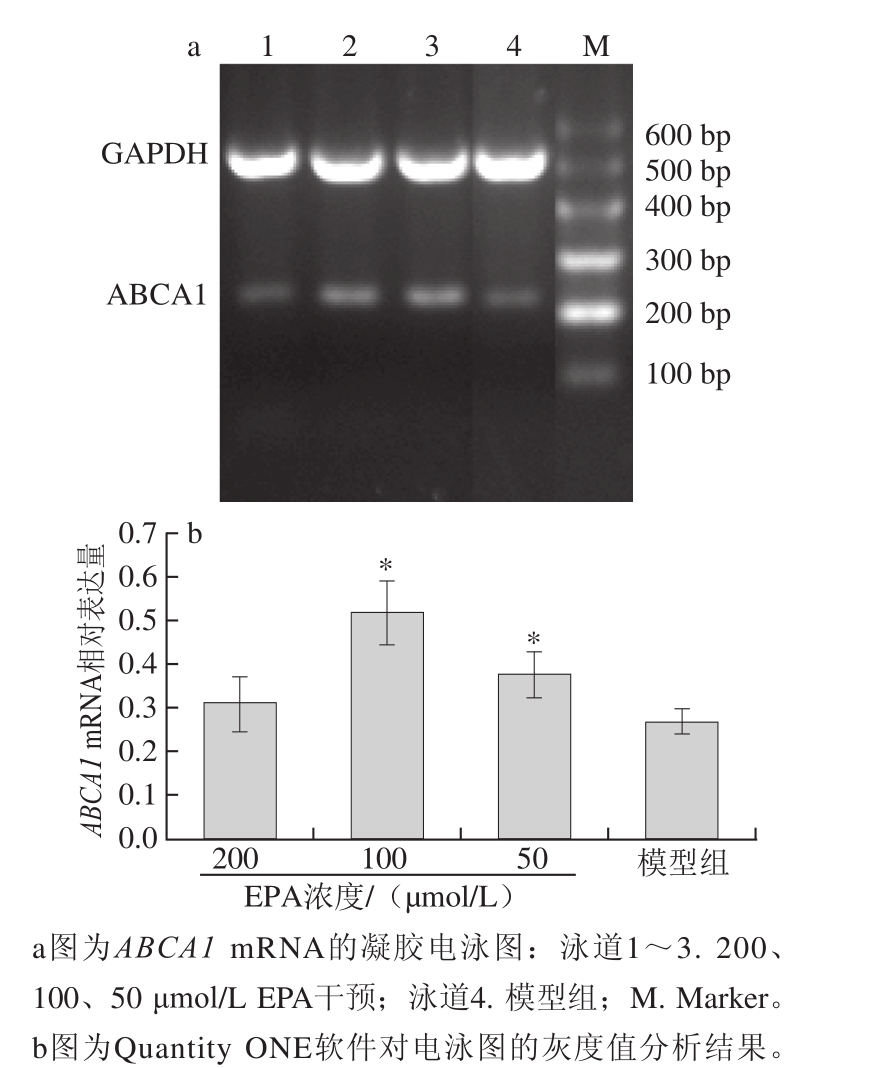
图4 不同浓度EPA对泡沫细胞AABBCCAA11 mRNA表达水平影响
Fig.4 Effect of EPA on ABCA1 mRNA expression in foam cells
如图4所示,经EPA处理后,50、100 μmol/L组泡沫细胞的ABCA1 mRNA相对表达量显著高于模型组(P<0.05),100 μmol/L组泡沫细胞的ABCA1 mRNA相对表达量高于50 μmol/L组。200 μmol/L组泡沫细胞的ABCA1 mRNA相对表达量反而降低的原因与2.3节所阐述的EPA对细胞内胆固醇的反作用原理相同,可能是因为高剂量的EPA造成了细胞部分功能的损害。
2.5不同浓度EPA对泡沫细胞上清液中炎性因子分泌水平的影响
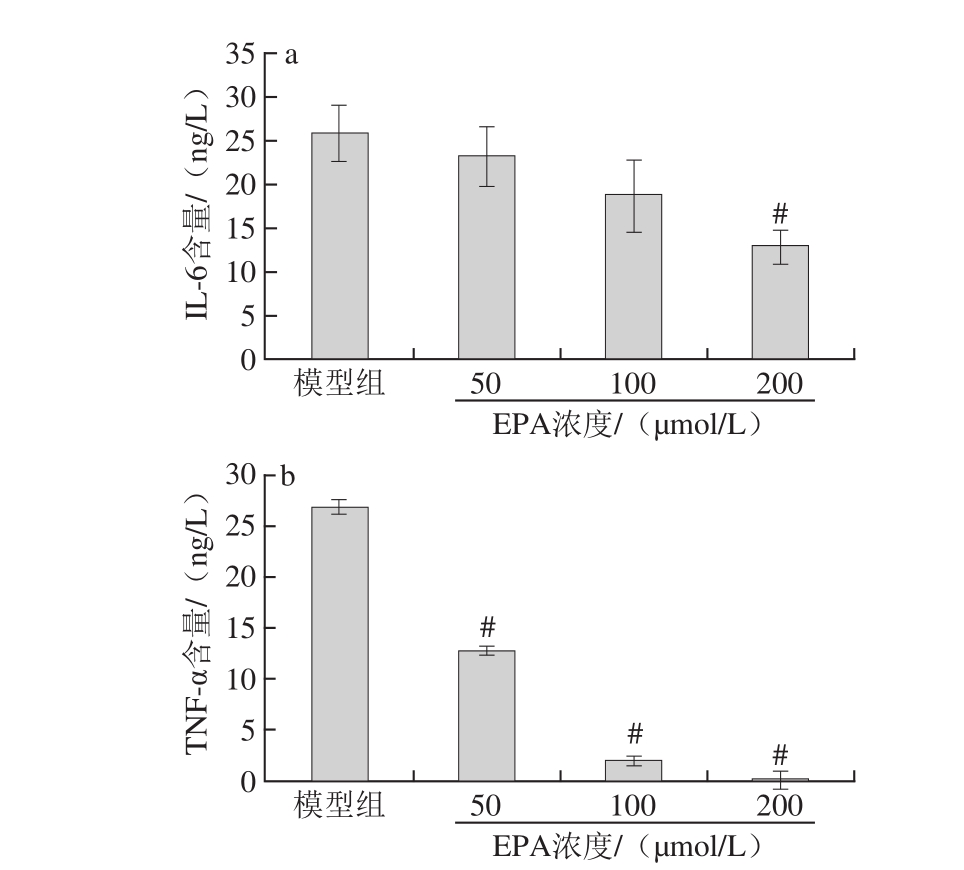
图5 不同浓度EPA对泡沫细胞上清液中炎性因子分泌量的影响(x±s,n=33)
Fig.5 Effect of EPA on the secretion of inflammatory factors in foam cell supernatant(x± s,n = 3)
如图5a所示,与模型组相比,200 μmol/L组泡沫细胞上清液中的IL-6含量与极显著降低(P<0.01),50、100 μmol/L组泡沫细胞上清液中的IL-6水平有所降低,但与模型组间无显著差异(P>0.05),EPA各剂量组之间存在量-效关系。如图5b所示,与模型组相比,EPA各剂量组泡沫细胞上清液中的TNF-α水平极显著降低(P<0.01),EPA各剂量组间也存在显著差异,且同样具有量-效关系。
EPA属于n-3系列多不饱和脂肪酸,海产品、深海鱼油是EPA重要的膳食来源,寒冷地区深海中肥鱼EPA含量高,如鲭鱼、鲑鱼、金枪鱼等[11-12]。近年来,大量研究表明EPA具有抗AS作用[4-6]。AS的发生、发展是多因素长期综合作用的过程,泡沫细胞形成是AS发生的早期事件和关键环节,在AS早期,巨噬细胞内无限制地聚集大量胆固醇脂滴,形成巨噬细胞源性泡沫细胞[13];AS中后期,泡沫细胞内过量蓄积的脂质最终导致其凋亡或坏死,细胞胞浆内脂质释放形成脂质堆积,导致血管壁形成纤维化斑块[14]。因此,泡沫细胞形成和发展贯穿AS发生发展始终,并起到至关重要的作用。而巨噬细胞内胆固醇稳态失衡是泡沫细胞形成的重要原因[15],巨噬细胞胆固醇稳态失衡使其胆固醇摄入量增加、胆固醇酯合成增加以及胆固醇流出减少,导致细胞内胆固醇蓄积泡沫细胞形成[16]。本实验发现,100、50 μmol/L的EPA能极显著降低THP-1巨噬细胞源性泡沫细胞内TC、FC、C E水平,可见EPA能降低泡沫细胞内胆固醇蓄积,这与Salehipour等[17]的研究结果一致。而200 μmol/L的EPA干预却不如100 μmol/L的EPA,这提示过高的剂量的EPA反而不利于抑制泡沫细胞的形成。
人ABCA1是染色体9q31编码的220 ku蛋白,介导细胞胆固醇的分泌,这种转运体在巨噬细胞中大量表达[18]。ABCA1是一种膜结合蛋白,它以ATP为能源,促进细胞内胆固醇的流出,在胆固醇逆转运和高密度脂蛋白生成过程中起重要作用[19]。本实验结果表明,100、50 μmol/L 的EPA均能显著上调ABCA1 mRNA的表达,这与Song Yue 等[9]的研究结果一致,Kasbi Chadli等[20]进行的动物实验也显示EPA干预提高了ABCA1 mRNA在仓鼠体内的表达。由于EPA能降低细胞内TC、FC、CE水平,同时可以上调ABCA1 mRNA表达,据此可推测EPA抑制THP-1细胞泡沫化的作用可能与其上调ABCA1 mRNA表达有关。
早在1999年,Ross教授[21]就在损伤反应学说的基础上提出了“动脉粥样硬化是一种炎症性疾病”的观点。巨噬细胞调节的免疫系统参与AS病变早期炎症反应,其介导的促炎反应是通过释放促炎因子来实现的,最具有代表性的是IL-6和TNF-α[22]。TNF-α、IL-6激活炎症反应,TNF-α促进LDL氧化为ox-LDL,活化单核细胞,促进细胞因子释放;IL-6刺激T细胞和B细胞增殖,促进中性粒细胞进入血管内膜,参与AS发展[23]。本实验结果表明,各个剂量组的EPA均能降低泡沫细胞上清液中IL-6和TNF-α的水平,且存在剂量-效应关系。这与文献[24-25]报道的服用EPA可以抑制IL-6和TNF-α的表达,抑制病变血管炎症反应的结果相一致。
综上所述,EPA能够上调ABCA1 mRNA表达,降低泡沫细胞内胆固醇的蓄积,抑制泡沫细胞的形成,降低IL-6及TNF-α这两种炎性因子的分泌量,进而预防动脉粥样硬化发生发展。
参考文献:
[1]CELERMAJER D S,CHOW C K,MARIJON E,et al.Cardiovascular disease in the developing world:prevalences,patterns,and the potential of early disease detection[J].Journal of the American College of Cardiology,2012,60(14):1207-1216.DOI:10.1016/j.jacc.2012.03.074.
[2]LIBBY P,RIDKER P M,MASERI A.Inflammation and atherosclerosis[J].Circulation,2002,105(9):1135-1143.DOI:10.1161/hc0902.104353.
[3]WOOLLARD K J,GEISSMANN F.Monocytes in atherosclerosis:subsets and functions[J].Nature Reviews Cardiology,2010,7(2):77-86.DOI:10.1038/nrcardio.2009.228.
[4]VENTURINI D,SIM‹O A N C,URBANO M R,et al.Effects of extra virgin olive oil and fish oil on lipid profile and oxidative stress in patients with metabolic syndrome[J].Nutrition,2 015,31(6):834-840.DOI:10.1016/j.nut.2014.12.016.
[5]GRENON S M,AGUADO-ZUNIGA J,HATTON J P,et al.Effects of fatty acids on endothelial cells:inflammation and monocyte adhesion[J].Journal of Surgical Research,2012,177(1):e35-e43.DOI:10.1016/j.jss.2012.04.010.
[6]LESLIE M A,COHEN D J A,LIDDLE D M,et al.A review of the effect of omega-3 polyunsaturated fatty acids on blood triacylglycerol levels in normolipidemic and borderline hyperlipidemic individuals[J].Lipids in Health and Disease,2015,14(1):53-71.DOI:10.1186/s12944-015-0049-7.
[7]IKEDA T,IWATA K,OCHI H.Effect of insulin,proinsulin,and amylin on renin release from perfused rat kidney[J].Metabolism,2001,50(7):763-766.DOI:10.1053/meta.2001.24200.
[8]PEREZ-MARTINEZ P,PEREZ-JIMENEZ F,LOPEZ-MIAANDA J.n-3 PUFA and lipotoxicity[J].Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids,2010,1801(3):362-366.DOI:10.1016/j.bbalip.2009.09.010.
[9]SONG Y,ZHANG L J,LI H,et al.Polyunsaturated fatty acid relatively decreases cholesterol content in THP-1 macrophage-derived foam cell:partly correlates with expression profile of CIDE and PAT members[J].Lipids in Health and Disease,2013,12(1):111.DOI:10.1186/1476-511X-12-111.
[10]张奕.n-3,n-6多不饱和脂肪酸对3T3-L1脂肪细胞脂联素表达的影响及PPARγ介导的机制[D].广州:南方医科大学,2012:31-32.
[11]高颐雄,张坚.α-亚麻酸体内转化为二十碳五烯酸和二十二碳六烯酸的研究进展[J].中国油脂,2015,40(9):27-31.
[12]MILLER M R,NICHOLS P D,CARTER C G.n-3 Oil sources for use in aquaculture:alternatives to the unsustainable harvest of wild fish[J].Nutrition Research Reviews,2008,21(2):85-96.DOI:10.1017/S0954422408102414.
[13]靳飞鹏,马双陶,杨永健.游离脂肪酸与动脉粥样硬化[J].西南军医,2013,15(2):225-228.DOI:10.3969/j.issn.1672-7193.2013.02.040.
[14]MOORE K J,TABAS I.Macrophages in the pathogenesis of atherosclerosis[J].Cell,2011,145(3):341-355.DOI:10.1016/j.cell.2011.04.005.
[15]SARABI M M,DOOSTI M,EINOLLAHI N,et al.Effect of eicosapentaenoic acid on the expression of ABCG1 gene in the human monocyte THP-1 cells[J].Acta Medica Iranica,2014,52(3):176-181.
[16]YUAN Y,LI P,YE J.Lipid homeostasis and the formation of macrophage-derived foam cells in atherosclerosis[J].Protein & Cell,2012,3(3):173-181.DOI:10.1007/s13238-012-2025-6.
[17]SALEHIPOUR M,JAVADI E,REZA J Z,et al.Polyunsaturated fatty acids and modulation of cholesterol homeostasis in THP-1 macrophage-derived foam cells[J].International Journal of Molecular Sciences,2010,11(11):4660-4672.DOI:10.3390/ijms11114660.
[18]FITZGERALD M L,MUJAWAR Z,TAMEHIRO N.ABC transporters,atherosclerosis and inflammation[J].Atherosclerosis,2010,211(2):361-370.DOI:10.1016/j.atherosclerosis.2010.01.011.
[19]MEURS I,OUT R,van BERKEL T J C,et al.Role of the ABC transporters ABCA1 and ABCG1 in foam cell formation and atherosclerosis[J].Future Medicine,2008,3(6):675-687.DOI:10.2217/17460875.3.6.675.
[20]KASBI CHADLI F,NAZIH H,KREMPF M,et al.Omega 3 fatty acids promote macrophage reverse cholesterol transport in hamster fed high fat diet[J].PLoS ONE,2013,8(4):101-109.DOI:10.1371/journal.pone.0061109.
[21]ROSS R.Atherosclerosis:an inflammatory disease[J].New England Journal of Medicine,1999,340(2):115-126.DOI:10.1056/NEJM199901143400207.
[22]HASHIZUME M,MIHARA M.Atherogenic effects of TNF-α and IL-6 via up-regulation of scavenger receptors[J].Cytokine,2012,58(3):424-430.DOI:10.1016/j.cyto.2012.02.010.
[23]刘俊田.动脉粥样硬化发病的炎症机制的研究进展[J].西安交通大学学报(医学版),2015,36(2):141-152.DOI:10.7652/jdyxb201502001.
[24]IBRAHIM A,MBODJI K,HASSAN A,et al.Anti-inflammatory and anti-angiogenic effect of long chain n-3 polyunsaturated fatty acids in intestinal microvascular endothelium[J].Clinical Nutrition,2011,30(5):678-687.DOI:10.1016/j.clnu.2011.05.002.
[25]DEROSA G,CICERO A F G,FOGARI E,et al.Effects of n-3 PUFAs on postprandial variation of metalloproteinases,and inflammatory and insulin resistance parameters in dyslipidemic patients:evaluation with euglycemic clamp and oral fat load[J].Journal of Clinical Lipidology,2012,6(6):553-564.DOI:10.1016/j.jacl.2012.02.010.
CHENG Chao1,2,XU Hui3,LI Wei2,ZHANG Qiuping3,WANG Xingping1,2,*
(1.Key Laboratory of Biological Resources Protection and Utilization of Hubei Province,Hubei University for Nationalities,Enshi 445000,China; 2.College of Biological Science and Technology,Hubei University for Nationalities,Enshi 445000,China; 3.Department of Immunology,School of Basic Medical Science,Wuhan University,Wuhan 430071,China)
中图分类号:R151.1
文献标志码:A
文章编号:1002-6630(2016)05-0162-05
DOI:10.7506/spkx1002-6630-201605029 10.7506/spkx1002-6630-201605029.http://www.spkx.net.cn
*通信作者:孙桂菊(1963—),女,教授,博士,研究方向为营养与慢性病。E-mail:gjsun@seu.edu.cn
作者简介:王炎炎(1990—),女,硕士研究生,研究方向为营养与慢性病。E-mail:wangyanyan_1231@126.com
基金项目:国家自然科学基金青年科学基金项目(81001244);南京中医药大学青年自然科学基金项目(13XZR16);
收稿日期:2015-11-02