刘容旭,高辰哲,姜 帆,崔 宪,何 畔,董和谦,韩建春*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:以五味子为原料水提多糖,经超滤、去蛋白后制得不同分子质量的五味子多糖(Schisandraceae polysaccharide,SP)组分SP1(分子质量100 ku以上)和SP2(分子质量10~100 ku),使用Caco-2和HT-29两种肠道肿瘤细胞检测体外抗肿瘤活性。结果表明:两种SP干预的肿瘤细胞增殖均受到抑制,实时荧光定量实时定量聚合酶链式反应检测发现Caspase-3相对表达量均出现了一定程度升高。其中SP1抑制作用较小,需较高剂量(500 μg/mL以上)孵育较长时间(72 h)才有显著抑制效果(P<0.05),SP2抑制作用明显,显著抑制所需孵育时间和剂量都更少,对Caspase-3相对表达量提升更大。实验显示SP具有很好的抑制肠道肿瘤增殖潜力,小分子质量组分抗癌活性更强。
关键词:五味子;多糖;抗肿瘤;实时定量聚合酶链式反应
引文格式:
刘容旭,高辰哲,姜帆,等.五味子多糖对两种肠道肿瘤细胞抑制作用的影响[J].食品科学,2016,37(5):192-196.
LIU Rongxu,GAO Chenzhe,JIANG Fan,et al.Inhibitory effect of Schisandraceae polysaccharides on growth of intestinal tumor cells[J].Food Science,2016,37(5):192-196.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605034.http://www.spkx.net.cn
五味子属木兰科植物,是一种味酸、性甘温的健康食品,具有调节神经系统、控制血压、改善视力和提高免疫力的作用[1-2]。近期研究也表明,五味子也有保肝[3]、抗疲劳[4-5]、抗肿瘤[6-7]、镇痛[8]与抗氧化[9]的功效。对五味子进行药理作用的研究表明,其抗肿瘤作用的有效成分主要是木质素和多糖[10-12]。
对五味子抗肿瘤活性成分的研究目前主要集中于肝癌细胞[13]、乳腺癌细胞[14]、胃癌细胞[15]、小鼠瘤体细胞[16]等,对于肠道肿瘤细胞的研究较少[17-18]。本实验采用结肠腺癌细胞Caco-2和结肠癌细胞HT-29,分别研究了超滤分级不同分子质量五味子多糖(Schisandraceaepolysaccharide,SP)组分对肿瘤细胞的抑制作用,为SP抗肿瘤特性的进一步研究提供理论依据。
1.1材料、培养基与试剂
干燥五味子 黑龙江省北安市红星农场;Caco-2细胞、HT-29细胞 中国科学院典型培养物保藏委员会细胞库。
RPMI 1640培养基 美国Hyclone公司;基础高糖培养基DMEM(dulbecco’s modified eagle’s medium,DMEM) 美国Gibco公司。
胎牛血清 美国Hyclone公司;青链霉素双抗(100×) 北京索莱宝科技有限公司;0.25%胰蛋白酶-乙二胺四乙酸(1×) 美国Gibco公司;四氮甲唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT) 美国Amresco公司;RNAprep pure总RNA提取试剂盒(离心柱型)、FastQuantRTKit(With gDNase)逆转录试剂盒、SuperReal PreMix Plus(SYBR Green)荧光定量试剂盒 天根生化科技(北京)有限公司;浓硫酸、苯酚、石油醚、NaOH、乙醇、葡萄糖、二甲基亚砜、氯仿、正丁醇等均为国产分析纯。
1.2仪器与设备
Labscale TTF System小型切向超滤系统 美国Millipore公司;Biomax Polyethersulfone小型超滤膜包×2 (10、100 ku孔径);721分光光度计 上海光学仪器厂;202型电热恒温干燥箱 天津市泰斯特仪器有限公司;索氏抽提器 天津市天玻仪器有限公司;超微细粉碎机 上海泰斯特仪器厂;HH-4型电热恒温水浴锅常州国华电器有限公司;HJ-5多功能搅拌器 江苏金坛医疗仪器厂;LG10-24A高速离心机 北京医用离心机厂;IKA小舞灵漩涡混合器 莱贝(上海)科学仪器有限公司;全自动酶标仪WD-2102A 杭州汇尔仪器设备有限公司;XSP-6C光学显微镜 日本Olympus公司;CO2培养箱 日本Sanyo公司;7500实时荧光定量系统美国Life Technologies公司。
1.3 方法
1.3.1 SP的提取与纯化
采用本课题组已报道的方法提取多糖[19]:取洁净饱满五味子,粉碎后烘干2 h至恒质量,使用索式抽提器脱脂12 h以上,按料液比1∶10(m/V)添加蒸馏水,4 ℃条件下浸泡6 h以上后加入NaOH缓慢调节pH值至7.0,60 ℃条件下水浴搅拌提取2 h以上,200 目尼龙纱布过滤后滤渣重复水提一遍,取两次提取滤液4 000 r/min离心20 min除杂后取上清液,先使用100 ku孔径超滤膜在0.207 MPa条件下超滤,收集SP1多糖(分子质量>100 ku)截留液;透过液使用10 ku孔径超滤膜在0.138 MPa条件下超滤,收集SP2多糖(分子质量为10~100 ku)截留液。分别对SP1、SP2截留液使用Sevag法除蛋白[20],4 ℃条件下透析除杂后冻干。
1.3.2 SP纯度的检测
使用苯酚硫酸法[21]测定总糖含量。取一定质量多糖冻干粉溶解后稀释一定倍数依次加入1 mL质量分数为6%的苯酚溶液、5 mL浓硫酸,室温反应30 min,漩涡振荡器混匀后于490 nm波长处测定吸光度。分别吸取0.1、0.2、0.3、0.4、0.8、1.2、1.6、2.0 mL葡萄糖标准液于150 mm×10 mm的试管中,各以蒸馏水补至2 mL,另取2 mL蒸馏水作为空白,在空白组和葡萄糖标准液中依次加苯酚、浓硫酸,横坐标为多糖质量浓度,纵坐标为吸光度值,得出标准曲线回归方程:y=0.009 1x+0.001 4 (R2=0.998 2)计算多糖质量浓度x,从而根据多糖溶液的体积算出溶液中多糖质量,溶液中多糖质量与溶解所用的冻干粉质量之比即为多糖纯度。
1.3.3 Caco-2和HT-29细胞的培养
完全培养基的配制:取10 mL胎牛血清,1 mL青链霉素双抗(100×),89 mL血清体积分数为10%的完全培养基(培养Caco-2细胞使用DMEM高糖培养基配制,培养HT-29细胞使用RPMI 1640培养基),使用0.22 μm微孔滤膜过滤除菌后冷藏备用。
HT-29细胞和Caco-2细胞分别于对应的完全培养基中在37 ℃、5% CO2培养箱中进行培养,大约2 d换液一次,每瓶加培养基5 mL。传代使用0.01 mol/mL磷酸盐缓冲液清洗后,0.25%胰蛋白酶-乙二胺四乙酸(1×)常温消化3 min。取长势良好的对数增殖期细胞用于实验。
1.3.4 MTT法检测SP细胞增殖抑制情况
使用1.3.3节中叙述的方法,分别消化两种细胞制成悬液,血球计数板计数,调整细胞浓度约2.5×104个/mL,取96 孔板每孔加入细胞悬液200 μL,接种培养24 h后,吸去培养基,加入配制好的含有不同浓度多糖培养液培养24、4 8、72 h,每个指标设5 个平行孔,并设不含SP的培养液组作为空白组。之后采用MTT法测定光密度(OD490 nm)值,研究SP不同组分、不同剂量对两种肿瘤细胞的抑制率。
MTT法细胞毒性检测采用Xu Weili等[22]的方法。现用现配质量浓度为5 mg/mL的MTT溶液,加药过程注意避光。每孔加入20 μL MTT溶液,于CO2培养箱中放置4 h,随后用针头吸去全部培养基,每孔加入150 μL二甲基亚砜试剂,避光静置20 min后用酶标仪在490 nm波长处检测。
1.3.5 实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,real time-qPCR)检测细胞凋亡基因表达
使用1.3.3节中叙述的方法,分别消化两种对数期生长的细胞,制备悬液后计数,调整细胞浓度5×106个/mL,每孔2 mL接种于6 孔板中,培养24 h后吸去培养基,加入含有不同质量浓度多糖的培养液培养24、36、48 h。使用显微镜对多糖不同质量浓度、时间作用下的两种肿瘤细胞进行观察,然后用于总RNA的提取实验。
1.3.5.1 细胞总RNA的提取与cDNA的合成
参考RNAprep pure总RNA提取试剂盒(离心柱型)说明提取细胞总RNA。使用细胞裂解液350 μL/孔裂解细胞,将所有溶液移至过滤柱12 000 r/min离心2 min除杂,然后加入与滤液同体积70%乙醇沉淀后移至吸附柱上,经除蛋白、DNA酶水解DNA、再次去蛋白、漂洗两次后使用RNase-Free ddH2O复融洗脱总RNA。使用紫外分光光度计分别检测RNA提取液在260 nm和280 nm波长处的吸光度,计算OD260 nm与OD280 nm的比值,若比值介于1.8~2.0之间则可用于下步实验。
参考FastQuantRTKit(With gDNase)逆转录试剂盒说明逆转录总RNA。取一定量总RNA提取液按比例加入gDNA buffer 42 ℃条件下孵育3 min去除基因组DNA,配制反转录反应体系混合液,42 ℃条件下孵育15 min,然后95 ℃条件下孵育3 min,即可逆转录制得cDNA用于real time-qPCR。短期4 ℃冷藏保存,长期-20 ℃冷冻保存。
1.3.5.2 real time-qPCR反应
参考SuperReal PreMix Plus(SYBR Green)荧光定量试剂盒说明预实验优化条件后进行检测。20 μL混合体系:2×SuperReal PreMix Plus 10 μL,上游引物(10 μmol/L)0.6 μL、下游引物(10 μmol/L)0.6 μL,cDNA模板1 μL,50×ROX Reference Dye 0.4 μL,7.4 μL ddH2O,引物序列如表1所示。使用三步法反应程序:95 ℃预变性15 min;95 ℃变性10 s,55 ℃退火20 s,40 个循环,最后72 ℃延伸32 s(荧光信号采集),熔解曲线分析。
表1 引物合成序列
Table 1 Primer sequences used for real time-qPCR
1.4数据统计
使用SPSS 13软件对数据进行统计学分析,MTT检验做5 副孔平行,其他实验均做3 组平行实验。结果用![]() 表示,用组间方差分析(analysis of variance,ANOVA)进行统计分析,采用最小差异显著法(least-significant difference,LSD)进行显著性比较(P<0.05)。
表示,用组间方差分析(analysis of variance,ANOVA)进行统计分析,采用最小差异显著法(least-significant difference,LSD)进行显著性比较(P<0.05)。
2.1SP的纯度鉴定
SP经过超滤分离、去蛋白处理后冻干,使用苯酚-硫酸法检测其配制的多糖溶液总糖含量,计算不同级分SP纯度:级分SP1(分子质量>100 ku)纯度可达92.32%,呈淡红褐色;级分SP2(分子质量为10~100 ku)纯度可达78.13%,呈浅黄色。两个级分的多糖冻干粉溶解于水的速率远优于传统有机溶剂沉淀法制备的多糖,这可能是由于超滤在纯化多糖的同时,可以起到一定的浓缩功效,直接将浓缩后的多糖冷冻干燥,多糖分子在较分散状态下去除了周围的水分,故组织状态较为蓬松,复溶速率大大提高。尽管超滤可以将色素类物质部分洗脱,但所得多糖仍有一定颜色,为了不破坏多糖原有活性,故没有使用较为剧烈的H2O2等氧化剂除色[23],而是直接将带有一定颜色的多糖用于细胞实验。
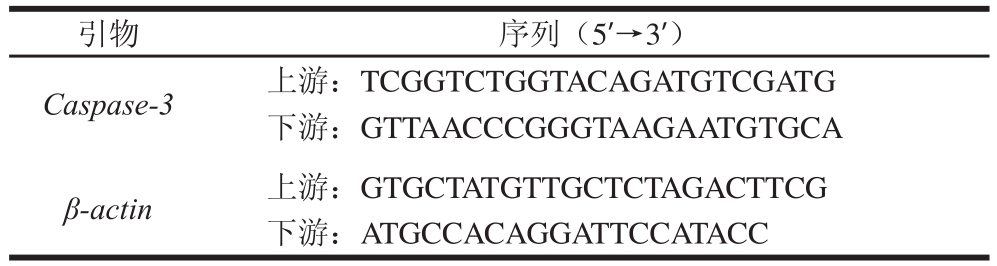
2.2SP对Caco-2细胞生长抑制作用

图1 SP对Caco-2细胞生长抑制作用
Fig.1 Inhibitory effect of SP1 and SP2 on the growth of Caco-2 cells
SP作用Caco-2细胞后,对细胞的存活率具有一定影响。由图1a可知,SP1多糖不同剂量孵育条件下,24 h时细胞的存活率并未出现明显下降,48 h个别高剂量细胞存活率有一定降低;72 h时100 μg/mL以上SP1多糖可以显著降低Caco-2细胞的存活率,提示较大分子质量的SP1多糖需要较长时间孵育才会对Caco-2肿瘤细胞的存活率造成影响,而短时间(48 h内)孵育影响不明显,整体抗癌活性较低。
由图1b可知,Caco-2细胞在SP2多糖孵育24 h时,500 μg/mL以上剂量细胞存活率同空白对照组相比出现显著下降(P<0.05),并呈现出一定的剂量依赖性。而相同多糖剂量孵育的Caco-2细胞存活率,也随着时间延长出现了一定下降,部分组别下降显著。同SP1多糖组的实验结果相比,SP2多糖500 μg/mL以上组24 h即可有显著抑制(P<0.05),孵育时间越长对细胞存活率影响更大。因此,更小分子质量的SP2多糖组具有更好的抑制Caco-2细胞活性。
2.3SP对HT-29细胞生长抑制作用
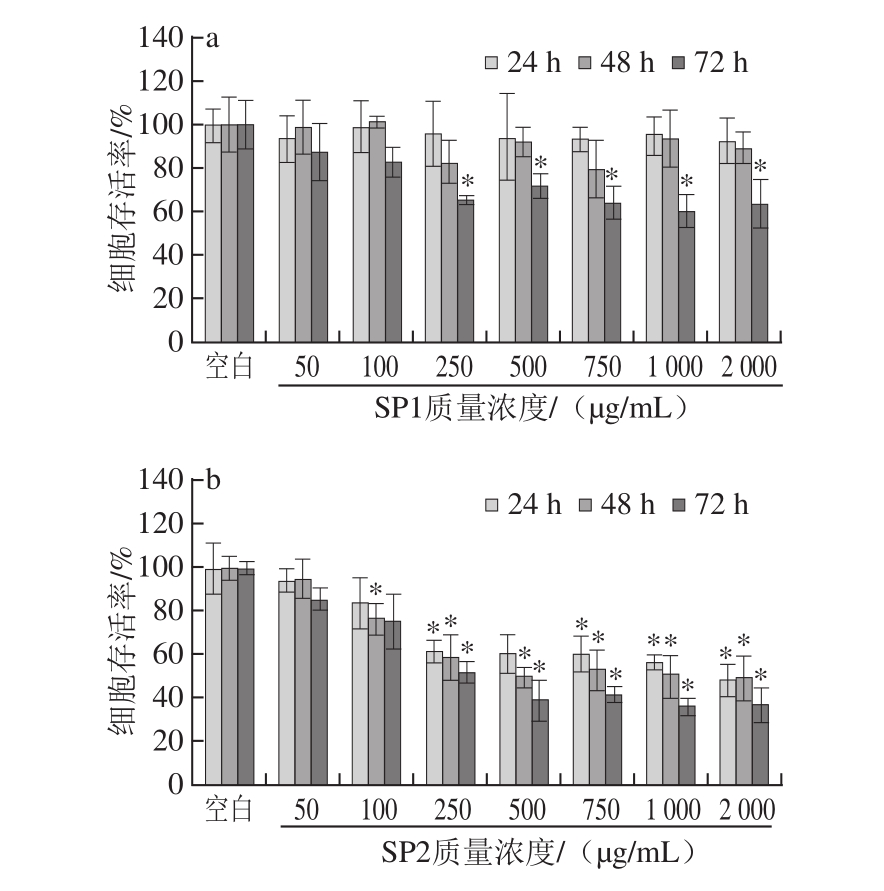
图2 SP对HT-29细胞生长抑制作用
Fig.2 Inhibitory effect of SP1 and SP2 on the growth HT-29 cells
由图2a可知,培养24、48 h时SP1多糖孵育的HT-29细胞存活率与空白组相比差异不显著(P>0.05),各相同剂量组24 h和48 h细胞存活率差异也不显著(P>0.05)。与此类似,HT-29细胞在72 h时,250 μg/mL以上的较高剂量作用可以对细胞存活率有显著下调作用(P<0.05)。在培养72 h时,SP1对HT-29细胞的抑制作用说明SP1在营养不足时,细胞较为脆弱,相同剂量的SP1多糖组分可能会对细胞的生长造成较大的影响。
由图2b可知,SP2多糖孵育HT-29细胞,不同剂量作用时细胞存活率出现了明显下降。当孵育24 h时,250 μg/mL以上SP2多糖剂量即可对HT-29细胞存活率造成显著下调(P<0.05),相比于Caco-2细胞,相同剂量SP2多糖对HT-29细胞存活率下调作用更显著(P<0.05),最低剂量更低(250 μg/mL),高剂量的抑制率也更大。因此,SP2多糖组分显示出更良好的抑制HT-29肿瘤细胞活力的能力。
2.4SP处理对相关细胞凋亡基因的表达影响
细胞凋亡是一种机体在某种状态下发生的程序化死亡过程[24],Caspase-3是细胞凋亡时的最终效应蛋白之一[25]。它可以通过诱导细胞内部骨架蛋白的分解和剪切,从而使细胞核形成分散片段,参与形成凋亡小体,最终引起细胞的凋亡。通过real time-qPCR对Caspase-3基因表达情况的检测,结果如图3所示。

图3 HT-29细胞(a)和 Caco-2细胞(b)中Cassppaassee--33基因mRNA的相对表达量变化
Fig.3 Relative mRNA expression levels of caspase-3 in both HT-29 cells(a)and Caco-2 cells(b)incubated with SP1 or SP2
由图3可知,不同剂量的SP1和SP2组分孵育,均使两种细胞的Caspase-3基因mRNA相对表达量有一定升高。其中SP1组分孵育Caco-2细胞可以使其Caspase-3基因mRNA相对表达量比空白组略多,而各剂量间差别较小,孵育HT-29细胞则呈现出一定递增趋势,但相同剂量下整体mRNA表达量与SP2组相比水平较低。SP2组分各剂量Caspase-3基因mRNA相对表达量显著高于空白组,且在两株细胞中均呈现出随剂量的递增而增大的趋势,由此可以推断,不同剂量的SP2可以有效促进Caspase-3基因mRNA的合成,从而参与引起了两种肿瘤细胞的凋亡。
SP经过超滤分级纯化,较好地保留了其生物活性,同传统柱分离法相比,产量较大,经过除蛋 白处理后两种分子质量组分纯度分别可达92.32%和78.13%,适合大规模制备用于下一步研究。
SP1组分对两种肠道肿瘤细胞的抑制作用较SP2组分低,需在较高剂量下孵育72 h以上时才能对两种细胞存活率产生显著影响(P<0.05),而SP2细胞的抗肿瘤活性较高,分别在500、250 μg/mL以上剂量时即可对Caco-2、HT-29两种肠道肿瘤细胞的生长产生显著的抑制作用(P<0.05),而且呈一定的剂量依赖性,提示小分子质量的SP产品具有更高的抗癌生物活性,进一步的SP抗癌研究可以集中于10~100 ku分子质量的多糖组分。
real time-qPCR结果显示,SP2组分的Caspase-3基因mRNA相对表达量有显著上升趋势,呈一定剂量依赖性,推测Caco-2和HT-29细胞的凋亡可能与Caspase-3参与的胞内凋亡途径有关,该途径某些关键酶的激活可能是SP抗癌作用的靶点所在,但其凋亡机制与具体作用位点还需要在进一步的分子生物学实验中进行探讨。
参考文献:
[1]陆兔林,吴杨,季德,等.五味子多糖提取分离和药理作用研究进展[J].中国中药杂志,2014(4):751-754.
[2]王春梅,李贺,孙靖辉,等.北五味子多糖抗焦虑和镇静催眠作用[J].食品科学,2015,36(13):239-242.DOI:10.7506/spkx1002-6630-201513044.
[3]吴夏.五味子鲜果多酚提取鉴定及其对受损HepG2细胞保护作用的研究[D].北京:中国农业大学,2014:59-83.
[4]徐思.五味子治疗慢性疲劳综合症药效及机理研究[D].成都:成都中医药大学,2003:9-69.
[5]LEONG P K,WONG H S,CHEN J H.Yang/Qi invigoration:an herbal therapy for chronic fatigue syndrome with Yang deficiency[J].Evidence-Based Complementary and Alternative Medicine,2015,2015:945901.DOI:10.1155/2015/945901.
[6]MIAO Y,XIAO B X,JIANG Z,et al.Growth inhibition and cellcycle arrest of human gastric cancer cells by Lycium barbarum polysaccharide[J].Medical Oncology,2010,27(3):785-790.DOI:10.1007/s12032-009-9286-9.
[7]HUANG L,CHEN L,ZHANG Z L,et al.Pathological observations of Fructus schisandrae polysaccharide on anti-tumor effects in S180-bearing mice[J].Journal of Chinese Medicinal Materials,2004,27(3):202-204.DOI:10.3321/j.issn:1001-4454.2004.03.023.
[8]YE C,HAN N,TENG F K,et al.Extraction optimization of polysaccharides of Schisandrae fructus and evaluation of their analgesic activity[J].International Journal of Biological Macromolecules,2013,57(6):291-296.DOI:10.1016/j.ijbiomac.2013.03.025.
[9]高晓旭,李继海,姜贵全,等.北五味子多糖超声波提取及对油脂的抗氧化性能[J].东北林业大学学报,2009,37(4):34-36.
[10]任丽佳,李林,殷放宙,等.五味子抗肿瘤活性成分及作用机制研究进展[J].中国药理学通报,2012,28(1):140-142.DOI:10.3969/j.issn.1001-1978.2012.033.
[11]张建国,范苗波.五味子多糖的研究概况[J].黑龙江科技信息,2013,5(3):44.DOI:10.3969/j.issn.1673-1328.2013.03.044.
[12]林俊,李萍,陈靠山.近5年多糖抗肿瘤活性研究进展[J].中国中药杂志,2013,38(8):1116-1125.
[13]WU Y F,CAO M F,GAO Y P,et al.Down-modulation of heat shock protein 70 and up-modulation of Caspase-3 during schisandrin B-induced apoptosis in human hepatoma SMMC-7721 cells[J].Word Journal of Gastroenterology,2004,10(20):2944-2948.DOI:10.3748/wjg.v10.i20.2944.
[14]LI L,LU Q,SHEN Y,et al.Schisandrin B enhances doxorubicininduced apoptosis of cancer cells but not normal cells[J].Biochemical Pharmacology,2006,71(5):584-595.DOI:10.1016/j.bcp.2005.11.026.
[15]刘晓霓,张承玉,李月珍,等.复方五味子素B及其成分体外抑制胃癌细胞的增殖[J].世界华人消化杂志,2007,15(23):2526-2529.
[16]于赫,李冀,齐彦.五味子多糖对肝癌小鼠肿瘤生长的抑制作用及其免疫学机理初探[J].中医药信息,2010,27(2):26-27.DOI:10.3969/j.issn.1002-2406.2010.02.011.
[17]姜恩平,王卓.五味子多糖对人结肠癌SW480细胞增殖和凋亡的作用[J].大家健康(学术版),2014,8(23):34-35.
[18]黄晓东,路倩,沈楠,等.五味子多糖对人结肠癌HT-29细胞体外增殖及侵袭能力的抑制作用[J].吉林大学学报(医学版),2015,41(2):287-290.DOI:10.13481/.j.16710587x.20150215.
[19]姜帆,韩建春,陈成,等.超滤法分级纯化五味子多糖及其影响因素的研究[J].食品工业科技,2012,33(20):276-279.
[20]方积年,丁侃.天然药物:多糖的主要生物活性及分离纯化方法[J].中国天然药物,2007,5(5):338-347.
[21]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1997:11-12.
[22]XU W L,LIU J R,LIU H K,et al.Inhibition of proliferation and induction of apoptosis by γ-tocotrienol in human colon carcinoma HT-29 cells[J].Nutrition,2009,25(5):555-566.DOI:10.1016/j.nut.2008.10.019.
[23]高晓旭.北五味子多糖理化性质、结构及活性研究[D].沈阳:沈阳农业大学,20 09:72-81.
[24]谢好贵,韦明钎,陈美珍,等.3种多糖复合体外抗肿瘤协同增效作用[J].食品科学,2013,34(15):289-294.DOI:10.7506/spkx1002-6630-201315060.
[25]余磊.五味子多糖诱导肿瘤细胞凋亡及其分子机制研究[D].长春:吉林大学,2012:12-32.
LIU Rongxu,GAO Chenzhe,JIANG Fan,CUI Xian,HE Pan,DONG Heqian,HAN Jianchun*(College of Food Science,Northeast Agricultural University,Harbin 150030,China)
Abstract:Polysaccharide components SP1 and SP2 with different molecular weights were obtained from Schisandraceae and through ultra-filtration and deproteinization.The intestinal cell lines Caco-2 and HT-29 were used to evaluate the antitumor activity of SP1 and SP2 in vitro.The results showed that the proliferation of both Caco-2 and HT-29 cells was inhibited by SP1 and SP2.Meanwhile,the increase in relative transcription level of caspase-3 was confirmed by realtime quantitative polymerase chain reaction(real time-qPCR).SP1 had no significant effect on the inhibition of tumor cell growth,except incubation for 72 h at a dose of 500 μg/mL(P < 0.05).However,SP2 showed an obvious tumor inhibitory effect even at lower dose and shortened incubation time,resulting in a more significant increase in the relative transcription level of caspase-3.In conclusion,the polysaccharides from Schisandraceae have great potential to inhibit the proliferation of intestinal tumor cells,especially the small molecular weight polysaccharide .
Key words:Schisandraceae; polysaccharides; anti-tumor activity; real-time quantitative polymerase chain reaction
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)05-0192-05
DOI:10.7506/spkx1002-6630-201605034 10.7506/spkx1002-6630-201605034.http://www.spkx.net.cn
*通信作者:韩建春(1973—),男,教授,博士,主要从事农产品加工研究。E-mail:hanjianchun@hotmail.com
作者简介:刘容旭(1991—),女,硕士研究生,主要从事农产品加工研究。E-mail:923296139@qq.com
基金项目:哈尔滨市应用技术研究与开发项目(2013RFXXJ080)
收稿日期:2015-06-24