成莉凤,冯湘沅,段盛文,郑 科,刘正初*
(中国农业科学院麻类研究所,湖南 长沙 410205)
摘 要:为探索能应用于葡甘寡糖制备的新型β-甘露聚糖酶,利用半纤维素降解高效菌株Bacillus subtilis BE-91高产的β-甘露聚糖酶水解魔芋胶(纯度>95%)。在单因素试验的基础上,采用四因素三水平的正交试验优化魔芋胶酶解工艺条件,薄层层析法定性分析酶解产物。结果表明:正交试验的最佳酶解工艺组合为魔芋胶质量浓度0.33 g/100 mL、加酶量6 U/g、酶解时间1 h、酶解温度60 ℃,在该条件下魔芋胶水解率为35.96%;β-甘露聚糖酶水解魔芋胶产物为二糖以上的寡糖,且主要介于二糖与六糖之间。该新型β-甘露聚糖酶用于葡甘寡糖制备,其工艺具有加酶量少、酶解时间短、产品纯度高等优势,在功能性食品制备方面具有广阔的应用前景。
关键词:Bacillus subtilis BE-91;β-甘露聚糖酶;魔芋胶;葡甘寡糖;工艺
引文格式:
成莉凤, 冯湘沅, 段盛文, 等. 新型β-甘露聚糖酶制备葡甘寡糖工艺优化[J]. 食品科学, 2016, 37(6): 34-38.
CHENG Lifeng, FENG Xiangyuan, DUAN Shengwen, et al. Optimization of the process conditions on preparation of glucomanno-oligosaccharides using a novel β-mannanase[J]. Food Science, 2016, 37(6): 34-38. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606006. http://www.spkx.net.cn
魔芋葡甘露聚糖是一种由D-葡萄糖和D-甘露糖组成以β-1,4糖苷键为主链、含有β-1,3糖苷键支链的高分子不均一多糖[1]。β-甘露聚糖酶水解魔芋葡甘聚糖可生成含有2~10 个单分子组成的葡甘寡糖,能有效降低人体胆固醇和三脂酰甘油水平、降低血糖、减轻便秘、增加肠道内益生菌比例,可作为高血压、糖尿病和肥胖症患者用甜昧剂[2-3]。
传统的化学方法(酸水解)和物理方法(超声波、射线辐射等)制备葡甘寡糖存在产物分子质量范围难掌控、副产物多和寡糖得率低等问题[4-7],而酶解制备方法有作用条件温和、酶切位点专一和寡糖产率高等优点。生物酶解法是高效利用魔芋胶制备葡甘低聚糖的发展趋势,其关键技术是采用高质量浓度魔芋胶溶液和高活力β-甘露聚糖酶[8-10]。过高质量浓度的魔芋胶溶液呈凝胶状态,影响酶的分子运动,也易出现产物抑制,降低水解效率。因此,采用高活力β-甘露聚糖酶是高效制备葡甘寡糖的有效途径之一。
本项目组前期选育到一个半纤维降解高效菌株Bacillus subtilis BE-91,其分泌的耐热偏酸性β-甘露聚糖酶是一种新型的工业酶[11-12]。本研究以该高酶活力(大于3 050 U/mL)的新型β-甘露聚糖酶为研究对象,用正交试验优化其水解魔芋胶的工艺参数,并结合薄层层析(thin-layer chromatography,TLC)定性分析酶解产物,为探索来源于B. subtilis BE-91的β-甘露聚糖酶在葡甘寡糖制备方面的应用提供科学依据。
1.1 材料与试剂
1.1.1 菌株
半纤维降解高效菌株B. subtilis BE-91(前期命名为欧文氏杆菌变异菌株CXJZ11-01)由中国农业科学院麻类研究所酶工程项目组选育并保存。
1.1.2 培养基
生长培养基组成(质量分数):0.5% NaCl、0.1%葡萄糖、0.4%魔芋精粉、0.3%牛肉膏、0.2%酵母膏和0.5%蛋白胨;固体培养基再添加2%琼脂粉。
诱导培养基组成(质量分数):0.7%魔芋精粉、0.3%牛肉膏、0.2%酵母膏、0.5%蛋白胨、0.5% NaCl[13]。
1.1.3 试剂
魔芋胶(纯度>95%,粒度≥120 目,黏度≥36 000 mPa·s) 成都路特实业有限公司;甘露糖美国Sigma公司;正丁醇、冰乙酸、苯胺、二苯胺、丙酮、磷酸等(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
切向流超滤膜包(孔径2 μm,截留分子质量50 kD 和5 kD) 德国Sartorius Vivaflow公司;Mltiskan GO酶标仪 美国Thermo Scientific公司;EU-88扫描仪 日本Epson公司;UV-2700紫外分光光度计 日本岛津公司;MS32000LE分析天平 瑞士梅特勒公司;GF254硅胶TLC板 青岛海洋化工分厂。
1.3 方法
1.3.1 菌种培养基及β-甘露聚糖酶液制备
取斜面保存的B. subtilis BE-91接种5 mL试管液,稀释涂皿。取优良单菌落接种5 mL试管液,35 ℃培养5 h;接种100 mL的小三角瓶,180 r/min,35 ℃培养6 h;按接种量2%接种诱导培养基(300 mL/瓶),35 ℃,180 r/min发酵9 h,即为成熟发酵液。取成熟发酵液2 L用孔径2 μm的膜包超滤除菌体,再依次用孔径截留分子质量50 kD和5 kD的膜包超滤,收集分子质量5~50 kD的截留液,即为β-甘露聚糖酶粗酶液[14]。
1.3.2 β-甘露聚糖酶活力测定
参照Akino等[15]方法。用魔芋胶和pH 6.5的0.025 mol/L柠檬酸-0.05 mol/L NaH2PO4缓冲液配制0.5 g/100 mL的底物溶液,取1 mL适当稀释的酶液与2 mL预热的底物溶液充分混匀,65 ℃反应10 min,3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测还原糖生成量。用灭活的酶液做相同处理作对照。β-甘露聚糖酶活力定义:底物每分钟释放相当于1 μmol甘露糖的还原糖所需酶量为1个酶活力单位(以U表示)。
1.3.3 魔芋胶总糖及游离还原糖含量测定
魔芋胶总糖含量指魔芋胶水解后的还原糖含量。称取20 mg魔芋胶于具塞比色试管中,加入4 mL 2 mol/L三氟乙酸,110 ℃水解3 h,冷却至室温,3 000 r/min离心10 min,取适当稀释倍数的水解产物用DNS法测定还原糖含量(mg/mL)[16],换算成总还原糖含量(g/mL)。以甘露糖为标准品,所得的糖质量浓度(mg/mL)标准曲线方程为:y=0.477 6x-0.011 6,R=0.999 5。
魔芋胶游离还原糖含量指魔芋胶水解前的还原糖含量。称取20 mg魔芋胶于具塞比色试管中,加入4 mL重蒸水充分溶胀,110 ℃保温3 h,冷却至室温,3 000 r/min离心10 min,取适当稀释倍数的水解产物用DNS法测定还原糖含量(mg/mL),换算成总游离还原糖含量(g/mL)。
1.3.4 魔芋胶水解率测定
不同质量浓度的魔芋胶于不同温度条件下酶解一定时间,取样、灭酶活,取适当稀释倍数的样品用DNS法测定以甘露糖计的还原糖含量(mg/mL),换算成酶解液的总还原糖含量(g/mL)[17]。水解率计算如下式所示:
式中:m1为魔芋胶总还原糖含量/(g/mL);m2为游离还原糖含量/(g/mL);m3为酶解液还原糖含量/(g/mL)。
1.3.5 工艺优化
1.3.5.1 单因素试验
分别以酶解时间(0~120 min)、酶解温度(35~70 ℃)和pH值(4.0~8.0)为变量,固定其他魔芋胶水解条件,进行单因素试验,选择最优水平。
1.3.5.2 正交试验
采用正交试验设计L9(34)优化水解工艺[18-19]。每组试验设置3 个重复,以平均水解率为衡量指标,结合极差分析和方差分析选择最优酶解工艺。
表1 L9(34)正交试验因素及水平
Table 1 Factors and levels for orthogonal array design L9(34)

1.3.6 水解产物定性分析
采用硅胶TLC法对酶解产物进行定性分析[20-22]。魔芋胶经β-甘露聚糖酶作用不同时间后,取水解产物进行干燥,用展层剂充分溶解后,上样。甘露寡糖分子质量标准与样品采用同样处理方法。展层剂成分:正丁醇-冰乙酸-水体积比12∶6∶6,显色剂:2 mL苯胺、2 g二苯胺、10 mL 85%磷酸溶液于丙酮,115 ℃显色10 min。
1.4 数据分析
每个指标重复3 次,取平均值。利用Excel 2007和统计分析软件SAS 9.0分别进行图表绘制和方差分析。
2.1 单因素试验结果
2.1.1 酶解时间的确定
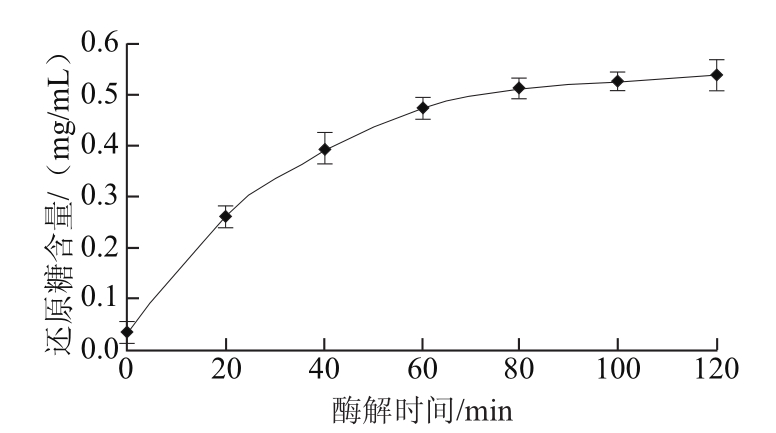
图1 酶解时间对魔芋胶降解程度的影响
Fig.1 Influence of hydrolysis time on the degradation degree of konjac gum
在魔芋胶质量浓度0.5 g/100 mL、加酶量2 U/g的条件下,取不同酶解时间的样品测定其以甘露糖计的还原糖含量。如图1所示,随着酶解时间的延长,还原糖含量不断增加,酶解80 min达到较高值;酶解100~120 min,还原糖含量增长幅度不明显。考虑到缩短生产周期可以提高生产效率和设备的利用率,同时可以降低染菌的风险,故选择酶解80 min为宜。
2.1.2 酶解温度的确定
在魔芋胶质量浓度0.5 g/100 mL、加酶量2 U/g的条件下,在不同温度反应30 min,取样测定以甘露糖计的还原糖含量。如图2所示,最适酶解温度为60 ℃。当温度提高到65~70 ℃时,魔芋胶的水解程度有所降低,这与β-甘露聚糖酶的热稳定性存在一定的关系[13]。
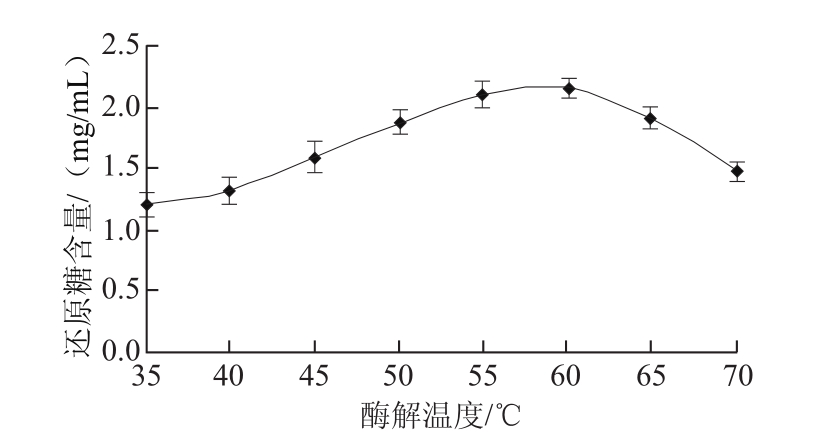
图2 酶解温度对魔芋胶降解程度的影响
Fig.2 Influence of hydrolysis temperature on the degradation degree of konjac gum
2.1.3 酶解pH值的确定

图3 酶解pH值对魔芋胶降解程度的影响
Fig.3 Influence of hydrolysis pH on the degradation degree of konjac gum
用不同pH值的磷酸盐缓冲液配制魔芋胶质量浓度0.5 g/100 mL的底物溶液,加酶量2 U/g、60 ℃反应30 min,取样测定以甘露糖计的还原糖含量。如图3所示,在酶解pH值为6.0时,魔芋胶的还原糖含量最高。这归结于该β-甘露聚糖酶的最适反应pH值为6.0[13],有利于酶催化魔芋葡甘露聚糖的水解。为了减轻实际生产的后续脱盐压力,用重蒸水代替缓冲液配制魔芋胶底物。
2.1.4 加酶量的确定
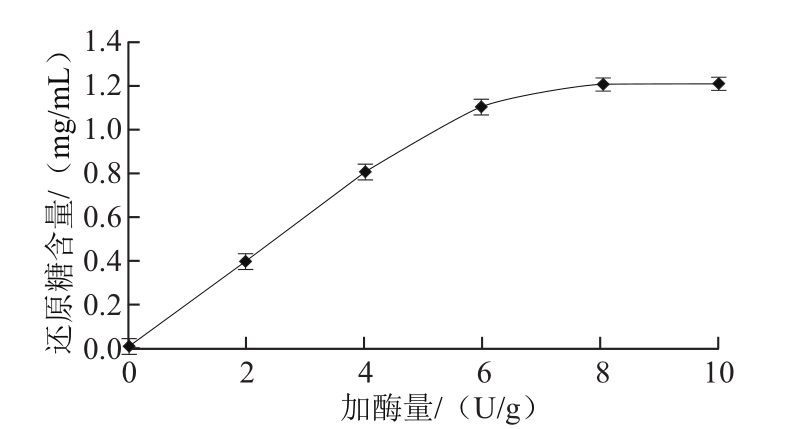
图4 加酶量对魔芋胶降解程度的影响
Fig.4 Influence of enzyme dose on the degradation degree of konjac gum
在魔芋胶质量浓度0.5 g/100 mL、添加不同酶量的条件下,50 ℃反应30 min。取不同的样品测定其以甘露糖计的还原糖含量。如图4所示,随着加酶量增加,其还原糖含量不断增加,加酶量为6 U/g达到较高值;加酶量大于6 U/g,还原糖含量增长幅度不明显。考虑到实际生产中,需要降低生产成本和减轻产物抑制,在该条件下选择加酶量6 U/g较合适。
2.2 正交试验结果
表2 L9(34)正交试验设计及结果
Table 2 Orthogonal array design L9(34) with experimental results

表3 L9(34)正交试验数据方差分析
Table 3 Analysis of vvariance of the results of orthogonal array design L9(34)
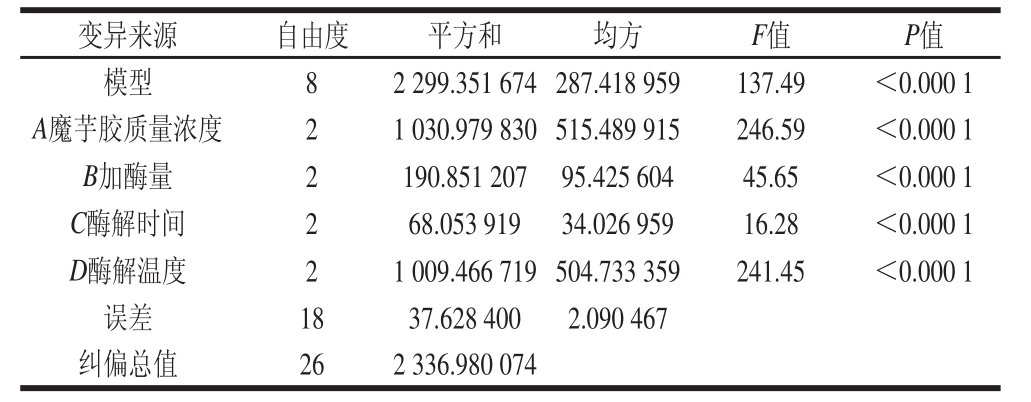
注:P<0.05为差异显著;P<0.01为差异极显著。
单因素试验可以直观了解各因素对魔芋胶降解程度的影响,但实际的酶解过程中各影响因素往往相互影响,并且生产中以还原糖得率为指标。在单因素试验的基础上,对底物质量浓度、加酶量、酶解时间和酶解温度进行正交试验。
表2和表3结果表明,影响因素的主次顺序为酶解温度>魔芋胶质量浓度>加酶量>酶解时间;在选定的条件下,最优工艺组合为魔芋胶质量浓度0.33 g/100 mL、加酶量6 U/g、酶解时间1 h、酶解温度60 ℃;魔芋胶水解率最高达35.96%。
2.3 魔芋胶酶解产物的定性分析
取不同降解时间的产物进行TLC分析(图5),酶解时间为0 h的样品主要成分是多糖,仅有的少量寡糖也集中在六糖以上;酶解时间为1 h的寡糖分子质量分布在三糖及以上,有微量二糖;酶解时间为2 h的产物主要分布在二糖到六糖。这与该β-甘露聚糖酶是典型的内切酶相符。

图5 魔芋胶水解产物的TLC分析
Fig.5 TLC analysis of the hydrolysis products of konjac glue
M.标准品,从上到下依次为甘露糖、甘露二糖、甘露三糖、甘露四糖、甘露五糖、甘露六糖;1.魔芋胶酶解1 h的产物;2.魔芋胶酶解2 h的产物;CK.未水解的魔芋胶,阴性对照。
利用B. subtilis BE-91高产的新型β-甘露聚糖酶降解魔芋胶工艺加酶量少,酶解效率高。有报道[23]利用重组β-甘露聚糖酶reAuMan5AN3C3水解魔芋精粉,当水解率为36.6%时,酶添加量为60 U/g魔芋精粉,水解时间为6 h。本研究的水解率达35.96%时,加酶量仅为6 U/g,酶解时间为1 h,其加酶量少和酶解时间短的优点可以节省生产成本。
不同来源的β-甘露聚糖酶作用于不同的底物,其降解产物分布不同。前期研究表明来源于B. subtilis BE-91的新型β-甘露聚糖酶的最适底物为魔芋胶[13],本研究进一步证明其水解产物以甘露寡糖(二糖到六糖)为主,几乎检测不到单糖。Qiao Yu等[24]以洋槐豆胶为底物进行酶水解,其主要产物为甘露一糖和甘露二糖。同比其他报道,该β-甘露聚糖酶降解魔芋胶的产物集中在二糖到六糖,有利于魔芋甘露低聚糖的制备。
本项目后续研究可结合液相色谱分析法对该β-甘露聚糖酶水解产物进一步定性和定量,为酶解工艺的中试实验提供科学依据;也可尝试β-甘露聚糖酶与β-内切葡聚糖酶、甘露糖苷酶、葡萄糖苷酶等协同降解魔芋胶原料,并对所产葡甘寡糖的功能、营养、药理(抗氧化)等性质进行研究,为酶法制备的甘露寡糖在食品工业应用提供理论依据[23,25]。
采用B. subtilis BE-91高酶活力的新型β-甘露聚糖酶水解魔芋胶,结合正交试验优化其制备葡甘寡糖工艺,获得了最佳工艺组合和较高的葡甘寡糖得率。水解产物主要成分为甘露寡糖(二糖到六糖),具备开发成功能性食品的潜能。
参考文献:
[1] DAVÉ V, MCCARTHY S P. Review of konjac glucomannan[J]. Journal of Environmental Polymer Degradation, 1997, 5(4): 237-241. DOI:10.1007/BF02763667.
[2] SUWANNAPORN P, THEPWRONG K, TESTER R, et al. Tolerance and nutritional therapy of dietary fibre from konjac glucomannan hydrolysates for patients with inflammatory boweldisease (IBD)[J]. Bioactive Carbohydrates and Dietary Fibre, 2013, 2: 93-98. DOI:10.1016/j.bcdf.2013.09.005.
[3] ZHENG Qiaoran, WU Yinglong, XU Huailiang. Effect of dietary oxidized konjac glucomannan on Schizothorax prenanti growth performance, body composition, intestinal morphology and intestinal microflora[J]. Fish Physiology and Biochemistry, 2015, 41: 733-743. DOI:10.1007/s10695-015-0042-0.
[4] JIN Weiping, MEI Ting, WANG Yuntao, et al. Synergistic degradation of konjac glucomannan by alkaline and thermal method[J]. Carbohydrate Polymers, 2014, 99: 270-277. DOI:10.1016/ j.carbpol.2013.08.029.
[5] PAN Tingtiao, PENG Shuhui, XU Zhenlin, et al. Synergetic degradation of konjac glucomannan by γ-ray irradiation and hydrogen peroxide[J]. Carbohydrate Polymers, 2013, 93: 761-767. DOI:10.1016/ j.carbpol.2012.11.075.
[6] JIN Weiping, XU Wei, LI Zhenshun, et al. Degraded konjac glucomannan by γ-ray irradiation assisted with ethanol: preparation and characterization[J]. Food Hydrocolloids, 2014, 36: 85-92. DOI:10.1016/j.foodhyd.2013.09.005.
[7] 罗清楠, 谭玉荣, 刘宏, 等. 响应曲面法优化酸法魔芋葡甘露聚糖水解工艺[J]. 食品科学, 2012, 33(6): 119-122.
[8] 党娅, 刘水英, 张志健, 等. 魔芋低聚糖生产制备工艺优化研究[J]. 食品工业科技, 2015, 36(8): 250-256. DOI:10.13386/ j.issn1002-0306.2015.08.044.
[9] WANG Lan, XIONG Guangquan, PENG Yongbo, et al. The cryoprotective effect of different konjac glucomannan (KGM) hydrolysates on the glass carp (Ctenopharyngodon idella) myofibrillar during frozen storage[J]. Food and Bioprocess Technology, 2014, 7: 3398-3406. DOI:10.1007/s11947-014-1345-3.
[10] 贺雪姣, 王洪新, 马朝阳, 等. β-甘露聚糖酶低限度水解制备适度黏度魔芋胶[J]. 食品与发酵工业, 2011, 37(6): 102-105. DOI:10.13995/ j.cnki.11-1802/ts.2011.06.024.
[11] LIU Zhengchu, XU Junfei, DUAN Shenwen, et al. Expression of modified xynA gene fragments from Bacillus subtilis BE-91[J]. Annals of Microbiology, 2014, 64: 139-145. DOI:10.1007/s13213-013-0642-9.
[12] LIU Zhengchu, DAI Xiaoyang, ZHANG Juzuo, et al. Screening of a xylanase high-producing strain and its rapid separation and purification[J]. Annals of Microbiology, 2011, 61: 901-906. DOI:10.1007/s13213-011-0212-y.
[13] 成莉凤. β-甘露聚糖酶高产菌株筛选及酶的纯化与性质研究[D]. 北京: 中国农业科学院, 2007.
[14] GUO Gang, LIU Zhengchu, XU Juzuo, et al. Purification and characterization of a xylanase from Bacillus subtilis isolated from the degumming line[J]. Journal of Basic Microbiology, 2011, 51: 1-10. DOI:10.1002/jobm.201100262.
[15] AKINO T, NAKAMURA N, HORIKOSHI K. Production of β-mannosidase and β-mannanase by an alkalophilic Bacillus sp.[J]. Applied Microbiology and Biotechnology, 1987, 26: 323-327.
[16] 余红英, 杨幼慧, 孙远明, 等. β-甘露聚糖酶作用魔芋胶条件研究[J]. 食品工业科技, 2003, 24(7): 33-35. DOI:10.13386/ j.issn1002-0306.2003.07.013.
[17] 石浩, 王仁才, 庞立, 等. 糖枣多糖的单糖组成分析[J]. 食品科学, 2015, 36(6): 169-172. DOI:10.7506/spkx1002-6630-201506031.
[18] 李小菊, 张越非, 钟玲, 等. 魔芋葡甘露聚糖的微波辅助纯化及其性能研究[J]. 食品科学, 2013, 34(12): 22-26. DOI:10.7506/spkx1002-6630-201312005.
[19] 李云雁, 胡传荣. 实验设计与数据处理[M]. 2版. 北京: 化学工业出版社, 2008: 124-127.
[20] 徐书景, 张跃灵, 张妍, 等. 改进重叠延伸PCR技术构建定点双突变[J]. 中国生物工程杂志, 2010, 30(10): 49-54. DOI:10.13523/ j.cb.20101009.
[21] ZHANG Yueling, JU Jiansong, PENG Hao, et al. Biochemical and structural characterization of the intracellular mannanase AaManA of Alicyclobacillus acidocaldarius reveals a novel glycoside hydrolase family belonging to clan GH-A[J]. The Journal of Biological Chemistry, 2008, 283(46): 31551-31558. DOI:10.1074/jbc. M803409200.
[22] 李坚斌, 陈小云, 梁慧洋, 等. 魔芋胶的性质研究[J]. 食品科学, 2009, 30(19): 93-95.
[23] 唐存多. β-甘露聚糖酶的基因克隆、分子改造及低聚甘露糖的酶法制备[D]. 无锡: 江南大学, 2013.
[24] QIAO Yu, CHEN Xiaobin, DING Hongbiao, et al. Heterologous expression and characterization of man gene from Bacillus subtilis in Pichia pastoris[J]. Frontiers of Biology in China, 2008, 3(1): 26-31. DOI:10.1007/11515-008-0002-5.
[25] CHEN Junfan, LIU Desheng, SHI Bo, et al. Optimization of hydrolysis conditions for the production of glucomanno-oligosaccharides from konjac using β-mannanase by response surface methodology[J]. Carbohydrate Polymers, 2013, 93: 81-88. DOI:10.1016/j.carbpol.2012.05.037.
CHENG Lifeng, FENG Xiangyuan, DUAN Shengwen, ZHENG Ke, LIU Zhengchu*
(Institute of Bast Fiber Crops, Chinese Academy of Agricultural Sciences, Changsha 410205, China)
Abstract: This study explored the preparation of glucomanno-oligosaccharides by the hydrolysis of konjac gum with purity more than 95% using a new high-yield β-mannanase with high degradation efficiency of hemicellulose secreted by Bacillus subtilis BE-91. Based on one-factor-at-a-time experiments, a four-variable, three-level orthogonal array design was applied to optimize the hydrolysis process of konjac gum, and thin layer chromatography (TLC) was used to qualitatively analyze the products. Results showed that the optimal experimental conditions that provided maximum hydrolysis efficiency (35.96%) were determined as follows: konjac gum concentration, 0.33 g/100 mL; β-mannanase dosage, 6 U/g; hydrolysis time, 1 h; and hydrolysis temperature, 60 ℃. The hydrolysis rate of the konjac gum obtained under these optimal conditions was 35.96%. The hydrolysis products were mostly oligosaccharides with a polymerization degree of 2–6. The enzymatic approach to the preparation of glucomanno-oligosaccharides possesses the advantages of lower enzyme consumption, shorter hydrolysis time, and higher-purity products which have broad application prospects in the preparation of functional foods.
Key words: Bacillus subtilis BE-91; β-mannanase; konjac gum; glucomanno-oligosaccharides; process
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)06-0034-05
DOI:10.7506/spkx1002-6630-201606006 10.7506/spkx1002-6630-201606006. http://www.spkx.net.cn
*通信作者:刘正初(1956—),男,研究员,硕士,研究方向为草本纤维生物提取科学与工程。E-mail:ibfclzc@189.cn
作者简介:成莉凤(1981—),女,助理研究员,博士,研究方向为微生物分子生物学。E-mail:chenglifeng0628@163.com
基金项目:国家创新工程项目(ASTIP-IBFC08);国家高技术研究发展计划(863计划)项目(2012AA022209D);国家现代农业(麻类)产业技术体系建设专项(CARS-19-E24)
收稿日期:2015-06-08