邓 娜1,乔 沈1,高 芯1,高娅茹1,马 捷1,张 娜2,郭庆启1,*
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150086)
摘 要:以石榴皮为原料,通过单因素试验及响应面试验优化石榴皮多酚的最佳提取工艺条件为:乙醇体积分数40%、超声波功率250 W、浸提温度60 ℃、料液比1∶27.5(g/mL)、超声时间39.3 min。此工艺条件下的多酚提取量为(1.13±0.26)mg/g。在优化条件下分别对石榴皮、石榴瓤和石榴籽中的多酚类化合物进行提取并比较其抗氧化活性,得到石榴不同部位的抗氧化活性大小依次为石榴皮>石榴籽>石榴瓤;进一步研究了人工模拟胃肠液对抗氧化活性最强组分石榴皮多酚活性的影响,发现经人工胃液处理后,石榴皮多酚的抗氧化活性升高(P<0.05),而经人工肠液处理后其抗氧化活性降低(P<0.05),推断石榴多酚类化合物在模拟胃肠液条件下其结构和功能的变化是不同的。
关键词:石榴;部位;多酚;抗氧化;响应面
邓娜, 乔沈, 高芯, 等. 响应面试验优化石榴皮多酚提取工艺及石榴不同部位多酚的抗氧化活性分析[J]. 食品科学, 2016, 37(6): 39-43. DOI:10.7506/spkx1002-6630-201606007. http://www.spkx.net.cn
DENG Na, QIAO Shen, GAO Xin, et al. Optimization of extraction process of polyphenols from pomegranate peel by response surface methodology and antioxidant activity analysis of polyphenols in different parts of pomegranate fruit[J]. Food Science, 2016, 37(6): 39-43. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606007. http://www.spkx.net.cn
石榴为石榴科石榴属植物[1],是一种集观赏、生态、经济、社会效益和保健功能于一身的优良果树[2-3]。石榴果实被誉为超级水果,既是生食鲜果,又可用于食品加工[4];石榴不仅营养丰富[5-6],而且富含多种生物活性物质,是历代药典中的重要中药,具有多种防病治病的功效[7-8],如预防和治疗心脑血管、炎症和癌症等疾病,这些功效多来自于果实中极为丰富多样的多酚类物质,如类黄酮、花青苷、酚酸和鞣花单宁等[9-10]。
目前对于石榴多酚的研究多集中于新技术在提取方法中的应用以及提取物的相关活性[11-12],本实验以石榴皮、石榴瓤和籽为研究对象,研究石榴不同部位之间多酚抗氧化活性的差异性,并考察模拟人体内微环境对石榴多酚抗氧化活性的影响,为进一步研究石榴中酚类物质组成及分布特征以及石榴产品精深加工提供理论基础。
1.1 材料与试剂
新鲜石榴(Punica granatum L.)市购,手工去皮剥籽,皮、瓤和籽分别于40 ℃恒温干燥后粉碎,过40 目筛后密封保存于冰箱中。
没食子酸标准品、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;胃蛋白酶、胰蛋白酶 国药集团化学试剂有限公司。所用化学试剂均为分析纯。
1.2 仪器与设备
TU-1800SPC紫外-可见分光光度计 北京普析通用仪器有限公司;FD-1A-80真空冻干机 北京博医康实验仪器有限公司;KQ-500DE数控型超声波清洗器 昆山超声仪器有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;DL-6M型离心机 湖南星科科学仪器有限公司;PB10酸度计 德国赛多利斯公司;FW135粉碎机天津泰斯特仪器有限公司。
1.3 方法
1.3.1 石榴皮多酚提取工艺的优化
以石榴皮为原料进行提取工艺的单因素试验。准确称取样品粉末2.00 g,按一定料液比(1∶5~1∶40)加入不同体积分数的乙醇溶液(30%~80%),在不同的超声波功率(200~400 W)和浸提温度(30~70 ℃)条件下浸提一定时间(20~70 min)后,真空抽滤并定容,进行多酚含量的测定[13],在单因素试验的基础上通过响应面法优化提取工艺参数[14-15]。
1.3.2 抗氧化活性的测定
在响应面法优化提取工艺参数的基础上,分别对石榴皮、瓤和籽中的多酚进行提取、富集并真空冻干,进行抗氧化活性的测定。
1.3.2.1 总还原能力的测定
准确移取1.0 mL样液于试管中,分别加入2.5 mL 0.2 mol/L磷酸缓冲液(pH 6.6)和2.5 mL 1%铁氰化钾溶液,于50 ℃水浴中保温20 min,快速冷却,再加入2.5 mL 10%三氯乙酸溶液,4 000 r/min离心10 min,取上清液2.5 mL,依次加入2.5 mL蒸馏水、0.5 mL 0.1%三氯化铁溶液,充分振荡,静置10 min后在700 nm波长条件下测其吸光度。取1.0 mL 60%乙醇溶液为空白对照液同以上操作参比调零,以吸光度表示总还原能力的大小[16]。
1.3.2.2 DPPH自由基清除能力的测定
准确移取1 . 0 m L测试液于试管中,加入2.0 mL 0.1 mmol/L DPPH溶液振荡摇匀,1.0 mL 70%乙醇溶液与2.0 mL 0.1 mmol/L DPPH溶液混合作为空白对照,常温避光反应60 min后在517 nm波长条件下测其吸光度,以70%乙醇溶液参比调零[17]。DPPH自由基清除率(Y)的计算如式(1)所示:
式中:A0为空白对照的吸光度;A为样品的吸光度。
1.3.2.3 羟自由基清除能力的测定
在反应体系中依次加入0.5 mL FeSO4(2 mmol/L)、1.0 mL水杨酸(6 mmol/L)和3.0 mL样液,混匀后加入0.5 mL H2O2(质量分数0.01%)启动反应,然后于37 ℃水浴30 min,冷却后于510 nm波长处测定吸光度[18]。羟自由基清除率(Z)的计算如式(2)所示:
式中:Z0为未加样液的吸光度;Zi为加入样液的吸光度;Zi0为试剂空白的吸光度。
1.3.3 人工模拟胃肠液处理对石榴皮多酚抗氧化活性的影响
量取1 mol/L的稀盐酸溶液16.4 mL,加入800 mL的蒸馏水和10.0 g的胃蛋白酶,溶解混合均匀后定容至1 000 mL配制成人工模拟胃液。称取6.8 g的KH2PO4,加入500 mL蒸馏水,用0.1 mol/L的NaOH调节溶液pH值至6.8,再加入10.0 g胰蛋白酶,溶解后加水定容至1 000 mL配制成人工模拟肠液[19]。
量取40%乙醇溶液配制的质量浓度为5 mg/mL石榴皮多酚溶液5 mL,分别加入到100 mL人工胃液和165 mL人工肠液中,将胃液处理组在37 ℃条件下,130 r/min水浴振荡70 min,将肠液处理组在37 ℃条件下,45 r/min水浴振荡120 min,以蒸馏水为空白对照组,处理结束后采用乙酸乙酯浸提3 次,合并萃取液真空浓缩并用乙醇溶液定容至50 mL[20],分别进行抗氧化活性的测定。
2.1 石榴皮多酚浸提单因素试验结果

图1 各单因素对多酚提取量的影响
Fig.1 Effect of some single factors on the yield of polyphenols
a.乙醇体积分数;b.料液比;c.浸提温度;d.超声时间;e.超声波功率。
由图1可知,通过单因素试验,确定最佳乙醇体积分数为40%,选取料液比、浸提温度、超声时间和超声波功率为变量,对应响应面设计0水平对应值分别为1∶25、60 ℃、40 min和250 W。
2.2 响应面试验结果
2.2.1 Box-Behnken试验设计与结果
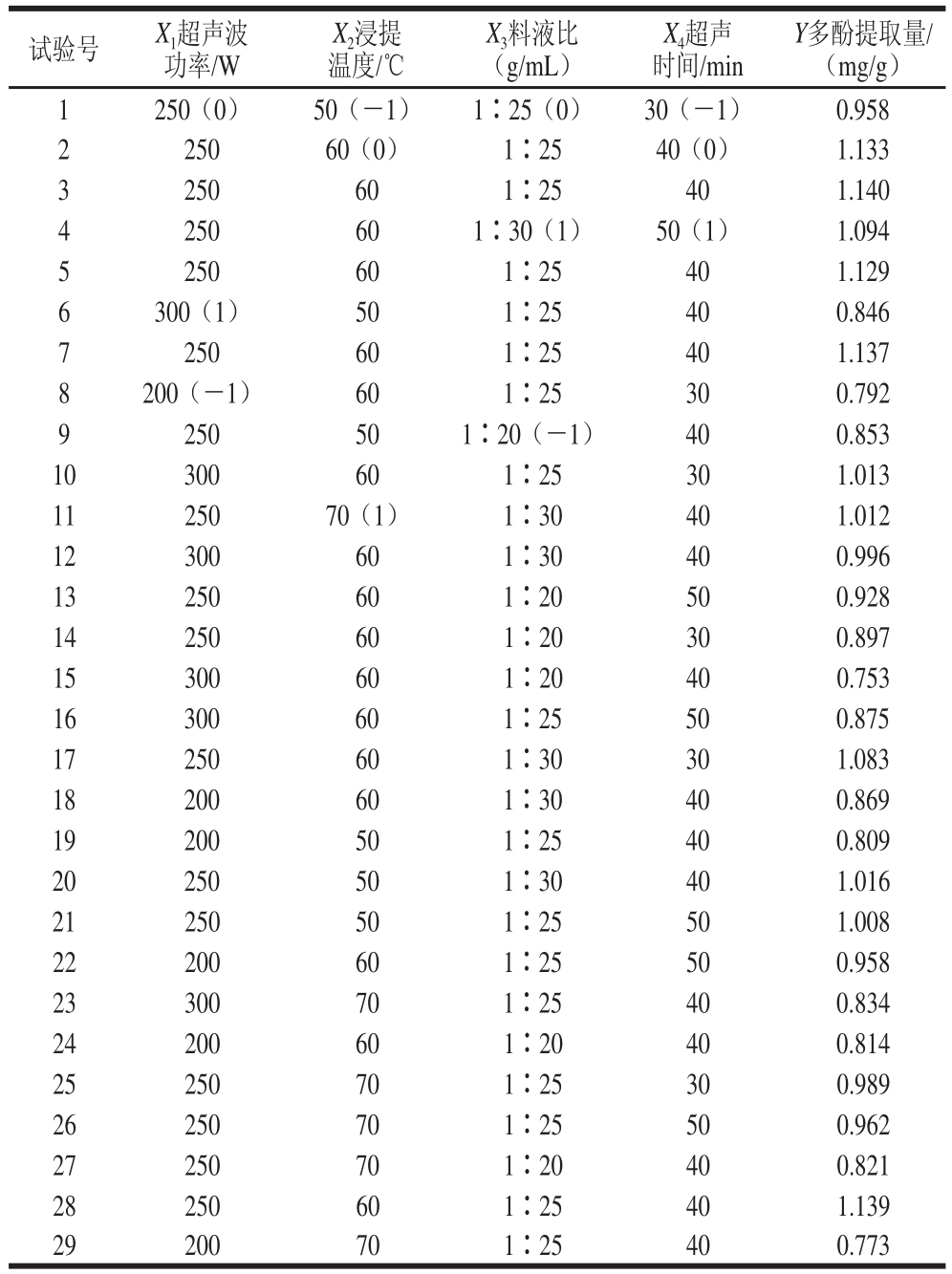
以多酚提取量为响应值,根据Box-Behnken设计因素水平编码值,利用Design-Expert 8.0设计响应面试验方案,试验测定结果见表1。
表1 超声波辅助提取石榴皮多酚的响应面试验设计及结果
Table 1 Experimental design and results for the response surface analysis to optimize the ultrasonic assisted extraction of polyphennols from pomegranate peel
2.2.2 模型方差分析及响应面试验结果
通过统计分析软件SAS 9.1对表1中实验数据进行二次多项式回归拟合,建立二次回归多元方程如下:Y= -11.956 917+0.039 365X1+0.147 235X2+0.146 35X3+![]()
![]()
![]()
![]()
由表2可知,模型F值为216.71,表明模型因变量与自变量之间的线性关系明显,该模型回归极显著(P<0.01),失拟项和纯误差的平方和和均方值较低。该模型R2=0.995 4,![]() 说明模型与试验拟合程度高,自变量与响应值之间的线性关系显著,可以用于不同变量条件下的响应值预测。
说明模型与试验拟合程度高,自变量与响应值之间的线性关系显著,可以用于不同变量条件下的响应值预测。
表2 响应面模型方差分析
Table 2 Analysis of variance for the fitted response surface model

从表2可以看出,X1、X3、X1X3、X1X4、![]() 项达到了极显著的影响水平(P<0.01),而X2和X4项为显著影响水平(P<0.05)。其中超声波功率和料液比、超声波功率和超声时间、浸提温度和超声时间之间存在着交互作用,具体交互作用如图2所示。
项达到了极显著的影响水平(P<0.01),而X2和X4项为显著影响水平(P<0.05)。其中超声波功率和料液比、超声波功率和超声时间、浸提温度和超声时间之间存在着交互作用,具体交互作用如图2所示。
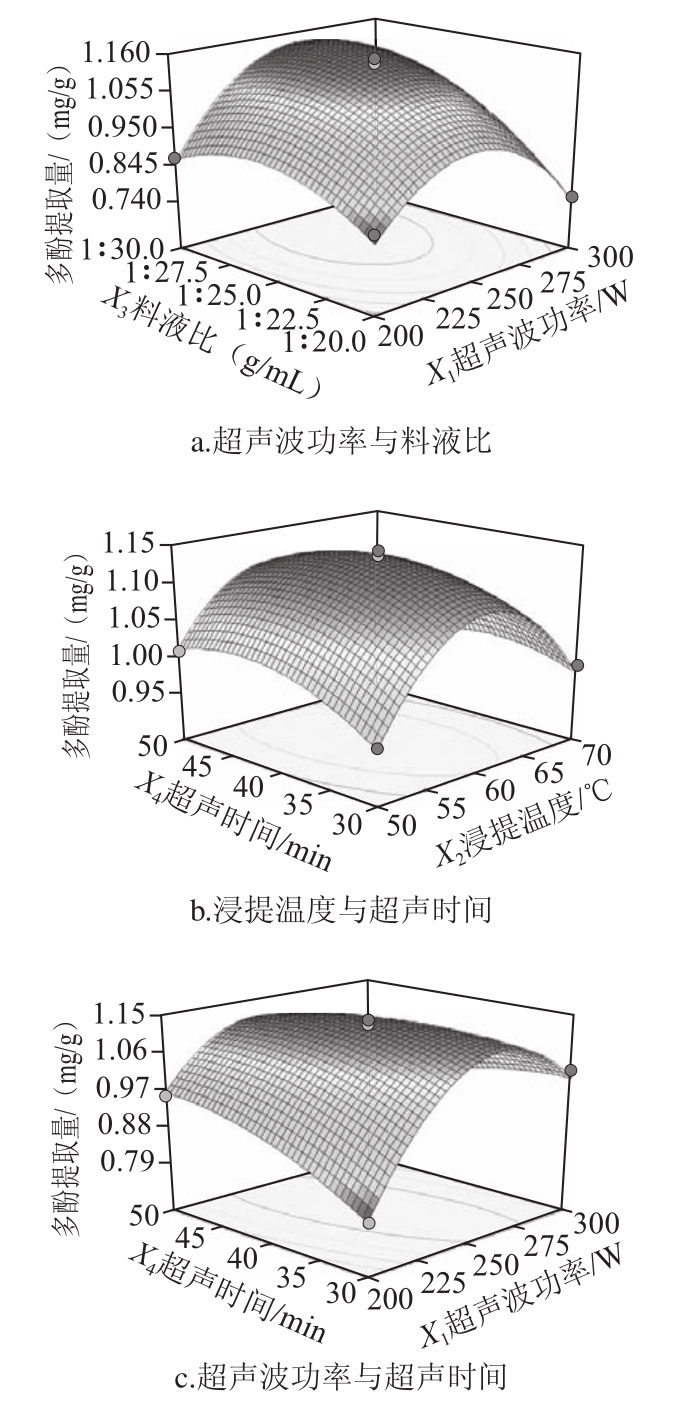
图2 各因素交互作用影响多酚提取量的响应面图
Fig.2 Response surface graphs showing the interactive effects of various factors on the yield of polyphenols
应用响应面寻优分析方法对回归模型进行分析得到最优结果为超声波功率257.06 W、浸提温度59.89 ℃、料液比1∶27.5、超声时间39.30 min,最大多酚提取量预测值为1.158 mg/g;考虑仪器设备及相关条件,确定最优工艺参数为超声波功率250 W、浸提温度60 ℃、料液比1∶27.5、超声时间39.3 min,在此工艺条件下进行3 次平行实验,得到多酚提取量为(1.13±0.26)mg/g。
2.3 石榴不同部位抗氧化活性的比较
在最优提取工艺条件下分别对石榴皮、石榴瓤和石榴籽中的多酚进行提取,测定其多酚提取量分别为石榴皮(1.13±0.26)mg/g、石榴籽(0.94±0.18)mg/g、石榴瓤(0.76±0.22)mg/g。进一步比较其总还原能力、DPPH自由基和羟自由基的清除能力,结果如图3所示。
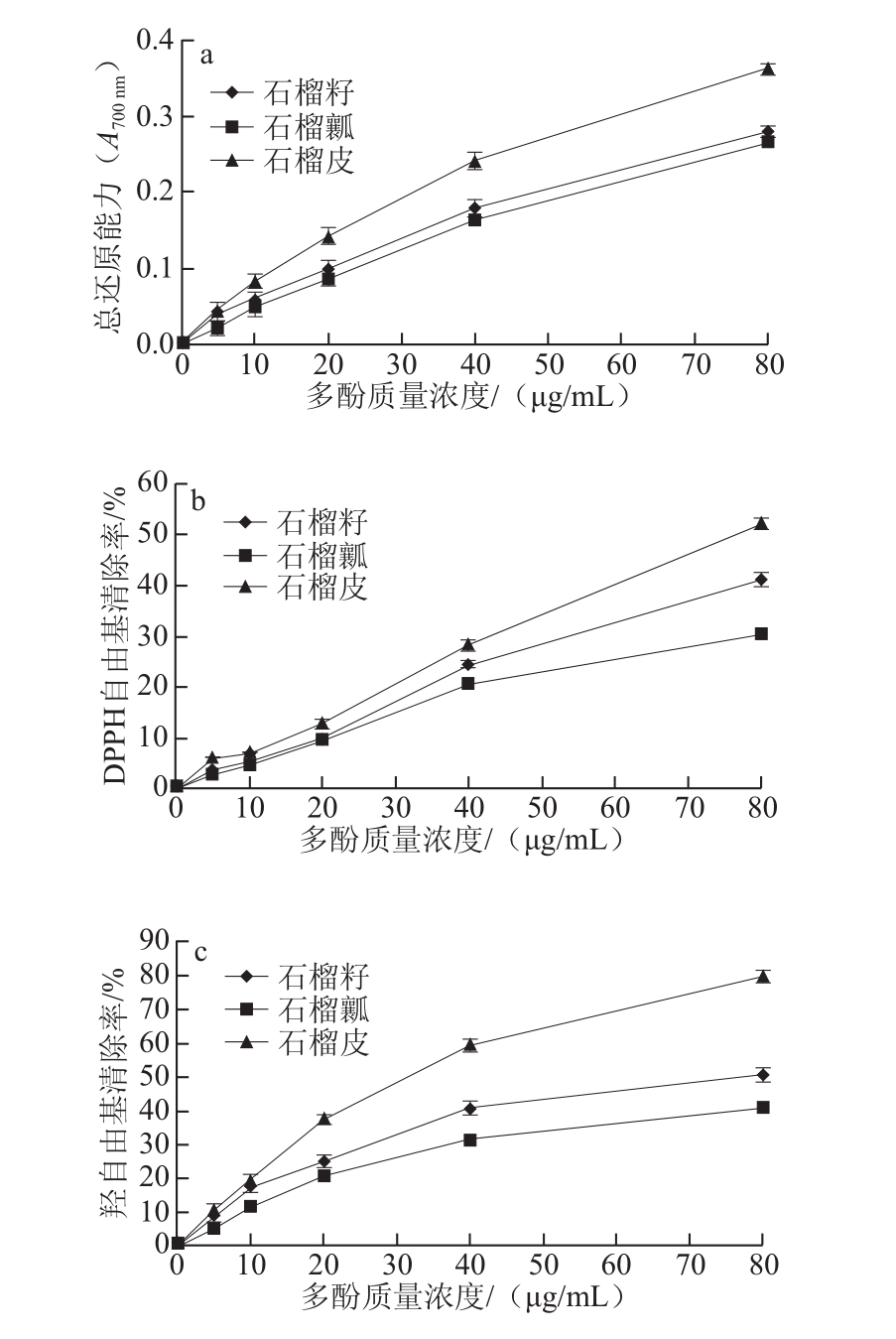
图3 石榴不同部位的总还原能力(a)、DPPH自由基(b)和羟自由基(c)的清除能力
Fig.3 Total reducing power, DPPH and hydroxyl free radical scavenging abilities of different parts of pomegranate
由图3可知,石榴不同部位提取出的多酚均具有一定的抗氧化能力,且随质量浓度的升高呈递增的趋势;相同质量浓度条件下,石榴不同部位的总还原能力、DPPH自由基和羟自由基的清除能力依次为石榴皮>石榴籽>石榴瓤,石榴不同部位清除DPPH自由基和羟自由基的IC50分别为:石榴皮82.161、28.939 μg/mL,石榴籽110.356、70.492 μg/mL,石榴瓤171.987、109.922 μg/mL。
2.4 人工模拟胃肠液处理对石榴皮多酚抗氧化能力的影响
采用人工模拟胃肠液的体内消化微环境,可以为石榴多酚的体内功能性实验提供数据指导[21]。经人工胃肠液处理后,石榴皮多酚的抗氧化能力如表3所示。
表3 人工胃肠液处理对石榴皮多酚抗氧化能力的影响
Table 3 Effect of artificial gastrointestinal treatment on antioxidant activities of pomegranate polyphenols
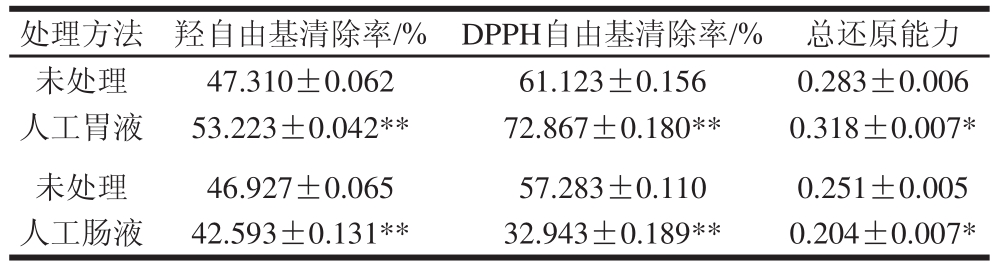
注:*.与未处理组相比差异显著(P<0.05),**.与未处理组相比差异极显著(P<0.01)。
由表3可知,经过人工胃肠液处理后,石榴皮多酚的抗氧化能力发生了不同趋势的变化。经人工胃液处理后,抗氧化能力提高,可能是由于多酚类化合物在低pH值条件下发生了水解[22],一些苷类化合物变成了相应的苷元从而引起抗氧化能力的提高[23]。研究同时发现,经过人工肠液处理后,石榴多酚的抗氧化能力下降,Pavan 等[24]认为可能是由于在肠液pH值条件下,大分子类的多酚类化合物较稳定,但是当它们水解成较小的分子(如没食子酸)时就变得不稳定,从而影响其活性。Kamiloglu等[25]认为可能是由于体系当中存在的抑制物或辅助因子对活性产生了影响。由于本研究中的石榴多酚为一种粗提物,因此人工模拟胃肠液环境对其抗氧化能力的影响还需要通过对纯品以及细胞学实验进行更深入和准确的研究。
通过单因素试验及响应面试验优化确定石榴皮多酚的最适提取工艺条件为超声波功率250 W、浸提温度60 ℃、料液比1∶27.5、超声时间39.30 min。此工艺条件下多酚提取量为(1.13±0.26)mg/g。通过对石榴不同部位的总还原能力、DPPH自由基和羟自由基清除能力测定发现,抗氧化能力由高到低依次为石榴皮、石榴籽、石榴瓤。研究了模拟体内微环境条件对石榴皮多酚抗氧化能力的影响,结果发现经人工胃液处理后,石榴皮多酚的抗氧化能力提高;而经人工肠液处理后,浸提物的抗氧化能力下降。推断石榴多酚类化合物在模拟胃肠液条件下其结构和功能的变化是不同的。
参考文献:
[1] 王如峰, 向兰, 杜力军, 等. 石榴的生物活性研究[J]. 亚太传统医药, 2006(6): 79-81.
[2] 唐丽丽, 张鹏. 石榴皮多酚类物质研究进展[J]. 农产品加工, 2014(12): 1529-1533. DOI:10.3969/jissn.1671-9646(X).2014.12.018.
[3] LI Y F, GUO C J, YANG J J, et al. Evaluation of antioxidant properties of pomegranate peel extract in comparison with pomegranate pulp extract[J]. Food Chemistry, 2006, 96: 254-260. DOI:10.1016/j.foodchem.2005.02.033.
[4] 李国秀. 石榴多酚类物质的分离鉴定和抗氧化活性研究[D]. 西安:陕西师范大学, 2008.
[5] 田树革, 魏玉龙, 刘宏炳. Folin-Ciocalteu比色法测定石榴不同部位总多酚的含量[J]. 光谱实验室, 2009, 26(2): 341-344. DOI:10.3969/ j.issn.1004-8138.2009.02.045.
[6] 周倩, 孙立立, 戴衍朋, 等. 石榴皮、石榴瓤及石榴籽的化学成分比较研究[J]. 中国中药杂志, 2013, 38(13): 2159-2162. DOI:10.4268/ cjcmm20131325.
[7] 李云峰, 郭长江, 杨继军, 等. 石榴皮抗氧化物质提取及体外抗氧化作用研究[J]. 营养学报, 2004, 26(2): 144-147. DOI:10.13325/j.cnki. acta.nutr.sin,2004.02.016.
[8] LI X, WASILA H, LIU L W, et al. Physicochemical characteristics, polyphenol compositions and antioxidant potential of pomegranate juices from 10 Chinese cultivars and the environmental factors analysis[J]. Food Chemistry, 2015, 175: 575-584. DOI:10.1016/ j.foodchem.2014.12.003.
[9] ZHANG L H, YANG X M, ZHANG Y H, et al. In vitro antioxidant properties of different parts of pomegranate flowers[J]. Food and Bioproducts Process, 2015, 174: 417-425. DOI:10.1016/ j.fbp.2010.04.007.
[10] 冯立娟, 陶吉寒, 尹燕雷, 等. 石榴功能物质鞣花酸研究进展[J].食品科学, 2014, 35(23): 325-330. DOI:10.7506/spkx1002-6630-201423063.
[11] AKHTAR S, ISMAIL T, FRATERNALE D, et al. Pomegranate peel and peel extracts: chemistry and food features[J]. Food Chemistry, 2015, 174: 417-425. DOI:10.1016/j/foodchem.2014.11.035.
[12] QU W J, PAN Z L, MA H L. Extraction modeling and activity of antioxidants from pomegranate marc[J]. Journal of Food Engineering, 2010, 99: 16-23. DOI:10.1016/j.jfooddeng.2010.01.020.
[13] 周卫龙, 徐建峰, 许凌. GB/T 8313—2008 茶叶中茶多酚和儿茶素类含量的检测方法[S]. 北京: 中国标准出版社, 2008.
[14] 贾冬英, 姚开, 谭薇, 等. 石榴皮中多酚提取条件的优化[J]. 林产化学与工业, 2006, 26(3): 123-126. DOI:10.3321/j.issn:0253-2417.2006.03.030.
[15] 张立华, 张元湖, 于军伟, 等. 超声波辅助提取石榴叶单宁的工艺[J]. 农业工程学报, 2009, 25(增刊1): 164-167. DOI:10.3969/ j.issn.1002-6819.2009.z1.033.
[16] 郭庆启, 张娜, 李梦云, 等. 落叶松松塔成分、抗氧化能力与海拔高度的相关性研究[J]. 北京林业大学学报, 2013, 35(1): 59-63. DOI:10.13332/j.1000-1522.2013.01.006.
[17] 苏晓雨, 王振宇. 红松种子壳多酚物质的提取及抗氧化特性[J]. 农业工程学报, 2009, 25(增刊1): 198-203. DOI:10.3969/j.issn.1002-6819.2009. z1.040.
[18] 江慎华, 王书源, 马海乐, 等. 丁香活性物质提取工艺优化与抗氧化活性研究[J]. 农业机械学报, 2010, 41(1): 132-138. DOI:10.3969/j. issn:1000-1298.2010.01.026.
[19] 国家药典委员会. 中华人民共和国药典: 二部[M]. 2010版. 北京: 中国医药科技出版社, 2010: 309.
[20] MADUREIRA A R, AMORIM M, GOMES A M, et al. Protective effect of whey cheese matrix on probiotic strains exposed to simulated gastrointestinal conditions[J]. Food Research International, 2011, 44(1): 465-470. DOI:10.1016/j.foodres.2010.09.010.
[21] SEIQUER I, RUEDA A, OLALLA M, et al. Assessing the bioavailability of polyphenols and antioxidant properties of extra virgin argan oil by simulated digestion and Caco-2 cell assays. Comparative study with extra virgin olive oil[J]. Food Chemistry, 2015, 188: 496-503. DOI:10.1016/j.foodchem.2015.05.006.
[22] JOASH B L T, YAU Y L. Critical analysis of current methods for assessing the in vitro antioxidant and antibacterial activity of plant extracts[J]. Food Chemistry, 2015, 172: 814-822. DOI:10.1016/ j.foodchem.2014.09.141.
[23] BERMÐDEZ-SOTO M J, TOM˘S-BARBER˘N F A, GARC¸ACONESA M T. Stability of polyphenols in chokeberry (Aronia melanocarpa) subjected to in virto gastric and pancreatic digestion[J]. Food Chemistry, 2007, 102: 865-874. DOI:10.1016/ j.foodchem.2006.06.025.
[24] PAVAN V, SANCHO R A S, PASTORE G M. The effect of in vitro digestion on the antioxidant activity of fruit extracts (Carica papaya, Artocarpus heterophillus and Annona marcgravii)[J]. LWTFood Science and Technology, 2014, 59: 1247-1251. DOI:10.1016/ j.lwt.2014.05.040.
[25] KAMIOGLU S, PASLI A A, OZCELIK B, et al. Influence of different processing and storage conditions on in vitro bioaccessibility of polylhenols in black carrot jams and marmalades[J]. Food Chemistry, 2015, 186: 74-82. DOI:10.1016/j.foodchem.2014.12.046.
DENG Na1, QIAO Shen1, GAO Xin1, GAO Yaru1, MA Jie1, ZHANG Na2, GUO Qingqi1,*
(1. School of Forestry, Northeast Forestry University, Harbin 150040, China; 2. College of Food Engineering, Harbin University of Commerce, Harbin 150086, China)
Abstract: The ultrasonic-assisted extraction of polyphenols from pomegranate peel was optimized through the combined use of single factor method and response surface methodology. The optimal extraction parameters were found as follows: ethanol concentration, 40%; ultrasonic power, 250 W; extraction temperature, 60 ℃; material/liquid ratio, 1:27.5 (g/mL); and extraction time, 39.3 min. The yield of polyphenols was (1.13 ± 0.26) mg/g under these conditions. Polyphenols compounds were extracted from the peel, pulp or seed of pomegranate under the optimal conditions, and their antioxidant activities were evaluated and compared. The results showed that the antioxidant activity of different fruit parts of pomegranate was in the decreasing order: peel > seed > pulp. The present study also found that after treatment with artificial gastric fluid, the antioxidant activity of pomegranate peel was significantly increased (P < 0.05) but was significantly decreased after treatment with artificial intestinal fluid (P < 0.05). The results suggested that the changes in the structure and function of polyphenols in artificial gastric and intestinal fluids were different.
Key words: pomegranate; parts; polyphenol; antioxidation; response surface methodology
中图分类号:S665.4
文献标志码:A
文章编号:1002-6630(2016)06-0039-05引文格式:
DOI:10.7506/spkx1002-6630-201606007
*通信作者:郭庆启(1978—),男,讲师,博士,研究方向为天然产物化学。E-mail:qingqiguo@126.com
作者简介:邓娜(1994—),女,本科,研究方向为天然产物化学。E-mail:1063008553@qq.com
基金项目:教育部东北林业大学大学生创新训练计划项目(201410225147);卓越农林人才培养计划改革试点项目(41110211);黑龙江省应用技术研究与开发计划项目(GC13B215)
收稿日期:2015-05-30