李佩艳1,韩四海1,罗登林1,赵胜娟1,刘建学1,尹 飞2
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.河南科技大学农学院,河南 洛阳 471023)
摘 要:以牡丹叶为原料,采用酶法提取牡丹叶黄酮,以纤维素酶用量、pH值、酶解温度、酶解时间为单因素,以牡丹叶黄酮提取率为考察指标,通过正交试验确定酶法提取牡丹叶黄酮的最佳工艺参数为:纤维素酶用量12.5 U/mL、pH 4.5、酶解温度45 ℃、酶解时间4 h。在此条件下牡丹叶黄酮提取率为2.43%。提取得到的牡丹叶黄酮浸提液可用于亚硝酸盐清除,通过正交试验优化得到牡丹叶黄酮清除亚硝酸盐的最佳反应条件为:反应温度70 ℃、pH 4.0、牡丹叶黄酮提取液添加量25 mL(10 μg亚硝酸钠)、反应时间20 min。在此条件下牡丹叶黄酮对亚硝酸盐清除率可达62.15%。
关键词:牡丹叶;黄酮;纤维素酶;亚硝酸盐;清除
李佩艳, 韩四海, 罗登林, 等. 牡丹叶黄酮的酶法提取条件优化及其对亚硝酸盐的清除作用[J]. 食品科学, 2016, 37(6): 77-81. DOI:10.7506/spkx1002-6630-201606013. http://www.spkx.net.cn
LI Peiyan, HAN Sihai, LUO Denglin, et al. Optimization of enzymatic extraction and nitrite scavenging capacity of flavonoids from peony leaves[J]. Food Science, 2016, 37(6): 77-81. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606013. http://www.spkx.net.cn
牡丹(Paeonia suffruticosa Andr.)是毛莨科、芍药属植物,为多年生落叶小灌木,是重要的观赏植物和药用植物。我国牡丹种质资源丰富,主要分布于河南、山东、湖北、甘肃、重庆、安徽等省,牡丹已成为广泛栽培的一种经济作物[1]。牡丹的开发利用主要集中在牡丹花[2-5]、牡丹皮[6-9]上,对于牡丹叶鲜有研究报道,仅有文献报道牡丹叶的抑菌作用[10]及对幼苗生长的抑制作用[11]。我国牡丹种植面积已超过一百万亩,每年牡丹叶产量相当可观,而牡丹叶在花期过后往往作为废弃物被丢弃,造成了极大的资源浪费。因此如何开发利用牡丹叶成为牡丹产业亟待解决的问题之一。
黄酮类化合物由于具有清除氧自由基、抗氧化、抗疲劳、抗肿瘤、抗病毒、抗菌、抗癌等多种生理和药理活性[12-16],因而在食品、保健品、医药等领域有广泛的应用[17]。牡丹中富含黄酮类化合物,王晓等[18]发现牡丹花中主要活性成分是黄酮类化合物,并从牡丹花中分离得到4 种黄酮苷[19];徐金龙等[20]发现牡丹皮中总黄酮提取率为3.11 mg/g。近些年学者研究发现牡丹叶中也富含黄酮类物质[21],然而关于牡丹叶黄酮的研究报道很少,尤其缺乏酶法辅助提取以及牡丹叶黄酮清除亚硝酸盐的研究。因此,采用酶法从牡丹叶中提取黄酮类物质并将其用于亚硝酸盐的清除,不仅可变废为宝,增加牡丹产业的附加值,而且可为黄酮的工业化生产提供新的来源。
为充分利用牡丹资源,本实验以牡丹叶为原料,采用纤维素酶辅助提取牡丹叶中黄酮,对其最佳提取工艺进行探讨,并将提取的黄酮用于体外亚硝酸盐的清除,本实验结果可为牡丹叶的综合开发利用提供新的思路,为牡丹叶黄酮的工业化生产提供技术支持,为开发有效实用的亚硝酸盐天然清除剂提供方法参考。
1.1 材料与试剂
牡丹叶采摘于河南科技大学,品种为“洛阳红”。
牡丹叶预处理方法为:牡丹叶→自来水清洗→蒸馏水清洗→滤纸吸干叶子表面水分→90 ℃烘箱灭酶15 min→60~65 ℃烘干→粉碎→过筛(80 目)→牡丹叶粉→备用。
纤维素酶(100 000 U/g) 和氏璧生物技术有限公司;芦丁(标准品) 中国食品药品检定研究院;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、对氨基苯磺酸、盐酸萘乙二胺均为分析纯。
1.2 仪器与设备
101-2-BS电热鼓风干燥箱 上海市跃进医疗器械厂;722S型分光光度计 上海第三分析仪器厂;BS200S电子分析天平 北京赛多利斯天平有限公司;HR1704粉碎机 珠海飞利浦家庭电器有限公司;HH-4恒温水浴锅 江苏省金坛市亿通电子有限公司;DELTA 320 pH计 瑞士Mettler Toledo公司;RE-52CS旋转蒸发仪、SHZ-III 台式循环水真空泵 上海亚荣生化仪器厂。
1.3 方法
1.3.1 牡丹叶黄酮的提取及测定
采用酶法提取牡丹叶黄酮,参照李佩艳等[22]方法测定牡丹叶黄酮含量。称取1 g牡丹叶粉,加入12.5 U/mL纤维素酶,在酶解温度为45 ℃、pH 4.5条件下酶解4 h,85 ℃灭酶15 min,然后加入60%的乙醇溶液在70 ℃条件下浸提3 h,过滤,定容至100 mL,即得牡丹叶黄酮提取液。
吸取牡丹叶黄酮提取液0.5 mL,分别加入0.3 mL亚硝酸钠溶液和4.0 mL氢氧化钠溶液,定容至10 mL,测定510 nm波长处的吸光度,按式(1)计算牡丹叶黄酮提取率。
1.3.2 牡丹叶黄酮最佳提取工艺优化
选择纤维素酶用量(2.5、5.0、7.5、10.0、12.5、15.0、17.5 U/mL)、pH值(3.5、4.0、4.5、5.0、5.5)、酶解温度(35、40、45、50、55 ℃)、酶解时间(1、2、3、4、5 h)为单因素进行试验,设计四因素三水平的正交试验确定牡丹叶黄酮的最佳提取工艺条件。
1.3.3 亚硝酸盐清除率测定
根据吴佳等[23]方法进行修改。比色管中分别加入2 mL 5 μg/mL亚硝酸钠标准溶液、一定量的牡丹叶黄酮提取液,混合均匀,之后加入2 mL 0.4%对氨基苯磺酸溶液混匀,静置5 min,加入1 mL 0.2%盐酸萘乙二胺溶液,混匀后静置15 min,加蒸馏水定容至50 mL,测定538 nm波长处吸光度(A样品),同时以蒸馏水代替亚硝酸标准溶液作为空白对照试验测定吸光度(A样空),以蒸馏水代替牡丹叶黄酮提取液的空白对照测定吸光度(A对照)。亚硝酸盐清除率按式(2)计算:
1.3.4 牡丹叶黄酮体外清除亚硝酸盐最优条件优化
将1.3.1节所得到的牡丹叶黄酮提取液用于体外清除亚硝酸盐研究。亚硝酸盐清除体系见1.3.3节,考察牡丹叶黄酮提取液添加量(5、10、15、20、25 mL)、pH值(2.5、3.0、3.5、4.0、4.5)、反应时间(10、15、20、25、30 min)、反应温度(40、50、60、70、80 ℃)对亚硝酸盐清除率的影响,设计四因素三水平正交试验,确定牡丹叶黄酮体外清除亚硝酸盐的最佳反应条件。
2.1 不同因素对牡丹叶黄酮 提取率的影响
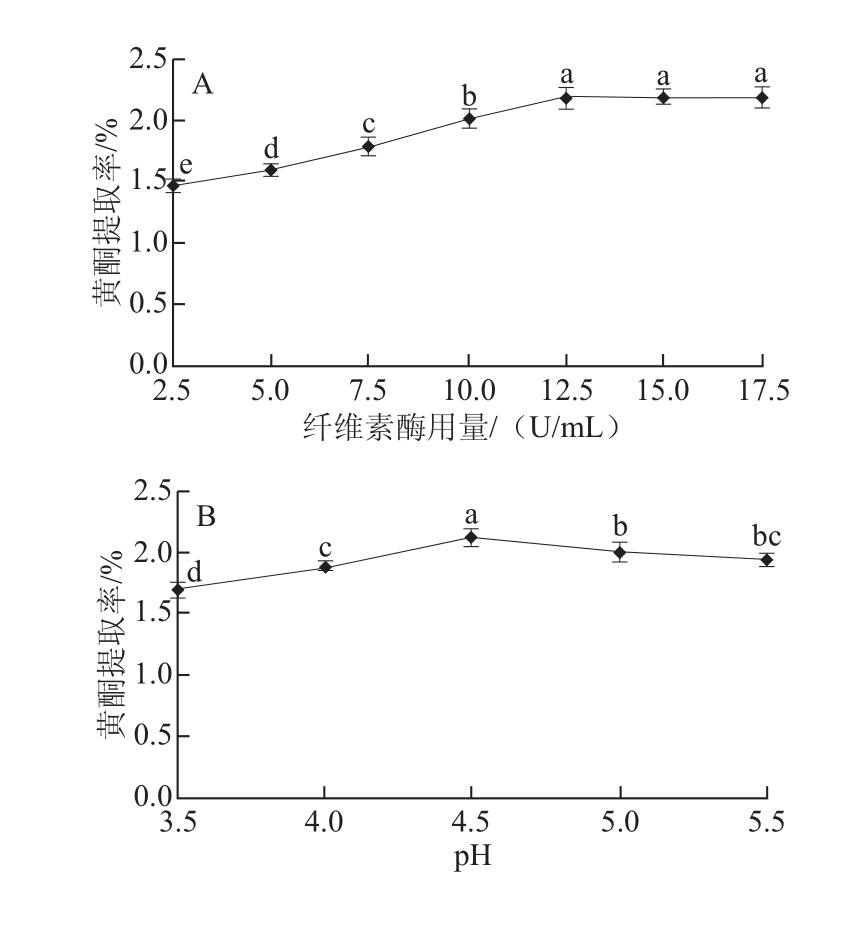
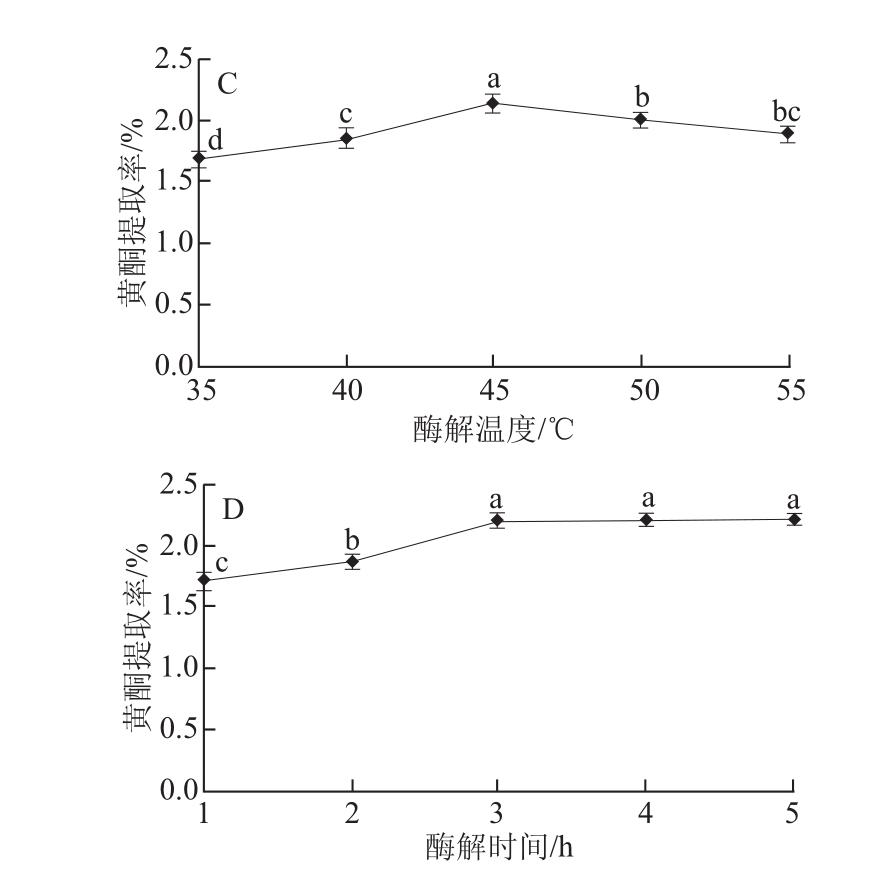
图1 不同因素对牡丹叶黄酮提取率的影响
Fig.1 Effects of different facto rs on the extraction efficiency of flavonoids from peony leaves
A.纤维素酶用量;B. pH值;C.酶解温度;D.酶解时间。
在酶解温度45 ℃、酶解时间3 h、酶解pH 4.5的条件下,不同纤维素酶用量对牡丹叶黄酮提取率的影响见图1A。从图1A可看出,随着纤 维素酶用量的增加,牡丹叶黄酮提取率逐渐增加,当纤维素酶用量为12.5 U/mL时牡 丹叶黄酮的提取率为2.19%,基本达到最大值,此时牡丹叶黄酮提取率与2.5、5.0、7.5、10.0 U/mL纤维素酶用量的黄酮提取率有显著差异(P<0.05),之后随着纤维素酶用量的增加,牡丹叶黄酮提取率变化不大,纤维素酶用量为12.5、15.0、17.5 U/mL对牡丹叶黄酮提取率的影响差异不显著(P>0.05)。这可能是由于纤维素酶用量为12.5 U/mL时能最大程度破坏牡丹叶的细胞壁结构,减少提取传质阻力,使牡丹叶中黄酮易于溶出,而之后虽然纤维素酶用量增加,但是牡丹叶细胞壁结构的破坏已达到最大程度,故牡丹叶黄酮提取率趋于稳定。因此,选择12.5 U/mL为最佳的纤维素酶添加量。
在酶解温度45 ℃、酶解时间3 h、纤维素酶用量12.5 U/mL条件下,不同pH值对牡丹叶黄酮提取率的影响见图1B。从图1B可看出,随着pH值的增加,牡丹叶黄酮提取率逐渐升高,当pH值为4.5时,牡丹叶黄酮提取率达到最高,为2.13%,之后随着pH值增加,牡丹叶黄酮提取率反而降低。这可能是由于纤维素酶作用的最佳pH值为4.5,偏离此值会导致酶活性降低,从而导致提取率降低。pH 4.5时,牡丹叶黄酮的提取率显著高于pH值为3.5、4.0、5.0、5.5条件下黄酮的提取率(P<0.05),因此选择pH 4.5为纤维素酶酶解的最佳pH值。
在纤维素酶用量12.5 U/mL、酶解时间3 h、酶解pH 4.5的条件下,不同酶解温度对牡丹叶黄酮提取率的影响见图1C。从图1C可看出,酶解温度对牡丹叶黄酮提取率的影响呈现先升高后降低的趋势,酶解温度为45 ℃时牡丹叶黄酮提取率达到最大值为2.15%,酶解温度高于或低于45 ℃均会降低牡丹叶黄酮提取率。酶解温度为45 ℃时,牡丹叶黄酮提取率显著高于其他温度条件下黄酮的提取率(P<0.05),因此,选择45 ℃为酶解的最佳温度。
在纤维素酶用量12.5 U/mL、酶解温度45 ℃、酶解pH 4.5的条件下,不同酶解时间对牡丹叶黄酮提取率的影响见图1D。从图1D可看出,酶解时间对牡丹叶黄酮提取率的影响呈现先增加后趋于稳定的趋势,酶解1~3 h之间随酶解时间延长,牡丹叶黄酮提取率逐渐增加,酶解3 h时牡丹叶黄酮提取率达到最大值2.21%,之后随着酶解时间的延长,牡丹叶黄酮提取率基本维持不变,这可能是由于酶解3 h后酶解作用已达最大程度,故牡丹叶黄酮提取率趋于稳定。酶解3 h后牡丹叶黄酮提取率均显著高于酶解1、2 h(P<0.05),且酶解3、4、5 h对牡丹叶黄酮提取率没有显著性差异(P>0.05),因此选择3 h为最佳酶解时间。
2.2 牡丹叶黄酮提取工艺正交试验结果
根据单因素试验结果,选定纤维素酶用量(A)、pH值(B)、酶解温度(C)、酶解时间(D)进行正交试验优化牡丹叶黄酮酶法提取最佳工艺,正交试验设计结果见表1。
表1 牡丹叶黄酮最佳提取工艺优化的正交试验设计及结果
Table 1 Orthogonal array design with experimental results for optimization of flavonoids extraction from peony leaves
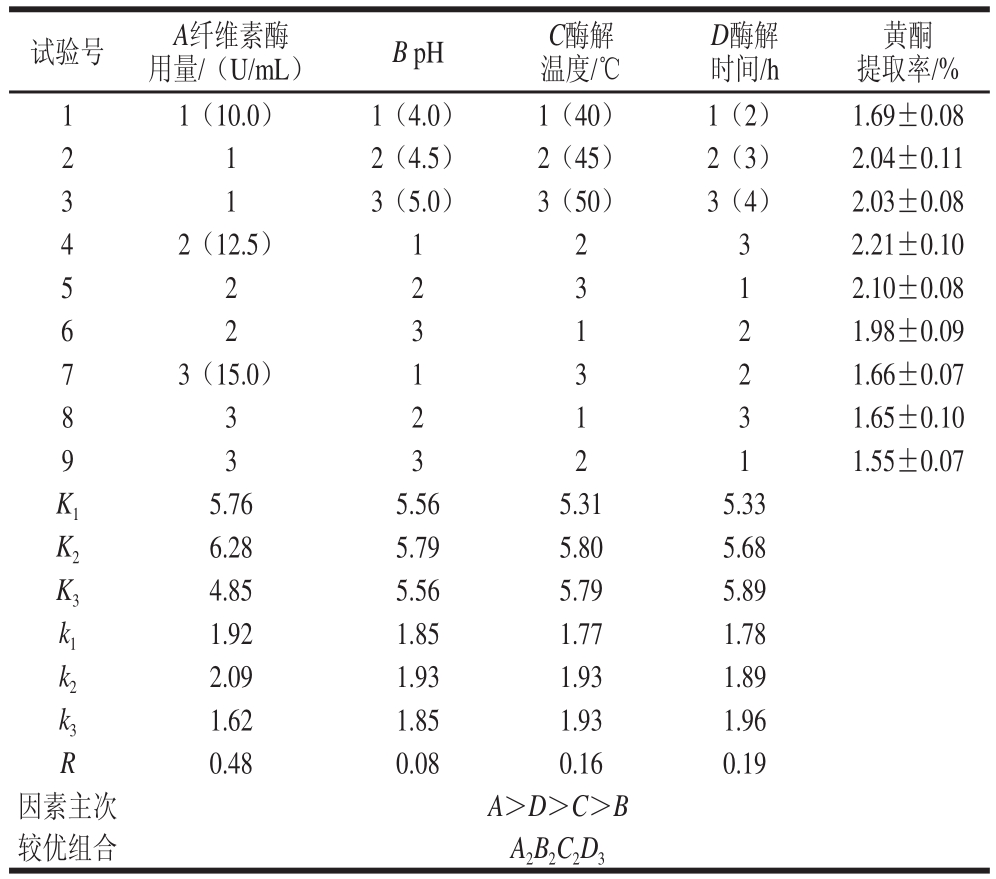
表2 牡丹叶黄酮提取正交试验方差分析
Table 2 Analysis of variance of the orthogonal array design for optimization of flavonoid extraction
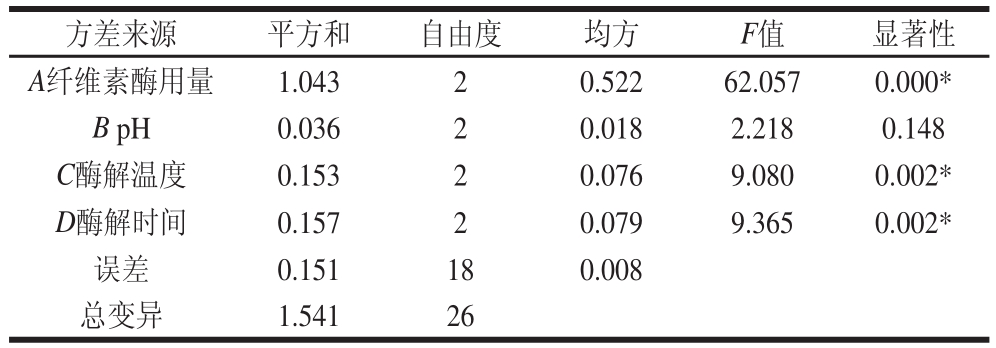
注:*.差异显著。表4同。
表1分析表明:四因素中影响牡丹叶黄酮提取率的主次顺序为:A>D>C>B,即:纤维素酶用量>酶解时间>酶解温度>pH值。由表2方差分析结果表明,纤维素酶用量、酶解温度、酶解时间对牡丹叶黄酮提取率的影响达到了显著水平,而pH值对牡丹叶黄酮提取率的影响没有达到显著水平,说明纤维素酶用量、酶解温度、酶解时间对黄酮提取率影响最大,而pH值对黄酮提取率影响相对较小,这与表1结果一致,因此在酶法提取牡丹叶黄酮中要严格控制酶的添加量、酶解温度、酶解时间。试验结果与崔旭[24]、李佩艳[22]等采用纤维素酶提取大青叶、红薯叶中黄酮的研究结果基本一致。通过正交试验得到的酶法提取牡丹叶黄酮的最佳提取条件为A2B2C2D3,即纤维素酶用量12.5 U/mL、pH 4.5、酶解温度45 ℃、酶解时间4 h,在此条件下牡丹叶黄酮的提取率为2.43%。
2.3 不同因素对牡丹叶黄酮体外清除亚硝酸盐的影响

图2 不同因素对牡丹叶黄酮清除亚硝酸盐的影响
Fig.2 Effects of different factors on the nitrite scavenging rate of flavonoids from peony leaves
A.反应温度;B. pH值;C.黄酮提取液添加量;D.反应时间。
根据1.3.3节测定体系,在反应pH 4.0、牡丹叶黄酮提取液添加量15 mL、反应时间20 min的条件下,不同反应温度对牡丹叶黄酮清除亚硝酸盐的影响见图2A。随着反应温度的升高,牡丹叶黄酮对亚硝酸盐清除率逐渐增加,当反应温度为70 ℃时,亚硝酸盐清除率最高可达51.38%,之后随着温度升高亚硝酸盐清除率逐渐下降(图2A)。这说明反应温度提高有助于牡丹叶黄酮快速清除亚硝酸根离子从而提高亚硝酸盐的清除率,但温度过高可能会影响黄酮的稳定性,从而导致亚硝酸盐清除率下降。反应温度为70、80 ℃时,牡丹叶黄酮对亚硝酸盐的清除率显著高于其他反应温度条件下的清除率(P<0.05),且反应温度为70 ℃或80 ℃对牡丹叶黄 酮清除亚硝酸没有显著性影响(P>0.05),因此,选择牡丹叶黄酮清除亚硝酸盐的最优反应温度为70 ℃。
在体系反应温度70 ℃、牡丹叶黄酮提取液添加量15 mL、反应时间20 min条件下,不同pH值对牡丹叶黄酮清除亚硝酸盐的影响见图2B。牡丹叶中黄酮具有很强的抗氧化能力,在酸性溶液中亚硝酸及亚硝酸盐容易被还原为NO。从图2B可看出,亚硝酸盐清除率随牡丹叶黄酮pH值增加逐渐增加,当pH值为4时牡丹叶黄酮对亚硝酸盐的清除率达最高,为52.01%,之后略有下降(图2B)。pH 4.0时牡丹叶黄酮对亚硝酸盐的清除率显著高于在其他pH值下的清除率(P<0.05),因此选择牡丹叶黄酮清除亚硝酸盐的最优pH值为4.0。
在体系反应温度70 ℃、pH 4.0、反应时间20 min条件下,不同牡丹叶黄酮提取液添加量对亚硝酸盐清除的影响见图2C。亚硝酸盐清除率随牡丹叶黄酮提取液添加量的增加逐渐上升,说明在一定时间内可以通过增加牡丹叶黄酮提取液用量的方式来提高亚硝酸盐的清除效果。牡丹叶黄酮提取液添加量为20 mL时对亚硝酸盐的清除率基本达到最高,为58.42%,此时,牡丹叶黄酮对亚硝酸盐的清除率显著高于添加量为5、10、15 mL时的亚硝酸盐清除率(P<0.05),牡丹叶黄酮提取液用量超过20 mL时,亚硝酸盐清除率增加缓慢,牡丹叶黄酮提取液添加量为25 mL时仅比20 mL的清除率仅增加了2.52%(图2C),且两者没有显著性差异(P>0.05),因此牡丹叶黄酮提取液最优添加量选用20 mL。
在体系反应温度70 ℃、pH 4.0、牡丹叶黄酮提取液添加量20 mL条件下,不同反应时间对牡丹叶清除亚硝酸盐的影响见图2D。随着反应时间的延长,牡丹叶黄酮对亚硝酸盐的清除率逐渐增加,反应时间为20 min时牡丹叶黄酮对亚硝酸盐的清除率达到最大值,为59.77%,之后随着反应时间的延长,亚硝酸盐清除率略有降低(图2D)。反应时间为20 min时牡丹叶黄酮对亚硝酸盐的清除率显著高于反应时间为10、15、25、30 min时亚硝酸盐的清除率(P<0.05),因此选择牡丹叶黄酮清除亚硝酸盐的最优反应时间为20 min。
2.4 牡丹叶黄酮体外清除亚硝酸盐正交试验结果
根据单因素试验结果,选定反应温度(A)、pH值(B)、牡丹叶黄酮提取液添加量(C)、反应时间(D)进行正交试验优化牡丹叶黄酮清除亚硝酸盐的最佳反应条件,正交试验设计及结果见表3。
表3 牡丹叶黄酮清除亚硝酸盐反应条件优化的正交试验设计及结果
Table 3 Orthogonal array design with experimental results for optimization of reaction conditions for nitrite scavenging by flavonoids from peony leaves

表4 牡丹叶黄酮清除亚硝酸盐反应正交试验方差分析
Table 4 Analysis of variance of the orthogonal array design for optimization of reaction conditions for nitrite scavenging

表3表明:影响牡丹叶黄酮提取的主次顺序为:C>A>B>D,即:牡丹叶黄酮提取液用量>反应温度>pH值>反应时间。表4方差分析结果表明,反应温度、pH值、牡丹叶黄酮提取液添加量均对亚硝酸盐的清除有显著影响,而反应时间对亚硝酸盐的清除没有显著影响,这与表3中极差分析结果一致。由正交试验得到牡丹叶黄酮清除亚硝酸盐的最佳反应条件为A2B2C3D2,即反应温度70 ℃、pH 4.0、牡丹叶黄酮提取液用量25 mL(10 μg亚硝酸钠)、反应时间20 min,在此条件下牡丹叶黄酮对亚硝酸盐的清除率可达62.15%。
牡丹叶中富含黄酮类物质,通过正交试验优化得到牡丹叶黄酮最佳酶法提取工艺为纤维素酶用量12.5 U/mL、 pH 4.5、酶解温度 45 ℃、酶解时间4 h,在此条件下牡丹叶黄酮的提取率为2.43%。酶法辅助提取牡丹叶中黄酮具有操作方法简便、黄酮得率高等优点,适于在工业化生产中推广。牡丹叶黄酮具有清除亚硝酸盐的作用,通过正交试验优化得到牡丹叶黄酮清除亚硝酸盐的最优反应条件为反应温度70 ℃、pH 4.0、牡丹叶黄酮提取液用量25 mL(10 μg亚硝酸钠)、反应时间20 min,亚硝酸盐清除率可达62.15%。我国牡丹叶资源丰富,材料廉价易得,从 牡丹叶中提取黄酮物质并将其用于亚硝酸清除具有广阔的应用前景,值得深入研究开发。
参考文献:
[1] 郭大龙. 牡丹种质资源遗传多样性研究进展[J]. 北方园艺, 2007(9): 61-65. DOI:10.3969/j.issn.1001-0009.2007.09.024.
[2] 朱素英. 牡丹花多酚提取优化与抗氧化性[J]. 生物技术, 2014, 24(3): 78-82.
[3] 王晓, 耿岩玲, 李福伟, 等. 酶法提取牡丹花总黄酮[J]. 山东科学, 2005, 8(4): 14-17. DOI:10.3969/j.issn.1002-4026.2005.04.005.
[4] 田给林. 牡丹花茶的研制与开发[J]. 贵州农业科学, 2013, 41(10): 14-16. DOI:10.3969/j.issn.1001-3601.2013.10.048.
[5] 罗磊, 刘云宏, 朱文学, 等. 低糖牡丹花脯加工工艺研究[J]. 食品工业科技, 2014, 35(5): 264-268.
[6] 高新彪, 孙磊, 乔善义, 等. 牡丹皮HPLC指纹图谱研究[J]. 中草药, 2013, 44(7): 900-904. DOI:10.7501/j.issn.0253-2670.2013.07.024.
[7] 徐金龙, 张红梅, 徐秀泉. 响应面分析优化牡丹皮中总黄酮的提取工艺[J]. 中国药房, 2011, 22(27): 2536-2538.
[8] 周刚, 吕庆红. 牡丹皮不同部位有效成分含量测定及指纹图谱化学成分研究[J]. 中国中药杂志, 2008, 33(18): 2070-2073. DOI:10.3321/ j.issn:1001-5302.2008.18.014.
[9] 张明华, 封亮, 顾俊菲, 等. 牡丹皮对AGEs诱导的系膜细胞增殖及基底膜增厚的影响[J]. 中国中药杂志, 2014, 39(3): 478-482. DOI:10.4268/cjcmm20140322.
[10] 唐浩国, 单方方, 魏晓霞, 等. 牡丹叶总黄酮抑菌活性研究[J]. 时珍国医国药, 2009, 20(6): 1355-1357. DOI:10.3969/j.issn.1008-0805.2009.06.028.
[11] 郭凤, 罗小勇. 牡丹叶及其不同溶剂提取物对生菜等幼苗生长的抑制效应[J]. 杂草科学, 2012, 30(3): 21-26. DOI:10.3969/j.issn.1003-935X.2012.03.005.
[12] CHEN Y T, ZHENG R L, JIA Z J, et al. Flavonoids as superoxide scavengers and antioxidants[J]. Free Radical Biology and Medicine, 1990, 9(1): 19-21. DOI:10.1016/0891-5849(90)90045-K.
[13] SUN L J, ZHANG J B, LU X Y, et al. Evaluation to the antioxidant activity of total flavonoids extract from persimmon (Diospyros kaki L.) leaves[J]. Food and Chemical Toxicology, 2011, 49(10): 2689-2696. DOI:10.1016/j.fct.2011.07.042.
[14] FENG L J, YU C H, YING K J, et al. Hypolipidemic and antioxidant effects of total flavonoids of Perilla frutescens leaves in hyperlipidemia rats induced by high-fat diet[J]. Food Research International, 2011, 44(1): 404-409. DOI:10.1016/j.foodres.2010.09.035.
[15] WOODMAN O L, MEEKER W F, BOUJAOUDE M. Vasorelaxant and antioxidant activity of flavonols and flavones: structure-activity relationships[J]. Journal of Cardiovascular Pharmacology, 2005, 46(3): 302-309. DOI:10.1097/01.fjc.0000175431.62626.07.
[16] 李富华, 刘冬, 明建. 苦荞麸皮黄酮抗氧化及抗肿瘤 活性[J]. 食品科学, 2014, 35(7): 58-63. DOI:10.7506/spkx1002-6630-201407012.
[17] 黄池宝, 罗宗铭. 黄酮类化合物在食品中的应用[J]. 广州化工, 2000, 28(4): 35-37.
[18] 王晓, 时新刚, 郑成超, 等. 牡丹花提取物清除活性氧及对OH引发的DNA损伤的保护作用[J]. 食品与发酵工业, 2004, 30(7): 55-58. DOI:10.3321/j.issn:0253-990X.2004.07.013.
[19] WANG X, CHEN C G, SUN Q L, et al. Isolation and purification of four flavonoid constituents from the flowers of Paeonia suffruticosa by highspeed counter-current chromatography[J]. Journal of Chromatography A, 2005, 1075: 127-131. DOI:10.1016/j.ch roma.2005.04.017.
[20] 徐金龙, 张红梅, 徐秀泉. 响应面分析优化牡丹皮中总黄酮的提取工艺[J]. 中国药房, 2011, 22(27): 2536-2538.
[21] 李叶, 唐浩国, 刘建学, 等. 牡丹叶总黄酮提取工艺条件优化研究[J]. 农业技术与装备, 2009(2): 14-16. DOI:10.3969/j.issn.1673-887X.2009.04.007
[22] 李佩艳, 尹飞, 刘建学, 等. 响应面法优化酶法提取红薯叶总黄酮的工艺[J]. 食品工业科技, 2012, 33(1): 275-277; 281.
[23] 吴佳, 解成喜. 石榴皮总黄酮的提取工艺及抑制亚硝化反应[J]. 食品科学, 2011, 32(2): 111-114.
[24] 崔旭, 李会端. 酶法辅助提取大青叶中总黄酮及抗氧化性研究[J].楚雄师范学院学报, 2014, 29(6): 46-52; 79.
LI Peiyan1, HAN Sihai1, LUO Denglin1, ZHAO Shengjuan1, LIU Jianxue1, YIN Fei2
(1. College of Food Science and Biotechnology, Henan University of Science and Technology, Luoyang 471023, China; 2. College of Agronomy, Henan University of Science and Technology, Luoyang 471023, China)
Abstract: Cellulose-assisted extraction was applie d to the extraction of flavanoids from peony leaves. Effects of enzyme dosage, pH, temperature and hydrolysis time on the extraction efficiency of flavanoids were investigated. The optimal hydrolysis conditions obtained by orthogonal array experiments for the extraction of flavonoids were as follows: enzyme dosage, 12.5 U/mL; initial pH, 4.5; temperature, 45 ℃; and hydrolysis time, 4 h. Under these conditions, the extraction yield of flavanoids was 2.43%. Flav anoids from peony leaves were able to scavenge nitrite. The optimal reaction conditions for nitrite scavenging by the flavanoids were found to be 20 min reaction at 70 ℃ and pH 4.0 after addition of 25 mL (10 μg sodium nitrate) of the radical scavenger, resulting in a scavenging rate of 62.15%.
Key words: peony leaves; flavanoids; cellulase; nitrite; scavenging
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2016)06-0077-05引文格式:
DOI:10.7506/spkx1002-6630-201606013
作者简介:李佩艳(1977—),女,讲师,博士,研究方向为食品质量与安全控制、果蔬贮藏与保鲜。E-mail:lipeiyan77@163.com
基金项目:河南科技大学博士科研启动基金项目(4009-13480053);河南科技大学青年科学基金项目(2015QN035);河南科技大学教育教学改革项目(2015YB-068);河南科技大学创新团队项目(2015XTD007)
收稿日期:2015-06-05