张晓松,张博雅,张永忠,金 花*
(东北农业大学理学院,黑龙江 哈尔滨 150030)
摘 要:利用“Amano”β-糖苷酶对槐角异黄酮进行水解制备染料木黄酮。采用高效液相色谱法检测槐角异黄酮水解率。探讨酶质量浓度、水解时间、pH值和水解温度对异黄酮水解率的影响,并通过响应面法确定最佳水解条件。结果表明,最佳水解条件为酶质量浓度0.5 mg/mL、水解时间3.68 h、pH 4.95、水解温度59.2 ℃。在此条件下,槐角异黄酮水解率达95.76%。该研究为自然界药用植物的开发应用提供了理论依据。
关键词:槐角异黄酮;酶水解;高效液相色谱
张晓松, 张博雅, 张永忠, 等. 响应面试验优化“Amano” β-糖苷酶水解槐角异黄酮工艺[J]. 食品科学, 2016, 37(6): 82-88. DOI:10.7506/spkx1002-6630-201606014. http://www.spkx.net.cn
ZHANG Xiaosong, ZHANG Boya, ZHANG Yongzhong, et al. Process optimization by response surface methodology for hydrolysis of Fructus Sophorae isoflavones by “Amano” β-glucosidase[J]. Food Science, 2016, 37(6): 82-88. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606014. http://www.spkx.net.cn
槐属豆科植物,其成熟果实为槐角,在传统中医学中槐角具有清热凉血、明目泻火的药理活性和保健功效,主要可用于缓解头痛、止血和治疗血管性高血压等疾病[1-9]。槐角除药用外,民间也常食用,国内有速溶槐角饮料研制的报道[10]。现代研究[1-3,11]表明槐角中富含异黄酮类物质,包括槐角苷、槐属双苷、染料木黄酮、染料木黄酮-7,4’-双葡萄糖苷等。异黄酮类化合物又被称为“植物雌激素”,具有抗氧化性和抑菌性等功能,能够有效地起到预防和抑制中老年骨质疏松、乳腺癌、前列腺癌以及妇女更年期综合症等疾病的作用[12-17],从而受到人们的广泛关注。目前,研究人员主要通过大豆来提取和制备异黄酮类化合物,但是大豆中除异黄酮类化合物之外,还含有较多的油脂、蛋白质、大豆低聚糖、大豆皂苷等成分,这些物质较难分离,使得大豆异黄酮的纯化成本较高。据测定大豆中总异黄酮类化合物含量约为525~986 mg/kg[18],远低于槐角中总异黄酮的含量(大于200 g/kg[19])。因此,以槐角替代大豆作为获取异黄酮类物质的原料,不仅能够解决纯化成本较高的问题,还不占用粮食资源,这对于开发槐角这种药用可再生植物的应用具有重要意义。
槐角中所含的染料木黄酮是一种天然的酪氨酸激酶抑制剂,是槐角异黄酮中功能活性最高的一种,其生物活性比糖苷型槐角苷、槐属双苷更加显著,但含量却相对较少。然而,染料木黄酮是槐角苷、槐属双苷等化合物的苷元,可以通过酶催化水解的方法,将槐角苷、槐属双苷等糖苷型异黄酮转化成为苷元型染料木黄酮,从而提高染料木黄酮的含量。国内已有通过水解方法制备染料木黄酮的报道[20-22]。由青霉菌属菌发酵生产的“Amano”β-糖苷酶制剂是一种葡聚糖酶配制品,在适宜条件下可将糖苷型大豆异黄酮一步转化成苷元形式。国内用“Amano”β-糖苷酶水解大豆异黄酮糖苷的研究也有报道[23],但应用“Amano”β-糖苷酶水解槐角总异黄 酮在国内外还鲜有报道。本研究以槐角为原料,借助高效液相色谱法,以提高染料木黄酮含量为目标,利用“Amano”β-糖苷酶水解成功将糖苷型异黄酮转化为苷元型染料木黄酮,并应用响应面法对工艺进行了优化。
1.1 材料与试剂
槐角异黄酮粉(总异黄酮含量46.5%) 课题组按文献[24]方法制备;染料木黄酮标准品(纯度98%)美国Sigma公司;“Amano”β-糖苷酶制剂(等电点4.3;最适温度60 ℃;最适pH 5.0~5.5;50 ℃以下稳定;pH 6以下稳定;β-糖苷酶活力约为600 U/g(1 U为pH 5.5条件下,在1 min内催化对-硝基苯酚-β-D-葡萄糖苷释放1 μmol对硝基苯酚的酶量)) 日本天野酶制品株式会社;甲醇(色谱纯) Dikma科技有限公司;实验用水为超纯水;其余所用试剂均为国产分析纯。
1.2 仪器与设备
HZS-H水浴振荡器 哈尔滨东明医疗仪器厂;pHs-25型pH计 上海精科雷磁仪器厂;1100高效液相色谱仪(G1314A泵、G1314A紫外检测器) 美国Agilent公司;AL104型电子天平 上海梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 高效液相色谱测定
色谱条件:流动相CH3OH-H2O体积比55∶45;色谱柱:C18柱(4.6 mm×150 mm);流速:1.00 mL/min;进样量:5 μL;柱温:室温;检测波长:260 nm;检测时间:15 min。
标准曲线的绘制:用分析天平称取染料木黄酮标准品0.025 0 g,用甲醇定容至100.0 mL容量瓶中,制成染料木黄酮标准储备液。精密吸取储备液,甲醇定容为25.00 mL,配制系列梯度质量浓度(0.01、0.03、0.05、0.07、0.09、0.11、0.13、0.15、0.17 mg/mL)的标准溶液待测。利用高效液相色谱进行测定,以质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.3.2 酶水解反应
本实验利用“Amano”β-糖苷酶对槐角中的糖苷型异黄酮进行水解,制备产物染料木黄酮。利用水和正丁醇混合溶液(水-正丁醇体积比1∶2),萃取槐角异黄酮粉3 次。萃取后的正丁醇相经减压脱溶、离心干燥后,得到异黄酮萃取物。精密称取此萃取物0.010 0 g,以0.05 mol/L的HAc-NaAc缓冲溶液溶解,稀释并定容至10.00 mL,然后再与10 mL酶液充分混合(用相同pH值缓冲溶液配制)。将此溶液转移至水浴振荡器内,于100 r/min条件下水解,反应结束,加15 mL甲醇终止反应,再将水解液用甲醇定容至50.00 mL。应用高效液相色谱测定水解液中染料木黄酮的含量,槐角异黄酮水解率计算公式如下:
以酸催化完全水解确定完全水解后产物中染料木黄酮含量。依据上述实验方法,以盐酸代替酶,调节盐酸浓度为2.5 mol/L,水解3.5 h。不断升高水解温度,直至染料木黄酮含量不再升高为止。
1.3.3 酶水解单因素试验
以槐角异黄酮水解率为评价指标,对酶质量浓度、水解时间、pH值和水解温度4 个因素进行单因素试验。单因素试验条件范围如下:设定水解pH 5、水解温度45 ℃、水解时间2.5 h,配制质量浓度为0.20、0.25、0.30、0.35、0.40、0.45、0.50 mg/mL的酶溶液10 mL,再分别与10 mL异黄酮溶液(1 mg/mL)相混合,进行水解;pH 5、水解温度45 ℃条件下,移取10 mL酶质量浓度为0.45 mg/mL的酶溶液与10 mL异黄酮溶液(1 mg/mL)相混合,分别使水解时间为1.5、2.5、3.5、4.5、5.5 h进行水解;设定水解温度45 ℃、水解时间3.5 h,移取10 mL酶质量浓度为0.45 mg/mL的酶溶液与10 mL异黄酮溶液(1 mg/mL)相混合,分别调整体系pH值为4.0、4.5、5.0、5.5、6.0进行水解;设定水解pH 5,移取10 mL酶质量浓度为0.45 mg/mL的酶溶液与10 mL异黄酮溶液(1 mg/mL)相混合,水解时间3.5 h,分别在温度为35、40、45、50、55、60、65、70 ℃条件下进行水解。根据单因素试验所确定的水解条件,通过测定槐角异黄酮水解率来测定最佳酶质量浓度、水解时间、pH值及水解温度。实验重复3 次,取平均值。
1.3.4 响应面优化试验
由单因素试验分析后,选择酶质量浓度、水解时间、pH值和水解温度4 个因素,使用Box-Behnken方法进行四因素三水平响应面试验设计[25],因素与水平见表1。并通过Design-Expert V8.0.6软件对试验数据进行处理分析。
表1 响应面试验因素与水平
Table 1 Factors and levels used in Box-Bchnken design

2.1 高效液相色谱法测定染料木黄酮的标准曲线
测定系列质量浓度的染料木黄酮标准溶液,以峰面积为纵坐标,染料木黄酮质量浓度为横坐标,得回归方程:Y=5 760.8X-2.047 6,R2=0.999 4。
2.2 单因素试验结果
2.2.1 酶质量浓度对异黄酮水解率的影响
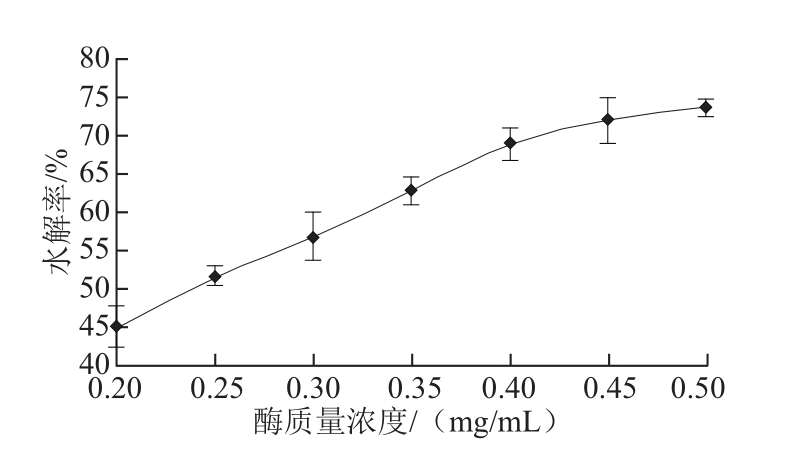
图1 酶质量浓度对水解效果的影响
Fig.1 Effect of enzyme concentration on hydrolysis efficiency of isoflavones
由图1可知,槐角异黄酮水解率随着酶质量浓度的增加而增加。当酶质量浓度在0.20~0.40 mg/mL时,槐角异黄酮的水解率升高较快。但是在酶质量浓度增加至0.40 mg/mL以后,水解率上升开始变缓慢。这是因为在酶质量浓度较低时,由于底物充足,提高酶质量浓度,酶与底物的结合程度会随之增强。当酶质量浓度上升到一定程度时,底物分子占据结合点饱和,限制了底物分子与酶质量浓度的结合力,从而减缓了水解效率的提高。因此继续增加酶质量浓度不再会使水解效率提升显著。所以选择酶质量浓度为0.45 mg/mL,最节省、合理。
2.2.2 水解时间对异黄酮水解率的影响
由图2可以看出,在水解时间为3.5 h之前,水解率随着水解时间的延长而快速提升。当水解时间3.5 h时,水解率最高。但是,继续延长水解时间时却发现异黄酮的水解率下降明显。分析造成这种现象的原因可能是随着反应的进行,体系中的产物含量提高,越来越多的产物分子逐步占据酶的活性部位,从而与底物形成竞争,抑制了酶促反应,最终导致水解率下降。
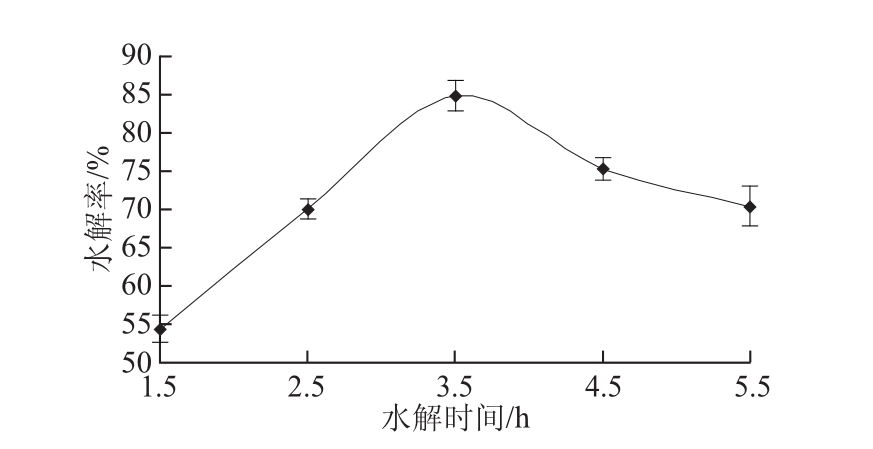
图2 水解时间对异黄酮水解率的影响
Fig.2 Effect of hydrolysis time on hydrolysis efficiency of isoflavones
2.2.3 pH值对异黄酮水解率的影响

图3 pH值对水解效果的影响
Fig.3 Effect of pH values on hydrolysis efficiency of isoflavones
由图3可知,在pH 5之前,增大体系pH值,槐角异黄酮的水解率上升显著。当pH 5时水解率达到最高。当pH值超过5以后,水解率则快速下降,由此可见体系pH值对酶活性有显著影响。这可能是由于酶空间构象会随着体系pH值的改变而发生变化,从而使酶活性部分解离效果受到影响,同时也可能改变底物的解离状态,进而影响底物与酶的结合程度。这说明“Amano”β-糖苷酶仅在较窄的pH值范围内(pH 5),底物与酶的活性部位结合最为充分,转化的水解产物也最多。
2.2.4 水解温度对异黄酮水解率的影响
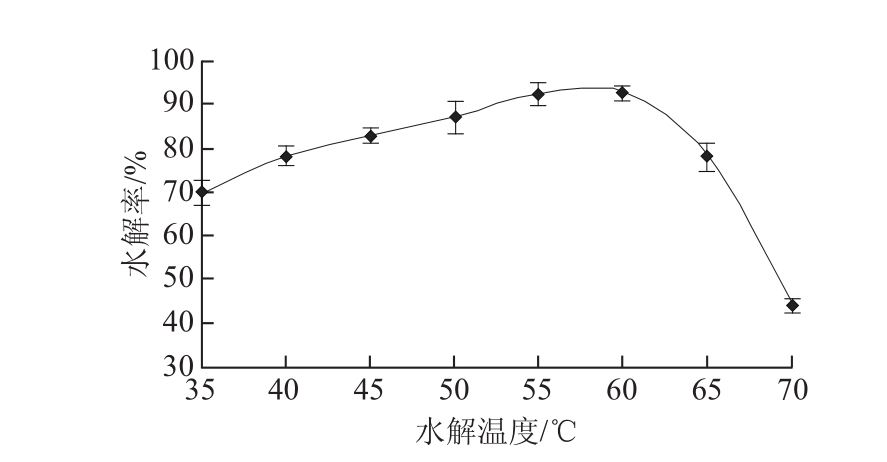
图4 水解温度对异黄酮水解率的影响
Fig.4 Effect temperatures on hydrolysis efficiency of isoflavones
由图4可以看出,随着水解温度的升高,水解率先平稳上升而后迅速下降。当水解温度为60 ℃时,槐角异黄酮的水解率最大。这是因为温度对水解过程同时有两方面的影响:一方面是,当温度升高,分子运动速率较快,水解进行越顺利;另一方面来说,温度升高还会导致 维持酶分子结构的次级键解体,从而引起酶蛋白变性,抑制了水解的进行。温度较低时,第一方面影响占据主导作用,水解率稳步上升;而当温度升高,酶蛋白变性占据主导作用,酶的活性迅速减弱乃至丧失。所以,水解反应温度不应选择过高,以60 ℃为宜。
2.3 响应面试验结果
2.3.1 多元二次模型方程的建立与检验
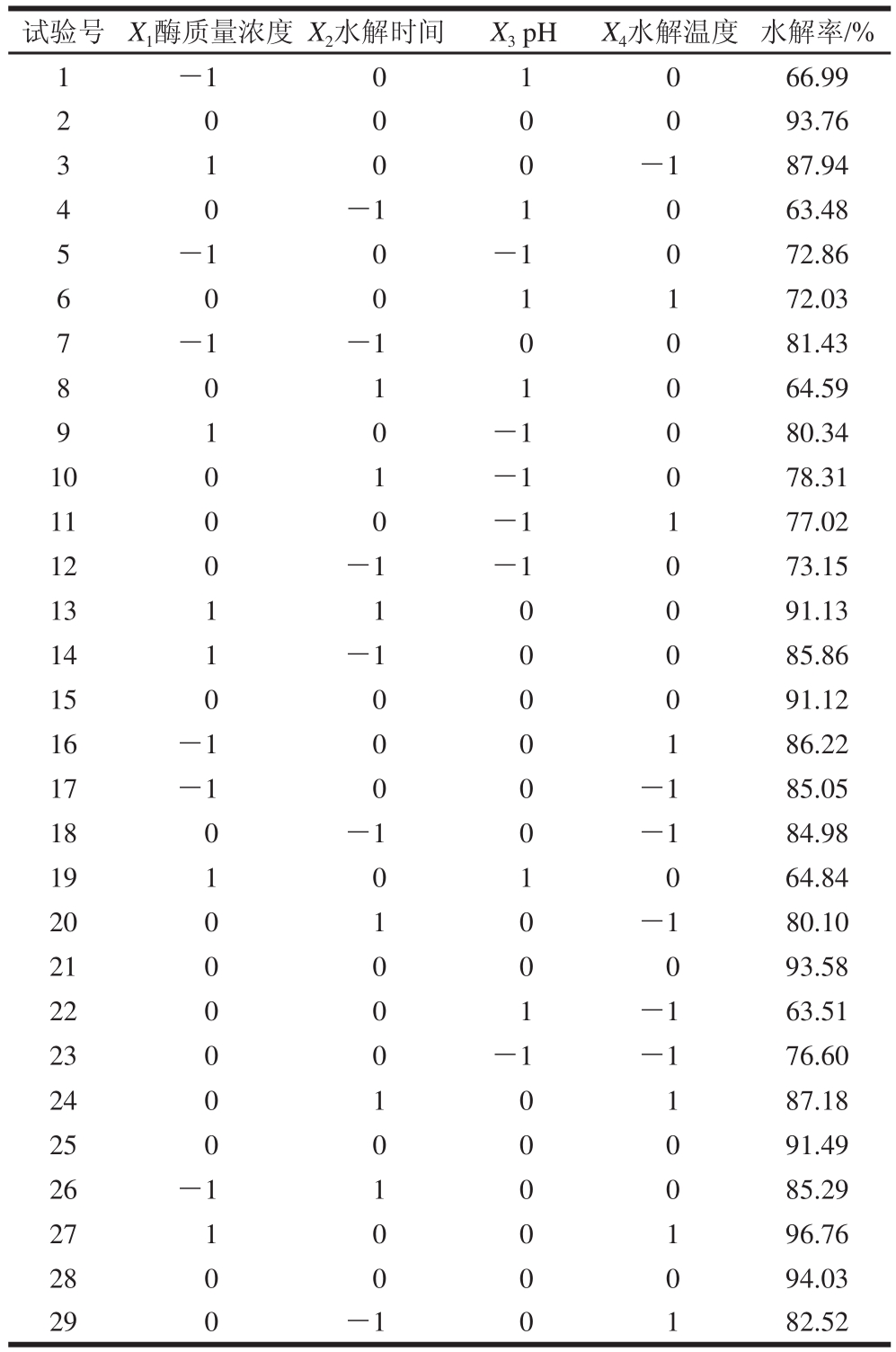
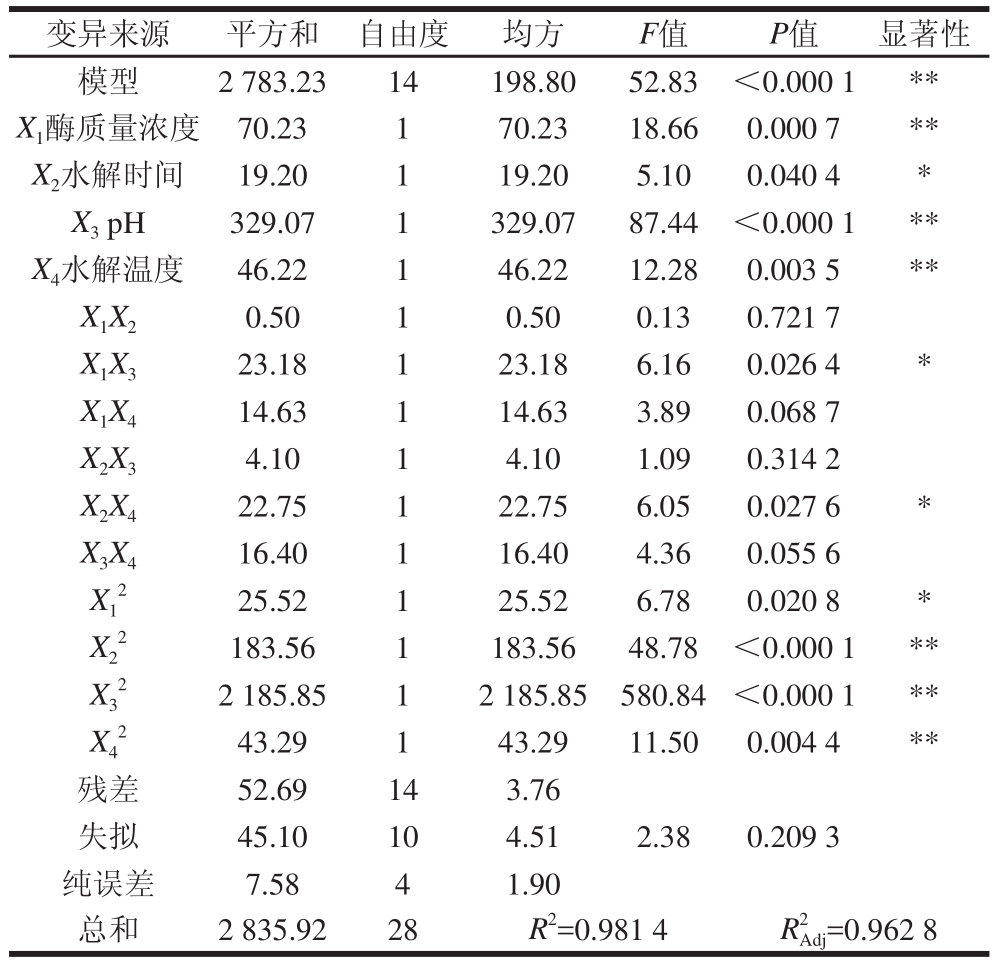
采用Design-Expert软件进行29 组试验设计,以酶质量浓度、水解时间、pH值和水解温度为自变量,以槐角异黄酮水解率为响应值进行试验,结果见表2。
表2 Box-Behnken试验设计与结果
Table 2 Box-Behnken experimental design with experimental results
使用Design-Expert软件对表2进行二次多元回归拟合,得到多元二次响应面回归模型,回归方程为:
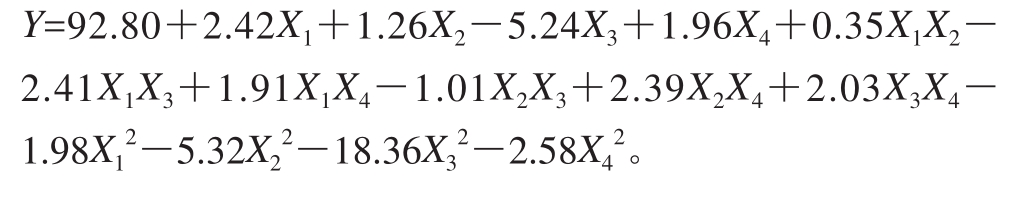
表3 Box-Behnken试验方差分析
Table 3 Analysis of variance of regression model
注:*.差异显著,P<0.05;**.差异极显著,P<0.01。
从表3可以看出,回归模型达到极显著水平(P<0.000 1),失拟误差(P=0.209 3>0.05)不显著,说明该回归方程的建立与实际情况互相吻合,同时决定系数与校正决定系数可以解释响应值的变化,因此可以利用该回归方程确定水解的最佳工艺条件。方差分析中一次项X1(酶质量浓度)、X3(pH值)、X4(水解温度)对模型影响极显著,一次项X2(水解时间)和交互项X1X3、X2X4影响显著,二次项![]() 对模型影响极显著,二次项
对模型影响极显著,二次项![]() 影响显著。结果表明试验因素对响应值不是简单的线性关系,而是一种非线性关系。因此,观察方差分析结果,可知各因素影响顺序:X3(pH值)>X1(酶质量浓度)>X4(水解温度)>X2(水解时间)。
影响显著。结果表明试验因素对响应值不是简单的线性关系,而是一种非线性关系。因此,观察方差分析结果,可知各因素影响顺序:X3(pH值)>X1(酶质量浓度)>X4(水解温度)>X2(水解时间)。
2.3.2 响应面分析
利用Design-Expert软件对表2数据进行二次多项回归拟合,做出二次回归方程响应面及等高线图,由图5可分析任何两因素对异黄酮水解率的交互影响,并确定最优工艺。
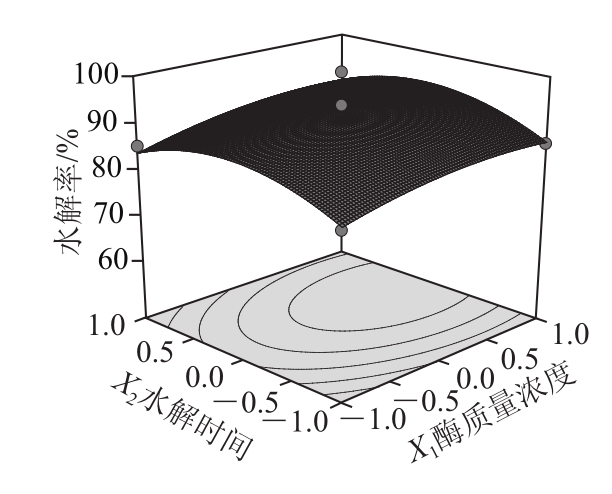


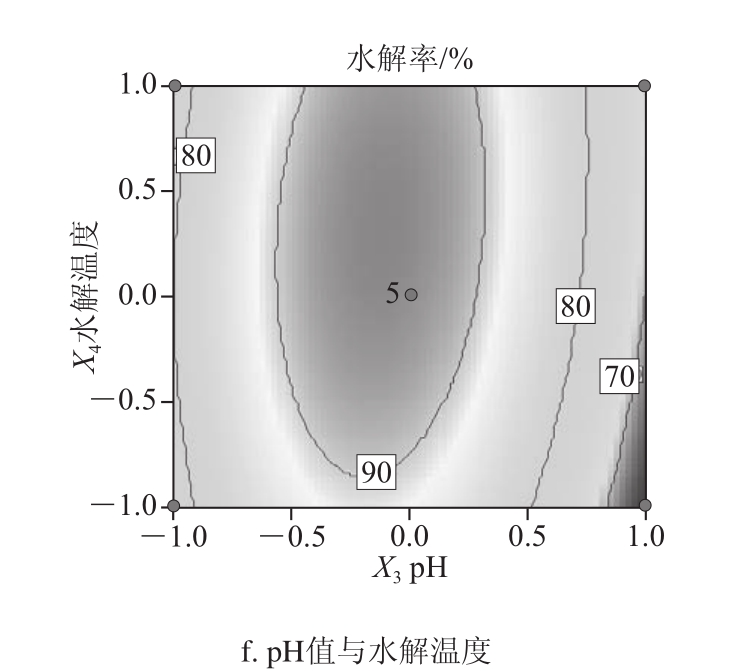
图5 两因素交互作用对异黄酮水解率影响的响应面和等高线图
Fig.5 Response surface and corresponding contour plots for the interactive effects of factors on hydrolysis efficiency of isoflavones
由图5可见,等高线图越趋近圆形,模型中各因素交互作用越弱,因此酶质量浓度与水解温度、pH值与水解温度的交互作用对异黄酮水解率的影响最大,与方差分析结果一致,所以X1X3与X2X4存在交互作用的影响。根据回归方程,考察拟合响应面的形状,当响应值 最大时,获得最优工艺参数为:酶质量浓度0.5 mg/mL、水解时间3.68 h、pH 4.95、水解温度59.2 ℃。预测最佳水解率为95.82%。
2.3.3 最佳条件验证实验结果
将实验条件设定为酶质量浓度0.5 mg/mL、水解时间3.68 h、pH 4.95、水解温度59.2 ℃时,重复实验3 次,实际测得异黄酮水解率平均值为95.76%。实测值与预测值相互吻合,说明该回归方程建立的模型正确且与实际情况拟合度较好,最佳工艺条件可行。
2.4 糖苷型异黄酮水解过程分析

图6 水解前(A)、后(B)槐角异黄酮样品的高效液相色谱图
Fig.6 HPLC chromatogram of Fructus sophorae isoflavones and their hydrosate
运用高效液相色谱分别对最佳工艺条件下水解前后样品进行分析(图6),根据洗脱定律,可推测水解前出峰较早为糖苷型异黄酮,而染料木黄酮极性较小,出峰较晚。水解前槐角中糖苷型异黄酮的出峰时间集中在2.1~3.5 min,峰值较高,相比染料木黄酮峰值很低,说明其含量较少;水解后糖苷型异黄酮峰值降低且无新峰出现,染料木黄酮峰升高明显。由此可知,糖苷型异黄酮经水解多数转化为染料木黄酮。这是因为在“Amano”β-糖苷酶的作用下,糖苷型异黄酮的糖苷键断裂,水解最终生成了苷元型染料木黄酮。本实验结果也与邬建国等[26]报道相吻合。
对比图6还可以看出,变化最剧烈的为保留时间2.4 min和3.3 min的峰。判断此两种物质为染料木苷和槐角苷,他们的水解转化率较完全。而峰值在保留时间2.1 min和2.8 min的物质水解前后两图变化不大,推测这两种物质有可能为槲皮素-3-O-β-D葡萄糖苷、槲皮素3-O-β-D-葡萄糖-O-鼠李糖、山柰酚3-O-β-D-葡萄糖苷等异黄酮糖苷,导致此两种物质没有转化得原因可能是它们的糖苷键位于C-3位,受到C-2位苯环的空间位阻的影响阻碍其水解。
应用“Amano”β-糖苷酶可对槐角总异黄酮进行水解,得到染料木黄酮。在单因素试验结果的基础上,根据Box-Behnken试验设计原理,设计四因素三水平试验,利用Design-Expert软件进行响应面分析,建立了槐角异黄酮水解率的回归方程。结果表明,酶质量浓度、pH值和水解温度对异黄酮水解率影响 极显著。最佳工艺条件为:酶质量浓度0.5 mg/mL、水解时间3.68 h、pH 4.95、水解温度59.2 ℃。在此条件下测得槐角总异黄酮的水解率为95.76%,与预测值吻合。
参考文献:
[1] GEVRENOVA R, KITANOV G, ILIEVA D. Ontogenetic and seasonal variation in the flavonoid composition of Sophora japonica cultivated in Bulgaria[J]. Pharmaceutical Biology, 2007, 45(2): 149-155. DOI:10.1080/13880200601113123.
[2] TULAGANOV A A, GAIBNAZARAVA D T. Isolation and identification of flavonoids from Sophora japonica occurring in Uzbekistan[J]. Pharmaceutical Chemistry Journal, 2001, 35(8): 433-434. DOI:10.1023/A:1013784222933.
[3] 唐于平, 楼凤昌, 马雯, 等. 槐果皮中的异黄酮甙类成分[J].中国药科大学学报, 2001, 32(3): 187-189. DOI:10.3321/ j.issn:1000-5048.2001.03.006.
[4] DO T H, TRINH N T, TRAN T P, et al. The selected flavonol glycoside derived from Sophorae Flos improves glucose uptake and inhibits adipocyte differentiation via activation AMPK in 3T3-L1 cells[J]. Bioorganic and Medicinal Chemistry Letters, 2010, 20: 6076-6081. DOI:10.1016/j.bmcl.2010.08.054.
[5] CHANG Lu, REN Yanping, CAO Liang, et al. Simultaneous determination and pharmacokinetic study of six flavonoids from Fructus Sophorae extract in rat plasma by LC-MS/MS[J]. Journal of Chromatography B, 2012, 904: 59-64. DOI:10.1016/ j.jchromb.2012.07.015.
[6] GEOFFREY C K, NIGEL C V, MARTHA E B, et al. Flavonol tetraglycosides from fruits of Styphnolobium japonicum (Leguminosae) and the authentication of Fructus Sophorae and Flos Sophorae[J]. Phytochemistry, 2009, 70: 785-794. DOI:10.1016/ j.phytochem.2009.04.003.
[7] LI Yumei, ZHONG Hao, LU Yuanqi. Comparative study on rare earth elements from Flos Sophorae and Fructus Sophorae[J]. Journal of Rare Earths, 2012, 30(4): 397-400.
[8] XU Qian, SHEN Yanyan, WANG Haifeng, et al. Application of response surface methodology to optimise extraction of flavonoids from Fructus Sophorae[J]. Food Chemistry, 2013, 138(4): 2122-2129. DOI:10.1016/j.foo dchem.2012.11.099.
[9] 许勇, 陈伟珍, 杜宁. 槐角苷及染料木素对成骨细胞生物学特性的影响[J]. 中西医结合学报, 2009, 7(3): 223-226. DOI:10.3736/ jcim20090305.
[10] 李亚琴. 速溶槐角饮料的研制[J]. 食品科学, 2000, 21(3): 32-34. DOI:10.3321/j.issn:1002-6630.2000.03.011.
[11] 何林兴, 徐云翔, 薛慧中. 槐角的避孕成分研究(Ⅱ): 化合物ⅤⅧ的分离与鉴定[J]. 生殖与避孕, 1984, 4(3): 51-53.
[12] TSAO R, PAPADOPOULOS Y, YANG R, et al. Isoflavone profiles of red clovers and their distribution in different parts harvested at different growing stages[J]. Journal of Agricultural and Food Chemistry, 2006, 54(16): 5797-5805.
[13] CORINNA E R, SABINE E K. Antioxiant activity of isoflavones and their major metabolites using different in vitro assays[J]. Journal of Agricultural and Food Chemistry, 2006, 54(8): 2926-2931.
[14] KELLOFF G J, CROWELL J A, HAWK E T, et al. Strategy and planning for chemopreventive drug development: clinical development plans Ⅱ.[J]. Journal of Cellular Biochemistry, 1994, 56: 55-62. DOI:10.1002/jcb.240630705.
[15] 李晓莉, 高任琪, 刘福玉, 等. 染料木黄酮对慢性缺氧大鼠血管活性物质的调节作用[J]. 食品科学, 2005, 26(10): 219-223. DOI:10.3321/ j.issn:1002-6630.2005.10.053.
[16] 张永忠, 陈学颖, 孙艳梅. 四种异黄酮抗氧化活性的比较研究[J]. 食品科学, 2008, 29(2): 383-386. DOI:10.3321/ j.issn:1002-6630.2008.02.085.
[17] 刘蓉, 曹树稳, 余燕影, 等. 染料木素及其乳糖苷清除自由基能力的研究[J]. 食品科学, 2008, 29(9): 111-114. DOI:10.3321/ j.issn:1002-6630.2008.09.018.
[18] DEVI M K A, GONDI M, SAKTHIVELU G, et al. Functional attributes of soybean seeds and products, with reference to isoflavone content and antioxidant activity[J]. Food Chemistry, 2009, 114(3): 771-776.
[19] 丛艳波, 张永忠, 刘潇. 亚临界水提取槐角中总异黄酮的研究[J]. 中草药, 2010, 41(5): 717-720.
[20] 孙艳梅, 张永忠, 王伊强, 等. 大豆葡萄糖苷酶水解大豆异黄酮糖苷的研究[J]. 中国粮油学报, 2006, 21(2): 86-89. DOI:10.3321/ j.issn:1003-0174.2006.02.023.
[21] 孙艳梅, 张永忠, 许晶, 等. 黑曲霉β-葡萄糖苷酶水解大豆异黄酮糖苷研究[J]. 东北农业大学学报, 2007, 38(1): 9-12. DOI:10.3969/ j.issn.1005-9369.2007.01.003.
[22] 许晶, 孙艳梅, 张永忠. 里氏木霉β-葡萄糖苷酶水解大豆异黄酮糖苷的工艺研究[J]. 中国粮油学报, 2009, 24(3): 31-34.
[23] 张永忠, 李木子, 孙艳梅, 等. “Amano” β-糖苷酶水解大豆异黄酮技术的研究[J]. 食品科学, 2008, 29(5): 254-258. DOI:10.3321/ j.issn:1002-6630.2008.05.052.
[24] 张博雅, 周丽, 王凤荣, 等. 加压溶剂法提取槐角总异黄酮的研究[J].中草药, 2012, 43(6): 1108-1111.
[25] JIN H L, MYOUNG G C. Determination of optimal acid hydrolysis time of soybean isoflavones using drying oven and microwave assisted methods[J]. Food Chemistry, 2011, 129(2): 577-582. DOI:10.1016/ j.foodchem.2011.04.069.
[26] 邬建国, 余伟, 葛娟, 等. 酶法转化槐角异黄酮的工艺及转化途径推论[J]. 华中科技大学学报(自然科学版), 2010, 38(8): 125-128. DOI:10.13245/j.hust.2010.08.011.
ZHANG Xiaosong, ZHANG Boya, ZHANG Yongzhong, JIN Hua*
(College of Science, Northeast Agricultural University, Harbin 150030, China)
Abstract: Purpose: To optimize the hydrolysis (into genistein) of isoflavones ex tracted from Fructus Sophorae with “Amano”β-glucosidase. Methods: The optimization of four hydrolysis conditions including enzyme concentration, time, pH and temperatur e for improved hydrolysis efficiency was performed using response surface methodology (RSM). Results: The optimal hydrolysis conditions were determined as follows: enzyme concentration, 0.5 mg/mL; hydrolysis time, 3.68 h; pH value, 4.95, and hydrolysis temperature, 59.2 ℃. Under these conditions, the hydrolysis efficiency of total isoflavones was as high as 95.76%. Our investigation is significant for the exploitation and application of medicinal pants.
Key words: Fructus Sophorae isoflavones; enzymatic hydrolysis; high performance liquid chromatography
中图分类号:Q946.8
文献标志码:A
文章编号:1002-6630(2016)06-0082-07引文格式:
DOI:10.7506/spkx1002-6630-201606014
*通信作者:金花(1982—),女,讲师,博士,研究方向为天然生物活性物质提取及应用。E-mail:jinhua@neau.edu.cn
作者简介:张晓松(1982—),男,实验师,硕士,研究方向为天然生物活性物质提取及应用。E-mail:liuxing167@163.com
收稿日期:2015-07-27