张艳梅,唐浩国*,焦润玲,杨同香,向进乐,刘 琼
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
摘 要:采用超滤技术对茅岩莓黄酮提取液进行分离,以膜通量和黄酮纯度为评价指标,采用单因素试验和正交试验研究了超滤时间、料液质量浓度、料液温度、超滤压力对超滤效果的影响,确定最佳的分离工艺参数,并研究含有60%黄酮的茅岩莓提取物的抑菌作用。结果表明,在料液质量浓度0.5 mg/mL、料液温度35 ℃、超滤压力0.2 MPa条件下,初始膜通量为0.215 mL/(cm2·min),黄酮纯度由32.7%提高到60.1%。超滤后的黄酮提取物对4 种细菌均有明显的抑制作用,其对4 种细菌最小抑菌浓度值分别为沙门氏菌0.75 mg/mL、绿脓杆菌1.50 mg/mL、金黄色葡萄球菌1.50 mg/mL、大肠杆菌3.00 mg/mL。其对4 种细菌最低杀菌浓度值分别为沙门氏菌0.75 mg/mL、绿脓杆菌3.00 mg/mL、金黄色葡萄球菌3.00 mg/mL、大肠杆菌3.00 mg/mL。
关键词:茅岩莓黄酮;超滤;膜通量;纯度;抑菌
张艳梅, 唐浩国, 焦润玲, 等. 超滤分离茅岩莓黄酮工艺优化及其抑菌作用[J]. 食品科学, 2016, 37(6): 89-94. DOI:10.7506/spkx1002-6630-201606015. http://www.spkx.net.cn
ZHANG Yanmei, TANG Haoguo, JIAO Runling, et al. Optimization of ultrafiltration separation of flavonoid from Ampelopsis grossedentata and its bacteriostatic activivity[J]. Food Science, 2016, 37(6): 89-94. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606015. http://www.spkx.net.cn
茅岩莓又名藤茶、白茶等,学名显齿蛇葡萄(Ampelopsis grossedentata),是张家界茅岩山原始森林珍稀物种。茅岩莓药食两用,黄酮含量高,尤其是二氢杨梅素含量丰富。目前,对茅岩莓黄酮化合物的提取主要以溶剂浸提为主,以超声波或微波加以辅助[1-4]。常用的分离茅岩莓黄酮方法主要有大孔树脂法和重结晶法等。大孔树脂法操作复杂,而重结晶法存在试剂消耗大、收率低的缺点,因此这两种方法均不合适工业化生产[5-6]。近年研究表明,茅岩莓黄酮具抗氧化[7-10]、降血脂、降血压、抗癌[11]、抗血小板聚集及抗血栓作用。因而对茅岩莓黄酮的研究和开发具有很高的经济和药用价值。
超滤是一种新兴的膜分离技术,其分离机理为筛孔分离过程,以压差为推动力,利用高分子薄膜凭借各组分在膜中传质的选择性差异对多组分流体物质进行分离、提纯和富集,可以有效地除去提取液中蛋白质、多糖、高分子单宁以及部分原花色素杂质[12]。本研究选取茅岩莓叶为材料,用乙醇提取茅岩莓黄酮,并用超滤法对其进行分离纯化。采用牛津杯抑菌实验法测定其对大肠杆菌、沙门氏菌、绿脓杆菌以及金黄色葡萄球菌的抑菌效果,通过本研究以评价茅岩莓黄酮作为天然抗菌剂的应用价值。
1.1 材料与试剂
茅岩莓 张家界茅岩莓有限公司;二氢杨梅素标准品南京广润生物有限公司;硫酸庆大霉素注射液(1 mL,40 000万单位) 河南辅仁怀庆堂制药有限公司;70%乙醇溶液、氢氧化钠、过氧化氢、牛肉膏、蛋白胨、琼脂、氯化钠、盐酸等试剂均为分析纯;实验用水为蒸馏水。
实验菌种(大肠杆菌、沙门氏菌、绿脓杆菌、金黄色葡萄球菌)由河南科技大学食品与生物工程学院发酵实验室提供。
1.2 仪器与设备
超滤膜(滤过相对分子质量10 000的聚砜膜) 上海泽权仪器设备有限公司;BT-300蠕动泵 保定兰格恒流泵有限公司;旋转蒸发仪 上海申生科技有限公司;UV754N紫外-可见分光光度计 上海佑科仪表仪器公司;BSM系列电子精密天平 上海卓精电子科技有限公司;循环水式真空泵 河南巩义市英峪予华仪器厂;电热鼓风干燥箱 上海一恒科学仪器有限公司;HWS-26电热恒温水浴锅 北京市永光明医疗仪器有限公司;LDZX-50KBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;SW-CJ-IF型单人双面超净工作台 苏州净化设备有限公司;PYX-DHS-X6-S型隔水式电热恒温培养箱上海跃进医疗器械厂;QYC211型摇床培养箱 上海福玛实验设备有限公司。
1.3 方法
1.3.1 标准曲线制作
茅岩莓黄酮主要为二氢杨梅素,此外还其他黄酮,如杨梅素等,但含量很少。因此总黄酮含量以二氢杨梅素计。标准曲线的制作方法参考文献[13-14],于292 nm波长处测定吸光度。利用Origin 9作图,以标样的质量浓度为横坐标,吸光度为纵坐标,得到回归方程:y=0.565 7x-0.024 9,相关系数R2=0.998 8。
1.3.2 茅岩莓黄酮提取液的制备及含量测定
将一定量的茅岩莓叶置于50 ℃烘箱烘干,干燥后的叶碎成粉,过60 目筛,石油醚脱脂后密封保存备用。称取10 g粉料装入圆底烧瓶,按1∶30的料液比倒入70%乙醇溶液300 mL,连接冷凝回流装置,在75 ℃条件下浸提90 min,抽滤,收集滤液;残渣倒入300 mL 70%乙醇溶液,再次浸提。浸提液合并液用三层滤纸进行多次抽滤,将滤液于45 ℃条件下真空浓缩至一定体积[15],备用。将样品提取液或超滤透过液稀释一定的倍数,按1.3.1节方法测定吸光度,带入回归方程可计算样品提取液中黄酮的质量浓度。
1.3.3 超滤纯化黄酮粗提物工艺流程
一定质量浓度茅岩莓黄酮提取液→三层滤纸反复抽滤→超滤→旋转蒸发浓缩→干燥→黄酮产品
1.3.4 超滤工艺参数分析及计算[16]
膜通量(Jw)是指在一定压力和温度条件下,单位时间内通过单位膜面积的液体量,计算如式(1)所示:
式中:V为透过液体积/mL;t为超滤时间/min;A为有效膜面积/cm2。
其中超滤后茅岩莓黄酮纯度计算如公式(2)所示:
式中:C为超滤浓缩后黄酮的质量浓度/(mg/mL);V为透过液体积/mL;M为干燥后黄酮产品质量/mg。
1.3.5 单因素试验
1.3.5.1 超滤时间对超滤效果的影响
固定料液温度35 ℃、料液质量浓度0.5 mg/mL、超滤压力0.2 MPa,作出膜通量随时间的变化趋势图,分析超滤时间对膜通量的影响,确定最佳超滤时间。
1.3.5.2 料液质量浓度对超滤效果的影响
固定料液温度35 ℃、超滤压力0.2 MPa,料液质量浓度依次为0.25、0.50、0.75、1.00 mg/mL,考察料液质量浓度对膜通量及黄酮纯度的影响。
1.3.5.3 料液温度对超滤效果的影响
固定料液质量浓度0.5 mg/mL、超滤压力0.2 MPa,料液温度分别为25、30、35、40 ℃,考察料液温度对膜通量及黄酮纯度的影响。
1.3.5.4 超滤压力对超滤效果的影响
固定料液质量浓度0.5 mg/mL、料液温度35 ℃,超滤压力依次为0.10、0.15、0.20、0.25 MPa,考察超滤压力对膜通量及黄酮纯度的影响。
1.3.6 正交试验设计及综合评分
根据单因素试验结果,选择料液质量浓度、料液温度、超滤压力3个因素进行正交试验,以膜通量和黄酮纯度为评价指标,超滤时间为60 min。正交试验因素水平见表1。
表1 正交试验因素与水平
Table 1 Factors and levels for orthogonal array design

L9(34)正交试验以膜通量、黄酮纯度为指标,对所得的指标数据进行归一化处理,消除各指标的量纲,使各指标处于同一数量级上,设Yjmax对应100 分,Yjmin对应0 分,按照式(3)计算各指标观测值的评分值Yij’:

式中:Yij为第i行第j列试验点的观测值;Yjmax为第j列中试验点观测值的最大值;Yjmin为第j列中试验点观测值的最小值[17]。
对2 个试验指标进行加权分配,膜通量和超滤后黄酮纯度都是评价超滤效果的重要指标,因此将膜通量和黄酮纯度的加权值wj分别设为w1=0.5、w2=0.5,且w1+w2=1;将膜通量和黄酮纯度按公式(3)进行加权评分,加权综合评分值Y=0.5Y1+0.5Y2。
1.3.7 抑菌实验
1.3.7.1 培养基的配制[18]
细菌培养基:牛肉膏0.5 g,蛋白胨l g,氯化钠0.5 g,琼脂1.5~2 g,蒸馏水100 mL,pH 7.0~7.2。于121 ℃的高压灭菌锅里灭菌20 min。
细菌液体培养基:不加琼脂,其余等同于牛肉膏蛋白胨培养基,配好后分装于各个试管里,于121 ℃的高压灭菌锅里灭菌20 min。
1.3.7.2 菌悬液的制备
在无菌操作条件下,将供试菌种接种于普通营养琼脂斜面培养基上,37 ℃恒温培养24 h。分别挑取一环已活化的菌置于10 mL的灭菌液体培养基内,37 ℃摇床培养24 h制成菌悬液[19],平板记数法测定菌悬液数量浓度,调整其数量浓度为106~107CFU/mL,现配现用。
1.3.7.3 抑菌圈的测定
用70%的乙醇溶液将超滤后的含有60%黄酮的茅岩莓提取物分别配制成质量浓度为8、12、16 mg/mL的溶液,用移液枪分别吸取各菌悬液100 μL,均匀涂布在倒好的已灭菌培养基平皿上。在培养皿中放入无菌牛津杯,等距离、均匀垂直放置5个牛津杯。用移液枪取不同质量浓度的黄酮溶液100 μL,加入标有记号的牛津杯中(1、2、3号),以70%乙醇溶液作为阴性对照(0号),以稀释10-3单位的庆大霉素注射液作为阳性对照(4号),置37 ℃恒温培养箱培养24 h,测定抑菌圈直径[20],重复3 次,计算平均值。
1.3.7.4 黄酮提取物最小抑菌浓度(minimum inhibitory concentration,MIC)的测定
在无菌条件下,取若干支灭菌试管分成4 组,每组7 支,将1~5号试管内加入4 mL灭菌的液体培养基,1号试管内加入4 mL黄酮溶液(12 mg/mL)充分混合后吸出4 mL到2号试管中,依次稀释到第5管,5号试管充分混匀后,吸出4 mL混合液丢弃,稀释后质量浓度分别为6、3、1.5、0.75、0.375 mg/mL,6号试管只加入4 mL培养基,作为不加黄酮的阳性对照,7号试管中加入4 mL黄酮溶液,但不加菌悬液作为阴性对照[12]。然后分别向7 个试管中加入100 μL各菌种的菌悬液。在37 ℃培养箱中培养24 h。观察实验结果,以无细菌生长的最高药物稀释度为该药物的MIC值。
1.3.7.5 黄酮提取物最低杀菌浓度(minimum bactericidal concentration,MBC)的测定
测出黄酮提取物MIC值后,将测定MIC值条件下的各供试菌菌液分别倒入培养皿,加入一定量的培养基后在37 ℃培养箱中培养24 h。观察菌落生长情况,以无菌落生长的培养物的质量浓度作为MBC值[19]。
2.1 单因素试验结果
2.1.1 超滤时间的确定

图1 超滤时间对膜通量的影响
Fig.1 Influence of ultrafiltration time on membrane flux
由图1可知,随着超滤时间的延长,膜通量逐渐下降,在超滤的前35 min膜通量下降明显,45 min后膜通量趋向平稳。这是因为超滤运行初期膜表面未受到污染和堵塞,阻力较小,随着超滤过程的进行,膜表面迅速吸附蛋白质等大分子物质,料液流速下降,透过液体积逐渐减少,导致膜通量下降迅速。40 min后由于浓差极化现象的出现和凝胶层的形成,膜通量趋于平稳[21-24]。从超滤效率和保护超滤膜的角度考虑,超滤时间以45~55 min为宜。
2.1.2 料液质量浓度的确定
由图2和表2可知,随着料液质量浓度增加,黏度增大,超滤通量下降,且质量浓度越高膜通量下降越快,当料液质量浓度为1 mg/mL时,膜通量下降较为迅速,这是因为料液中的多糖等大分子溶质更多地吸附积聚在膜表面,导致传质阻力更大、膜的污染现象更为严重,随着大分子物质不断增加,浓差极化更加严重,形成的凝胶层逐渐变厚,致使超滤膜的透过率通量和下降,纯度降低[25-26]。因此选择料液质量浓度为0.25~0.75 mg/mL,做进一步正交试验。

图2 料液质量浓度对膜通量的影响
Fig.2 Influence of feed concentration on membrane flux
表2 不同料液质量浓度的超滤效果
Table 2 Results of ultrafiltration at different feed concentrations

注:此处黄酮纯度为最终纯度,下同。
2.1.3 料液温度的确定

图3 料液温度对膜通量的影响
Fig.3 Influence of feed temperature on membrane flux
表3 不同料液温度的超滤效果
Table 3 Results of ultrafiltration at different feed temperatures
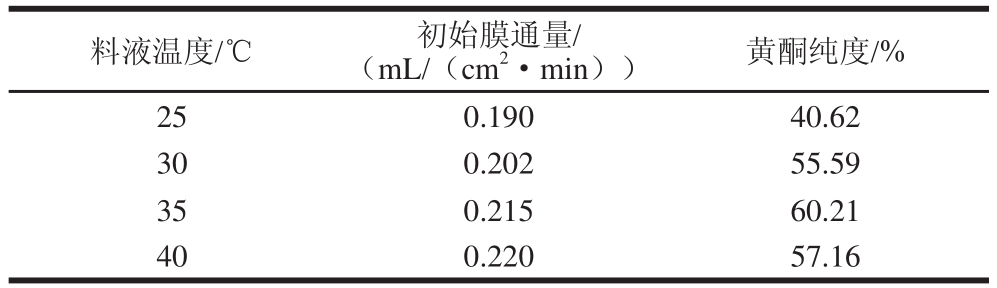
由图3和表3可知,料液温度与膜通量呈正相关。黄酮的溶解率随着料液温度的升高而升高,因此截留液中黄酮含量减小,而透过液中黄酮含量增加。温度升高加快了超滤膜的聚合物链节的微观布朗运动[27],使单位时间和单位体积形成小孔的可能性增加,导致膜的截留性能下降,随着温度的升高,溶质的透过性增加,但对大分子等杂质的截留率也有所降低,此时黄酮纯度就取决于黄酮和杂质相对透过性能的变化程度,纯度在40 ℃时略有下降,是因为杂质的相对透过性能增加的缘故。如果仅考虑通量大小,理论上选择高温较好,但温度太高会加速膜的老化,缩短膜的寿命,同时高温可能会导致膜截留性能发生改变[28]。因此选取30~40 ℃做进一步正交试验。
2.1.4 超滤压力的确定
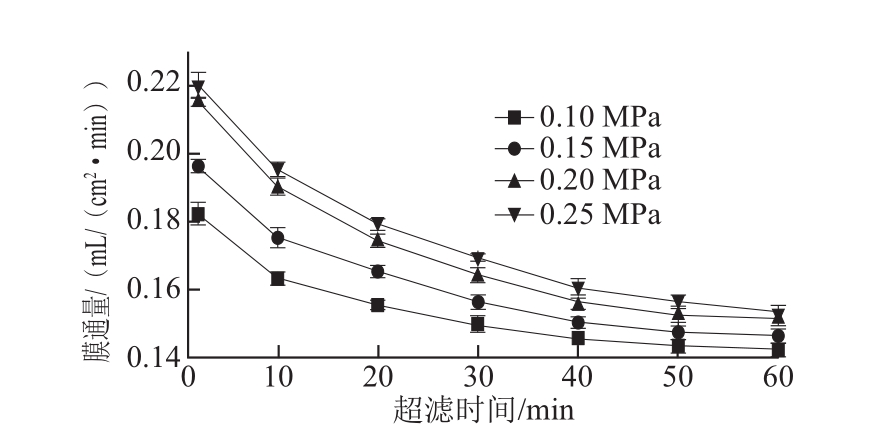
图4 超滤压力对膜通量的影响
Fig.4 Influence of pressure on membrane flux
表4 不同超滤压力的超滤效果
Table 4 Results of ultrafiltration at different pressures
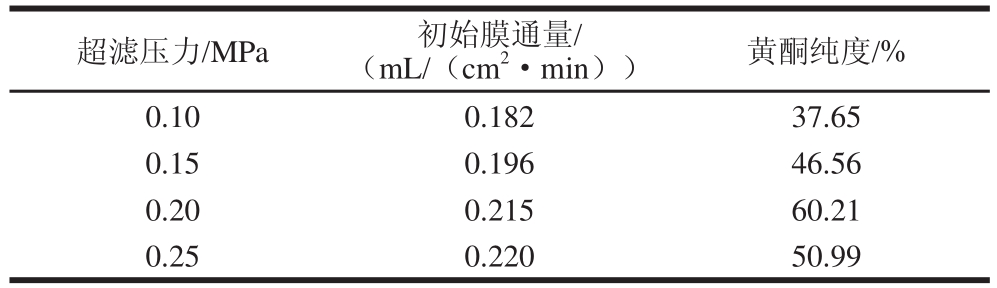
由图4和表4可知,随着超滤压力的增大,膜通量也随之增加,但当压力达到0.20 MPa时,膜通量增加的趋势逐渐减缓。在操作压力较小时,超滤膜的透过通量较小,被截留物形成的凝胶层较薄,膜的浓差极化作用较弱,当压力升高到某一数值时,膜面上被截留的高分子可溶性固形物质量浓度增加,浓差极化作用增强,此时开始形成较厚的膜面凝胶层,此时超滤阻力除膜阻力外,又增加了极化层阻力和凝胶层阻力,使得超滤阻力增加[29-30]。因此选取超滤压力为0.15~0.25 MPa做进一步正交试验。
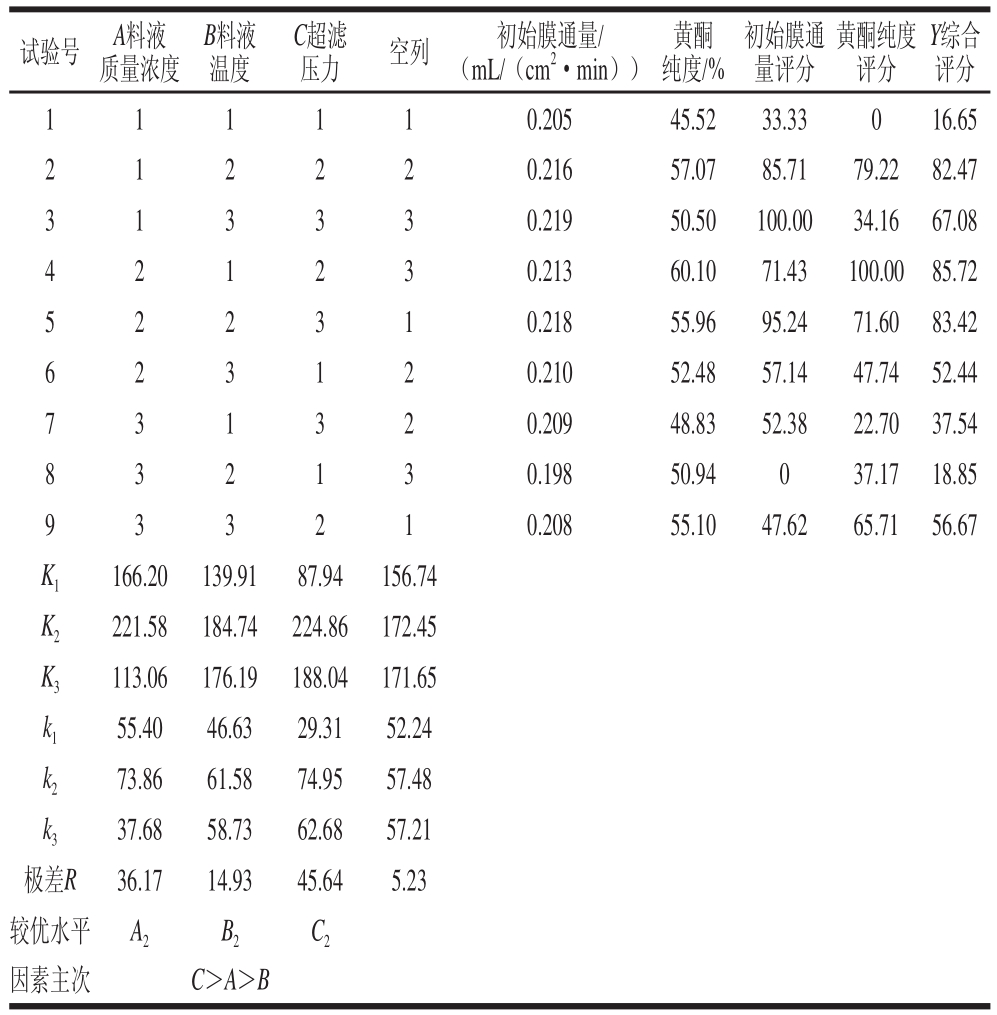
2.2 正交试验结果
采用L9(34)正交试验表对超滤后膜通量和黄酮纯度进行研究,利用DPS 8.05数据处理软件,试验结果及极差分析见表5。
由表5可知,各因素对综合评分影响的主次顺序为超滤压力>料液质量浓度>料液温度,超滤工艺的最佳工艺参数为A2B2C2,即料液质量浓度0.5 mg/mL、料液温度35 ℃、超滤压力0.2 MPa,在试验中没有出现,采用A2B2C2组合进行验证实验。在此条件下,初始膜通量达到0.215 mL/(cm2·min),超滤后黄酮纯度达到60.1%,综合评分为90.48。因此,此方案可行。
表5 正交试验结果与极差分析
Table 5 Orthogonal array design with range analysis of experimental results
2.3 抑菌实验结果
2.3.1 茅岩莓黄酮提取物的抑菌效果
表6 茅岩莓黄酮对供试菌的抑制效果(抑菌圈直径)
Table 6 Inhibitory effect ofAmpelopsis grossedentata flavonoids on bacteria mm

注:表中数据为“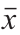 ±s”,n=3。。
±s”,n=3。。
超滤后的茅岩莓黄酮提取物对各供试菌的抑制效果见表6。各质量浓度的茅岩莓黄酮提取物对供试菌均具有抑制作用,抑菌圈直径随着黄酮提取物溶液质量浓度的增大而增大,但不呈正比例关系。其中,对沙门氏菌的抑制作用最为明显,其次是金黄色葡萄球菌、绿脓杆菌,对大肠杆菌的抑制作用最弱。
2.3.2 茅岩莓黄酮提取物对各种菌的MIC
由表7可知,超滤后的茅岩莓黄酮提取物溶液对黄酮对各供试菌的MIC分别为:沙门氏菌0.75 mg/mL、绿脓杆菌1.50 mg/mL、金黄色葡萄球菌1.50 mg/mL、大肠杆菌3.00 mg/mL。
表7 茅岩莓黄酮提取物对各种细菌的MIC
Table 7 Minimum inhibitory concentrations of Ampelopsis grossedentata

注:+.有细菌生长,-.没有细菌生长。下同。
表8 茅岩莓黄酮提取物对各种细菌的MBC
Table 8 Minimum bactericidal concentrations of Ampelopsis grossedentata

由表8可知,超滤后的茅岩莓黄酮提取物溶液对黄酮对各供试菌的MBC分别为沙门氏菌0.75 mg/mL、绿脓杆菌3.00 mg/mL、金黄色葡萄球菌3.00 mg/mL、大肠杆菌3.00 mg/mL。
采用超滤法对茅岩莓黄酮粗提液进行了纯化,研究了截留相对分子质量为10 000的聚砜膜对茅岩莓黄酮提取液的纯化效果,考察了料液质量浓度、料液温度、超滤压力对膜通量和黄酮纯度的影响,通过单因素和正交试验对超滤工艺进行优化,确定了最佳的工艺条件:料液质量浓度0.5 mg/mL、料液温度35 ℃、超滤压力0.2 MPa。在此条件下初始膜通量为0.215 mL/(cm2·min),茅岩莓黄酮化合物的纯度由32.7%提高到60.1%。
采用牛津杯法研究了超滤后茅岩莓黄酮提取物的抑菌作用。结果显示,各质量浓度的黄酮提取物对供试菌均具有抑制作用,对沙门氏菌的抑制作用最为明显,其次是金黄色葡萄球菌、绿脓杆菌,对大肠杆菌的抑制作用最弱,其对4种细菌MIC值分别为沙门氏菌0.75 mg/mL、绿脓杆菌1.50 mg/mL、金黄色葡萄球菌1.50 mg/mL、大肠杆菌3.00 mg/mL。超滤后的茅岩莓黄酮提取物对黄酮对各供试菌的MBC值分别为:沙门氏菌0.75 mg/mL、绿脓杆菌3.00 mg/mL、金黄色葡萄球菌3.00 mg/mL、大肠杆菌3.00 mg/mL。
参考文献:
[1] 熊伟, 李雄辉, 胡居吴, 等. 藤茶活性成分的同步提取分离研究[J]. 食品研究与开发, 2011, 32(10): 183-186. DOI:10.3969/ j.issn.1005-6521.2011.10.053.
[2] 宾冬梅, 易诚, 颜彩虹. 微波辅助法提取藤茶黄酮工艺优化[J].安徽农业科学, 2014, 42(27): 9320-9321. DOI:10.3969/ j.issn.0517-6611.2014.27.023.
[3] 梁刑, 邱岚, 张良. 响应面法对超声波提取藤茶二氢杨梅素工艺的优化[J]. 湖北农业科学, 2015, 54(2): 416-421. DOI:10.14088/j.cnki. issn0439-8114.2015.02.040.
[4] 金慧鸣, 谭兴和, 蔡文, 等. 响应面法优化藤茶总黄酮的提取工艺[J].食品安全质量检测学报, 2015, 6(5): 1575-1582.
[5] 占春瑞, 廖燕燕, 李海燕, 等. 二氢杨梅素分析用标准样品制备及结构分析[J]. 现代食品科技, 2009, 25(10): 1124-1128. DOI:10.3969/ j.issn.1673-9078.2009.10.004.
[6] 陈玉琼, 李安琪, 孟燕. 大孔树脂纯化藤茶黄酮及主要成分结构鉴定[J]. 食品科学, 2009, 30(9): 51-55. DOI:10.3321/ j.issn:1002-6630.2009.09.011.
[7] YE Liyun, WANG Hengjian, DUNCAN S E, et al. Antioxidant activities of Vine tea (Ampelopsis grossedentata) extract and its major component dihydromyricetin in soybean oil and cooked ground beef[J]. Food Chemistry, 2015, 172: 416-422. DOI:10.1016/ j.foodchem.2014.09.090.
[8] ZHENG X J, XIAO H, ZENG Z, et al. Composition and serum antioxidation of the main flavonoids from fermented vine tea (Ampelopsis grossedentata)[J]. Journal of Functional Foods, 2014, 9: 290-294. DOI:10.1016/j.jff.2014.04.028.
[9] XIN Mingliang, MA Yujie, XU Kai, et al. Dihydromyricetin an effective non-hindered phenol antioxidant for linear low-density polyethylene stabilisation[J]. Journal of Thermal Analysis and Calorimetry, 2013, 114: 1167-1175. DOI:10.1007/s10973-013-3169-1.
[10] ZHENG Qiukai, XU Linli, ZHU Linhua, et al. Preliminary investigations of antioxidation of dihydromyricetin in polymers[J]. Indian Academy of Sciences, 2010, 33(3): 273-275. DOI:10.1007/ s12034-010-0042-8.
[11] KOU XianJuan, CHEN Ning. Pharmacological potential of ampelopsin in Rattan tea[J]. Food Science and Human Wellness, 2012, 1: 14-18. DOI:10.1016/j.fshw.2012.08.001.
[12] 唐浩国. 黄酮类化合物研究[M]. 北京: 科学出版社, 2009.
[13] 曾云想, 郁建平. 茅岩莓总黄酮提取方法的优选[ J ] . 山地农业生物学报, 2013, 32(2): 153-158. DOI:10.3969/ j.issn.1008-0457.2013.02.014.
[14] 刘建兰, 于华忠, 高梦, 等. 藤茶总黄酮和二氢杨梅素的提取检测研究进展[J]. 广东农业科学, 2013, 40(19): 90-93.
[15] 陈玉琼, 李安琪, 孟燕. 藤茶黄酮及二氢杨梅素提取条件的优化[J]. 华中农业大学学报, 2009, 28(1): 106-110. DOI:10.3321/ j.issn:1000-2421.2009.01.026.
[16] 杨芙莲, 何琳. 超滤法纯化甜荞麦麸皮中黄酮类化合物研究[J]. 粮食与油脂, 2010(12): 42-45. DOI:10.3969/ j.issn.1008-9578.2010.12.013.
[17] 张仲欣, 杜双奎. 食品试验设计与数据处理[M]. 郑州: 郑州大学出版社, 2011.
[18] 秦翠丽, 李松彪, 李市场, 等. 微生物学实验技术[M]. 北京: 兵器工业出版社, 2008.
[19] 王鸿飞, 刘飞, 徐超, 等. 费菜总黄酮及其不同极性提取物抑菌活性研究[J]. 中国食品学报, 2013, 13(5): 124-127.
[20] 刘鹏举, 付志慧, 孙东, 等. 桑叶凝集素分离纯化及抑菌活性研究[J].天然产物研究与开发, 2015, 27(3): 475-479.
[21] 王芸芸, 刘利军. 超滤膜技术用于甘草总黄酮的分离纯化[J].化学研究与应用, 2012, 24(4): 645-649. DOI:10.3969/ j.issn.1004-1656.2012.04.033.
[22] ZHANG Yuqing, SHAN Xing, GAO Xiaoquan. Development of a molecularly imprinted membrane for selective separation of flavonoids[J]. Separation and Purification Technology, 2011, 76: 337-344. DOI:10.1016/j.seppur.2010.10.024.
[23] CARVALHO L J, CASTRO I M, SILVA C B. A study of retention of sugars in the process of clarification of pineapple juice (Ananas comosus L. Merril) by micro-and ultra-filtration[J]. Journal of Food Engineering, 2008, 87: 447-454. DOI:10.1016/j.jfoodeng.2007.12.015.
[24] TANG Haoguo, LI Ye, XIANG Jinle, et al. Study on purification of flavonoids from leaves of Dendrocalamus latiflorus by ultrafiltration[J]. 食品科学, 2008, 29(5): 177-179.
[25] 冯颖, 于磊, 孟宪军, 等. 响应面法优化超滤提纯无梗五加果多糖工艺[J]. 食品科学, 2013, 34(2): 67-70.
[26] 杨宁, 赵谋明, 崔春, 等. 仙人掌多糖的超滤膜分离提取及其影响因素[J]. 华南理工大学学报, 2007, 35(4): 42-45. DOI:10.3321/ j.issn:1000-565X.2007.04.010.
[27] 刘志强, 张初署, 孙杰, 等. 膜分离技术纯化花生衣中的原花色素[J].食品科学, 2010, 31(20): 183-186.
[28] 郎昌野, 马丽苹, 赵琨, 等. 正交试验优化银条多糖超滤浓缩工艺[J].食品科学, 2013, 34(4): 51-54.
[29] 孙工兵, 朱登超, 陈伟求, 等. 超滤纯化黄芩黄酮的工艺研究[J].农产品加工(学刊), 2013, 6(6): 11-15. DOI:10.3969/jissn.1671-9646(X).2013.06.033.
[30] 易克传, 曾其良, 李慧, 等. 膜技术纯化菊花总黄酮的工艺研究[J].天然产物研究与开发, 2012, 24(10): 1449-1453. DOI:10.3969/ j.issn.1001-6880.2012.10.029.
ZHANG Yanmei, TANG Haoguo*, JIAO Runling, YANG Tongxiang, XIANG Jinle, LIU Qiong
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China)
Abstract: The separation of flavonoid from the crude extract of Ampelopsis grossedentata (FAG) by ultrafiltraion was optimized using single factor and orthogonal experiments. The independent variables were ultrafiltration time, feed concentration, temperature and pressure, and the responses were membrane flux and flavonoid purity. Furthermore, the bacteriostatic activity of FAG containing 60% flavonoid was studied. The results showed that when the ultrafiltration of the sample containing 0.5 mg/mL flavonoid at 35 ℃ was conducted at 0.2 MPa, the initial membrane flux was 0.215 mL/(cm2·min), yielding an increase in FAG purity from 32.7% to 60.1%. After ultrafiltration, FAG exhibited obvious inhibitory effects on 4 kinds of bacteria with minimal inhibitory concentration (MIC) values of 0.75, 1.50, 1.50 and 3.00 mg/mL and minimal bactericidal concentration (MBC) values of 0.75, 3.00, 3.00 and 3.00 mg/mL for Salmonella, Pseudomonas aeruginosa, Staphylococcus aureus, and Escherichia coli, respectively.
Key words: flavonoid from Ampelopsis grossedentata (FAG); ultrafiltration; membrane flux; purity; bacteriostasis
中图分类号:TS202.1
文献标志码:A
文章编号:1002-6630(2016)06-0089-06引文格式:
DOI:10.7506/spkx1002-6630-201606015
*通信作者:唐浩国(1968—),男,教授,博士,主要从事食品化学及营养学和食品生物技术研究。E-mail:tanghaoguo@126.com
作者简介:张艳梅(1989—),女,硕士研究生,主要从事农产品加工及贮藏研究。E-mail:295777983@qq.com
收稿日期:2015-07-21