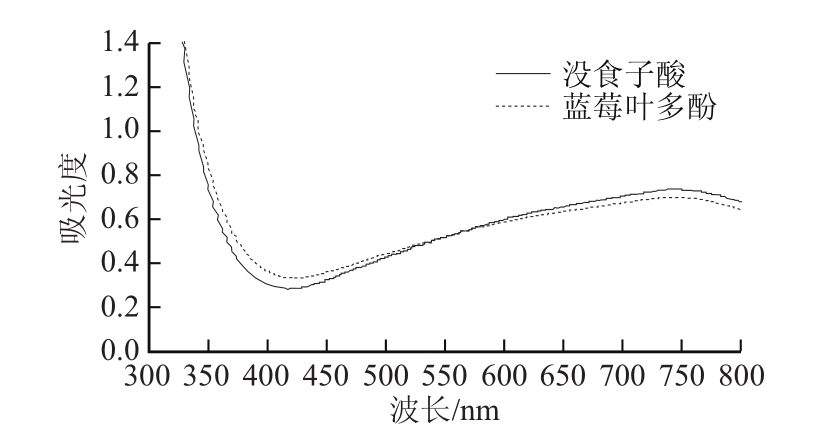
图1 蓝莓叶多酚和没食子酸的吸收光谱图
Fig.1 Absorption spectra of polyphenols from blueberry leaves and gallic acid
李颖畅,王玉华,韩美洲,张 笑,励建荣*
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁 锦州 121013)
摘 要:通过特征颜色反应、紫外-可见光谱、傅里叶红外光谱、高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)法对蓝莓叶多 酚样品进行定 性分析。结果表明:蓝莓叶多酚中含有羟基、糖基、苯环、甲氧基和含氧杂环等特征基团。蓝莓叶多酚在醇溶液中最大吸收波长分别在354 nm和748 nm处。通过HPLC-MS的保留时间和多酚单体的一、二级质谱图分析,并与标准的质谱数据和保留时间比较,得知蓝莓叶多酚中有5 种多酚单体,分别为表儿茶素没食子酸酯、绿原酸、甲基-芥子酸-己糖苷、5-O-阿魏酰奎尼酸、槲皮素3-O-葡萄糖苷。
关键词:蓝莓叶多酚;组成分析;高效液相色谱-质谱联用
李颖畅, 王玉华, 韩美洲, 等. 蓝莓叶多酚组成成分分析[J]. 食品科学, 2016, 37(6): 106-110. DOI:10.7506/spkx1002-6630-201606018. http://www.spkx.net.cn
LI Yingchang, WANG Yuhua, HAN Meizhou, et al. Polyphenol composition of blueberry leaves[J]. Food Science, 2016, 37(6): 106-110. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606018. http://www.spkx.net.cn
蓝莓,又名越橘,属杜鹃花科越橘属植物。蓝莓种类繁多,分为兔眼蓝莓,高丛蓝莓,半高丛蓝莓和低丛蓝莓。蓝莓叶为药食两用植物,有解毒、利尿等功效[1]。蓝莓叶中含有粗蛋白、脂肪酸、氨基酸、有机酸和大量多酚类化合物[2]。多酚是多羟基酚类化合物的总称,按分子质量大小对其进行分类可分为多酚单体和由单体聚合成的单宁类物质,多酚单体主要含有酚酸类化合物和黄酮类化合物,而单宁类物质主要为原花青素类物质[3]。近年来,国内外学者对蓝莓叶的组成和生理功能进行了研究。研究[4]发现兔眼蓝莓叶的乙醇提取物中多酚类物质含量较高,且抗氧化能力强于兔眼蓝莓果。Matsuo等[5]对兔眼蓝莓叶多酚进行组成分析,发现其主要成分为咖啡酰奎尼酸、黄酮苷、黄烷-3-醇、原花青素等。Deng 等[6]对不同的成熟阶段的蓝莓叶多酚组成进行分析,发现在不成熟的蓝莓叶提取物中含有大量的香草酸、阿魏酸和没食子酸;而半成熟和成熟的蓝莓叶提取物中含有大量的咖啡酸、丁香酸以及少量的阿魏酸。Takesshita 等[7]研究发现蓝莓叶中的原花青素能有效地抑制丙肝病毒的RNA表达。Turhan等[8]对蓝莓果和蓝莓叶的多酚含量进行分析,发现蓝莓叶多酚含量高于蓝莓果,且蓝莓叶多酚清除1,1-二苯基-2-三硝基苯肼自由基能力和还原能力强于蓝莓果。不同品种的蓝莓叶多酚组成成分不同,在食品中应用也有较大差别,因此了解其他品种的蓝莓叶多酚组成对开发和利用蓝莓叶非常重要。本实验利用紫外分光光谱、傅里叶红外光谱和高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用3 种分析方法对栽培品种蓝丰蓝莓叶多酚的组成成分进行定性分析,以期为充分利用蓝莓叶资源提供理论参考。
1.1 材料与试剂
蓝丰蓝莓叶 沈阳农业科学发展研究院;甲醇(色谱纯) 北京迪马科技有限公司;无水乙醇、氢氧化钠、无水碳酸钠、甲酸(均为国产分析纯) 天津致远化学试剂有限公司;没食子酸 天津市光复精细化工研究所;福林-酚试剂 上海如吉生物科技有限公司;AB-8大孔树脂 沧州宝恩科技有限公司。
1.2 仪器与设备
1 200HPLC仪、Eclipse Plus C18柱(4.6 mm×250 mm,5 μm)、Scimitar 2000傅里叶变换红外光谱仪 美国安捷伦科技公司;MicroTOFQ质谱美国Bruker公司;Milli-Q超纯水系统 美国Millipore公司;Sorvall Biofuge Stratos离心机 美国Thermo公司; FreeZone 2.5升台式冻干机 美国Labconco公司;UV-2550紫外-可见分光光度仪 岛津仪器(苏州)有限公司。
1.3 方法
1.3.1 蓝莓叶多酚样品的制备
参照李颖畅等[9]的方法,稍作修改。将一定量蓝莓叶在50 ℃条件下烘干,粉碎。取20 g蓝莓叶粉按1∶20(g/mL)的料液比溶于70%乙醇溶液,60 ℃恒温水浴2 h,抽滤,滤液用旋转蒸发仪在50 ℃条件下进行旋转蒸发浓缩,得到粗提液。经AB-8型大孔树脂纯化,50 ℃条件下减压旋转浓缩,得到纯化的蓝莓叶浓缩液,真空冷冻得到红色粉末。
1.3.2 蓝莓叶多酚与FeCl3显色反应[10]
取10 mg的蓝莓叶多酚粉末溶于100 mL 70%乙醇溶液中,溶液中滴入数滴1%的FeCl3溶液,观察蓝莓叶多酚溶液的颜色变化。
1.3.3 蓝莓叶多酚与中性醋酸铅的沉淀反应[11]
取10 mg的蓝莓叶多酚粉末溶于100 mL 70%乙醇溶液中,加入中性醋酸铅溶液,观察蓝莓叶多酚溶液的变化。
1.3.4 蓝莓叶多酚的紫外-可见光谱分析
参考文献[12],稍作修改。将蓝莓叶多酚样品、没食子酸、槲皮素分别溶于0.1%盐酸-甲醇溶液中,分别在5 mL没食子酸与蓝莓叶多酚中加入1 mL福林-酚试剂和3 mL 10%的碳酸钠溶液并定容至25mL显色。参考文献[13],分别在5 mL槲皮素与蓝莓叶多酚溶液中加入1 mL 5%亚硝酸钠、1 mL 10%硝酸铝溶液和10 mL 10%氢氧化钠溶液,并定容至25 mL,显色,用UV-2550紫外-可见分光光度仪在200~800 nm波长范围内进行扫描进行,得到3种物质的紫外-可见光谱图,将蓝莓叶多酚分别与没食子酸和槲皮素进行对比,对蓝莓叶多酚成分进行分析。
1.3.5 蓝莓叶多酚的红外光谱分析
取少量蓝莓叶多酚样品置于研钵中,加入一定量的KBr粉末作为载体,研磨后放入压片模具中加压,3 min后取出样品,放入样品槽内,用傅里叶红外光谱仪对样品进行扫描,得到蓝莓叶多酚样品的红外光谱图。
1.3.6 蓝莓叶多酚的HPLC-MS分析
1.3.6.1 样品处理
将真空冷冻干燥的蓝 莓叶多酚样品溶于含0.5%盐酸的50%甲醇溶液中,配成2.5 mg/mL的溶液,经0.45 μm的滤膜后得到滤液。
1.3.6.2 HPLC分析条件
参考Chiara等[14]的方法,稍作修改进行测定:安捷伦1200 HPLC仪,紫外检测器,波长320 nm;流动相:A甲醇,B 0.1%的甲酸溶液;色谱柱:Eclipse Plus C18柱(4.6 mm×250 mm,5 μm);流速:0.6 mL/min,柱温35℃。梯度洗脱程序:0~3 min,5%~30% A;3~5 min,30%~40% A;5~10 min,40%~48% A;1 0~1 5 m i n,4 8 %~5 2 % A;1 5~2 0 m i n,52%~58% A。
1.3.6.3 MS分析条件
采用正离子模式,电喷雾方式离子化,雾化压力1.2 bar,干燥气体的流速8.00 mL/min,温度180 ℃,毛细管电压4.5 kV,质量扫描范围m/z 50~3 000。
2.1 蓝莓叶多酚与FeCl3显色反应
添加FeCl3后的蓝莓叶多酚溶液,振荡后变成深褐色溶液,该颜色变化是具有酚羟基的特征颜色反应,说明蓝莓叶多酚中含有酚羟基特征基团。
2.2 蓝莓叶多酚与中性醋酸铅的反应
向蓝莓叶多酚溶液中加入中性醋酸铅溶液,立即产生沉淀,随着中性醋酸铅溶液的增加,沉淀逐渐增多,说明蓝莓叶多酚中含有酚羟基。
2.3 蓝莓叶多酚的紫外-可见吸收光谱特征

图1 蓝莓叶多酚和没食子酸的吸收光谱图
Fig.1 Absorption spectra of polyphenols from blueberry leaves and gallic acid

图2 蓝莓叶多酚和槲皮素的吸收光谱图
Fig.2 Absorption spectra of polyphenols from blueberry leaves and quercetin
加入福林-酚试剂和10%碳酸钠显色后的蓝莓叶多酚和没食子酸的波长扫描光谱如图1所示,可知蓝莓叶多酚的最大吸收波长在748 nm处,与没食子酸的吸收光谱基本一致,推测蓝莓叶多酚中可能含有没食子酸或与没食子酸相似的官能团。加入5%亚硝酸钠、10%硝酸铝和氢氧化钠溶液显色后的蓝莓叶多酚和槲皮素的波长扫描光谱如图2所示,可知蓝莓叶多酚的最大吸收波长在354 nm处,与槲皮素的吸收光谱基本一致,由此推测蓝莓叶多酚中可能含有槲皮素或与槲皮素相似的官能团。
2.4 红外光谱法分析蓝莓叶多酚中化学基团组成
从图3可以看出,蓝莓叶多酚的主要吸收峰有3 421.712、2 931.793、1 508.331、1 446.609、1 386.815、1 282.660、1 199.721、1 116.682、1 068.562 cm-1。根据张叔良[15]研究,3 500~3 200 cm-1处为分子内羟基与其他基团形成的氢键所对应的特征吸收峰,因此3 421.712 cm-1(强、宽)谱带可推测,蓝莓叶多酚中含有羟基基团,且羟基数目较多;2 931.793 cm-1处为甲氧基中C—H伸缩振动的吸收峰;1 508.331、1 446.609 cm-1处可能是芳烃骨架C=C键伸缩振动吸收峰;1 386.815 cm-1处可能是甲氧基C—H面内弯曲振动吸收峰;1 199.721、1 116.682、1 068.562 cm-1处可能是C—O—C伸缩振动吸收峰。而羟基、甲氧基中C—H、芳烃骨架C=C键和C—O均为酚类的特征基团,可见蓝莓叶多酚中有羟基、苯环、甲氧基和含氧杂环等特征基团。
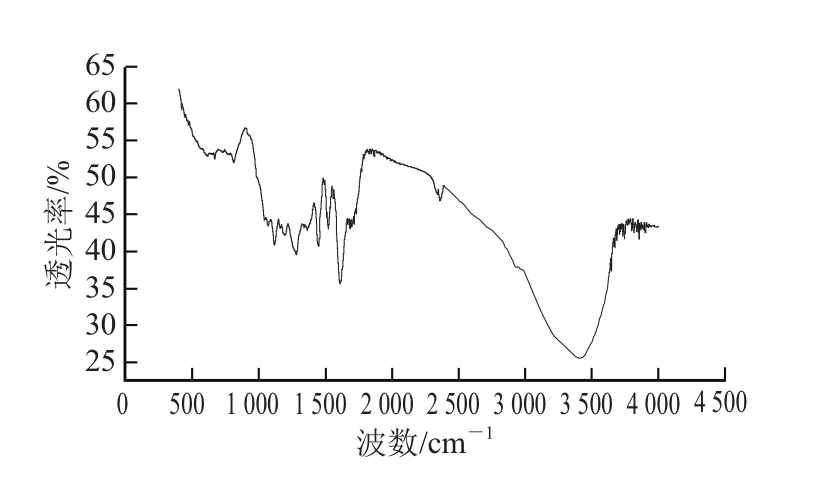
图3 蓝莓叶多酚的红外谱图
Fig.3 Infrared spectrum of polyphenols from blueberry leaves
2.5 HPLC-MS法分析蓝莓叶多酚组成
在检测波长320 nm条件下,采用HPLC对蓝莓叶多酚进行分离,通过HPLC-MS对其进行分析。由图4可知,HPLC分离出4 种物质,而总离子流图(图5)中分离出5 种物质,这可能是由于总 离子流图中峰5所对应的物质含量低,因此在色谱图中未显示。

图4 蓝莓叶多酚样品的HPLC图
Fig.4 HPLC of polyphenols from blueberry leaves

图5 蓝莓叶多酚样品总离子流图
Fig.5 TIC chromatogram of polyphenols from blueberry leaves
表1 蓝莓叶多酚样品中主要组分的保留时间、对应的的一级、二级质谱峰及对应的化合物
Table 1 Mass spectral data of the major components of polyphenols from blueberry leaves

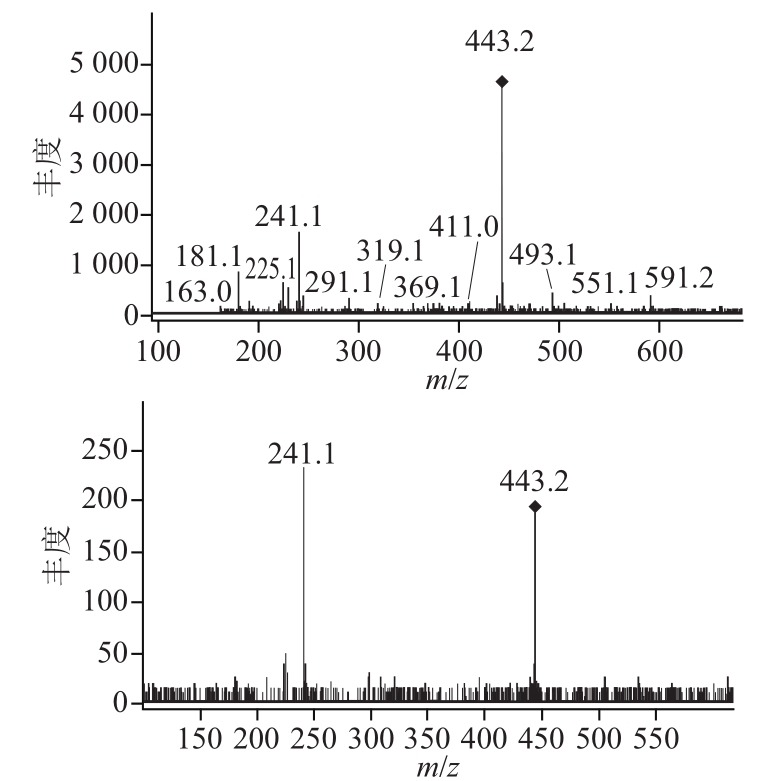
图6 1号峰对应的一、二级质谱图
Fig.6 Mass spectra of peak 1

图7 2号峰对应的一、二级质谱图
Fig.7 Mass spectra of pe ak 2

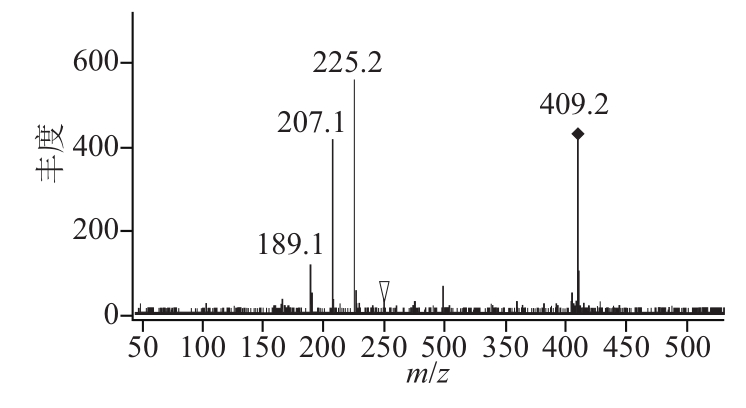
图8 3号峰对应的一、二级质谱图
Fig.8 Mass spectra of peak 3
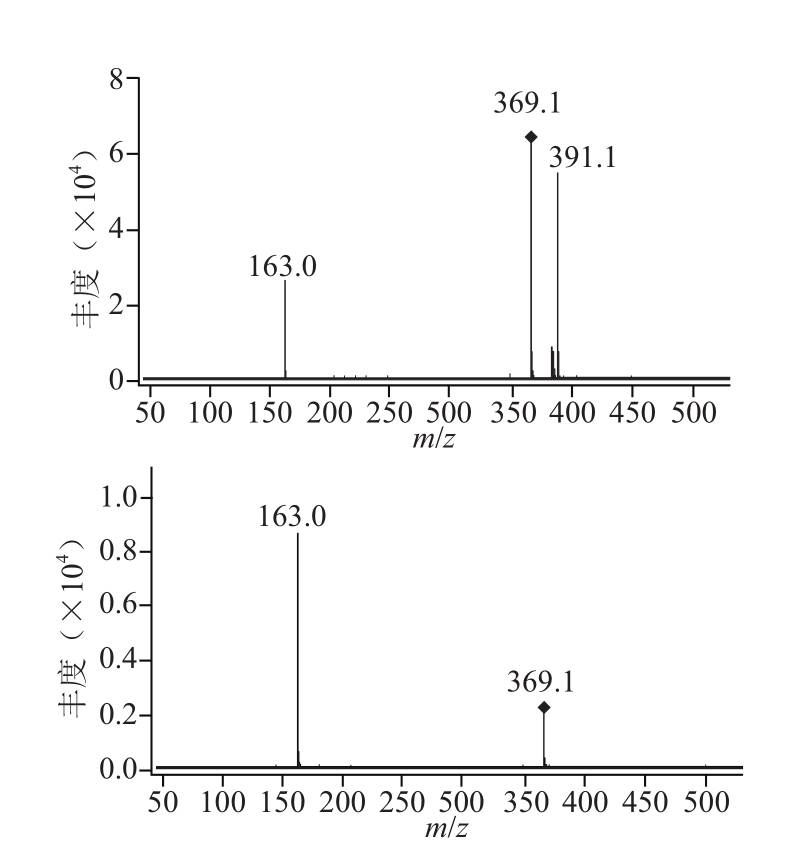
图9 4号峰对应的一、二级质谱图
Fig.9 Mass spectra of peak 4

图10 5号峰对应的一、二级质谱图
Fig.10 Mass spectra of peak 5
为进一步确定蓝莓叶多酚的组成,对总离子流图中这5 个峰进行质谱分析,结果见表1。由表1、图6~10可知,1号峰在一级质谱中出现的准分子离子峰m/z 443.2,可推断其相对分子质量为442,其二级质谱图中离子碎片峰m/z 241.1,推测可能是表儿茶素没食子酸酯[16]。2号峰在一级质谱中出现的准分子离子峰m/z 355.1,可推断其相对分子质量为354,其二级质谱图中离子碎片峰m/z 163,绿原酸的加氢峰为m/z 354.93,与本实验测出的355.1接近,而绿原酸二级质谱的离子碎片峰为162.93,因为采用的是正离子模式,162.93相当于一个糖苷基(162),由此推测峰2可能是绿原酸[17]。3号峰在一级质谱中出现的准分子离子峰m/z 409.2,可推断其相对分子质量为408,其 二级质谱图中离子碎片峰m/z 225.2、207.1,3号峰的的二级离子碎片峰为芥子酸的基峰,3号峰由相对分子质量409到二级离子碎片225.2失去了一个相对分子质量为15的甲基和一个相对分子质量为168的己糖苷,由此推测3号峰可能是甲基-芥子酸-己糖苷[18-20]。4号峰在一级质谱中出现的准分子离子峰m/z 369,可推断其相对分子质量为368,其二级质谱图中离子碎片峰m/z 163,根据5-O-阿魏酰奎尼酸的加氢峰相对分子 质量为369.40,碎片峰相对分子质量为163.17[21],推测4号峰可能为5-O-阿魏酰奎尼酸。5号峰在级质谱中出现的准分子离子峰m/z 465.1,可推断其相对分子质量为464,其二级质谱图中离子碎片峰m/z 303.1,[465.1-303.1]为162,是失去一个葡萄糖苷基,303.1为槲皮素的基峰,所以推测5号峰为槲皮素3-O-葡萄糖苷[14,17]。Li等[22]对兔眼蓝莓叶多酚组成进行了分析,发现兔眼蓝莓叶中有新绿原酸、绿原酸、3,5-D-O-奎宁酸、4,5-D-O-奎宁酸和槲皮素及其衍生物。蓝丰蓝莓叶中主要为表儿茶素没食子酸酯、绿原酸、甲基-芥子酸-己糖苷、5-O-阿魏酰奎尼酸、槲皮素3-O-葡萄糖苷,与兔眼蓝莓叶中含有相同的化合物绿原酸。
通过颜色反应判断蓝莓叶多酚含有酚羟基特征基团。蓝莓叶多酚主要在波长354 nm和748 nm处有吸收峰,与没食子酸和槲皮素有相似官能团。经傅里叶红外光谱分析可知,蓝莓叶多酚含有羟基、苯环、甲氧基和含氧杂环等特征基团。HPLC-MS联用对蓝莓叶多酚进行分离得到5 个主要的吸收峰,分别为表儿茶素没食子酸酯、绿原酸、甲基-芥子酸-己糖苷、5-O-阿魏酰奎尼酸、槲皮素3-O-葡萄糖苷。
[1] 马田田. 笃斯越桔叶营养成分分析[J]. 特产研究, 2001(1): 19-21. DOI:10.3969/j.issn.1001-4721.2001.01.006.
[2] 李颖畅, 王亚丽. 蓝莓叶多酚研究进展及其在食品中的应用[J].食品与发酵科技, 2013, 49(6): 99-103. DOI:10.3969/j.issn.1674-506X.2013.06-021.
[3] 左丽丽, 王振宇, 樊梓鸾, 等. 植物多酚类物质及其功能研究进展[J]. 中国林副特产, 2012, 10(5): 39-43. DOI:10.3969/ j.issn.1001-6902.2012.05.012.
[4] LI C, FENG J, HUANG W Y, et al. Composition of polyphenols and antioxidant activity of rabbiteye blueberry (Vaccinium ashei) in Nanjing[J]. Journal of Agricultural and Food Chemistry, 2013, 61(2): 523-531. DOI:10.1021/jf3046158.
[5] MATSUO T, FUJITA Y, OHNISHI S, et al. Chemical constitution of the leaves of rabbiteye blueberry (Vacinium ashei) and characterisation of polymeric proanthocyanidins containing phenypropanoid units and A-type linkages[J]. Food Chemistry, 2010, 121(4): 1073-1079. DOI:10.1016/j.foodchem.2010.01.052.
[6] DENG Y, YANG G Y, YUE J, et al. Influences of ripening stages and extracting solvents on the polyphenolic compounds, antimicrobial and antioxidant activities of blueberry leaf extracts[J]. Food Control, 2014, 38(1): 184-191. DOI:10.1016/j.foodcont.2013.10.023.
[7] TAKESHITA M, ISHIDA Y, AKAMATSU E, et al. Proanthocyanidin from blueberry leaves suppress expression of Hepatitis C virus RNA[J]. Journal of Biological Chemistry, 2009, 284(32): 21165-21176. DOI:10.1074/jbc.M109.004945.
[8] TURHAN S, TEMIZ H, KOCA A F. Oxidatibe stability of brined anchovies with extracts from blueberry (Vaccunum sp.) fruits and leaves[J]. Journal of Food Quality, 2009, 32(2): 411-424. DOI:10.1111/j.1745-4557.2009.00270.x.
[9] 李颖畅, 李冰心, 吕艳芳, 等. AB-8型大孔树脂纯化蓝莓叶多酚的工艺研究[J]. 食品工业科技, 2012, 33(20): 258-261. DOI:10.13386/ j.issn1002-0306.2012.20.036.
[10] 刘贤明. 天然食用色素落葵红的初步研究[J]. 食品科学, 1990, 11(8): 9-13.
[11] 王景辰, 王学 增, 王亚莉. 黑米天然黑(紫)色素的研究[J]. 食品科学, 1993, 14(6):13-16.
[12] 李颖畅, 吕艳芳, 励建荣. Folin-Ciocalteu法测定不同品种蓝莓叶中多酚含量[J]. 中国食品学报, 2014, 14(1): 273-278.
[13] 李敏, 霍燕燕, 刘梅. 山楂总黄酮提取及其抗氧化作用[J]. 光谱实验室, 2013, 30(6): 3145-3148.
[14] CHIARA C, DORA M, GABRIELLA G , et al. Identification of phenolic constituents in red chicory salads (Cichorium intybus) by high-performance liquid chromatography with diode array detection and electrospray ionisation tandem mass spectrometry[J]. Food Science, 2013, 138: 1062-1071. DOI:10.1016/ j.foodchem.2012.11.060.
[15] 张叔良. 红外光谱分析与新技术[M]. 北京: 中国医药科技出版社, 1993: 76-116.
[16] de QUIRŁS A R, LAGE-YUSTY M A, LŁPEZ-HERN˘NDEZ J. Determination of phenolic compounds in macroalgae for human consumption[J]. Food Chemistry, 2010, 121(2): 634-638. DOI:10.1016/j.foodchem.2009.12.078.
[17] D¸AZ-GARC¸A M C, OBŁN J M, CASTELLAR M R, et al. Quantification by UHPLC of total individual polyphenols in fruit juices[J]. Food Chemistry, 2013, 138(4): 938-949. DOI:10.1016/ j.foodche m.2012.11.061.
[18] PALAFOX-CARLOS H, YAHIA E M, GONZ˘LEZ-AGUILAR G A, et al. Identification and quantification o f major phenolic compounds from mango (Mangifera indica, cv. Ataulfo) fruit by HPLC-DADMS/MS-ESI and their individual contribution to the antioxidant activity during ripening[J]. Food Chemistry, 2012, 135(1): 105-111. DOI:10.1016/j.foodchem.2012.04.103.
[19] DANIELA H, LAURA I, PAMELA V, et al. Polyphenol content and antiradical activity of Cichorium intybus L. from biodynamic and conventional farming[J]. Food Chemistry, 2009, 114(3): 765-770. DOI:10.1016/j.foodchem.2008.10.010.
[20] 李颖畅, 马勇, 孟宪军, 等. 圣云蓝莓花色苷的组成分析[J]. 食品与发酵工业, 2009, 35(8): 129-131. DOI:10.13995/j.cnki.11-1802/ ts.2009.08.022.
[21] RAMESHKUMAR A, SIVASUDHA T, JEYADEVI R, et al. Profil ing of phenolic compounds using UPLC-Q-TOF-MS/MS and nephroprotective activity of Indian green leafy vegetable Merremia emarginata (Burm. f.)[J]. Food Research International, 2013, 50(1): 94-101. DOI:10.1016/j.foodres.2012.09.035.
[22] LI C Y, FENG J, HUANG W Y, et al. Composition of polyphenols and antioxidant activity of rabbiteye blueberry (Vacciniumashei) in Nanjing[J]. Agricultural and Food Chemistry, 2013, 61(2): 523-531. DOI:10.1021/jf3046158.
LI Yingchang, WANG Yuhua, HAN Meizhou, ZHANG Xiao, LI Jianrong*
(College of Food Science and Technology, Bohai University, National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, Food Safety Key Laboratory of Liaoning Province, Jinzhou 121013, China)
Abstract: Specific chemical reactions, ultraviolet-visible spectroscopy, infrared absorption spectroscopy, and high performance liquid chromatography-mass spectrometry (HPLC-MS) analyses indicated that polyphenols from blueberry leaves contained the characteristics groups of hydroxide radical, glycosyl, benzene ring, methoxyl and oxygen heterocycle. The maximum absorption wavelengths of polyphenols from blueberry leaves were 354 nm and 748 nm in alcohol. Five individual polyphenols i.e., epigallocatechin gallate, chlorogenic acid, methyl-sinapic acid-hexoside, 5-O-feruloylquinic acid and ouercetin 3-O-glucoside were tentatively identified by comparing their mass spectral data and retention times with those of reference standards and published data.
Key words: polyphenols from blueberry leaves; composition analysis; high performance liquid chromatography-mass spectrometry (HPLC-MS)
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)06-0106-05引文格式:
DOI:10.7506/spkx1002-6630-201606018
*通信作者:励建荣(1964—),男,教授,博士,研究方向为水、农产品贮藏与加工。E-mail:lijr6491@163.com
作者简介:李颖畅(1973—),女,副教授,博士,研究方向为农、水产品加工与贮藏。E-mail:liyingchangsy@sina.com
基金项目:国家自然基金青年科学基金项目(31201308);“十二五”国家科技支撑计划项目(2012BAD29B06)
收稿日期:2015-06-23