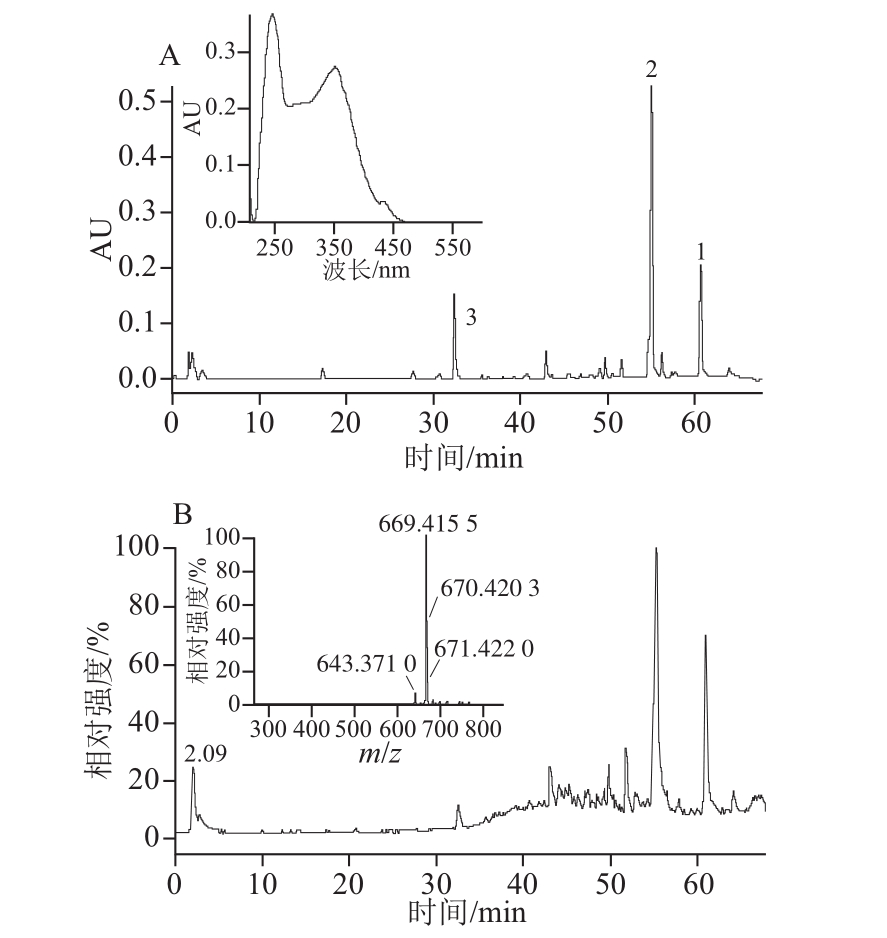
图1 岭南山竹子果实粗提取物的高效液相色谱-飞行时间质谱
Fig.1 Typical chromatograms obtained from HPLC-TOF-MS analysis of G. oblongifolia fruits
A.总紫外色谱图(波长280 nm)及化合物1的紫外吸收图;B.负态总离子图及化合物1的质谱图。
黎 平1,郭志永1,谷荣辉1,张贝西1,吴晓欢1,李玉婷1,龙春林1,2,*
(1.中央民族大学生命与环境科学学院,北京 100081;2.中国科学院昆明植物研究所,云南 昆明 650201)
摘 要:目的:通过高效液相色谱-飞行时间质谱法对岭南山竹子果实的化学组分进行分析。方法:利用硅胶柱色谱、凝胶柱色谱、高速逆流色谱、高效液相色谱等分离和纯化化合物,并以核磁共振确定化合物的结构。结果:基于高效液相色谱-飞行时间质谱法的分析,初步鉴定了11 个化合物,主要为双黄酮类和多戊异烯基取代的苯甲酮类。提取分离得到5 个化合物,分别鉴定为:oblongifolin C(1)、oblongifolin A(2)、volkensiflavone(3)、GB-1a(4)和β-谷甾醇(5)。结论:从该植物中分离得到化合物3和化合物4,确定岭南山竹子果实的化学成分,可为开发该热带水果提供数据参考。
关键词:岭南山竹子果实;苯甲酮类;双黄酮类;高效液相色谱-飞行时间质谱
黎平, 郭志永, 谷荣辉, 等. 岭南山竹子果实的化学成分分离与确定[J]. 食品科学, 2016, 37(6): 132-136. DOI:10.7506/ spkx1002-6630-201606023. http://www.spkx.net.cn
LI Ping, GUO Zhiyong, GU Ronghui, et al. Separation and identification of chemical constituents from Garcina oblongifolia fruits[J]. Food Science, 2016, 37(6): 132-136. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606023. http://www.spkx.net.cn
岭南山竹子(Garcinia oblongifolia Champ. ex Benth.),系藤黄科藤黄属植物,是我国南方热带地区广泛分布的物种[1]。热带地区的各族人们都将岭南山竹子果实作为一种野生水果,因食用果实而使牙齿变黄,也被当地人称作黄牙果、染牙果。岭南山竹子亦是一种民间药用植物,该植物的树皮和叶均可入药,可止痛、收敛生肌、治疗烧伤、跌打损伤等[2]。从岭南山竹子树皮和叶片中分离得到主要的化学成分有苯甲酮类[3-4]、呫吨酮类[5]、黄酮类[6]、萜类[7]及其他[8],这些化合物具有抗肿瘤[4,9]、抗氧化[10]、抗炎[11]、抗HIV[12]、抗菌[13]等生物活性。岭南山竹子的苯甲酮类化合物结构新颖和抗癌作用引起许多研究者的关注,例如从岭南山竹子树皮中分离得到的oblongifolin C具有显著的抗HeLa、SGC7901和HepG2人类肿瘤细胞活性[4,14]。近年来,随着藤黄属植物在经济和医药上的重要价值被发现,尤其是其食用、药用和保健功效,已成为研究热点[15]。因此藤黄属植物药用基础研究,开展种质评价与创新利用,是今后的重要发展方向。虽然岭南山竹子是藤黄属植物较为常见且广泛分布的物种,其果实产量较高。但是,国内外有关岭南山竹子果实的化学基础的研究鲜有报道。为了寻找藤黄属植物的活性成分,本研究应用多种色谱波谱法,分析和分离岭南山竹子果实中的化学成分,研究结果对该热带野生水果资源的开发与利用提供数据参考。
1.1 材料与试剂
岭南山竹子果实于2013年7月采自海南省乐东县,植物标本(编号20130655)保存于中央民族大学标本室。乙腈、水、甲酸(均为质谱纯) 美国J.T.Baker公司;其余分离用试剂均为国产分析纯。
1.2 仪器与设备
AVANCE Ⅲ 600 MHz超导核磁共振波谱仪 德国布鲁克科技有限公司;高效液相色谱-飞行时间质谱联用仪 美国沃特世科技有限公司;循环制备液相色谱仪日本佳仪科技公司;高速逆流色谱 上海同田生物技术有限公司;旋转蒸发仪 瑞士布琪有限公司;薄层层析硅胶、柱层析硅胶 青岛海洋化工厂公司;Sephadex LH-20柱 美国Amersham Pharmacia生物技术公司;Synergi Hydro-RP 80A液相分析柱(250 mm×4.6 mm,4 μm) 美国菲罗门公司。
1.3 方法
1.3.1 液相色谱-质谱条件
液相色谱-质谱由高效液相链接一个配有电喷雾离子源接口的LCT Premier XE飞行时间质谱仪组成,数据分析软件为MassLynx V4.1。
质谱条件:质量扫描范围m/z 100~1 000的正负态模式,正负态的毛细管电压分别设定为3 000 V和2 500 V;氮气作为去溶剂化和锥气体,流速分别为600 L/h和20 L/h;离子源温度和去溶剂化温度分别为120 ℃和400 ℃。
液相色谱条件:流动相由0.1%甲酸溶液(A)和乙腈(B)组成;0~8 min:10%~20% B,8~15 min: 20%~20% B,15~25 min:20%~40% B,25~35 min:40%~75% B,35~50 min:75%~95% B,50~65 min:95%~95% B,65~70 min:95%~10% B。流速0.2 mL/min;进样体积10 μL;检测波长190~600 nm。分析前,取少量提取物溶于甲醇,配制成2 mg/mL样品溶液,用0.45 μm滤膜过滤,待液相色谱-质谱分析。
1.3.2 提取和分离
新鲜岭南山竹子果实(3 kg),切成小块,用体积分数80%乙醇溶液浸泡24 h。过滤提取液,减压浓缩滤液后得到样品的粗提物。重复提取3 次,最后获得总浸膏560 g。称取500 g浸膏加入适当的蒸馏水超声溶解成水悬液,依次用等体积的石油醚、三氯甲烷、醋酸乙酯萃取,分别浓缩得到相应的萃取物。三氯甲烷萃取物过硅胶柱(石油醚-丙酮(100∶0,V/V)溶液,0~100梯度洗脱),得到7 个组分(Fr L-A、B…G),其中Fr L-B过Sephadex LH-20 柱,以甲醇做流动相,分离得到化合物1 (40 mg)和化合物5(10 mg)及次馏分(Fr L-B-1、Fr L-B-2和Fr L-B-3)。次馏分Fr L-B-3经过半制备循环液相色谱,以甲醇-乙腈(70∶30,V/V)溶液做流动相,流速3 mL/min,6 个循环后得到化合物2(20 mg)。醋酸乙酯层通过高速逆流色谱,以正己烷-乙酸乙酯-甲醇-0.1%醋酸溶液(3∶5∶3∶5,V/V)溶液分离体系,主机转速900 r/min;流动相流速2.5 mL/min;一次进样280 mg分离得到化合物3(12 mg)和化合物4(18 mg)。
2.1 果实粗提物的液相色谱-质谱分析
通过比较分析不同的溶剂体系、柱温、流速等因素,优化后的高效液相 色谱条件获得了较为满意的分离效果。如图1所示,共检测15 个主要峰,出峰时间在45~65 min之间,果实提取物中的化合物1和化合物2的含量相对较高,且极性较小。由液相色谱-质谱分析可以获得提取物中主要成分的保留时间,紫外吸收特征和正负态的分子离子峰等信息,通过查询数据库及文献比对推测该化合物的可能结构或类型。化合物1的紫外吸收特征峰为波长245 nm和波长352 nm(图1A),对应的图1B中的分子离子峰m/z 669.415 5[M-H]-可以得出化合物的分子式为C38H49O6。通过分析,最终鉴定了11 个化合物,如表1所示,主要为双黄酮类化合物和多异戊烯基取的苯甲酮类化合物。
双黄酮类是藤黄属植物中常见的化合物,结构稳定,将质谱数据结合相关资料,鉴定的3 个双黄酮分别为GB-1a-7”-O-glucoside、藤黄双黄酮和volkensiflavone,见表1。而藤黄属的主要成分之一为多异戊烯基取代的苯甲酮类化合物,在果实含量相对较高[16],这类化合物具有结构复杂多样,同分异构体并存,极性较小等特点[17]。因此,对于分析和分离该类化合物是一个难点。在缺少标准品的情况下,从液相色谱-质谱分析得到的信息有限,仍不能准确的确定各类化合物的结构。通过高效液相色谱-飞行时间质谱分析,获得潜在的主要成分的信息,判断化合物的类型及相对含量,为进一步提取分离提供重要的参考价值。

图1 岭南山竹子果实粗提取物的高效液相色谱-飞行时间质谱
Fig.1 Typical chromatograms obtained from HPLC-TOF-MS analysis of G. oblongifolia fruits
A.总紫外色谱图(波长280 nm)及化合物1的紫外吸收图;B.负态总离子图及化合物1的质谱图。
2.2 化合物结构鉴定
通过多种色谱手段,从三氯甲烷层及醋酸乙酯层分离得到5 个化合物,结合高分辨质谱及核磁共振波谱数据分别鉴定为oblongifolin C(1)、oblongifolin A(2)、volkensiflavone(3)、GB-1a(4)和β-谷甾醇(5),化合物结构见图2。

图2 化合物1~5的结构图
Fig.2 Chemical structures of compounds 1–5
表1 高效液相色谱-飞行时间质谱分析和鉴定岭南山竹子果实的化合物
Table 1 Chemical constituents detected and characterized in G. oblongifolia fruits by using HPLC-TOF-MSS
化合物1:淡黄色油状,通过高分辨质谱m/z 671.430 1 [M+H]+可知该化合物的分子式为:C43H58O6。1H-NMR (600 MHz,CDCl3)中,δ 6.96(s,2H)和6.56 (d,J=8.0 Hz,1H),为苯环 的ABX取代,化学位移δ 5.10(d,J=19.6 Hz,2H),4.97(s,2H),4.80 (s,1H),共有5 个氢,推测该化合物有5 个烯键;1.51~1.72(m,30H),及0.90(br s,3H)可知该化合物有11 个CH3。13C-NMR谱(125 MHz,CDCl3):δ 196 (C-1),116.8(C-2),195.3(C-3),68.1(C-4),51.6(C-5),41.1(C-6),42.7(C-7),64.6(C-8),207.4(C-9),197.5(C-10),128.9(C-11),116.4(C-12),143.9(C-13),149.6(C-14),114.5 (C-15),124.2(C-16),26.7(C-17),122.2(C-18),134.6(C-19),25.9(C-20),18.4(C-21),16.2(C-22),36.7(C-23),29.1(C-24),123.8(C-25),137.6(C-26),39.9(C-27),16.5(C-28),31.1(C-29),119.6(C-30),135.1(C-31),26.1 (C-32),18.3(C-33),28.9(C-34),124.2(C-35),131.7(C-36),25.9(C-37),17.9(C-38),24.5(C-39),124.3(C-40),132.1(C-41),25.7 (C-42),17.8(C-43)。以上数据与文献[3]报道一致,故鉴定化合物1为oblongifolin C。
化合物2:淡黄色油状。通过高分辨质谱m/z 603.368 6 [M+H]+获得化合物2的分子式为C38H50O6;结合氢谱和碳谱,可以推测出化合物2与化合物1相似,为多戊异烯基取代的苯甲酮类化合物。该碳谱数据13C-NMR (125 MHz,CDCl3):δ 196.3(C-1),116.7(C-2),196.3(C-3),68.9(C-4),48.6(C-5),47(C-6),40.7(C-7),58.9(C-8),208.3(C-9),19 6.3(C-10),128.6(C-11),115.9(C-12),143.7(C-13),149.7(C-14),114.9(C-15),124.4(C-16),27 (C-17),120.2(C-18),135.3(C-19),26.2(C-20),18.1(C-21),27.2(C-22),23.1(C-23),29.2(C-24),124.5(C-25),138.8(C-26),47(C-27),16.6(C-28),31.2(C-29),119.3(C-30),135.4(C-31),26.2(C-32),18.3(C-33),27.2(C-34),124.4(C-35),131.8(C-36),26.1(C-37),17.8(C-38)。化合物2与文献[3]报道的oblongifolin A的核磁数据相似,确定化合物2为oblongifolin A。
化合物3:浅黄色粉末。质谱分子离子m/z 541.112 9 [M+H]+得知分子式为C30H21O10。1H-NMR谱中,δ 6.04 (d,J=11.9)和4.82(d,J=11.9)为C环的3位和4位上的氢,δ 6.40单峰为E环的3位C上的氢原子。两组AABB系统分别为δ 7.08(d,J=8.2 Hz,1H),6.69(d,J=8.4 Hz,1H),6.61(d,J=10.1 Hz,1H),7.08(d,J=8.2 Hz,1H)和7.73(d,J=7.6 Hz,1H),6.91(d,J=7.6 Hz,1H),6.69(d,J=8.4 Hz,1H),7.61(d,J=8.2 Hz,1H),可以判断该化合物是双黄酮类化合物。ABC环上的碳:该数据与文献[24]数据比对,基本一致,故确定化合物3为volkensiflavone。
化合物4:浅黄色粉末。由高分辨质谱正 态离子m/z 543.128 8[M+H]+,(C30H23O10,-0.6×10-6);负态离子m/z 541.113 0[M-H]-(C30H21O10,-0.9×10-6);可知该化合物的分子式为C30H22O10,1H-NMR谱发现,化合物4与化合物3相似,但化合物4在δ 2.52~2.92具有2 个氢原子,是二氢黄酮的特征峰,结合文献[25],确定化合物4为GB-1a。
化合物5:白色针状结晶,硫酸-乙醇显色反应显紫红色,与β-谷甾醇标准品对照,比移 值在多种溶剂系统中与标准品一致,且显色过程相同,故确认该化合物为β-谷甾醇。
本研究通过高效液相色谱-飞行时间质谱法分析岭南山竹子果实的提取物,获得主要成分的紫外及质谱碎片信息,结合文献[3-4,18-23]分析,尝试性鉴定了11 个化合物,主要为双黄酮类和多异戊烯基取代的苯甲酮类化合物。其次运用高速逆流色谱和循环制备液相色谱法,快速分离得到5 个化合物,通过核磁共振波谱确定结构,分别为oblongifolin C、oblongifolin A、volkensiflavone、GB-1a和β-谷甾醇,其中volkensiflavone和GB-1a为首次从该植物中分离得到,确定了岭南山竹子果实的主要化学成分,为开发该热带水果提供数据参考。
本研究结合了高效液相色谱-飞行时间质谱法、高速逆流色谱和循环制备液相色谱,实现了有效发分离目标化合物,且分离得到oblongifolin C是具有抗肿瘤细胞活性的化合物[14],因此,岭南山竹子果实可能具有潜在的抗癌功效。岭南山竹子果实的化学成分仍有待进一步提取分离和活性研究,以提升岭南山竹子的经济价值。
参考文献:
[1] 中国科学院中国植物志编委会. 中国植物志: 第50卷[M]. 北京: 科学出版社, 1990: 89.
[2] 广西壮族自治区卫生厅. 广西中药标准: 第二册[M]. 南宁: 广西科学出版社, 1986: 176.
[3] HAMED W, BRAJEUL S, MAHUTEAU-BETZER F, et al. Oblongifolins A-D, polyprenylated benzoylphloroglucinol derivatives from Garcinia oblongifolia[J]. Journal of Natural Products, 2006, 69(5): 774-777. DOI:10.1021/np050543s.
[4] SHAN W G, LIN T S, YU H N, et al. Polyprenylated xanthones and benzophenones from the bark of Garcinia oblongifolia[J]. Helvetica Chimica Acta, 2012, 95(8): 1442-1448. DOI:10.1002/hlca.201200019. [5] HUANG S X, FENG C, ZHOU Y, et al. Bioassay-guided isolation of xanthones and polycyclic prenylated acylphloroglucinols from Garcinia oblongifolia[J]. Journal of Natural Products, 2008, 72(1): 130-135. DOI:10.1021/np800496c.
[6] WU X, KE C Q, YANG Y P, et al. New biphenyl constituents from Garcinia oblongifolia[J]. Helvetica Chimica Acta, 2008, 91(5): 938-943. DOI:10.1002/hlca.200890099.
[7] 王宁, 汤丽昌, 姚海萍, 等. 岭南山竹子叶三萜成分研究[J]. 时珍国医国药, 2012, 23(11): 2700-2701. DOI:10.3969/ j.issn.1008-0805.2012.11.014.
[8] 余辅松, 姚海萍, 邓世明, 等. 岭南山竹子茎皮的挥发性成分分析[J].海南大学学报(自然科学版), 2013(2): 124-126. DOI:10.3969/ j.issn.1004-1729.2013.02.008.
[9] ITO C, ITOIGAWA M, MIYAMOTO Y, et al. Polyprenylated benzophenones from Garcinia assigu and their potential cancer chemopreventive activities[J]. Journal of Natural Products, 2003, 66(2): 206-20 9. DOI:10.1021/np020372g.
[10] YAMAGUCHI F, ARIGA T, YOSHIMURA Y, et al. Antioxidative and anti-glycation activi ty of garcinol fro m Garcinia indica fruit rind[J]. Journal of Agricultural and Food Chemistry, 2000, 48(2): 180-185. DOI:10.1021/jf990845y.
[11] CHEN J J, TING C W, HWANG T L, et al. Benzophenone derivatives fr om the fruits of Garcinia mul tiflora and their anti-inflammatory activity[J]. Journal of Natural Products, 2009, 72(2): 253-258. DOI:10.1021/np8006364.
[12] RUKACHAISIRIKUL V, PAILEE P, HIRANRAT A, et al. Anti-HIV-1 protostane triterpenes and digeranylbenzophenone from trunk bark and stems of Garcinia speciosa[J]. Planta Medica, 2003, 69(12): 1141-1146. DOI:10.1055/s-2003-818006.
[13] SAKUNPAK A, PANICHAYUPAKARANANT P. A ntibacterial activity of Thai edible plants against gastrointestinal pathogenic bacteria and isolation of a new broad spectrum antibacterial polyisoprenylated benzophenone, chamuangone[J]. Food Chemistry, 2012, 130(4): 826-831. DOI:10.1016/j.foodchem.2011.07.088.
[14] FENG C, ZHOU L Y, YU T, et al. A new anticancer compound, oblongifolin C, inhibits tumor growth and promotes apoptosis in HeLa cells through bax activation[J]. International Journal of Cancer, 2012, 1 31(6): 1445-1454. DOI:10.1002/ijc.27365.
[15] HEMSHEKHAR M, SUNITHA K, SANTHOSH M S, et al. An overview on genus Garcinia: phytochemical and therapeutical aspects[J]. Phytochemistry Reviews, 2011, 10(3): 325-351. DOI:10.1007/s111 01-011-9207-3.
[16] KUMAR S, SHARMA S, CHATTOPADHYAY S K. The potential health benefit of polyisoprenylated benzophenones from Garcinia and related genera: ethno botanical and therapeutic importance[J]. Fitoterapia, 2013, 89(7): 86-125. DOI:10.1016/j.fitote.2013.05.010.
[17] WU S B, LONG C, KENNELLY E J. Structural diversity and bioactivities of natural benzophenones[J]. Natural Product Reports, 2014, 31(9): 1158-1174. DOI:10.1039/C4NP00027G.
[18] C HEN F C, LIN Y M, HUNG J C. A new biflavanone glucoside from Garcinia multiflora[J]. Phytochemistry, 1975, 14(3): 818-820. DOI:10.1016/0031-9422(75)83048-2.
[19] TRISUWAN K, RUKACHAISIRIKUL V, PHONGPAICHIT S, et al. Tetraoxygenated xanthones and biflavanoids from the twigs of Garcinia merguensis[J]. Phytochemistry Letters, 2013, 6(4): 511-513. DOI:10.1016/j.phytol.2013.06.013.
[20] FENG C, HUANG S X, GAO X M, et al. Characterization of proapoptotic compounds from the bark of Garcinia oblongifolia[J]. Journal of Nat ural Products, 2014, 77(5): 1111-1116. DOI:10.1021/ np4007316.
[21] ZHOU Y, LEE S, CHOI F F K, et al. Qualitative and quantitative analysis of polycyclic polyprenylated acylphloroglucinols from Garcinia species using ultra performance liquid chromatography coupl ed with electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. Analytica Chimica Acta, 2010, 678(1): 96-107. DOI:10.1016/j.aca.2010.08.010.
[22] TERASHIMA K, SHIMAMURA T, T ANABAYASHI M, et al. Constituents of the seeds of Garcinia kola: two new antioxidants, garcinoic acid and garcinal[J]. Heterocycles, 1997, 45(8): 1559-1566. DOI:10.3987/COM-97-7854.
[23] ZHANG H, TAO L, FU W W, et al. Prenylated benzoylphloroglucin ols and xanthones from the leaves of Garcinia oblongifolia with antienteroviral activity[J]. Journal of Natural Products, 2014, 77(4): 1037-1046. DOI:10.1021/np500124e.
[24] H ERBIN G A, JACKSON B, LOCKSLEY H D, et al. The biflavonoids of Garcinia volkensii (Guttiferae)[J]. Phytochemistry, 1970, 9(1): 221-226. DOI:10.1016/S0031-9422(00)86633-9.
[25] KAPADIA G J, OGUNTIMEIN B, SHUKLA Y N. High-speed counter-current chromatographic separation of biflavanoids from Garcinia kola seeds[J]. Journal of Chromatography A, 1994, 673(1): 142-146. DOI:10.1016/0021-9673(94)8 7067-5.
LI Pi ng1, GUO Zhiyong1, GU Ronghui1, ZHANG Beixi1, WU Xiaohuan1, LI Yuting1, LONG Chunlin1,2,*
(1. College of Life and Environmental Sciences, Minzu University of China, Beijing 100081, China; 2. Kunming Institute of Botany, Chinese Academy of Sciences, Kunmi ng 650201, China)
Abstract: High performance liquid chromatography coupled with time-of-flight mass spectrometry (HPLC-TOF-MS) was appli ed to analyze the chemical composition of Garcina oblongifolia fruits. The crude extract of Garcina oblongifolia fruits was separated and purified by sequential chromatographies using silica gel column, Sephadex LH-20 column, high spee d counter current chromatograhy (HSCCC). The structures of the purified compounds were confirmed by nuclear magnetic resonance (NMR). As a result, 11 compounds, which were mainly categorized to benzophenones and biflavonoids, were tentatively identified from the fruit extract. Further isolation yielded 5 compounds, which were identified as oblongifolin C (1), oblongifolin A (2), volkensiflavone (3), GB-1a (4) and β-sitosterol (5), respectively, of which compounds 3 and 4 were isolated from this plant for the first time. This study provides important evidence supporting the exploitation of this tropical fruit.
Key words: Garcina oblongifolia fruits; benzophenones; biflavonoids; high performance liquid chromatography coupled with time-of-flight mass spectrometry (HPLC-TOF-MS)
中图分类号:O657.7
文献标志码:A
文章编号:1002-6630(2016)06-0132-05引文格式:
DOI:10.7506/spkx1002-6630-201606023
*通信作者:龙春林(1964—),男,教授,博士,研究方向为民族植物学、植物种质资源和生物多样性。E-mail:long@mail.kib.ac.cn
作者简介:黎平(1986—),男,博士研究生,研究方向为民族植物学、民族药物化学。E-mail:liping2005hot@126.com
基金项目:国家外专局、教育部“111工程”项目(B08044);国家自然科学基金面上项目(31070288);国家自然科学基金国际(地区)合作与交流项目(31161140345);中央民族大学博士自主科研项目(Z2014045);中央民族大学URTP项目(2014110027)
收稿日期:2015-06-06