采用GC×GC-TOFMS结合顶空固相微萃取技术检测枯草芽孢杆菌发酵液中吡嗪类物质
周庆伍1,汤有宏1,2,徐祥浩1,2,刘国英1,2,高江婧1,2,姜 利1
(1.安徽古井贡酒股份有限公司,安徽 亳州 236820;2.安徽省固态发酵工程技术研究中心,安徽 亳州 236820)
摘 要:应用全二维气相色谱-飞行时间质谱联用仪结合顶空固相微萃取技术同时检测枯草芽孢杆菌发酵液中吡嗪类物质。结果表明:标准曲线线性关系良好,相关系数r2均大于0.99,相对标准偏差在4.2%~10.9%之间,加标回收率在84%~116%之间,满足发酵液样品中吡嗪类物质定量要求。
关键词:全二维气相色谱-飞行时间质谱;顶空固相微萃取;枯草芽孢杆菌;发酵液
周庆伍, 汤有宏, 徐祥浩, 等. 采用GC×GC-TOFMS结合顶空固相微萃取技术检测枯草芽孢杆菌发酵液中吡嗪类物质[J].食品科学, 2016, 37(6): 157-160. DOI:10.7506/spkx1002-6630-201606028. http://www.spkx.net.cn
ZHOU Qingwu, TANG Youhong, XU Xianghao, et al. Using GC×GC-TOFMS combined with headspace solid phase microextraction to detect pyrazines in Bacillus subtilis fermentation broth[J]. Food Science, 2016, 37(6): 157-160. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606028. http://www.spkx.net.cn
吡嗪类物质是白酒中的一类重要健康功能成分,其中四甲基吡嗪对扩张血管、轻度降压、改善组织微循环、提高组织血液灌注、抑制血小板黏附聚集和血栓形成、抑制平滑肌细胞、调节脂质代谢以及抗脂质过氧化均有一定的治疗作用[1-2]。另外,由于吡嗪类物质大都具有焙烤香气及坚果香气,再加上该类物质的阈值较低。因此,该类物质对酒体的风味也起到了较大贡献作用[3-4]。
目前,分离白酒中吡嗪类物质的方法有液液萃取、固相萃取、固相微萃取、大孔径阴阳离子交换、二氧化碳超临界萃取[5-12]等。顶空固相微萃取样品前处理方式,是一种集采样、萃取、浓缩和进样于一体的无溶剂样品微萃取新技术。与固相萃取技术相比,固相微萃取操作更简单,携带更方便,操作费用也更加低廉,另外克服了固相萃取回收率低、吸附剂孔道易堵塞的缺点;与液液萃取方法相比,固相微萃取操作更简单、耗时更短、安全性更高。例如唐坤甜等[8]采用顶空固相微萃取技术萃取啤酒麦芽中的含氮类香味物质,最后经气相色谱-质谱进行定量分析。
全二维气相色谱具分辨率、灵敏度高、峰容量大等优势,十分适合复杂体系的分析研究;飞行时间质谱具有很高的采集频率,能够实现与全二维气相色谱的最佳配合。并且仪器自带的高性能数据处理软件,具备自动峰识别以及图谱去卷积解析功能,大大提高了检测分析的灵敏度[13-19]。本研究采用全二维气相色谱-飞行时间质谱结合顶空固相微萃取样品前处理方式测定枯草芽孢杆菌(Bacillus subtilis)发酵液中吡嗪类物质,此方法分析结果准确,可用于枯草芽孢杆菌发酵液中吡嗪类物质的定性与定量分析。
1 材料与方法
1.1 材料与试剂
2-乙酰基吡啶(内标)、吡嗪、2-甲基吡嗪、2,3-二甲基吡嗪、2,5-二甲基吡嗪、2,6-二甲基吡嗪、2-乙基吡嗪、2-乙基-5-甲基吡嗪、2,3,5-三甲基吡嗪、2,3-二乙基-5甲基吡嗪、四甲基吡嗪(均为色谱纯) 美国Sigma-Aldrich公司;无水乙醇(色谱纯) 上海安普科学仪器有限公司;无水乙醚(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Pegasus4D全二维气相色谱-飞行时间质谱联用仪美国力可公司;MPS多功能样品前处理平台 德国Gerstel公司。
1.3 方法
1.3.1 内标及标准溶液配制
内标为2-乙酰基吡啶,吸取0.05 g内标物,用无水乙醇配制于50 mL容量瓶中,定容后作为内标储备液(约1 000 mg/L);各称取0.05 g吡嗪类标准物质,用无水乙醇溶解,转移到50 mL容量瓶中,定容后得到约1 000 mg/L吡嗪类标准物质储备液,置于4 ℃冰箱中避光保存。用无水乙醇及超纯水将各个标准品储备液稀释配制成混合标准溶液,逐级稀释得到实验需要的不同梯度(800、400、200、80、40 μg/L)混合标准液,并且保证每个梯度混标液的酒精体积分数为10%。
1.3.2 吡嗪类标准品标准曲线绘制
准确移取8 mL配制好的各级梯度混合标准溶液于20 mL顶空瓶中,加入3.0 g NaCl,最后加入10 μL内标溶液,确保内标液质量浓度在标准品质量浓度梯度范围内。将上述5 个梯度的吡嗪混合标准溶液在选定的色谱条件下进样分析,以标准品质量浓度为横坐标,标准品与内标的峰面积比值为纵坐标,绘制10 种吡嗪类物质的标准曲线。1.3.3 发酵液样品测定
将待测发酵液样品稀释至一定质量浓度,并用无水乙醇溶液调节其酒精体积分数为10%,准确移取8 mL稀释好的发酵液于20 mL顶空瓶中,加入3.0 g NaCl,最后加入10 μL内标溶液。借助多功能样品前处理平台,采用全自动固相微萃取和全自动进样方式进行样品的吸附和解吸[10],萃取温度50 ℃、萃取时间40 min、解吸时间5 min。
1.3.4 固相微萃取头活化
65 μm二乙基苯/聚二甲基硅氧烷(divinylbenzene/ polydimethylsiloxane,DVB/PDMS)两相萃取头在250 ℃条件下活化0.5 h,整个活化过程必须在高纯氮气流保护下进行[12-15]。
1.3.5 全二维气相色谱-飞行时间质谱分析条件
一维柱:DB-wax色谱柱(60 m×0.25 mm,0.25 μm);二维柱:Rtx-200色谱柱(2 m×0.18 mm,0.18 μm);两根色谱柱通过毛细管柱连接器以串联方式连接;调制器设置为不工作;进样口温度230 ℃;载气为He;流速1.0 mL/min;不分流模式;升温程序:一维柱温箱初始温度40 ℃,保持2 min,然后以4 ℃/min升温至180 ℃,再以6 ℃/min升温至230 ℃,保持15 min;二维柱温箱初始温度45 ℃,保持2 min,然后以4 ℃/min升温至180 ℃,再以6 ℃/min升温至230 ℃,保持15 min。
质谱条件:质谱检测器为飞行时间质谱;电子电离源;离子源温度200 ℃;电离电压-70 V;传输线温度250 ℃;采用全扫描方式;质量扫描范围30~400 u;采集频率10张全谱图/s;检测器电压1 470 V。
1.4 数据处理
所得数据再经Pegasus 4D的工作站自动处理,定性所用的图谱库为NIST/EPA/NIH Version 2.0,所得数据再经进一步处理得到最终结果。
2 结果与分析
2.1 标准样品保留时间及定量离子确定
以3 级混标溶液(约200 μg/L)为分析样品,对标准样品中各种物质的的保留时间以及定量离子确定进行研究,见图1和表1。
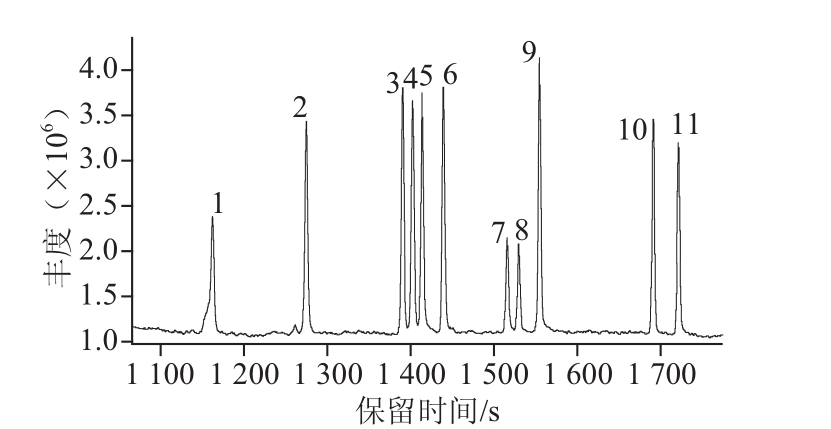
图1 10 种吡嗪标准样品及内标的飞行时间质谱总离子流图
Fig.1 Total ion current (TIC) chromatogram of mixed standards of 10 pyrazines and internal standard
1.吡嗪;2. 2-甲基吡嗪;3. 2,5-二甲基吡嗪;4. 2,6-二甲基吡嗪;5. 2-乙基吡嗪;6. 2,3-二甲基吡嗪;7. 2-乙基-5-甲基吡嗪;8. 2,3,5-三甲基吡嗪;
9.四甲基吡嗪;10. 2,3-二乙基-5甲基吡嗪;11. 2-乙酰基吡啶(内标)。
表1 10 种吡嗪标准样品及内标物保留时间及定量离子
Table 1 Retention times and quantitation ions of 10 pyrazines and internal standard
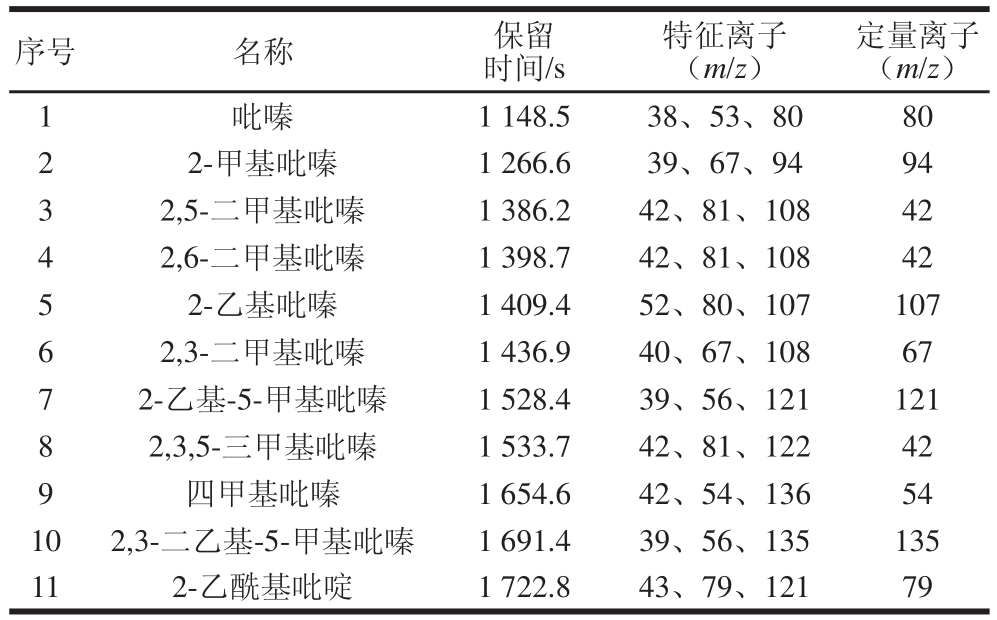
序号 名称 保留时间/s特征离子(m/z)定量离子(m/z)1吡嗪 1 148.5 38、53、80 80 2 2-甲基吡嗪 1 266.6 39、67、94 94 3 2,5-二甲基吡嗪 1 386.2 42、81、108 42 4 2,6-二甲基吡嗪 1 398.7 42、81、108 42 5 2-乙基吡嗪 1 409.4 52、80、107 107 6 2,3-二甲基吡嗪 1 436.9 40、67、108 67 7 2-乙基-5-甲基吡嗪 1 528.4 39、56、121 121 8 2,3,5-三甲基吡嗪 1 533.7 42、81、122 42 9 四甲基吡嗪 1 654.6 42、54、136 54 10 2,3-二乙基-5-甲基吡嗪 1 691.4 39、56、135 135 11 2-乙酰基吡啶 1 722.8 43、79、121 79
2.2 线性范围及标准曲线
按照1.3.1节和1.3.2节方法进行实验,获得不同质量浓度条件下各组分的峰面积,以标准品的质量浓度为横坐标,标准品与内标的峰面积比值为纵坐标,绘制标准曲线,如表2所示。10 种吡嗪类物质线性关系良好,相关系数r2在0.992~0.999之间。
表2 10 种吡嗪类物质的标准曲线
Table 2 Standard curves for 10 pyrazines
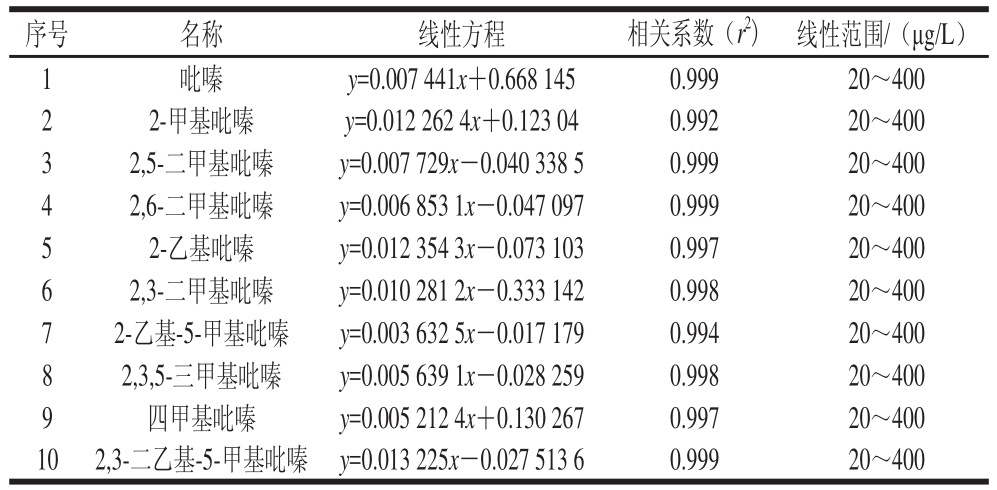
序号 名称 线性方程 相关系数(r2) 线性范围/(μg/L)1吡嗪 y=0.007 441x+0.668 145 0.999 20~400 2 2-甲基吡嗪 y=0.012 262 4x+0.123 04 0.992 20~400 3 2,5-二甲基吡嗪 y=0.007 729x-0.040 338 5 0.999 20~400 4 2,6-二甲基吡嗪 y=0.006 853 1x-0.047 097 0.999 20~400 5 2-乙基吡嗪 y=0.012 354 3x-0.073 103 0.997 20~400 6 2,3-二甲基吡嗪 y=0.010 281 2x-0.333 142 0.998 20~400 7 2-乙基-5-甲基吡嗪 y=0.003 632 5x-0.017 179 0.994 20~400 8 2,3,5-三甲基吡嗪 y=0.005 639 1x-0.028 259 0.998 20~400 9 四甲基吡嗪 y=0.005 212 4x+0.130 267 0.997 20~400 10 2,3-二乙基-5-甲基吡嗪 y=0.013 225x-0.027 513 6 0.999 20~400
2.3 方法的相对标准偏差、加标回收率以及定量限
表3 方法的相对标准偏差、加标回收率以及定量限
Table 3 Relative standard deviations, spiked recoveries and limits of quantitation
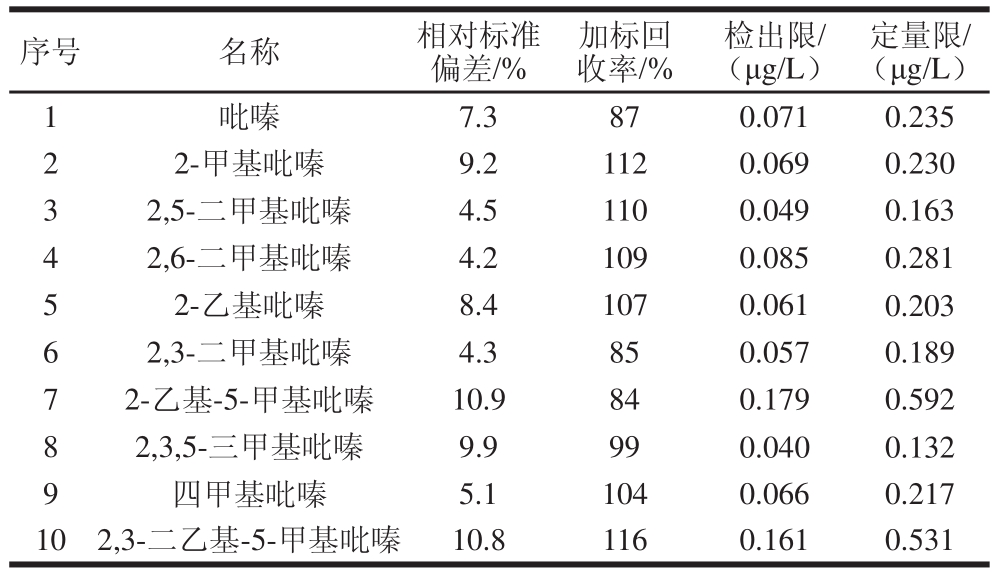
序号 名称 相对标准偏差/%加标回收率/%检出限/ (μg/L)定量限/ (μg/L)1吡嗪 7.3 87 0.071 0.235 2 2-甲基吡嗪 9.2 112 0.069 0.230 3 2,5-二甲基吡嗪 4.5 110 0.049 0.163 4 2,6-二甲基吡嗪 4.2 109 0.085 0.281 5 2-乙基吡嗪 8.4 107 0.061 0.203 6 2,3-二甲基吡嗪 4.3 85 0.057 0.189 7 2-乙基-5-甲基吡嗪 10.9 84 0.179 0.592 8 2,3,5-三甲基吡嗪 9.9 99 0.040 0.132 9 四甲基吡嗪 5.1 104 0.066 0.217 10 2,3-二乙基-5-甲基吡嗪 10.8 116 0.161 0.531
按照信噪比10 倍标准,计算10 种吡嗪类物质的定量限,按信噪比3 倍标准,计算10种吡嗪类物质的检出限,选取3 级混合标准溶液(约200 μg/L)进行5 次平行实验,进行精密度分析;将3 级混合标准溶液(约200 μg/L)添加到发酵液中,经1.3.3节所述的方法,测定方法的加标回收率,结果见表3。相对标准偏差在4.2%~10.9%之间,加标回收率在84%~116%之间,满足发酵液样品中吡嗪类物质定量要求。
2.4 发酵液样品检测结果
按照1.3.3节方法,将样品稀释100 倍,并用无水乙醇调节其酒精体积分数为10%,分别测定3 个发酵液中吡嗪类物质的含量,乘以稀释倍数后的结果见表4。
表4 发酵液样品检测结果
Table 4 Analytical results for the determination of 10 pyrazines in fermentation broth samples
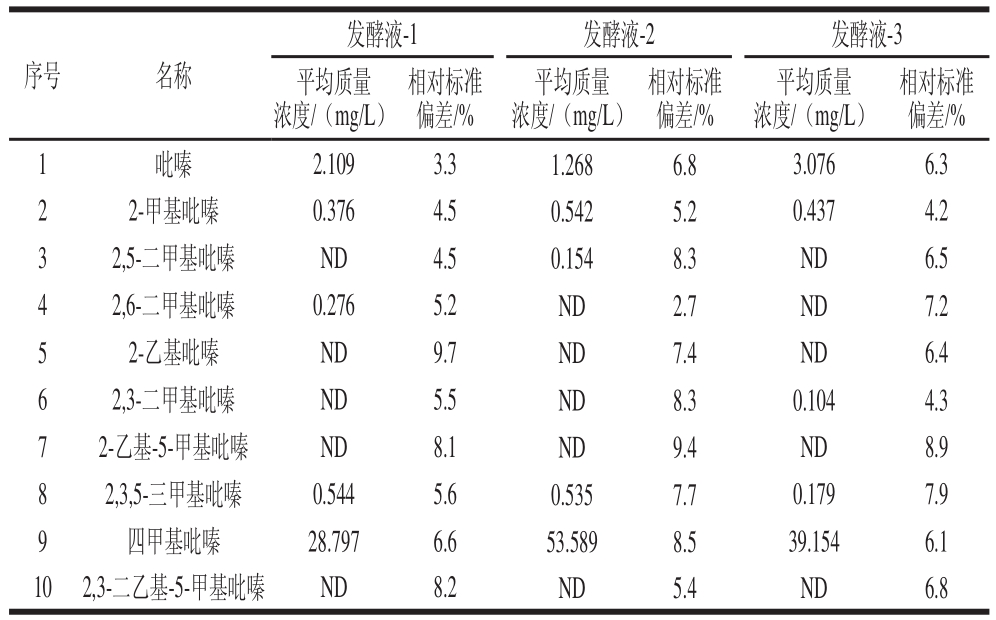
注:ND.未检出。
序号 名称发酵液-1 发酵液-2 发酵液-3平均质量浓度/(mg/L)相对标准偏差/%平均质量浓度/(mg/L)相对标准偏差/%平均质量浓度/(mg/L)相对标准偏差/% 1 吡嗪 2.109 3.3 1.268 6.8 3.076 6.3 2 2-甲基吡嗪 0.376 4.5 0.542 5.2 0.437 4.2 3 2,5-二甲基吡嗪 ND 4.5 0.154 8.3 ND 6.5 4 2,6-二甲基吡嗪 0.276 5.2 ND 2.7 ND 7.2 5 2-乙基吡嗪 ND 9.7 ND 7.4 ND 6.4 6 2,3-二甲基吡嗪 ND 5.5 ND 8.3 0.104 4.3 7 2-乙基-5-甲基吡嗪 ND 8.1 ND 9.4 ND 8.9 8 2,3,5-三甲基吡嗪 0.544 5.6 0.535 7.7 0.179 7.9 9 四甲基吡嗪 28.797 6.6 53.589 8.5 39.154 6.1 10 2,3-二乙基-5-甲基吡嗪 ND 8.2 ND 5.4 ND 6.8
3 结 论
利用全二维气相色谱-飞行时间质谱结合顶空固相微萃取技术测定枯草芽孢杆菌发酵液中吡嗪类物质含量。全二维气相色谱具分辨率高、灵敏度高、峰容量大等优势,具备自动峰识别以及图谱去卷积解析功能,大大提高了检测分析的灵敏度。另外,所采用的顶空固相微萃取样品前处理方式,较固相萃取操作费用更低廉,克服了固相萃取回收率低、吸附剂孔道易堵塞的缺点;较液液萃取方法操作更简单、耗时更短、安全性更高[20-21]。样品的测定结果表明,10 种吡嗪类物质线性关系良好,相关系数在0.992~0.999之间,相对标准偏差在4.2%~10.9%之间,加标回收率在84%~116%之间,满足发酵液样品中吡嗪类物质定量要求。
参考文献:
[1] 晁建平. 重要的食品杂环香料: 吡嗪类化合物[J]. 精细石油化工, 1994(4): 44-47.
[2] RUDOLF M, SUGIMA R. Pyrazines: occurrence, formation and biodegradation[J]. Applied Microbiology and Biotechnollgy, 2010, 85: 1315-1320. DOI:10.1007/s00253-009-2362-4.
[3] LENKA L, KATERINA R, JANA H, et al. Alternative GC-MS approaches in the analysis of substituted pyrazines and other volatile aromatic compounds formed during Maillard reaction in potato chips[J]. Analytical Chimica Acta, 2009, 641: 101-109. DOI:10.1016/ j.aca.2009.03.036.
[4] HASSAN S, JACINTHE F, NNTHALIE M. Identifi cation of pyrazine derivatives in a typical maple syrup using headspace solid-phase micro extraction with gas chromatography-mass spectrometry[J]. Food Chemistry, 2012, 133: 1006-1010. DOI:10.1016/ j.foodchem.2011.07.132.
[5] 耿平兰, 孙棣, 寻思颖. 酒中吡嗪类物质的检测技术研究进展[J]. 酿酒科技, 2013(9): 90-92. DOI:10.13746/j.njkj.2013.09.038.
[6] 严矿林, 林丽琼. 样品前处理技术在气相色谱分析中的应用进展[J].色谱, 2013, 31(7): 634-639. DOI:10.3724/SP.J.1123.2013.05035.
[7] 贾玮, 黄峻榕. 食品中香精香料检测前处理技术研究进展[J]. 食品与机械, 2012, 28(2): 245-249. DOI:10.3969/ j.issn.1003-5788.2012.02.067.
[8] 唐坤甜. 顶空固相微萃取-气相色谱-质谱法测定麦芽美拉德反应香味物质[J]. 啤酒科技, 2013(12): 18-24.
[9] 张艳红, 范文来, 徐岩, 等. 顶空固相微萃取与气相色谱-火焰热离子检测器联用测定白酒中吡嗪类化合物[J]. 分析试验室, 2008, 27(6): 39-41.
[10] PHILIPPUS A, MARIA A S, SYLVIA O P, et al. Survey of 3-alkyl-2-methoxypyrazine content of South African Sauvignon blanc wines using a novel LC-APCI-MS/MS method[J]. Journal of Agricultural and Food Chemistry, 2009, 57(20): 9347-9355. DOI:10.1021/jf9026475.
[11] LLUIS B, ROSALIS T, ANNA G, et al. Mass spectrometry identifi cation of alkyl-substituted pyrazines produced by Pseudomonas spp. isolates obtained from wine corks[J]. Food Chemistry, 2013, 138: 2382-2389. DOI:10.1016/j.foodchem.2012.12.030.
[12] LAURA C, ANA E, EVA C, et al. Multidimensional gas chromatography-mass spectrometry determination of 3-alkyl-2-methoxypyrazines in wine and must a comparison of solid-phase extraction and headspace solid-phase extraction methods[J]. Journal of Chromatography A, 2009, 1216: 4040-4045. DOI:10.1016/ j.chroma.2009.02.072.
[13] 季克良, 郭坤亮, 朱书奎, 等. 全二维气相色谱/飞行时间质谱用于白酒微量成分的分析[J]. 酿酒科技, 2007(3): 100-102.
[14] 郭琨, 周建, 刘泽龙. 全二维气相色谱-飞行时间质谱联用技术分析重馏分油中芳烃组成[J]. 色谱, 2012, 30(2): 128-134. DOI:10.3724/ SP.J.1123.2011.09015.
[15] 谢诚, 欧昌荣, 曹锦轩, 等. 全二维气相色谱-飞行时间质谱法分析糟带鱼挥发性风味成分[J]. 现代食品科技, 2014, 30(2): 234-243.
[16] JULIANE E W, VITOR M, MAURO Z, et al. Characterization of the volatile profi le of Brazilian Merlot wines through comprehensive two dimensional gas chromatography time-of-flight mass spectrometric detection[J]. Journal of Chromatography A, 2012, 1226: 124-139. DOI:10.1016/j.chroma.2012.01.002.
[17] WANG K, ZHU R Z, QU R F, et al. Comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry for the analysis of volatile components in Neroli essential oil[J]. Mendeleev Communications, 2012, 22: 45-46. DOI:10.1.16/j.mencom.2012.01.08.
[18] JULIANE E W, VITOR M, MAURO Z, et al. Differentiation of wines according to grape variety using multivariate analysis of comprehensive two-dimensional gas chromatography with time-offlight mass spectrometric detection data[J]. Food Chemistry, 2013, 141: 3897-3905. DOI:10.1016/j.foodchem.2013.06.100.
[19] VENKATRAMANI C J, XU J, PHILLIPS J B, et al. Separation orthogonality in temperature-programmed comprehensive twodimensional gas chromatography[J]. Analytical Chemistry, 1996, 68(9): 1486-1492. DOI:10.1021/ac951048b.
[20] 张明霞, 赵旭娜, 杨天佑, 等. 顶空固相微萃取分析白酒香气物质的条件优化[J]. 食品科学, 2011, 32(12): 49-53.
[21] 郑杨, 赵纪文, 张锋国, 等. 扳倒井芝麻香型白酒香成分分析[J]. 食品科学, 2014, 35(4): 60-65. DOI:10.7506/spkx1002-6630-201404013.
Using GC×GC-TOFMS Combined with Headspace Solid Phase Micro-Extraction to Detect Pyrazines in Bacillus subtilis Fermentation Broth
ZHOU Qingwu1, TANG Youhong1,2, XU Xianghao1,2, LIU Guoying1,2, GAO Jiangjing1,2, JIANG Li1
(1. Anhui Gujing Distillery Co. Ltd., Bozhou 236820, China; 2. Anhui Engineering Research Center of Solid-State Fermentation, Bozhou 236820, China)
Abstract: Pyrazines are one of the most important flavors in Chinese liquor. The pyrazines in Chinese liquor were analyzed by comprehensive two dimensional gas chromatography-time of flight mass spectrometry combined with headspace solid phase micro extraction. The results showed that 10 pyrazines were detected in fermentation broth samples and the standard curves for all the analytes exhibited a good linear relationship (r2> 0.99), with a relative standard deviation (RSD) between 4.2% and 10.9%. The average recoveries of spiked samples ranged between 84%–116%. This method can meet the requirements for pyrazine detection in Bacillus subtilis fermentation broth.
Key words: gas chromatography-time of flight mass spectrometry (GC×GC-TOFMS); headspace solid phase micro extraction (HS-SPME); Bacillus subtilis; fermentation broth
中图分类号:O657.63
文献标志码:A
文章编号:1002-6630(2016)06-0157-04引文格式:
DOI:10.7506/spkx1002-6630-201606028
作者简介:周庆伍(1974—),男,高级工程师,硕士,主要从事酿酒发酵技术管理与研究。E-mail:qw@gujing.com.cn
收稿日期:2015-06-04




